
- •Болезни в трех томах
- •Общая часть
- •8 Список сокращений
- •Основные сведения об инфекционных болезнях
- •Классификация инфекционных болезней
- •2 Ж. Возианова
- •Принципы лечения инфекционных болезней
- •Характер взаимодействия с микро-и макроорганизмом
- •Возможные побочные реакции
- •II. Аминогли-козиды
- •III. Тетрацик-лины
- •Специфическая профилактика инфекционных болезней
- •Заболевания преимущественно с воздушно-капельным механизмом передачи
- •1Ейраминидаза
- •Действие на факторы клеточного и гуморального иммунитета
- •Формирование антитоксического иммунитетаСтимуляция местных факторов защиты, в том числе завершенного фагоцитоза
- •Функциональные нарушения
- •Механизмов защиты
- •Внедрение микоплазм в слизистую оболочку дыхательных путей
- •Заболевания преимущественно с фекально-оральным механизмом передачи
- •Размножение сальмонелл в тонкой кишке
- •Вегетативная нс
- •Заболевания, вызываемые иерсиниями
- •Желудке (высвобождение эндотоксина при этом незначительное)
- •Непосредственное повреждающее действие шигелл на слизистую оболочку толстой кишки
- •Серогруппа 01 (холерные)
- •Всасывание фрагментов вибрионов в кровь Образование различных факторов агрессии
- •Выработка вибриоцидных антител
- •Структура и функции печени
- •Методы диагностики, использующиеся при обследовании больных вг, и их оценка
- •21 Ж. Возианова
- •Особенности лечения больных вирусным гепатитом с затяжным течением
- •Заболевания, вызываемые вирусами
- •Энтеровирусами Паралитические формы (полиомиелитоподобные заболевания)
- •Асептический серозный менингит
- •Энтеровирусный энцефалит
- •Синдром Гийена—Барре (полирадикулоневрит)
- •Острые респираторные заболевания («летний грипп»)
- •Лихорадка с экзантемой
- •Везикулярный стоматит с экзантемой (ящуроподобный синдром)
- •Герпетическая ангина (герпангина)
- •Эпидемический конъюнктивит
- •Энтеровирусная диарея (летние гастроэнтериты)
- •Энтеровирусный гепатит
- •Эпидемическая миалгия (плевродиния, борнхольмская болезнь)
- •Энтеровирусная инфекция у новорожденных
- •Бессимптомная инфекция
- •Лечение нематодозов
- •Лечение цестодозов
- •Протозойные заболевания
- •1Нфекц1йн1 I паразитарн1 хвороби
Генерализованный
васкулит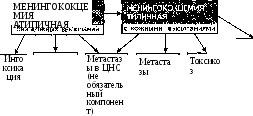
Функциональные нарушения
Метастазы
во внутренние органы (не обязательный
компонент)
Изолированные повреждения отдельных органов
В кожу
Во все внутренние
органы
|
Менингит, |
|
Геморра- |
|
менингоэн- |
|
гическая |
|
цефалит |
|
сыпь |
ИТШ
синдром Уотерха-уза - Фри-дериксена
-две-
синдром
Повреждение органов с нарушением их функции
Тяжелые циркуляторные и метаболические нарушения
Возможны летальные исходы
Рис. 12
Варианты течения менингококцемии
Патогенез хронической формы менингококковой инфекции (прежде всего менингококцемии) изучен недостаточно. Неясно, где сохраняется возбудитель в межрецидивный период. Не исключена роль L-форм, но пока наибольшее значение придают врожденным дефектам в системе комплемента (в частности, отсутствие С6-компонента). Провести четкую грань между реинфекцией и обострениями хронической инфекции, особенно если они наступают с интервалами в несколько месяцев или даже лет, практически невозможно. Но случаи рецидивирующего менингококкового менингоэнцефалита в литературе описаны.
Патогенез острой менингококковой инфекции схематически представлен на рис. 13.
Инфицирование менингококком слизистой оболочки носоглотки


Стимуляция неспецифических и специфических
Механизмов защиты
Менингококцемия
Проникновение менингококка в ЦНС
Диссеминация менингококка в органы и ткани
Токсикоз
Менингит (менин-гоэнцефалит)
ИТШ.ДВС-синдром,синдром Уотерхауза-Фридериксена
I
Отек-набухание головного мозга
Повреждение органов, нарушение их функции
Циркуляторные и метаболические нарушения
Очищение от менингококка
ВЫЗДОРОВЛЕНИЕ
Возможна смерть
"J--"-»
Рис. 13
Схема патогенеза менингококковой инфекции (ведущие звенья)
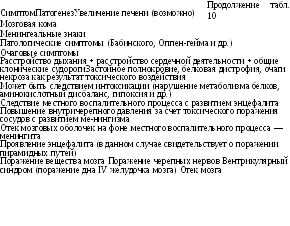
Один и тот же клинический симптом, возникающий у больного с менингококковой инфекцией, может иметь разные причины, механизм развития и, следовательно, требует дифференцированного подхода к назначению патогенетической терапии. В табл. 10 представлены патогенетические механизмы, ответственные за возникновение наиболее часто встречающихся клинических симптомов и синдромов.
Таблица 10. Патогенез ведущих клинических симптомов при генерализованных формах менингококковой инфекции
Симптом
Патогенез
Повышение температуры тела
Снижение температуры тела на пике клинических проявлений
Геморрагическая сыпь
Обширные кровоизлияния, кровотечения Глухость сердечных тонов, нарушение ритма
Снижение АД
Одышка, цианоз
Острая почечная недостаточность (олигурия, анурия)
Действие эндотоксина, в том числе на центр терморегуляции, увеличение количества катехолами-нов
Признак ИТШ
Повреждение токсином сосудов с повышением их проницаемости Бактериальные тромбы
Проявление ДВС-синдрома
Кровоизлияния, нарушения трофики, ишемичес-кие и дистрофические изменения в мышце сердца, эндокарде, перикарде (миокардит, эндокардит, перикардит)
Снижение тонуса сосудов на фоне надпочечни-
ковой недостаточности
ИТШ
Действие гистамина, ацетилхолина, катехолами-нов и др.
Нарушение центральной регуляции гемодинамики Нарушение функции миокарда Иногда — кровотечения на фоне ДВС-синдрома Нарушение функции дыхания в результате повреждения сосудов легких, отек легких Поражение мышцы сердца (сердечная недостаточность) Отек мозга
На фоне ИТШ как проявление действия прере-нальных факторов
Симметричный кортикальный некроз почек Токсико-аллергический нефрит Возможна рефлекторная задержка мочеиспускания
 Клиника.
Локализованные
формы. Менитококконосительство
Клиника.
Локализованные
формы. Менитококконосительство
клинических проявлений не имеет. Диагноз ставят на основании выделения возбудителя из носоглотки и (или) ретроспективно по нарастанию титра специфических антител.
Менингококковый назофарингит. Клинические проявления зависят от тяжести течения.
При легком течении бывает незначительное повышение температуры (до 37—37,5 °С), иногда лихорадка может даже отсутствовать. Длительность лихорадки 1—3 дня. Характерны умеренная головная боль в лобно-теменной области, боль в горле при глотании, иногда появляется охриплость голоса. Заложенность носа, слизисто-гнойное отделяемое из носа — наиболее постоянные и типичные симптомы. Слизистая оболочка задней стенки глотки гиперемирована с гипертрофией фолликулов и гнойной «дорожкой» (слизисто-гнойное содержимое из хоан стекает по задней стенке глотки в виде двух полосок), гиперемирована также слизистая оболочка носа. Могут появиться герпетические высыпания на губах. Легкую форму заболевания очень часто не диагностируют, поскольку больные, самочувствие которых остается вполне удовлетворительным, редко обращаются к врачу.
При среднетяжелом течении больше выражены явления общей интоксикации, температура может достигать 38 °С. Возможны гипотен-зия, тахикардия, головокружение, рвота. Следует помнить, что средне-тяжелое и тем более тяжелое течение для локализованных форм не характерно. Если врач оценивает течение заболевания как среднетяжелое, он должен особенно тщательно осмотреть пациента, поскольку выраженный токсикоз — обычно признак генерализации. Если же на переходной складке конъюнктивы нижнего века, на коже выявляются хотя бы единичные геморрагические высыпания, можно с уверенностью говорить о генерализации процесса. Не следует забывать и о том, что сыпь — не обязательный признак менингококцемии.
При тщательном сборе анамнеза у половины больных с генерализованными формами инфекции можно выявить предшествовавший назофарингит.
Генерализованные формы. Менингококцемия — одна из наиболее тяжелых форм менингококковой инфекции.
Длительность инкубационного периода, как и при других формах, составляет 5—6 дней с колебаниями от 1 до 10 дней.
Чаще заболевание возникает остро, внезапно. Если генерализации предшествовали явления назофарингита, то внезапное ухудшение в виде значительного повышения температуры, головной боли, миалгии, артралгии заставляет думать о начавшейся генерализации процесса. Лихорадка в последующие дни носит постоянный или интермиттирую-щий характер. Появляются разлитая головная боль, которая может сопровождаться рвотой, иногда боль в горле, ринит (если генерализации предшествовал назофарингит). Обращают на себя внимание бледность кожи, тахикардия, иногда — одышка.
Характерным признаком менингококцемии является сыпь, которая нередко появляется уже в первый день или даже в первые часы заболевания. Элементы сыпи чаще всего локализуются на коже дистальных отделов (кисти, предплечья, стопы, голени, ягодицы). Они имеют неправильную звездчатую форму, размеры от мелких петехий до крупных экхимозов диаметром в несколько сантиметров. Элементы плотноваты на ощупь, слегка возвышаются над поверхностью кожи. При тяжелом течении заболевания сыпь может покрывать все туловище и конечности, а в дистальных отделах приобретать характер обширных кровоизлияний с неровными, но достаточно четкими контурами, имеющими вначале вид «трупных пятен», а затем постепенно темнеющих, приобретающих красновато-фиолетовую окраску. В особо тяжелых случаях кровоизлияния на конечностях, сливаясь, образуют зону обширных поражений по типу высоких перчаток, сапог. Такие изменения практически несовместимы с жизнью. Лицо обычно свободно от
сыпи, но кровоизлияния могут проявляться на мочках ушей, ушных раковинах, кончике носа, щеках. Кожа между кровоизлияниями бледная.
В начальный период болезни с геморрагической сыпью могут сочетаться розеолезно-папулезные элементы, но они быстро (через 1—2 дня) исчезают бесследно.
Нередко одновременно с кожными высыпаниями, а чаще — раньше них, появляются кровоизлияния на слизистой оболочке полости рта, склерах, конъюнктиве. При иридоциклохориоидите радужная оболочка приобретает ржавый цвет. Более тяжелые поражения глаз, вплоть до панофтальмита, чрезвычайно редки.
Не на всех участках тела сыпь появляется одновременно. Возможно подсыпание, появление новых высыпаний на уже пораженных участках и на новых, увеличение размеров кровоизлияний. Никакой четкой закономерности в этом процессе нет, иногда в течение суток и даже нескольких часов появляется настолько обильная сыпь (скорее в таких случаях можно говорить о кровоизлияниях, так как элементы этой сыпи иногда достигают такой величины, что их нельзя прикрыть ладонью), что проследить за появлением новых элементов невозможно. К тому же такой вариант высыпаний сопровождается развитием ИТШ со всеми присущими ему чертами — резким снижением АД, тахикардией, падением температуры тела и т.д. Следует помнить, что обилие сыпи, ее характер (мелкие геморрагии или обширные кровоизлияния) являются надежным критерием тяжести состояния больного.
В дальнейшем мелкие геморрагии пигментируются, а затем исчезают бесследно. Крупные элементы нередко уже в первые дни болезни некротизируются, затем покрываются корками, после отторжения которых остаются различной глубины дефекты тканей, которые могут оставлять после себя рубцы. Возможны некроз и сухая гангрена ушных раковин, носа, фаланг пальцев и даже кистей и стоп.
Кровоизлияния в слизистую оболочку желудка (в сочетании с ДВС-синдромом) могут быть причиной желудочных кровотечений, у женщин могут развиваться маточные кровотечения; нередки носовые кровотечения (особенно при развитии ДВС-синдрома).
Поражение сердца проявляется глухостью сердечных тонов, тахикардией, снижением АД, возможны нарушения сердечного ритма.
Нередко, особенно при тяжелом течении с быстрым прогрессирова-нием клинических симптомов, возникают одышка, сухой кашель, обусловленные кровоизлияниями или специфической менингококковой пневмонией, отеком легких или даже поражением плевры.
Возможны увеличение печени и даже незначительная желтуха.
Поражения суставов чаще возникают в виде моноартритов, реже в процесс вовлекаются два сустава и более. Обычно это лучезапястный, локтевой, коленный, тазобедренный суставы. При этом усиливается боль, появляется отечность в области пораженных суставов. При пункции получают гной. В нелеченых случаях наблюдают организацию гноя, возникают контрактуры.
Поражение ЦНС на фоне менингококцемии проявляется умеренной головной болью, бессонницей, иногда — заторможенностью. Сознание, как правило, сохраняется даже при самом тяжелом течении менингококцемии. Но возможно развитие менингизма и энцефалопатии, обусловленных токсическим поражением ЦНС. Появление на фоне менингококцемии резко выраженного менингеального синдрома, потеря сознания, двигательное беспокойство, очаговые симптомы дают основание думать о проникновении возбудителя в ЦНС с развитием ме-нингококкового менингита, энцефалита, а чаще всего — менингоэнце-фалита. Таким образом, возникает комбинированная форма менингококковой инфекции (менингококцемия + менингоэнцефалит). Менингококцемия с учетом ее быстрой, иногда почти молниеносной динамики, непредсказуемости течения, полисистемности поражений должна рассматриваться всегда как тяжелая форма, угрожающая жизни больного, то есть можно говорить лишь о тяжелом и очень тяжелом течении болезни, последнее ассоциируется с ИТШ, синдромом Уотер-хауза—Фридериксена, ДВС-синдромом.
При фульминантной (молниеносной) менингококцемии с момента появления первых симптомов болезни до смерти проходят иногда всего лишь часы. Острейшее начало заболевания (озноб, мышечная боль, резкий подъем температуры тела до 40 °С и выше) с первых часов сопровождается появлением обильной, быстро распространяющейся сыпи, образующей массивные кровоизлияния. На этом фоне быстро, иногда критически, падает температура тела до нормальной и даже субнормальной, нарастают явления сердечной слабости, резко снижается АД, развивается анурия. Могут появляться кровавая рвота, носовые кровотечения, но в большинстве случаев они не успевают развиться, смерть наступает раньше. Ей могут предшествовать потеря сознания, судороги, но нередко больные умирают при полном сознании от острой сердечно-сосудистой недостаточности. На секции помимо множественных кровоизлияний во все органы часто обнаруживают массивные кровоизлияния в корковое вещество надпочечников, неповрежденная ткань в них в особо тяжелых случаях почти отсутствует. В табл. 11 представлена динамика симптомов у больных с острейшим менингококковым сепсисом при переходе из I фазы шока во II. Врач не должен допустить перехода болезни во II фазу, когда помощь может оказаться безрезультатной.
Безусловно,
возможно более легкое течение
менингококцемии, когда бактериемия
проявляется в виде полиморфной сыпи,
сохраняющейся 2—3 ч. Такая сыпь
напоминает коревую, аллергическую,
нередко в этом случае и ставят диагноз
«аллергическая сыпь», «экссудативный
диатез», за которым следуют и
соответствующие диагнозу лечебные
мероприятия. В большинстве случаев,
если правильный диагноз свое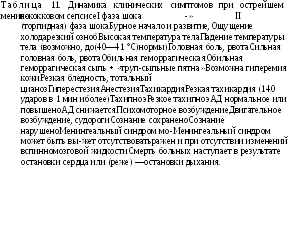
временно не поставлен и лечение больной не получает, в дальнейшем появляется типичная для менингококцемии сыпь с последующим нарастанием клинических симптомов и соответствующей динамикой.
Атипичная менингококцемия. Генерализация менингококковой инфекции может проходить без кожных высыпаний, но с поражением внутренних органов. При этом на первый план выступают признаки поражения отдельных органов или систем (менингококковый миокардит, эндокардит, пневмония). Кстати, пневмония может, как полагают, быть следствием распространения менингококка и по дыхательным путям, а не только менингококцемии. Тем не менее, решить вопрос о том, каким путем произошло обсеменение легких, практически не представляется возможным. Наиболее часто пневмонию вызывают менингококки группы У. Особенностью менингококковой пневмонии является частое сочетание с симптомами поражения верхних дыхательных путей (насморк, сухой кашель, першение в горле). Процесс чаще локализуется в правом легком и бывает достаточно обширным: могут поражаться одновременно вся нижняя и средняя доли. Выздоровление обычно идет медленно, длительно сохраняются кашель, астения. Считают, что предшествующая вирусная респираторная инфекция способствует возникновению менингококковой пневмонии.
Поражение мышцы сердца возникает при менингококковой инфекции значительно чаще, чем его диагностируют. При тяжелом течении заболевания возникают выраженная тахикардия, иногда — ритм галопа на фоне глухости тонов, неприятных ощущений в сердце. Нарастают явления сердечной недостаточности, приводящие к отеку легких.
Перикардит возникает либо в результате кровоизлияний, либо вследствие заноса в перикард менингококков. В последнем случае может развиваться гнойный перикардит. При обследовании таких больных на фоне резкой глухости сердечных тонов может выслушиваться шум трения перикарда.
Менингококки могут вызывать поражения придаточных пазух. Они возникают как при менингококковом назофарингите, так и при генерализованных формах.
Редко (у гомосексуалистов, при орогенитальных контактах) менингококк может быть причиной развития уретрита, напоминающего по клинике гонококковый.
Хроническая менингококцемия характеризуется периодическими рецидивами, сопровождающимися относительно невысокой температурой тела, сыпью, артритами. В крови обнаруживают менингококк. Наблюдений, касающихся хронической менингококцемии, немного, но уже доказано, что она может длиться несколько лет.
Менингококковый менингит (менингоэнцефалит). Обычно начало заболевания острое, внезапное. Одним из первых симптомов является упорная распирающая головная боль, часто она возникает одновременно с повышением температуры, которая может достигать 39—40 °С. Появляются рвота (нередко многократная, не приносящая облегчения), гиперестезия. В первые часы болезни уже можно обнаружить менингеальные знаки (симптомы Кернига, Брудзинского, ригидность затылочных мышц), но их выраженность может еще не соответствовать тяжести процесса в ЦНС. При осмотре у больных иногда выявляют оживление или угнетение рефлексов, нередко их асимметрию. Сознание вначале сохранено, затем нарушается, проходя последовательно стадии оглушенности, сопора, комы. Иногда от момента заболевания до состояния комы проходят не дни, а часы, так быстра динамика. Нередко возникают психомоторное возбуждение, делириозное состояние. Чем раньше наступает потеря сознания, тем хуже прогноз. Возбуждение, потеря сознания, а тем более кома обусловлены поражением вещества головного мозга. При поражении менингококком ЦНС изолированная локализация процесса только на мозговых оболочках или в веществе мозга встречается редко, чаще эти процессы сочетаются. Менингоэнцефалит характеризуется преобладанием с первых дней болезни энцефалитических нарушений над менингеальными: нарушение сознания, ранние парезы и параличи. В тяжелых случаях могут возникнуть генерализованные судороги, опасные тем, что на их фоне может наступить асфиксия. Обычно судороги носят ограниченный характер. У маленьких детей возникает типичная поза — на боку с запрокинутой головой и приведенными к животу ногами, у взрослых такая поза бывает редко.
Изменения функции сердечно-сосудистой системы обычно весьма умеренны: небольшая тахикардия, АД остается нормальным или даже слегка повышается. Более тяжелое состояние развивается, если патологический процесс затрагивает сосудодвигательный центр, при этом нередко возникает брадикардия, возможна внезапная остановка сердца.
Нарушение дыхания (тахипноэ) возможно при гипертермии; кратковременное апноэ может наступить во время общих судорог. При поражении дыхательного центра в IV желудочке может наступить внезапная остановка дыхания.
Поражение черепных нервов протекает в виде токсического или ин-фильтративного неврита. Чаще всего в процесс вовлекаются III и IV пары нервов с развитием диплопии, птоза, анизокории, страбизма, а также VII и VIII пары. Может возникать поражение слухового нерва с выраженным снижением слуха (в прошлом одна из основных причин глухоты).
Длительность заболевания определяется прежде всего своевременностью распознавания болезни и адекватностью лечения. При рано, в 1-е сутки, начатом лечении быстро возникает улучшение и обратное развитие патологических симптомов, у большинства таких больных состояние улучшается раньше, чем санируется спинномозговая жидкость. Удаление гнойного экссудата в период выздоровления происходит путем ферментативного растворения и всасывания его.
Возможна хронизация процесса с развитием в дальнейшем рецидивов, по клиническому течению сходных с заболением, возникшим при первичном заражении. Причина хронизации недостаточно изучена.
Описывают затяжное (до 2 мес) волнообразное чередование периодов улучшений и обострений течения менингоэнцефалита с медленной нормализацией состава спинномозговой жидкости. Чаще оно наблюдается у детей, страдающих гипотрофией, рахитом, экссудативным диатезом.
В клинике в последние годы все чаще встречается менингококковый менингоэнцефалит в сочетании с менингококцемией. При этом наблюдают симптомы, свойственные обеим клиническим формам заболевания: в одних случаях более выражены симптомы поражения ЦНС, в других — проявления сепсиса. Основной задачей врача является решение вопроса о характере поражения ЦНС в этих случаях — токсическое с развитием энцефалопатии и менингизма или воспалительное.
Пожалуй, наиболее надежным методом дифференциальной диагностики этих двух состояний является спинномозговая пункция.
Осложнения. На фоне менингококцемии в острый период болезни могут возникать следующие осложнения:
ИТШ, его возникновение может спровоцировать и назначение мощных антибиотиков, действующих бактерицидно;
ОПН (как преренальная, так и обусловленная поражением самих почек);
ДВС-синдром, на фоне которого могут возникать обильные кровотечения;
— острая надпочечниковая недостаточность (синдром Уотерхау-за—Фридериксена);
отек легких;
инфаркт миокарда (преимущественно у пожилых людей);
отек мозга в результате токсического поражения ЦНС;
панофтальмит.
В более поздние сроки, обычно в период реконвалесценции, иногда возникают:
—гангрена (чаще пальцев верхних и нижних конечностей) как следствие глубоких массивных кровоизлияний; в этих случаях приходится прибегать к ампутации;
— анкилоз суставов после перенесенного гнойного артрита. Своевременное лечение (в том числе оперативное, введение в сустав антибиотиков после извлечения гноя) нередко возвращает суставу подвижность;
постинфекционный миокардиосклероз;
слепота после перенесенного панофтальмита.
Следует разграничивать поражения органов, обусловленные менингококками (их рассматривают как одну из клинических форм генерализованной менингококковой инфекции — менингококковый артрит, менингококковый миокардит и др.), и те, которые возникают в результате действия иммунных комплексов (моно- и полиартриты, перикардит, васкулиты, эписклерит и т.д.).
Хроническая менингококцемия может сопровождаться развитием:
узловатой эритемы;
подострого менингококкового эндокардита;
нефрита.
В развитии этих осложнений основная роль принадлежит действию не самого менингококка, а ИК.
При менингококковом менингоэнцефалите острый период может протекать с такими осложнениями:
— острое набухание и отек мозга как следствие токсикоза, гиперпродукции спинномозговой жидкости, избыточного введения жидкости. Клиническими признаками этого состояния являются нарушение сознания, двигательное беспокойство, судороги, расстройство дыхания, повышение АД и давления спинномозговой жидкости. Прогностически неблагоприятно поражение дыхательного центра;
вклинение продолговатого мозга в большое затылочное отверстие. Наиболее частые причины — резкий отек мозга, неправильно проведенная спинномозговая пункция. При этом возникают гиперемия и цианоз лица, тонико-клонические судороги, угасают корнеальные рефлексы, появляется дыхание Чейна—Стокса. Смерть наступает на фоне остановки дыхания;
синдром церебральной гипотензии возникает при интенсивной дегидратационной терапии. Он проявляется снижением внутричерепного давления (церебральный коллапс), спадением желудочков мозга (вентрикулярный коллапс). На фоне признаков обезвоживания (заострившиеся черты лица, сухость кожи) исчезают менингеальные знаки и сухожильные рефлексы, возникают мышечная гипотензия, ступор, иногда судороги;
эпендиматит (вентрикулит) развивается при поздно начатом лечении, особенно при введении антибиотика в спинномозговой канал. Формирующийся к этому времени спаечный процесс в сочетании с неравномерным распределением антибиотика приводит к тому, что спинномозговая жидкость санируется неравномерно: при санации в спинномозговом канале она не санируется в желудочках мозга. Состояние больного ухудшается, появляются тремор, гипертонус, прострация или беспокойство. Присоединяются расстройства дыхания, клонико-тони-ческие судороги. Прогноз неблагоприятный. На глазном дне — застой сосков зрительных нервов, в спинномозговой жидкости нарастает содержание белка;
субдуральный выпот чаще возникает у маленьких детей. На фоне малоизмененной спинномозговой жидкости ухудшается состояние, поднимается температура тела, нередко она приобретает гектический характер, появляются очаговые симптомы (характер их зависит от локализации выпота). Большие выпоты могут организовываться, приводить к стойким парезам, психическим расстройствам;
при возникновении кровоизлияний в область дна IV желудочка возможна внезапная смерть от остановки сердца или дыхания.
В поздние сроки (иногда спустя месяцы после выписки из стационара) могут развиться:
глухота в результате стойкого повреждения слухового нерва;
снижение интеллекта;
— гидроцефалия в результате нарушения ликвородинамики (особенно у маленьких детей);
— эпилепсия.
При всех формах заболевания возможна активация латентной инфекции (особенно часто herpes simplex). После перенесенной генерализованной формы менингококковой инфекции, особенно тяжело протекавшей, формируется длительный астенический синдром.
Исходы. При отсутствии лечения летальность при менингококцемии достигает почти 100 %, даже при своевременно начатом лечении умирают 10—20 из 100 заболевших. Среди леченых больных менингоэнце-фалитом летальность составляет 3—5 %. Нередко возникают неизлечимые осложнения (глухота, слепота, слабоумие, гидроцефалия, эпилепсия).
Методы диагностики. Общеклинические методы исследования.
В анализе крови при менингкокковом назофарингите может выявляться лишь небольшой лейкоцитоз, но нередко бывает и нормоцитоз в сочетании с незначительным сдвигом в формуле влево, СОЭ нормальная или слегка увеличенная.
Для генерализованных форм характерны выраженный нейтрофиль-ный лейкоцитоз со сдвигом в формуле до юных форм, анэозинофилия, увеличенная СОЭ. При тяжелой менингококцемии возможны тромбо-цитопения, небольшая анемия. Для изолированно протекающего менингита или менингоэнцефалита анемия и тромбоцитопения не характерны. Чаще уровень лейкоцитоза коррелирует с остротой и тяжестью процесса.
Необходимо контролировать уровень гематокрита. В начальный период на фоне циркуляторных нарушений он может увеличиваться, свидетельствуя о сгущении крови. Определение гематокрита в динамике позволяет контролировать объем инфузионной терапии (наиболее простой и доступный метод).
Тяжелая интоксикация может сопровождаться даже лейкопенией, что является плохим прогностическим признаком.
Анализ мочи обычно свидетельствует о токсическом раздражении почек — появляются следы белка, единичные эритроциты, цилиндры. При развивающейся острой почечной недостаточности в моче увеличивается количество белка, эритроцитов, зернистых цилиндров.
Анализ спинномозговой жидкости. Результаты исследования зависят от периода болезни. В первые часы болезни на фоне типичной клиники менингоэнцефалита жидкость может оставаться прозрачной с невысоким (несколько сотен клеток) смешанным цитозом. Но часто уже в 1-е сутки она становится мутной, в клеточном составе 80—90 % приходится на долю нейтрофилов, в окрашенных мазках обнаруживают диплококки, расположенные внутриклеточно в нейтрофилах. Высокий (от нескольких сотен до нескольких тысяч клеток в 1 мм3) цитоз сочетается с невысоким содержанием белка (клеточно-белковая диссоциация), уровень сахара умеренно снижен. Реакция Нонне—Апельта (+ + + +).
На фоне лечения быстро уменьшается цитоз, увеличивается количество лимфоцитов. Цитоз в спинномозговой жидкости менее 100 в
1 мм с преобладанием лимфоцитов, отсутствие менингококков являются показанием к отмене антибиотиков.
При менингизме состав спинномозговой жидкости (клеточный и биохимический) остается нормальным на фоне ее повышенного давления.
При проведении пункции спинномозговую жидкость берут в 4 пробирки: одну отправляют для общеклинического исследования (в общеклиническую лабораторию); другую (стерильную) — в бактериологическую лабораторию для посева; третью — в биохимическую лабораторию; четвертую (если жидкость прозрачная) оставляют в отделении для выявления пленки (для исключения туберкулезного менингита).
Биохимические исследования. Учитывая полиорганность и многофакторность поражений, возникающих при генерализованных формах, объем и характер исследований определяются клинической формой и тяжестью течения процесса. Во всех случаях целесообразно исследовать в динамике КОС и электролитный состав плазмы. При менингококцемии следует контролировать показатели свертывающей системы крови, почечные тесты.
Специфическая диагностика. Выявление возбудителя и его антигенов возможно (в зависимости от клинической формы и периода болезни) в крови, моче, спинномозговой, синовиальной, плевральной, пе-рикардиальной жидкостях, мазках из носа и ротоглотки.
Менингококк может быть обнаружен в исследуемом материале при прямой бактериоскопии мазков, окрашенных по Граму или обработанных метиленовым синим (нефиксированный мазок в течение 2 мин обрабатывают 1% водным раствором метиленового синего).
Обнаружение внутриклеточно и внеклеточно расположенных грам-отрицательных диплококков или одиночных кокков является весомым аргументом в пользу менингококковой инфекции. Метод используют для экспресс-диагностики.
Культуру менингококка можно выделить, засеяв исследуемый материал (кровь, спинномозговую жидкость, отделяемое из носоглотки, плевральную жидкость и др.) на сывороточный агар и другие элективные среды. Перед отправкой в лабораторию спинномозговую жидкость или другой исследуемый материал следует хранить в термостате при температуре +37 "С, но не более 2—3 ч, учитывая нестойкость менингококка во внешней среде. Ответ из лаборатории получают не ранее чем на 4-е сутки после посева. Желательно материал для посевов брать до назначения антибактериальной терапии, так как даже однократный прием антибиотика снижает вероятность обнаружения менингококка.
После выделения возбудителя сложности возникают при необходимости его идентификации по серогруппам, с этой целью используют РА.
Группоспецифический менингококковый антиген можно обнаружить в исследуемом материале с помощью реакций иммуноэлектрофо-реза, преципитации, латекс-агглютинации и др. Все они достаточно специфичны, не дают перекрестных реакций с другими возбудителями.
В последние годы начинает использоваться ПЦР, особую ценность она имеет при обследовании больных, у которых возбудители в спинномозговой жидкости и крови не обнаруживаются.
С помощью этих реакций можно исследовать мочу, так как именно почками возбудитель и его компоненты выводятся из организма. Но необходимо обязательно сочетать исследование мочи с исследованием других биологических жидкостей по одной методике.
Серологические исследования — выявление противоменингококко-вых антител (группоспецифических в РСК, РПГА и др.) — используют для ретроспективной диагностики. Сроки появления антител определяются клинической формой болезни, ее тяжестью. Исследование крови производят в динамике с интервалом 7—12 дней.
Дополнительные методы диагностики — ЭЭГ, компьютерную томографию, ЭКГ, ФКГ — проводят в динамике.
ЭЭГ позволяет уточнить наличие структурных изменений в мозге по его биоэлектрической активности, а КТ особую помощь оказывает в уточнении диагноза при наличии гематом, гидроцефалии и других объемных поражений мозга. К обследованию больного часто привлекаются другие специалисты: окулисты (осмотр глазного дна), невропатологи, отоларингологи, кардиологи, реаниматологи.
Критерии диагноза. Диагноз менингококкового назофарингита помогают поставить следующие клинические проявления:
двусторонний ринит с гнойным (слизисто-гнойным) отделяемым;
гранулезный фарингит с гнойной «дорожкой»;
умеренно выраженные явления интоксикации;
умеренный нейтрофильный лейкоцитоз.
Выявление внутриклеточно расположенных диплококков в назофа-рингеальных мазках и тем более выделение культуры менингококка подтверждает диагноз.
Для менингококцемии характерны:
острое начало заболевания;
предшествовавший назофарингит (признак непостоянный);
выраженный общеинтоксикационный синдром;
высокая температура (до развития ИТШ);
— геморрагическая сыпь, локализующаяся вначале на склерах, конъюнктиве, кистях, стопах, ягодицах;
— появление обширных геморрагии с некрозами (в тяжелых случаях);
— полисистемность поражений;
— возникновение у некоторых больных уже в первые часы болезни таких грозных осложнений, как ИТШ, ДВС-синдром, острая надпочеч-никовая недостаточность;
— выраженный нейтрофильный лейкоцитоз.
Возбудитель может быть обнаружен в крови, в кожных высыпаниях.
При менингококковом менингоэнцефалите для подтверждения диагноза имеют значение:
предшествовавший назофарингит;
острое начало заболевания;
упорная разлитая головная боль, сопровождающаяся не приносящей облегчения рвотой;
наличие менингеальных знаков, очаговых симптомов, признаков поражения вещества головного мозга в сочетании с геморрагическими высыпаниями на коже (даже единичными). Это очень важный признак, поскольку изолированные поражения ЦНС очень трудно по клиническим признакам отличить от гнойного менингоэнцефалита другой этиологии;
гнойный характер спинномозговой жидкости, наличие в ней вне-и внутриклеточно расположенных грамотрицательных диплококков;
— нейтрофильный лейкоцитоз;
— быстрый эффект от антибактериальной терапии в адекватных дозах (пенициллин, левомицетина сукцинат растворимый и др.).
Дифференциальный диагноз. 1. Менингококковый назофарингит
приходится дифференцировать с различными поражениями носоглотки вирусной, бактериальной, аллергической природы.
Поражение носоглотки, вызванное респираторными вирусами (гриппозными и парагриппозными вирусами, риновирусами, аденовирусами), отличают следующие признаки:
характер отделяемого из носа (при ОРВИ — водянистые, серозные; при менингококковой инфекции — гнойные, слизисто-гнойные с первого для болезни);
отсутствие характерных для менингококкового назофарингита гнойных «дорожек»;
— отсутствие лейкоцитоза, нейтрофилеза в крови. Гайморит от менингококкового назофарингита отличают:
поражение преимущественно одной пазухи (отсюда — одностороннее гнойное отделяемое из носа);
длительное упорное течение с периодическими рецидивами;
характерная рентгенологическая картина (затемнение верхнечелюстной пазухи, возможно наличие «уровня»);
отсутствие контагиозное™.
Общими признаками для менингококкового назофарингита и дифтерии носоглотки являются умеренная интоксикация, боль в горле, серозно-гнойное отделяемое из носа. Однако при дифтерии:
отделяемое из носа может приобретать слизисто-кровянистый характер;
местный процесс может сопровождаться образованием высыпаний и корочек на слизистой оболочке у входа в нос;
на слизистой оболочке носа, глотки могут появляться белесоватые, с трудом снимающиеся налеты, после снятия которых обнажается кровоточащая поверхность;
процесс может распространяться на слизистую оболочку миндалин, нёба, гортани и т.д.;
слизистые оболочки ротоглотки отечны, цианотичны (гиперемия выражена в меньшей степени);
отсутствует гнойная «дорожка»;
— в отделяемом из носа обнаруживают палочки в форме гантели. 2. Менингококцемию следует дифференцировать прежде всего с
заболеваниями, ведущими симптомами которых являются интоксикация и сыпь.
Скарлатину от менингококцемии отличают:
— «пылающий зев», «малиновый» язык;
обильная мелкоточечная сыпь на гиперемированном фоне кожи, захватывающая лицо, туловище, конечности; особенно обильна сыпь в местах естественных складок;
наличие носогубного треугольника (бледного участка кожи, свободного от сыпи);
— ангина — частый признак;
в мазках обнаруживают грамположительные кокки. Для кори в отличие от менингококцемии характерны:
наличие пятен Коплика;
— этапный характер пятнистых высыпаний с наиболее обильной сыпью на лице и туловище;
явления трахеобронхита;
необильное серозное отделяемое из носа;
лейкопения.
Ветряная оспа от менингококцемии отличается прежде всего характером высыпаний и их четкой динамикой: (пятно-»папула-»везику-ла—шустула (не всегда)—жорочка). Для менингококковой инфекции пустулезные высыпания не характерны. В 1-е же сутки болезни, когда еще нет типичных везикул, отличием ветряной оспы является обилие высыпаний на лице.
При инфекционном мононуклеозе высыпания бывают полиморфными, даже геморрагическими. Однако:
— локализация сыпи на кистях и стопах для мононуклеоза не характерна;
часто бывает ангина;
характерна генерализованная лимфаденопатия;
гепатоспленомегалия — постоянный признак;
— в крови выявляются атипичные мононуклеары на фоне лимфомо-ноцитоза.
Для сыпного тифа характерны выраженная интоксикация в сочетании с геморрагической сыпью. Отличают его от менингококцемии следующие симптомы:
позднее (3—5-й день) появление сыпи, локализующейся преимущественно на боковых поверхностях грудной клетки, сгибательной поверхности верхних конечностей; кисти и стопы от сыпи свободны;
кратковременное снижение температуры тела перед появлением сыпи (температурный «врез»);
— увеличение печени и селезенки;
характерный внешний вид больного — «красные глаза на красном лице»;
рано выявляющиеся бульбарные расстройства (симптом Говорова—Годелье, дизартрия и др.);
— отсутствие ринита, фарингита;
— в крови обнаруживаются плазматические клетки Тюрка (до 8—10 %).
Для лептоспироза, как и для менингококцемии, характерны острое начало, тяжелая интоксикация, обильная геморрагическая сыпь. В отличие от менингококцемии лептоспирозу присущи следующие симптомы:
жестокая миалгия с преимущественной локализацией боли в икроножных мышцах;
поражение почек — один из наиболее постоянных и ранних признаков, проявляющийся гематурией с последующим развитием острой почечной недостаточности;
гиперемия и одутловатость лица;
отсутствие катаральных явлений;
увеличение печени и селезенки;
желтуха (при желтушных формах);
артралгия, но не артрит;
в гемограмме — прогрессирующая анемия, резко увеличенная СОЭ;
в крови или спинномозговой жидкости могут быть обнаружены лептоспиры (при исследовании «раздавленной» капли в темном поле).
Клинику септической формы иерсиниоза и менингококцемии сближают острое начало, лихорадка, интоксикация, наличие геморрагической сыпи, вероятность возникновения артритов.
Септическая форма иерсиниоза отличается от менингококцемии:
— лихорадкой чаще неправильного типа, сопровождающейся резким ознобом и потом;
локализацией сыпи (она наиболее обильна на туловище);
наличием гепатолиенального синдрома;
наличием болезненных и увеличенных периферических лимфатических узлов;
увеличением мезентериальных лимфатических узлов, что может вызвать появление боли в животе и положительного симптома Падал-ки;
вероятностью нарушения функции печени с умеренной гиперг ферментемией;
возможностью длительного течения заболевания;
нередкими эозинофилией, анемией.
Очень затруднена дифференциальная диагностика острейшего ме-нингококкового сепсиса (молниеносной менингококцемии) с сепсисом другой этиологии, так как он также может сопровождаться ИТШ и тяжелыми сосудистыми расстройствами. Пожалуй, наиболее надежные признаки острейшего менингококкового сапсиса — наличие назофарингита и выделение менингококка.
ГЛПС от менингококцемии отличают следующие особенности:
пребывание в эндемичной по ГЛПС местности;
мучительная постоянная головная боль;
для начального периода заболевания характерны одутловатость и гиперемия лица;
ведущий признак — поражение почек с выраженной гематурией и развитием ОПН;
характерны локализация (в области ключиц, шеи, на лице, в подмышечных впадинах) и характер (в виде полос, напоминающих удар хлыста) сыпи;
позднее появление сыпи (с 3—4-го дня заболевания);
часто возникающая боль в животе и в поясничной области;
увеличение печени;
— в гемограмме — гиперлейкоцитоз с плазмоцитозом (10—20 %), СОЭ резко увеличена.
Тромбоцитопеническая пурпура отличается от менингококцемии:
преимущественно постепенным началом;
длительным хроническим течением;
частыми кровотечениями, особенно из слизистой оболочки полости рта;
локализацией сыпи преимущественно на коже туловища и сгиба-тельной поверхности верхних конечностей;
отсутствием в классических случаях поражений суставов и сердечно-сосудистой системы;
— частым увеличением селезенки;
— выраженной гипохромной анемией, тромбоцитопенией.
Геморрагический васкулит, как и менингококцемия, может протекать с лихорадкой, высыпаниями (иногда геморрагическими), артритами. Однако он отличается тем, что:
протекает более длительно;
сыпь бывает преимущественно папулезная, уртикарная, эритема-тозная, лишь некоторые элементы приобретают геморрагический характер;
сыпь располагается симметрично, преимущественно на разгиба-тельной поверхности конечностей, вокруг суставов;
кровотечения не характерны;
часто возникают серозные артриты;
возможно увеличение селезенки;
иногда возникают кровоизлияния в оболочки и вещество мозга с соответствующими изменениями в спинномозговой жидкости;
в крови выявляется незначительный лейкоцитоз или нормоцитоз.
3. Менингококковый менингит (менингоэнцефалит). Менингеальный синдром появляется при многих патологических состояниях. Он может быть обусловлен воспалительным процессом в мозговых оболочках (менингит), токсическим раздражением их с нарушением ликво-родинамики, отеком (менингизм), очаговым поражением сосудов.
Причиной воспалительных изменений наиболее часто бывают бактерии (гнойное воспаление) или вирусы (серозное). Явлениями менин-гизма могут сопровождаться многие инфекционные заболевания, протекающие с выраженным токсикозом (грипп, тяжело протекающая пневмония, сальмонеллез и др.).
Исследование спинномозговой жидкости при менингеальном синдроме обязательно. Даже при наличии четких клинических и лабораторных данных, позволяющих верифицировать заболевание, при котором появился менингеальный синдром (энтеровирусные заболевания, грипп, лептоспироз и др.), решить вопрос о характере возникающих на этом фоне поражений ЦНС (менингит? менингизм? кровоизлияние?) не представляется возможным без спинномозговой пункции. И при явной клинике менингококкового менингита (менингоэнцефалита), подтвержденного выделением возбудителя из носоглотки, пункция необходима для определения давности процесса, его тяжести.
Основные дифференциально-диагностические признаки, на которые следует обращать внимание при исследовании спинномозговой жидкости, представлены в табл. 12.
При проведении спинномозговой пункции необходимо соблюдать ряд правил.
Так, перед пункцией больной должен быть осмотрен окулистом: при застойном соске зрительного нерва от нее следует временно воздержаться, назначив сначала дегидратационную терапию. Если все же ее
 On
On
On
On
необходимо произвести по жизненным показаниям, спинномозговую жидкость следует выпускать редкими каплями, под прикрытием манд-рена, чтобы избежать вклинения.
Одномоментно следует выпускать не более 3—5 мл жидкости и не делать пункцию часто (ежедневно), так как это приведет к компенсаторной гиперпродукции спинномозговой жидкости.
На основании только клинических признаков провести дифференциальную диагностику между вирусным и бактериальным менингитами (менингоэнцефалитами) в подавляющем большинстве случаев не представляется возможным. Поэтому исследование спинномозговой жидкости может играть решающую роль. Однако туберкулезный менингит и субарахноидальное кровоизлияние имеют некоторые клинические отличия, позволяющие подумать об этой патологии еще до того, как будет произведена спинномозговая пункция.
Так, при туберкулезном менингите в отличие от менингококкового:
часто имеются указания на перенесенный туберкулез (туберкулезный менингит всегда бывает вторичным);
при осмотре обнаруживаются признаки поражения легких, а иногда и лимфатических узлов;
заболевание начинается постепенно, все клинические симптомы (головная боль, тошнота, рвота, менингеальные знаки) нарастают постепенно;
температура тела также нарастает постепенно, редко достигая высоких показателей;
явления назофарингита не характерны;
нередко выявляется поражение черепных нервов (VI—VIII пары);
— заболевание имеет тенденцию к длительному, упорному течению. При субарахноидальном кровоизлиянии:
следует обращать внимание на возраст больных, этот патологический процесс развивается преимущественно у лиц пожилого возраста;
в анамнезе часто имеются указания на наличие хронических заболеваний сосудов или на предшествовавшие данному заболеванию различные провоцирующие факторы (физические нагрузки, стрессы и т.д.);
— заболевание возникает остро, внезапно, в виде «удара»;
нередко с первых же минут болезни возникает спутанность или даже потеря сознания, возможны судороги;
температура тела нормальная в первые дни болезни, в дальнейшем (с 3—4-го дня) может повышаться до субфебрильной;
часто в ранние сроки можно выявить очаговые симптомы (их локализация и выраженность зависят от локализации и обширности зоны поражения ЦНС).
При различных коматозных состояниях, которые сопровождают тяжелое течение сахарного диабета, почечной и печеночной недостаточности, может возникнуть менингеальный синдром.
Общими признаками коматозных состояний и менингита (менингоэнцефалита) являются нарушения сознания, дыхания и сердечной деятельности, судороги, появление менингеальных симптомов и очаговой церебральной симптоматики.
При уремической коме в анамнезе имеются указания на болезнь почек. С развитием уремии появляются сонливость, беспокойство, судорожные подергивания мышц лица, конечностей. Сухожильные рефлексы высокие. В крови повышен уровень мочевины, креатинина. Определяются низкая относительная плотность мочи (1006—1010), альбуминурия, гематурия. В периферической крови — анемия, лейкоцитоз.
При диабетической (гипергликемической) коме в анамнезе имеются указания на сахарный диабет. Она развивается постепенно, начинаясь со слабости, головокружения, головной боли. Температура нормальная или снижена. Затем возникают нарушение сознания, расстройство дыхания (по типу Куссмауля). Лицо бледнеет. Появляется запах ацетона изо рта. Кожа сухая, в области ладоней, стоп слегка жел-тушна. Гипотония глазных яблок, мышц, гипорефлексия — характерные признаки. Развивается артериальная гипотензия, возможно развитие коллапса. Бывают задержка мочи или непроизвольное мочеиспускание. Содержание сахара в крови значительно повышено. Сахар появляется в моче в сочетании с повышенным количеством лейкоцитов, эритроцитов, белка. В периферической крови — лейкоцитоз.
Гипогликемическая кома развивается при передозировке инсулина или при особой к нему чувствительности. Характерны резкая общая слабость, раздражительность, чувство голода, головокружение, сердцебиение, иногда аритмия, тремор, усилено потоотделение. В дальнейшем появляются психические расстройства, бред, судороги, паралич сфинктеров, артериальная гипотензия. Реакция мочи на сахар отрицательная. Запах ацетона изо рта отсутствует. Не характерны гипотония глазных яблок, нарушение дыхания по типу Куссмауля.
Кома на фоне ВГ развивается обычно постепенно, она также сопровождается потерей сознания, двигательным возбуждением, может появиться менингеальный синдром. Поставить диагноз проще, если все эти изменения происходят на фоне выраженной желтухи, гепатоспленомегалии и сопровождаются повышением активности печеночных цитолитических ферментов. При спинномозговой пункции (если в этом возникает необходимость) можно получить жидкость, практически соответствующую той, какая бывает при менингизме.
Следует помнить и о других, более редко встречающихся комах (эклампсическая, алкогольная, малярийная и др.).
Лечение. В лечении различных форм менингококковой инфекции важнейшую роль играют антибактериальные препараты. Выбор их, доза, длительность курса лечения определяются чувствительностью менингококка к данному препарату, клинической формой заболевания, тяжестью течения.
I. Локализованные формы. Санацию бактерионосителей можно проводить в домашних условиях, больных с менингококковым назофа- рингитом следует госпитализировать с учетом непредсказуемости дальнейшего развития инфекционного процесса.
Эти©тропную терапию можно проводить левомицетином (0,75 г 4 раза в сутки) или ампициллином (0,5 г 4 раза в сутки), длительность лечения 5 дней. Все меньшей популярностью пользуются сульфаниламиды из-за частого развития вызываемых ими различных побочных реакций, низкой чувствительности к ним менингококков. По эффективности они уступают антибиотикам. При назофарингите одновременно с антибактериальными средствами назначают полоскание горла растворами фурацилина, гидрокарбоната натрия. С учетом наличия у менингококка аллергизирующего фактора из патогенетических средств можно назначить диазолин или тавегил. Контрольный бактериологический посев следует делать не ранее чем через 2 дня после окончания курса лечения антибактериальными препаратами.
II. Генерализованные формы. Больные с генерализованными фор- мами подлежат срочной госпитализации в инфекционные стационары, желательно в реанимационные отделения или палаты интенсивной те- рапии, где им обеспечивается постоянное круглосуточное наблюдение. Режим строгий постельный.
Менингококцемия. Желательно, чтобы больные с таким диагнозом доставлялись в стационар шоковой бригадой, поскольку сама транспортировка больного может сопровождаться бурным прогрессирова-нием заболевания. Главное на догоспитальном этапе — не допустить развитие ИТШ. Врач скорой помощи не должен начинать антибактериальную терапию до поступления больного в стационар, а глюкокортикостероиды (не менее 40—60 мг преднизолона внутривенно) следует ввести перед транспортировкой.
Этиотропная терапия. При выборе антибактериального препарата следует помнить о спектре чувствительности менингококка, характере действия препарата. Наиболее эффективен пенициллин, оказывающий выраженное бактерицидное действие на менингококк. Однако именно высокая активность препарата требует большой осторожности при назначении его больным с менингококцемией, особенно сопровождающейся развитием ИТШ, так как лечение пенициллином может усугубить явления шока. Не рекомендуется назначать и другие препараты, обладающие бактерицидным действием, из-за возможности усиления эндотоксических реакций.
Значительно менее выражено бактерицидное действие на менингококк при применении обычных терапевтических доз левомицетина. Поэтому ему отдают предпочтение. Обычно назначают левомицетина сукцинат (суточная доза до 4 г, вводят равными частями через каждые 6—8 ч внутримышечно или внутривенно).
В первые дни заболевания антибиотики, как и другие препараты, следует вводить внутривенно. Чтобы обеспечить постоянный доступ к вене (локтевой или подключичной), проводят катетеризацию.
Длительность курса лечения — не менее 10—12 дней. При явном улучшении состояния больного можно перейти на внутримышечное введение антибиотика. Если необходимо пролонгировать антибактериальную терапию, можно через 7—10 дней заменить один антибиотик другим. Эффективен при лечении менингококцемии тетрациклин (25 мг/кг массы тела больного в сутки), но внутримышечное введение его весьма болезненно, а внутривенное нередко вызывает флебиты. Пероральное применение антибиотиков при менингококцемии нецелесообразно, так как нарушается всасывание препаратов.
Патогенетическая терапия. Дезинтоксикационную терапию осуществляют солевыми растворами («Ацесоль», 5 % раствор глюкозы, раствор Рингера). При необходимости проводят коррекцию КОС и электролитов. Общее количество введенной жидкости должно составлять около 40 мл/кг массы тела в сутки. Если рвоты нет и больной может пить, внутривенное введение растворов желательно ограничить и перейти на пероральную детоксикацию. Обязательно в ходе лечения следить за водным балансом, учитывая возможность задержки жидкости в организме с последующим развитием отека легких и мозга. Нецелесообразно применение на фоне выраженных микроциркуляторных нарушений коллоидных растворов (реополиглюкин, полиглюкин), так как они способствуют развитию отека легких и сердечной недостаточности. Иногда может возникнуть необходимость в назначении мочегонных средств, с этой целью внутривенно вводят лазикс. Внутривенное введение гепарина (10 ООО — 20 000 ЕД в сутки) на ранней стадии ИТШ препятствует развитию ДВС-синдрома; в дальнейшем лечебную тактику будут определять характер и глубина коагуляционных нарушений.
При менингококцемии применение глюкокортикостероидов обязательно, так как это мощное противовоспалительное и противоаллергическое средство. Необходимо также учитывать, что при поражении надпочечников необходима заместительная терапия.
Особенно важно выбрать адекватную дозу глюкокортикостероидов при тяжелом течении менингококцемии в первые дни (часы) болезни, когда гипофункция надпочечников может быть связана со стрессом. В этих случаях иногда необходимо назначать преднизолон в очень большой дозе — по 30—60 мг, а иногда и более через каждые 40—50 мин до стабилизации АД. От допамина лучше в это время воздержаться. Такая массированная гормональная терапия редко бывает необходима более 1—2 дней, затем быстро, в течение 1—2 дней, дозы глюкокортикосте-роидов снижают до 30—40 мг в сутки. Обычно большие дозы глюко-кортикостероидов бывают необходимы лишь при развитии или угрозе развития ИТШ. Если снижение АД связано с заболеванием сердца (фоновым или возникшим в ходе данного инфекционного процесса), то водно-солевые растворы следует применять осторожно, так как увеличивается опасность развития отека легких. Целесообразно назначение дигиталиса в обычных терапевтических дозах. Показана оксигенотера-пия.
При менингококковом менингите (менингоэнцефалите) эффективность лечения в значительной мере определяется ранним назначением антибиотика: если лечение начато с первого дня болезни, то заболевание может принять абортивное течение, а спинномозговая жидкость останется серозной.
При проведении антибактериальной терапии этим больным следует соблюдать ряд правил:
выбранный для лечения антибиотик должен хорошо проникать через гематоэнцефалический барьер, обладать минимальной токсичностью для ЦНС и всего организма, к нему не должен быть резистентным менингококк;
не следует применять комбинации антибиотиков, так как это сопровождается усилением токсического действия на ЦНС;
не следует вводить антибиотик непосредственно в спинномозговой канал, так как это может привести к усилению местных токсических реакций (возможны судороги на этом фоне) и способствовать позже развитию вентрикулита;
в ходе лечения нельзя уменьшать дозу препарата, так как и без того при уменьшении воспаления снижается проницаемость гематоэн-цефалического барьера и, следовательно, концентрация антибиотика в спинномозговой жидкости;
при назначении мочегонных средств (а это обязательный компонент медикаментозной терапии при менингите) быстрее уменьшается концентрация антибиотика в спинномозговой жидкости, поэтому интервалы между введением препарата должны быть короче;
длительность антибактериальной терапии должна быть не менее 10—12 дней. Показанием к ее отмене (в комплексе) являются нормализация температуры, исчезновение менингеальных знаков, санация спинномозговой жидкости.
Препаратом выбора является пенициллин. Его назначают в суточной дозе до 24 ООО ООО ЕД (большие дозы уже могут оказать токсическое действие), интервал между введением доз — не более 3 ч. Следует чередовать калиевую и натриевую соль пенициллина, чтобы избежать гиперкалиемии. В такой же дозе можно назначать пенициллин G, при этом уменьшается частота инъекций (2—4 раза в сутки). Эффективен и ампициллин в суточной дозе до 400 мг/кг массы тела больного.
При непереносимости пенициллина можно назначать левомицетина сукцинат растворимый (до 4 г в сутки), оксациллин (до 300 мг/кг массы в сутки с интервалами между введениями не более 3 ч, но он хуже проникает через гематоэнцефалический барьер, оказывая к тому токсическое действие на клетки головного мозга). Можно назначить тетрациклин внутривенно, он хорошо проникает через гематоэнцефалический барьер. Эффективны также цефалоспорины третьего поколения (цеф-триаксон, цефотаксим). Обладая широким спектром действия, они показаны в тех случаях, когда еще не уточнена этиология гнойного менингита.
Патогенетическая терапия включает применение глюкокортикосте-роидов, предпочтительнее дексаметазон (выпускается в ампулах, содержащих в 1 мл 0,004 г препарата). Он обладает способностью купировать отек мозга, не вызывает задержку солей и воды в организме. Минимальная суточная доза — 2—3 мг (до 8—10 мг), вводить его можно внутривенно. Вопрос о длительности гормонотерапии решают индивидуально, но обычно бывает достаточно 4—6 дней. Обязательно назначают мочегонные средства, при этом осмотические диуретики (15 % раствор маннитола, 30 % раствор мочевины) следует сочетать с лазик-сом, эуфиллином. Можно использовать 20 % раствор альбумина, если нет признаков сгущения крови. Осуществляют парентеральную деток-сикацию солевыми растворами, при необходимости — коррекцию КОС. Показана оксигенотерапия.
При лечении комбинированной формы (менингококцемия + менингоэнцефалит) любой препарат оценивают применительно к каждому из этих двух патологических состояний, учитывая степень тяжести каждого из них.
Так, например, среди этиотропных средств предпочтение следует отдать левомицетина сукцинату, так как он все же проходит через гематоэнцефалический барьер и не усиливает явления эндотоксикоза (так как на менингококк он действует преимущественно бактериоста-тически). Можно назначать тетрациклин. Пенициллин предпочтительнее других препаратов, если менингококцемия не сопровождается ИТШ. Введение растворов следует уменьшить с учетом поражения ЦНС. От назначения эуфиллина следует воздержаться, так как давление и без того имеет тенденцию к снижению. Не назначать мочегонные средства, пока не стабилизируется АД. Исключить мочевину из лечебных средств, так как при менингококцемии могут поражаться почки.
Выбор дозы гормонов и длительности курса лечения определяются состоянием надпочечников, вероятностью развития ИТШ и других осложнений.
Таким образом, единой схемы лечения при смешанных формах быть не может.
Следует помнить, что чем больше медикаментов получает больной, тем больше вероятность побочных реакций (токсических, аллергических).
Порядок выписки из стационара. Реконвалесцентов, перенесших генерализованные формы менингококковой инфекции, выписывают после полного клинического выздоровления, но не ранее чем через 3 нед от начала болезни. Все, перпенесшие менингит, должны находиться под наблюдением невропатолога и участкового врача не менее 2 лет. При благоприятном исходе болезни обследование проводят в течение первого года 1 раз в 3 мес, в течение второго года — 1 раз в б мес. При наличии остаточных явлений назначают соответствующее лечение.
Профилактика. Общая профилактика сводится к своевременному выявлению, изоляции и лечению больных с различными формами менингококковой инфекции, мероприятиям в очаге (санитарная обработка, наблюдение за контактными).
Специфическая профилактика обеспечивается вакцинацией. Изготовлены вакцины, содержащие капсульный полисахарид менингококков типа А, С, У, W135. Имеются моновакцины (А и С), бивалентные вакцины (А + С), квартавакцины (A + C + y+W135).
Вводят вакцину однократно внутримышечно, доза зависит от возраста. Слабый иммунный ответ вырабатывается у детей в возрасте до 2 лет, что объясняется несовершенством иммунной системы. В остальных возрастных группах получен хороший эффект: А-вакцина обеспечивает защиту на 2 года, С — на 2—4 года.
Против менингококков типа В вакцины пока нет, что объясняется слабой иммуногенностью этого возбудителя.
Целесообразность проведения экстренной профилактики контактным антибиотиками или сульфаниламидами признается не всеми.
Легионеллез
Легионеллез — острое инфекционное заболевание с капельным механизмом передачи, вызываемое легионеллами и характеризующееся широким диапазоном клинических проявлений — от субклинических или относительно легко протекающих респираторных заболеваний до тяжелой патологии легких, нервной системы, пищеварительного тракта и др. (лат. — legionellesis, англ. — legionella infections, legionellesis).
Термины «болезнь легионеров» (legionnaires disease — англ.), «питтс-бургская пневмония» (Pittsburg pneumonia — англ.), «лихорадка Понтиак» (Pontiac fever — англ.) являются не синонимами, а обозначениями клинических форм инфекции, вызываемой легионеллами.
Краткие исторические сведения. Впервые вспышка легионеллеза была зарегистрирована в Филадельфии (США) в июле-августе 1976 г. Болезнь охватила главным образом участников конгресса организации «Американский легион», что обусловило в дальнейшем ее название «болезнь легионеров». Заболел 221 человек, из них 34 — умерли. Заболевшие проживали в отеле «Белью-Стратфорд» или поблизости и посещали заседания конгресса. Через 5 мес L.Mc Dade (1977) выделил неизвестную ранее грамотрицательную палочку из легочной ткани человека, умершего во время вспышки. Этиологическая роль выделенного микроорганизма была доказана ретроспективно при изучении ранее взятых сывороток больных, в которых был выявлен высокий уровень специфических антител к выделенному новому микроорганизму. Ретроспективное изучение сывороток, хранившихся в Центре по контролю за болезнями в г. Атланте (США), показало, что тот же возбудитель послужил причиной возникновения не расшифрованных ранее ОРЗ в Вашингтоне (1965), в г. Понтиак штата Мичиган (1968), в г. Бени-дорм в Испании (1973). В последующие годы около 200 вспышек заболеваний со сходной клиникой были зарегистрированы в США, Великобритании, Испании, Италии, Франции, Швеции, ФРГ, ЮАР, Нидерландах, Греции и других странах мира. В ноябре 1978 г. на Международном симпозиуме по болезни легионеров, проходившем в г. Атланте (США), для возбудителя новой инфекции было предложено название Legionella pneumophila. Позже была установлена серологическая неоднородность легионелл.
Актуальность. Легионеллезы регистрируются практически во всех странах мира и наносят обществу значительный экономический ущерб, что обусловлено длительной временной утратой трудоспособ-
ности, тяжестью течения, высокой (1—50 %) летальностью. С каждым годом отмечается рост заболеваемости в Великобритании, Канаде, Австралии, США, Франции и других странах мира. Удельный вес легио-нелл в этиологической структуре острых пневмоний достигает в различных регионах 5—20 %. В США заболевания, вызываемые Legionella pneumophila, составляют 7—12 на 100 ООО в год.
Легионеллез относится к числу «новых» инфекций, поэтому наши сведения об этой инфекционной патологии еще далеко не полные.
Этиология. Возбудитель легионеллеза относится к роду Legionella, семейству Legionellaceae. К настоящему времени известно около 30 видов легионелл, из которых лишь 12 достоверно вызывают заболевание у человека: L.pneumophila, L.micdadei, L.bozemanii, L.jordanis, L.gor-manii, L.longbeachae 1 и 2, L.oakridgensis, L.wadsworthii, L.dumoffii, L.feeleii, L.hackeliae, L.maceachernii. Вид L.pneumophila является наиболее представительным по числу входящих в него серогрупп (12] и наиболее изученным. Легионеллы — ДНК-содержащие грамотрицатель-ные палочковидные бактерии диаметром 0,5—0,7 мкм и длиной 2— 3 мкм. Встречаются более длинные формы — до 50 мкм, а также кокко-видные и плеоморфные формы. Хорошо окрашиваются по Гименесу (D.Gimenez, 1964) гематоксилином и эозином, импрегнацией серебром по Дитерле. Микроорганизмы располагаются вне- и внутриклеточно. Некоторые из внутриклеточных форм близки морфологически к грам-отрицательным внутриклеточным облигатным паразитам типа риккет-сий и хламидий. В легких человека бактерии обнаруживаются в некротических альвеолярных макрофагах. Электронно-микроскопические исследования выявили у легионелл жгутики (1 или 2), обеспечивающие поступательное движение возбудителя.
Легионеллы — факультативные паразиты, требующие для своего роста максимально обогащенную искусственную питательную среду (ВСУЕ-агар) со специфической добавкой (полимиксин и др.). Подходящей средой для легионелл является также агар Мюллера—Хинтона с добавлением гемоглобина (1 %) и изовитолекса (1 %). Для всей группы легионеллоподобных микроорганизмов наиболее надежным остается культивирование в куриных эмбрионах. Оптимальная температура роста + 35 "С, рН 6,9—7,0. При температуре ниже 25 °С и выше 42 °С рост отсутствует. Ухудшение роста легионелл отмечается при снижении концентрации кислорода и полностью прекращается в анаэробных условиях.
Легионеллы отличаются значительной устойчивостью. В воде из крана при температуре + 4 °С они выживают в течение года, в дистиллированной воде — 120 дней, при —70 °С — несколько лет, а при температуре + 32...+ 40 "С могут даже размножаться.
При исследовании биохимического спектра активности различных штаммов легионелл существенных различий не обнаружено. Все легионеллы обладают выраженной ферментативной активностью: они выделяют р-лактамазу (она инактивирует пенициллин, но не действует на цефокситин или цефуроксим), протеолитические ферменты, эстеразы, фосфатазу, фосфоамилазу и др. Предполагают, что ферментативная активность легионелл различна в разных условиях (при паразитическом существовании в организме человека или животного, росте на искусственных средах и в природной водной среде).
Антигенная структура легионелл представляется достаточно сложной. Многие анаэробные и аэробные бактерии могут давать перекрестные реакции с легионеллами. Выделен группоспецифический антиген — липидо-протеино-карбогидратный комплекс. На поверхности бактериальной клетки имеется также специфический для каждой группы высокомолекулярный карбогидратный антиген.
Основным фактором патогенности легионелл являются термостабильные эндотоксины. Они многокомпонентны, сложны по структуре, имеют в своем составе гемолизины, цитотоксины. Один из эндотоксинов нарушает потребление кислорода и бактерицидную активность макрофагов, что играет важную роль в прорыве защиты против легионелл при инфицировании. Токсическая активность утрачивается лишь после 30 мин кипячения. Не исключается наличие экзотоксина. Легио-неллы стимулируют продукцию специфических антител.
Эпидемиология. Возбудитель легионеллеза — естественный обитатель открытых водоемов, почвы, грунтовых вод. Особенно благоприятные условия для жизни и размножения микроорганизмов создаются в воде систем кондиционирования воздуха рециркуляторного типа, водных охладительных установок, головок душа, испарительных конденсаторов, искусственных термальных водоемов промышленных и энергетических объектов (в том числе атомных электростанций), а также ирригационных сооружений, водопроводного и лабораторного оборудования, плавательных бассейнов, массажных ванн. Легионеллы выделяются из природных водоемов в ассоциациях с фотосинтезирующими сине-зелеными водорослями, причем фотосинтетическая активность последних влияет на скорость их размножения. Доказано, что морфология, питательные потребности и метаболизм легионелл адаптированы к существованию внутри амёб, в одной амёбе может находиться более 1000 микробных клеток. Таким образом, легионелла — типичный представитель группы сапронозных инфекций, при этом возбудитель может длительно обитать в окружающей среде, но при попадании в организм не погибает, а использует его как новую среду обитания.
Восприимчиво к инфекции население всех возрастных групп. Возраст больных, у которых заболевание протекает с поражением легких, составляет 50—60 лет, а заболевших лихорадкой Понтиак — 18—39 лет. Болезнь легионеров в 2—4 раза чаще регистрируют у мужчин. Дети заболевают редко, иногда в возрастной группе до 2 лет заболевание встречается в виде спорадических случаев.
Выявление антител к легионеллам в сыворотках крови домашних животных и обезьян указывает на возможное их заражение в естественных условиях.
Путь передачи инфекции — аэрогенный, хотя не во всех известных случаях он убедительно доказан. При этом в помещение, где находятся люди, поступает воздух из системы кондиционеров, содержащий ле-гионеллы. О возможности передачи инфекции от человека к человеку до сих пор ведутся дебаты, хотя имеются данные, достаточно убедительно свидетельствующие о такой вероятности. Так, L.Saravolatez (1979) в реакции гемагглютинации выявил более высокие титры антител к L.pneumophila у группы сотрудников, работавших с больными болезнью легионеров. Имеются сведения и о разной степени контагиозное™ при различных клинических формах легионеллезов.
Заболевания регистрируют в виде вспышек и спорадических случаев. Обращает на себя внимание выраженная сезонность заболевания: эпидемические вспышки возникают преимущественно в летнее время, что связано с интенсивным использованием систем кондиционирования воздуха. Легионеллы могут быть причиной вспышек внутриболь-ничной пневмонии. Именно так проявила себя питтсбургская пневмония в 1978 г. Факторы передачи инфекции при спорадических случаях заболевания не известны. Описан случай выделения L.pneumophila из плацентарной ткани здоровой матери, что указывает на возможность носительства легионелл и вертикального пути передачи инфекции. Заболеваемость выше в экономически развитых индустриальных районах.
Классификация. В настоящее время выделяют следующие клинические формы легионеллеза, различающиеся по особенностям течения:
болезнь легионеров, протекающая с преобладанием синдрома поражения легких;
лихорадка Понтиак — респираторное заболевание без пневмонии;
— лихорадка Форт—Брэгг (лихорадка с сыпью);
— питтсбургская пневмония, возникающая при выраженных имму-нодефицитах.
По степени тяжести различают течение:
субклиническое,
легкое,
средней тяжести,
тяжелое,
крайне тяжелое (молниеносное).
Не исключается возможность носительства легионелл. Легионеллез — новое инфекционное заболевание, которое только изучается. Еще не упорядочена номенклатура, а поэтому представленная классификация еще неоднократно будет изменяться, дополняться.
Примерная формулировка диагноза. 1. Легионеллез (лихорадка Понтиак), течение средней тяжести.
2. Легионеллез (болезнь легионеров), тяжелое течение, ИТШ.
Патогенез. Легионеллез относится к числу инфекций, изучение которых началось только в последние 1,5—2 десятилетия. В патогенезе легионеллеза еще много белых пятен. Наиболее изучен к настоящему времени патогенез болезни легионеров, поэтому на его рассмотрении мы и остановимся.
При инфицировании заболевание возникает далеко не у всех.
К группам риска относятся:
больные с иммунодефицитом различного происхождения;
лица пожилого и старческого возраста;
— люди, страдающие тяжелыми хроническими заболеваниями сердца, почек, легких, а также диабетом;
— хронические курильщики и алкоголики.
Основной моделью для экспериментального изучения легионеллеза являются морские свинки, у которых инфекция протекает с развитием некробиотических процессов на фоне выраженного токсикоза, что, как правило, приводит к гибели животных.
Проникновение легионелл в организм происходит через реснитчатый эпителий дыхательных путей. Вероятность заражения зависит в значительной мере от вирулентности легионелл, их количества, размеров аспиратов, с которыми они попадают в дыхательные пути (чем мельче аспират, тем глубже проникает возбудитель). В зону, куда проникли легионеллы, устремляются макрофаги. Они захватывают легионелл, однако способность легионелл угнетать функциональную активность лейкоцитов приводит к тому, что фагоцитоз становится незавершенным: легионеллы не только сохраняются, но и размножаются в макрофагах. Инфицированные макрофаги затем способствуют проникновению инфекции в альвеолы. Размножение и накопление легионелл происходит в клетках альвеол, где и возникает выраженная местная воспалительная реакция. В воспалительном экссудате содержатся макрофаги, полиморфноядерные нейтрофилы, эритроциты, фибрин, белок. Альвеолы теряют свою эластичность. Воспаление распространяется и на интерстициальную ткань, где возникают также клеточная инфильтрация, отек, фибринозное пропитывание. В воспалительном очаге легионеллы располагаются внутриклеточно (в альвеолярном эпителии, макрофагах) и внеклеточно. Очаги поражений могут быть небольшими или захватывать целую долю легкого. Процесс носит преимущественно двусторонний характер. Нередко появляется и небольшой плевральный экссудат, в котором обнаруживаются макрофаги, возбудитель, его растворимые антигены, фибрин. В зоне поражения иногда появляются очаговые кровоизлияния, абсцессы. Все эти изменения приводят к нарушению дыхания, развитию гипоксемии и гипоксии. Нарушения выражены тем значительнее, чем массивнее поражение легочной ткани.
Воспалительные изменения выявляются нередко и в слизистой оболочке бронхиол (отек, инфильтрация макрофагами и полиморфноядер-ными нейтрофилами). Они могут сочетаться с поражением легочной ткани или возникать изолированно (самостоятельно).
Из воспалительного очага легионеллы, расположенные внеклеточно и внутри макрофагов, разносятся лимфогенным и гематогенным путем по всему организму (генерализация и диссеминация процесса), оседая затем во внутренних органах. Но основное повреждающее действие оказывают токсические субстанции легионелл, а не сам возбудитель.
Токсины, растворимые антигены, ферменты попадают в кровяное русло при разрушении циркулирующих легионелл или из очагов воспаления путем диффузии через ткани. От их количества зависит степень интоксикации, могут развиться ИТШ, ДВС-синдром. Поражение сосудов, ЦНС, печени обусловлено главным образом действием токсинов, ферментов и различных антигенных компонентов легионелл. Следствием возникающих на этом фоне циркуляторных расстройств являются увеличение печени (застойная печень) и селезенки, отек легких, нарушение кровообращения в сердечной мышце с развитием миокардита, возможен перикардит. Но все изменения, кроме тех, которые возникают в легких, не имеют специфических признаков.
В ответ на агрессию легионелл организм вырабатывает средства защиты — антитела различных классов. Легионеллы оказываются резистентными к бактерицидному действию иммунной сыворотки, но чувствительны к специфическим антителам и комплементу. У перенесших болезнь легионеров обнаруживают антитела класса IgG, длительность существования которых не уточнена. Не исключено, что иммунитет может поддерживаться за счет персистирования возбудителей в организме.
Клиника. Болезнь легионеров. Болезнь легионеров и пневмонию Брод-Стрит первоначально описывали как отдельные клинические формы. Однако дальнейшее изучение показало полную идентичность этих заболеваний.
Болезнь легионеров вызывает чаще всего L.pneumophila. Инкубационный период при этом заболевании составляет 2—11 дней (в среднем 7 дней). Заболевание протекает с большим полиморфизмом клинических проявлений — от субклинических или идущих с умеренным респираторным синдромом форм до молниеносных, обусловленных развитием ИТШ.
Для типичных случаев заболевания характерно острое, внезапное начало.
В первые дни болезни ведущим является общетоксический синдром: упорная головная боль, мышечная боль, артралгия. В тяжелых случаях рано появляются спутанность сознания, бред, галлюцинации, затруднение речи — симптомы, свидетельствующие о развитии токсической энцефалопатии. В отдельных случаях возникают парезы черепных нервов. При исследовании спинномозговой жидкости изменений не выявляют.
Температура с ознобом быстро поднимается до высокой, достигая 40 °С и более, она бывает постоянного или ремиттирующего характера. Особенностью лихорадки является то, что антипиретики не дают ожидаемого эффекта.
Симптомы поражения дыхательных путей проявляются со 2—4-го дня болезни на фоне выраженного токсикоза. Возникает сухой кашель, не приносящий облегчения, нередко он сопровождается болью в грудной клетке. Через несколько дней появляется небольшое количество мокроты, чаще слизисто-гнойной, нередко с примесью крови. Нарастает одышка. Поражаться может одно легкое или оба, процесс может быть очаговым, сегментарным. Нередко поражается вся доля легкого (чаще нижняя справа), давая соответствующую клиническую картину при физикальном исследовании. В процесс может вовлекаться плевра, в связи с чем появляется шум трения плевры. Нарастающие явления дыхательной недостаточности сопровождаются тахипноэ, цианозом. Состояние больного ухудшается, если в легких образуются единичные или множественные абсцессы. Но особенностью этой клинической формы является то, что трахея и крупные бронхи в патологический процесс не вовлекаются.
Почти у половины больных с первых дней болезни проявляется га-строинтестинальный синдром в виде сильной боли в животе (преимущественно в эпигастральной области), тошноты, рвоты, диареи. Стул водянистый, без патологических примесей. В отдельных случаях симптомы поражения дигестивной системы могут преобладать над респираторными, что в сочетании с симптомами токсикоза может быть причиной диагностических ошибок. Диарея длится обычно до 5—10 дней, она может сопровождаться значительными водными и электролитными нарушениями.
Гипоксия, токсикоз создают неблагоприятные условия для работы всех органов. При исследовании сердечно-сосудистой системы определяют глухость сердечных тонов, относительную брадикардию, гипотен-зию. У части больных выявляют поражение почек различной степени, оно может проявляться лишь умеренной протеинурией и гематурией или даже почечной недостаточностью. Отмечается увеличение печени, у части больных выявляется умеренное нарушение ее функции. Возможно развитие ДВС-синдрома.
Наиболее тяжелые случаи заболевания сопровождаются развитием
ИТШ. Чаще всего он возникает в 1—2-е сутки заболевания и является непосредственной причиной смерти больного еще до развития признаков тяжелого поражения дыхательных путей.
При благоприятном течении заболевания и отсутствии осложнений со 2-й недели начинается процесс обратного развития, который прежде всего проявляется постепенным снижением температуры, уменьшением кашля, токсикоза. Однако период реконвалесценции идет очень медленно: рассасывание пневмонических инфильтратов продолжается в течение нескольких недель, месяцами сохраняются одышка при физической нагрузке, слабость, астенический синдром. Полное завершение процесса в легких и нормализация рентгенологической картины иногда затягиваются до 8—10 нед.
Существует и другая форма болезни легионеров — острый альвео-лит. Она отличается от типичного течения тем, что обильная, длительно сохраняющаяся звучная крепитация сочетается с отсутствием выраженных рентгенологических изменений. В затяжных случаях развивается фиброзирующий альвеолит.
Лихорадка Понтиак (по названию местности, где в 1968 г., еще до открытия возбудителя, возникла вспышка заболевания) вызывается L.pneumophila или L.feeleii.
Инкубационный период длится 5—66 ч, в среднем — 36 ч, но он может удлиняться до 3 нед. Заболевание начинается остро с недомогания, диффузной мышечной боли, тошноты, анорексии. Озноб, повышение температуры до 37,9—40,2 "С являются постоянными признаками данной клинической формы. Симптомы поражения верхних дыхательных путей (насморк, сухой кашель, болезненность и сухость в глотке, боль в области грудины) наблюдаются у половины больных. Нередко появляется светобоязнь, боль при движении глазных яблок. При относительно редко встречающемся тяжелом течении возможно появление признаков, свидетельствующих о токсическом действии на ЦНС, — бессонница, галлюцинации, рвота, нарушение сознания и координации движений, расстройство памяти. У 1/3 больных появляются боль в животе, диарея, боль в суставах, носовые кровотечения. Заболевание заканчивается без лечения в течение 2—5 дней. Период реконвалесценции характеризуется недомоганием, нарушением памяти, способности сосредоточиться, раздражительностью. У 14 % больных возникают рецидивы. Кратковременность течения болезни, отсутствие особых специфических признаков, сходство со многими другими респираторными заболеваниями являются причиной того, что диагноз при спорадических случаях ставят только ретроспективно.
Лихорадка Форт—Брэгг по клиническим проявлениям очень напоминает лихорадку Понтиак. Главное отличие — полиморфные кожные высыпания, которые появляются с первых дней болезни. Через несколько дней они исчезают, не оставляя следа. Диарея бывает реже.
Питтсбургская пневмония, получившая название от местности, где впервые возникла вспышка этой болезни, вызывается L.micdadei (возбудитель выделен лишь в 1979 г.). Эта форма заболевания особенно часто встречается у больных с иммунодефицитом (получавших имму-нодепрессивнуто терапию, страдающих злокачественными и тяжелыми гематологическими заболеваниями, после трансплантации органов).
Заболевание может регистрироваться как нозокомиальная инфекция. У лиц с неотягощенным анамнезом оно протекает по типу обычной нетяжелой пневмонии и часто даже не требует особого лечения. При рентгенологическом исследовании в легких можно выявить инфильтраты, не склонные к распространению.
У больных с иммунодефицитом заболевание протекает тяжело и характеризуется острым началом, высокой температурой, интоксикацией (головная боль, миалгия). Часто появляются боль в животе, диарея. Обычные проявления — кашель, боль в грудной клетке, одышка. На этом фоне возможны легочная эмболия, кожные абсцессы. Часто возникает распространенный прогрессирующий процесс в легких, сопровождающийся в ряде случаев плевральным выпотом.
Осложнения. При тяжелом течении болезни легионеров и питтс-бургской пневмонии могут развиваться самые различные осложнения: отек, абсцесс или инфаркт легких, эмпиема плевры, ИТШ, ДВС-син-дром с нарушением микроциркуляции, желудочными, кишечными, носовыми, маточными кровотечениями, кровохарканьем, гематурией. Описаны случаи развития ОПН, проявляющейся продолжительной анурией, азотемией (обычно на фоне ИТШ).
Указанные осложнения развиваются преимущественно на фоне хронических неспецифических заболеваний легких, у лиц с иммуноде-прессией различной природы, в том числе и на фоне иммунодепрес-сивной терапии глюкокортикостероидами, цитостатиками.
При лихорадке Понтиак серьезные осложнения не зарегистрированы.
Исходы. Летальность при болезни легионеров достигает 20—30%, при питтсбургской пневмонии с фоновым иммунодефицитом она бывает еще выше.
У реконвалесцентов длительно сохраняется астенический синдром (слабость, головокружение, раздражительность), иногда возникает амнезия.
В отдаленный период возможно формирование хронической пневмонии, фиброза легких, хронического гепатита, миокардита. Однако частота таких осложнений и реальная связь их именно с легионелле-зом сейчас уточняются.
Лихорадка Понтиак и лихорадка Форт—Брэгг протекают сравнительно легко, в большинстве случаев заканчиваются полным выздоровлением.
Остается открытым вопрос о возможности персистирования легионелл в организме.
Методы диагностики. Общеклинические методы исследования. В
острый период болезни в анализе крови выявляют лейкоцитоз (10—17 • 10 /л), сдвиг лейкоцитарной формулы влево, в тяжелых случаях — тромбоцитопению, выраженную лимфопению, СОЭ значительно увеличена и может достигать 80 мм/ч.
Микроскопическое исследование мочи позволяет выявить увеличение числа цилиндров, эритроцитов; возможны повышение содержания белка, лейкоцитурия.
При микроскопии мазков мокроты, окрашенных по Граму, обнаруживают множество полиморфноядерных нейтрофилов и моноцитов, но бактерий обычно не находят.
Биохимические методы исследования информативны при тяжелом течении легионеллеза. Они позволяют уточнить степень нарушения метаболизма, поражения печени, почек. Так, гипонатриемия, гипофос-фатемия могут сопровождать легионеллез, протекающий с диареей, а также длительной лихорадкой, потливостью. Метаболический респираторный ацидоз, гипоксию обычно наблюдают при легочной форме заболевания, степень выраженности этих нарушений коррелирует с тяжестью процесса в легких. При поражении печени активность транс-фераз повышается, но увеличение содержания билирубина не характерно. При поражении почек повышается уровень креатинина, мочевины, что свидетельствует о почечной недостаточности.
Специфическая диагностика. Легионеллы могут быть обнаружены в исследуемом материале (мокрота, трупный материал — ткань печени, легких, селезенки) при использовании окраски по Гименесу или импрегнацией серебром.
Возможно выделение возбудителя из мокроты, промывных вод бронхов и легочной ткани умерших от легионеллеза. В период разгара болезни возбудитель может быть выделен из крови. Посевы производят на специальные среды, в них при сильном загрязнении материала можно добавлять ванкомицин, к которому легионеллы резистентны в отличие от многих других возбудителей. Однако трудоемкость метода не оправдывается низким числом положительных результатов. Чувствительность метода несколько повышается, если предварительно исследуемым материалом заразить морских свинок, а затем суспензию из их селезенок засеять на искусственную питательную среду или инфицировать ею куриные эмбрионы.
Методы выделения возбудителя трудоемки, небезопасны для персонала лабораторий, а поэтому такие исследования могут осуществляться лишь в специальных, приспособленных для этого лабораторных комплексах.
Прямая РИФ позволяет в исследуемом материале обнаружить легионеллы. Используют реакцию как экспресс-метод диагностики легионеллеза. Однако в последние годы убедились, что тест не обладает ни высокой специфичностью, ни высокой чувствительностью, что ограничивает его применение.
Методом латекс-агглютинации выявляют наличие растворимых легионелл в моче. Тест высокоспецифичен и чувствителен, позволяет определять антигены даже на фоне лечения. Снижает его диагностическую ценность необходимость ставить реакцию с каждой серогруппой легионелл отдельно.
Серологические методы. Чаще всего используют РНИФ.
Наиболее надежно исследование парных сывороток (первое исследование проводят в 1—2-ю неделю заболевания, второе — через 3— 4 нед), в которых должно быть нарастание титров антител не менее чем в 4 раза. Однако затрудняет постановку этой реакции наличие перекрестных реакций с другими легионеллами, поэтому с каждым серо-типом исследование проводят отдельно. Кроме того, возможны ложно-положительные результаты за счет наличия общих антигенов с возбудителями лептоспироза, микоплазмоза, туляремии и некоторыми другими.
В тех случаях, когда больные поступают в стационар поздно и клиническая картина типична, титры 1:256 даже при однократном исследовании являются достаточными для подтверждения диагноза легионеллеза, так как для ложноположительных реакций такие разведения не характерны.
После перенесенного заболевания титры антител 1:64 — 1:128 могут сохраняться до 10 лет, из-за чего возникают сложности в определении давности процесса.
Возможности других методов (РМА, РФА, РПГА, метод иммунного прилипания и др.) изучают, пока мнения о них разноречивы.
Перспективной может считаться реакция гиперчувствительности с группоспецифическим антигеном, но пока ее изучение не вышло за рамки эксперимента.
Таким образом, в клинической практике в настоящее время наиболее широкое применение получили прямая РИФ, РНИФ.
Дополнительные методы диагностики. Исследование функции дыхания дает возможность выявить нарушения вентиляции по обстру-ктивному типу различной степени. Исследование капиллярного кровообращения легких позволяет уточнить степень его нарушения.
Важным методом обследования является рентгенография органов грудной клетки, помогающая выявить характерные изменения в легких при болезни легионеров. Эти изменения следует оценивать в динамике и совокупности с клиническими проявлениями. Так, изменения в легких в первые дни болезни обнаруживают почти у всех больных (90 % и более) в виде диффузных мелких инфильтратов в легочной ткани, преимущественно в нижних отделах легких. Эти инфильтраты в дальнейшем сливаются, образуя обширные зоны уплотнения легочной ткани, нередко процесс захватывает всю долю легкого. Начинаясь в одном легком, процесс может переходить и на другое легкое даже на фоне проводимой антибактериальной терапии. В плевральной полости иногда появляется в небольшом количестве экссудат. Обратное развитие происходит медленно (до 3—4 нед), отставая от клинического выздоровления. Образование абсцессов и тем более эмпиемы не характерно, хотя и возможно.
Критерии диагноза. При постановке диагноза «болезнь легионе-ров» следует учитывать не только эпидемиологические особенности этой патологии (теплое время года, проживание или работа в помещении с кондиционерами, работа в стационарах, где лечат больных с хронической легочной патологией, респираторными заболеваниями), но и некоторые клинические особенности болезни легионеров, а именно:
острое начало;
высокая лихорадка;
выраженная интоксикация;
полисистемность поражений (ЦНС, пищеварительный тракт, сердечно-сосудистая, а иногда и мочевыделительная системы);
преобладание на этом фоне симптомов поражения легких в виде различных по размером и локализации пневмонических очагов с развитием легочной недостаточности; нередко — появление плеврального выпота;
— медленная реконвалесценция.
Для лихорадки Понтиак характерны такие клинические признаки:
острое начало;
высокая лихорадка;
выраженный общеинтоксикационный синдром, нередко с болью в животе и расстройством стула;
катаральные явления с признаками поражения верхних дыхательных путей и носоглотки;
отсутствие признаков поражения легких;
кратковременное (3—5 дней) течение болезни.
Основное отличие лихорадки Форт—Брэгг от лихорадки Понтиак — наличие полиморфной сыпи.
Питтсбургская пневмония имеет в основном те же признаки, что и болезнь легионеров, но отличается от нее тем, что:
— развивается почти исключительно у лиц с отягощенным анамнезом;
процесс в легких может принимать «ползучий» характер;
возможны осложнения в виде эмболии, кожных абсцессов.
Для всех форм легионеллеза характерен нейтрофильный лейкоцитоз. Диагноз подтверждают обнаружением возбудителя (прямая РИФ) или антител к нему (РНИФ).
Дифференциальный диагноз. Болезнь легионеров и обычная бактериальная пневмония имеют много общего: интоксикация, кашель с мокротой, одышка, притупление звука в зоне поражения, крепитация, хрипы, лейкоцитоз, увеличенная СОЭ.
Бактериальную пневмонию от болезни легионеров отличают такие признаки:
— возникает она преимущественно в холодное время года, часто является следствием переохлаждения;
отсутствует поражение пищеварительного тракта;
печень не увеличена;
— заболевание, как правило, не носит затяжного, упорного характера;
— не характерны явления энцефалопатии, поражение почек.
Для туберкулеза легких также характерны изменения в легких, длительная лихорадка, интоксикация, кашель с мокротой, в которой нередко бывает примесь крови.
Однако при туберкулезе легких:
не характерно острое начало заболевания; интоксикация и кахексия нарастают по мере развития заболевания (которое обычно начинается постепенно), а не с первых дней;
признаки поражения ЦНС возникают лишь при наличии туберкулезного менингита, генез которого нетрудно определить при спинномозговой пункции;
при обследовании легких выявляют очень скудные физикальные данные;
процесс в большинстве случаев локализуется в области верхушек;
— диарея, увеличение печени не характерны.
При орнитозе также могут наблюдаться острое начало, интоксикация, длительная упорная лихорадка, поражение легких, сопровождающееся кашлем и нарушением дыхания, брадикардия, гипотензия.
Отличают орнитоз от легионеллеза следующие особенности:
эпидемиологический анамнез, свидетельствующий о возможности заражения от птиц (риск профессионального заражения);
весьма скудные физикальные данные, не соответствующие тяжести течения болезни;
отсутствие диареи, поражения почек;
появляющиеся нередко полиморфные высыпания на коже;
лейкопения.
Пневмония, обусловленная PC-вирусом, как и болезнь легионеров, протекает с лихорадкой, интоксикацией, кашлем, а иногда с явлениями дыхательной недостаточности.
Но пневмония при PC-инфекции имеет свои особенности:
она обычно развивается постепенно;
характерные проявления первых дней болезни — ринит, першение в горле;
интоксикация умеренная;
преимущественное поражение интерстициальной ткани и бронхов обусловливает и отличающуюся клиническую картину — сухой, приступообразный кашель, свистящее дыхание, большое количество рассеянных сухих, а нередко и влажных хрипов;
диарея отсутствует;
при рентгенологическом исследовании определяется лишь усиление легочного рисунка с участками эмфиземы;
в крови чаще выявляется нормоцитоз (возможен невысокий лейкоцитоз), СОЭ — в пределах нормы.
Инфаркт легких также начинается внезапно, остро: появляются боль в груди, кашель с кровянистой мокротой, хрипы в легких.
Но для инфаркта легких в отличие от болезни легионеров характерны такие признаки:
внезапная боль в груди (обычно самый первый признак болезни);
кровянистая мокрота, нередко и с примесью алой крови;
лихорадка в первые дни может отсутствовать, если она не является признаком другого воспалительного заболевания, обусловившего инфаркт легкого;
отсутствие энцефалопатии и кишечных расстройств;
при рентгеноскопии определяется клиновидная тень в легком.
Лихорадка Понтиак по течению очень сходна с гриппом: оба заболевания начинаются остро, иногда внезапно, выражены общетоксические проявления (головная и мышечная боль, светобоязнь, боль в глазных яблоках), катаральный синдром (кашель, насморк, боль в груди). Оба заболевания протекают кратковременно, заканчиваются к 4—5-му дню.
В большинстве случаев различить эти заболевания по клинике очень сложно, но иногда этому помогают:
— эпидемиологический анамнез (лихорадка Понтиак обычно возникает в летнее время у людей, пользующихся кондиционерами, посещающими бассейн; учитывают наличие больных с подобной симптоматикой среди контактных);
— особенности течения лихорадки Понтиак у отдельных лиц (наличие признаков энцефалопатии на протяжении почти всего периода болезни, диарея, увеличение печени, возможность рецидивов).
Серологические исследования для уточнения диагноза при наличии эпидемиологических предпосылок необходимы даже в тех случаях, которые, казалось бы, не вызывают клинически никаких сомнений.
Питтсбургскую пневмонию следует дифференцировать с теми же заболеваниями, что и болезнь легионеров. Нужно только помнить о наибольшей вероятности возникновения питтсбургской пневмонии и особенностях ее течения у больных с иммунодефицитом. Питтсбург-скую пневмонию у лиц с неотягощенным анамнезом на основании только клинических данных отличить от обычной бактериальной пневмонии не представляется возможным. Тем большее значение в этом случае приобретает анамнез. Решающую роль в дифференциальной диагностике играют специфические методы исследования (выявление возбудителя и антител).
Лечение. Больных с лихорадкой Понтиак можно лечить в домашних условиях. Необходимость и целесообразность госпитализации регламентируется тяжестью состояния больного.
Пациенты с болезнью легионеров, питтсбургской пневмонией подлежат обязательной госпитализации в инфекционные отделения, что связано с возможностью передачи инфекции, тяжестью течения, вероятностью и непредсказуемостью развития осложнений и неблагоприятных исходов. При легком и среднетяжелом течении болезни рекомендуют полупостельный режим, при тяжелом — строгий постельный. В связи с тем что нередко в патологический процесс вовлекаются печень и почки, необходима диета № 5/7 по Певзнеру.
Этиотропная терапия. При лечении легионеллезных пневмоний наиболее эффективен эритромицин. Начинать лечение в тяжелых случаях следует с внутривенного капельного введения препарата в дозе по 500—1000 мг через каждые 6 ч. Внутривенное введение желательно продолжать 6—7 дней. В ряде случаев эффект наступает уже через 24—48 ч, но иногда, несмотря на активное лечение, лихорадка сохраняется еще 4—6 дней. Это ни в коем случае не должно служить основанием для отмены эритромицина или замены его другим антибиотиком, так как эритромицин является здесь препаратом выбора. В особо тяжелых случаях можно сочетать его с рифампицином (300—600 мг внутривенно через каждые 6 ч), который также способен проникать в легочную ткань. Однако без эритромицина рифампицин неэффективен.
Через 7 дней после внутривенного введения эритромицина можно перейти на пероральный прием препарата (500 мг 4 раза в сутки). Длительное внутривенное введение эритромицина не показано из-за возможности развития флебита. Лечение следует продолжать еще не менее 1—2 нед во избежание рецидивов болезни и формирования резистентных форм. В ходе лечения дозу уменьшать не следует. Перораль-но одновременно можно назначать и рифампицин при необходимости.
Имеются данные об эффективности тетрациклина, но она значительно ниже, чем у эритромицина. Пенициллин, аминогликозиды, це-фалоспорины не эффективны. Целесообразность применения сульфаниламидов изучают.
Антибактериальные препараты при лихорадке Понтиак можно не назначать.
Патогенетическая и симптоматическая терапия. Учитывая выраженность интоксикации, осуществляют дезинтоксикационную терапию, характер которой зависит от степени нарушения электролитного баланса (гипонатриемия), КОС, уровня глюкозы в крови, функционального состояния почек. Предпочтительнее дезинтоксикацию осуществлять перорально. Обязателен контроль за водным балансом.
Развитие ОПН, ИТШ, ДВС-синдрома, отека мозга требует соответствующих мероприятий.
Развивающаяся на фоне дыхательной недостаточности гипоксия является основанием для назначения кислорода, а в тяжелых случаях — ИВЛ.
Глюкокортикостероиды противопоказаны. Даже если больной до возникновения болезни их получал, следует отменить эти препараты, если только возможно. Абсолютным показанием к назначению глюкокортикостероидов в больших дозах коротким (2—3 дня) курсом является ИТШ.
Не получено убедительных данных об эффективности при легионел-лезе интерферона и лаферона.
Не показана отвлекающая терапия (горчичники, банки) из-за возможности усиления геморрагических проявлений в легких.
Выписка из стационара. Твердых критериев не существует. Следует ориентироваться на состояние больного, вероятность возникновения рецидивов. Антибактериальное лечение должно быть закончено в стационаре.
Вопрос о выписке больных на работу решают индивидуально с учетом тяжести и длительности течения болезни, наличия и характера осложнений, полноты выздоровления, имеющихся фоновых заболеваний.
Профилактика. В общей профилактике особое значение имеют своевременное обнаружение водного резервуара обитания возбудителя, санитарный надзор над системой водоснабжения и кондиционер-ными условиями. Повышение температуры воды с 45 °С до 55—60 °С «очищает» от легионелл систему горячего водоснабжения. Необходимо уделять больше внимания стерилизации различного больничного оборудования (приборы, используемые в дыхательной терапии).
В микробиологических лабораториях работать необходимо в масках.
Специфическая профилактика не разработана. Вопрос о создании специфического профилактического препарата против легионеллезной инфекции находится в начальной стадии разработки.
Хламидиозы
Хламидиозы — большая группа острых и хронических инфекций, вызываемых у птиц, различных млекопитающих и человека особыми возбудителями — хламидиями. Заболевания могут проявляться в виде пневмонии, менингоэнцефалита, полиартрита, поражений лимфатической системы, сосудов, урогенитальных и онкоге-нитальных заболеваний, сепсиса (лат. — chlamydiosis, англ. -— chlamidiae infections).
Хламидии являются облигатными внутриклеточными паразитами. От вирусов их отличают наличие одновременно ДНК и РНК, чувствительность к антибиотикам, наличие клеточной стенки, подобной стенке грамотрицательных бактерий (хламидии тоже грамотрицатель-ны). С вирусами этих возбудителей сближает отсутствие способности синтезировать собственную АТФ, что определяет их «энергетический паразитизм». Они занимают промежуточное положение между вирусами и бактериями.
Свое название хламидии получили от греч. «chlamus» (плащ) из-за того что образуемые ими внутриклеточные микроколонии кажутся как бы окутанными мантией (хламидой). Относятся они к семейству Chla-mydiaceae, роду Chlamydia, включающему 3 патогенных вида:
Ch. trachomatis (различные серологические варианты являются возбудителями трахомы и паратрахомы, урогенитального хламидиоза, пневмонии новорожденных, венерической лимфогранулемы);
Ch. pneumoniae (представители этого вида являются причиной пневмонии, бронхиальной астмы, респираторных заболеваний, атеросклероза, саркоидоза);
— Ch. psittaci — возбудитель орнитоза.
Ch. trachomatis и Ch. pneumoniae патогенны только для человека (ан-тропонозы). Ch. psittaci является возбудителем заболеваний у диких и домашних птиц и животных, а также у человека. Эти возбудители имеют ряд общих антигенов, но различаются по способности синтезировать гликоген, чувствительности к сульфаниламидным препаратам и ряду других признаков. Различны пути проникновения этих возбудителей в организм человека, как и характер вызываемых ими поражений.
Последние годы хламидии привлекают самое пристальное внимание кардиологов как одна из причин, способствующих развитию атеросклероза.
Для инфекциониста главный интерес представляет заболевание, вызываемое Chlamydia psittaci.
Орнитоз
Орнитоз — хламидийное зоонозное инфекционное заболевание, протекающее с интоксикацией, полиорганными поражениями с преимущественным патологическим процессом в легких в форме мелкоочаговой или интерстициальной пневмонии (лат. — ornithosis, англ. — ornithosis, psittacosis).
Название заболевания происходит от греческого слова «ornis» — птица, так как птицы являются основным источником инфекции.
Краткие исторические сведения. Заболевание впервые было описано в 1875 г. Jurgenson. Несколько позже, в 1879 г., Ritter сообщил о нескольких случаях «атипичной пневмонии», высказав предположение о возможном заражении заболевших от завезенных в страну попугаев.
Окончательно роль попугаев как источника инфекции была доказана в 1892 г. В 1895 г. A. Morang предложил название болезни «пситтакоз», так как возбудителем считался микроб, передающийся только от попугаев (psitacos, греч. — попугай).
В 1930 г. Bedson, Western и Simpson воспроизвели инфекцию у здоровых птиц, заразив их фильтратом взвеси органов павшего от пситтакоза попугая и описали возбудителя как фильтрующийся вирус.
Тогда же независимо друг от друга морфологию возбудителя описали Levinthal, Coles и Lillie. Морфогенез и цикл развития возбудителя в органах чувствительных животных были описаны Bedson и Bland (1932), а в культуре тканей — Bland и Canti (1935).
Rasmussen-Ejde, Haagen, Mayer в 1938 г. при изучении этиологии «атипичных пневмоний» впервые доказали роль птиц непопугайных пород в распространении инфекции и заражении человека. В 1941 г. K.Mayer предложил термином «пситтакоз» пользоваться только для названия заболеваний у попугаев и людей, от них заразившихся. В случаях, когда заражение происходит от других птиц, предлагалось болезнь называть «орнитоз». Однако такое разделение оказалось искусственным, ибо ни клиническая картина заболевания, ни биологические свойства возбудителей пситтакоза и орнитоза не имели различий.
В крови человека возбудителя орнитоза в 1942 г. обнаружил Mayer. И. И. Терских (1957, 1964), А. А. Шаткин (1969), Stors, Page (1971), изучая возбудителя, определили его как биологически самостоятельный организм, отличный от бактерий, риккетсии и вирусов.
Актуальность. Вспышки орнитоза профессионального характера и спорадические случаи заболевания регистрируют на всех континентах.
При этом у больных с клиническими диагнозами «грипп», «ОРЗ», «пневмония» в 10—25 % случаев выявляют орнитоз при специальном обследовании.
Естественный резервуар инфекции в природе — дикие перелетные птицы, к орнитозу восприимчивы почти все виды птиц, хотя и в разной степени. Загрязнение окружающей среды выделениями больных птиц способствует распространению инфекции среди домашних животных и птиц, делает процесс распространения инфекции среди них практи- чески неуправляемым. '
После 1945 г. заболеваемость людей орнитозом значительно возросла, что связано с созданием крупной индустрии по производству птичьего мяса и яиц — птицефабрик, птицекомбинатов. Тем не менее, спорадическая заболеваемость значительно превышает эпидемическую профессиональную.
Показателем распространения орнитоза могут служить данные серологического исследования здорового населения: специфические антитела в РСК выявляли у 6,3% (Ленинград, 1964), 7,2% (США, 1957), 22% (Австралия, 1955) обследованных.
Но несмотря на то что у 18—20 % больных пневмонией патологию вызывают Ch. psittaci, диагностируют орнитоз обычно не более чем в 1% случаев. Остальным больным ставят традиционные, наиболее привычные диагнозы ■— «ОРЗ», «ОРВИ», «пневмония». Это отражается на эффективности лечения, способствует возникновению рецидивов, переходу в затяжную и хроническую формы.
Обследование рабочих и служащих на птицефабриках показало, что число клинически выраженных форм орнитоза в 3 раза меньше бессимптомных.
Этиология. Возбудитель орнитоза (пситтакоза) существует в виде трех форм, каждая их которых окружена трехслойной оболочкой:
инфекционной (элементарные тельца) в виде сферы со средним диаметром 250—350 нм;
вегетативной (ретикулярные тельца), имеющей овальную и неопределенную форму со средним диаметром 400—1200 нм;
промежуточной.
Инфекционные формы (внутриклеточные) способны при фагоцитозе проникать внутрь чувствительной клетки, где они не погибают, а превращаются в вегетативные формы, которые начинают активно размножаться поперечным делением. Процесс создания дочерних клеток и образование колоний продолжается до тех пор, пока в пораженной клетке сохраняются благоприятные условия для жизни и размножения хламидии. При резком снижении в ней содержания АТФ и некоторых других необходимых для хламидии факторов прекращается размножение вегетативных форм, они превращаются через промежуточные снова в инфекционные формы, которые покидают клетку посредством
экзоцитоза или выходят во внеклеточное пространство при гибели и разрушении клетки. Инфекционные формы внедряются в новые клетки, цикл повторяется.
Ch. psittaci способны образовывать экзотоксин, вызывающий гибель мышей при внутривенном введении, они также имеют эндотоксин, который попадает в окружающую среду при гибели возбудителя. По характеру действия эндотоксин сходен с действием токсических субстанций грамотрицательных бактерий.
Возбудитель орнитоза, как и другие хламидии, не имеет своего активного механизма проникновения в чувствительную клетку, не обладает адгезивными и инвазивными свойствами. Проникновение инфекционной формы осуществляется благодаря наличию фагоцитарной активности у чувствительной клетки.
Проникшие в клетку хламидии подавляют синтез клеточной ДНК хозяина с дальнейшим уменьшением синтеза РНК и белка. Энергия клетки хозяина становится доступной паразиту и переключается на синтез ДНК и протеинов самого возбудителя.
Такие свойства хламидии, как подавление синтеза клеточной ДНК, неспособность производить собственную АТФ, зависимость от энергии клетки хозяина, являются результатом тонкой адаптации возбудителя к внутриклеточным условиям развития. Не вызывая разрушения среды клетки хозяина и не вступая с ней в конкуренцию в отношении метаболизма, возбудитель орнитоза обеспечивает свое развитие. Внутриклеточное расположение хламидии является, кроме того, фактором защиты от действия иммунной системы хозяина, что обеспечивает длительную персистенцию возбудителя в организме. Ch.psittaci обладает тропностью к эпителию бронхов и бронхиол, к ретикулоэндотелиаль-ным и лимфоидным клеткам и в наибольшей степени к альвеолярным клеткам. Все это обеспечивает большой спектр органных поражений и большой полиморфизм клинических проявлений.
Возбудитель культивируется в развивающихся куриных эмбрионах, в организме лабораторных мышей. Он способен длительно сохраняться в воде, молоке, в выделениях птиц и их перьях. Инактивируется при температуре свыше +70 °С, при воздействии 0,1 % раствора формалина, 2 % хлорамина, 0,5 % фенола, высокочувствителен к кислотам и щелочам, эфиру, лизолу, тетрациклинам и макролидам.
Высокую чувствительность к антибиотикам тетрациклинового ряда и макролидам возбудитель орнитоза проявляет только в период внутриклеточного размножения. Большинство штаммов резистентно к сульфаниламидам, стрептомицину, аминогликозидам. Пенициллины лишь обратимо ингибируют репродукцию хламидии и вызывают их трансформацию в L-формы, которые уже не чувствительны ни к макролидам, ни к тетрациклинам.
Антигены Chlamydia psittaci, как и других хламидии, делятся на термолабильные и термостабильные.
Терморезистентные антигены являются группоспецифическими, они реагируют с антителами ко всем видам хламидии в РСК, РТГА, РИФ, РИА, а также при постановке аллергической кожной пробы. Терморезистентный антиген содержится в клеточной стенке и цитоплаз-матической мембране, представляет собой как минимум двухкомпо-нентный гликолипопротеиновый эфирорастворимый комплекс.
Термолабильные антигены обладают токсическими свойствами типа эндотоксина, специфичны для каждого вида хламидии. Термолабильные видоспецифические антигены вступают в реакцию с гомологичными антителами или частично с антителами против близкородственных антигенов. Эти антигены могут быть выявлены в РН, а также в РСК после удаления или уничтожения группоспецифического термостабильного антигена.
При изучении видоспецифического антигена орнитоза отмечено, что не все штаммы этого возбудителя полностью идентичны в антигенном отношении, возможно наличие разных серотипов.
При заболевании орнитозом образуются и циркулируют в крови комплементсвязывающие антитела к обоим антигенам — группо- и ви-доспецифическому. Нейтрализующие, агглютинирующие и преципи-тирующие антитела вырабатываются обычно в низком титре или даже отсутствуют, но может определяться и высокая антигемагглютинирую-щая активность, обусловленная преимущественно IgM.
Эпидемиология. Основным источником инфекции являются птицы (больные или с латентной инфекцией), в первую очередь домашние (особенно утки и индюки), затем голуби, комнатные экзотические птицы (чаще всего попугаи и канарейки), перелетные дикие птицы. Около 200 видов птиц участвуют в распространении инфекции.
Возбудитель интенсивно распространяется по путям миграции диких птиц, инфицирует различные виды полудиких и домашних птиц, формируя природные очаги.
Птицы являются основным резервуаром этой инфекции, тем более, что возможна трансовариальная передача возбудителя потомству зараженных птиц. Значительно реже человек заражается от домашних (кошек, собак) и сельскохозяйственных животных (коров, телят). Возможно участие грызунов в эпидемическом процессе.
ВОЗ (1969 г.) отнесла эту инфекцию к непосредственным зоонозам.
Традиционно считают, что больной человек не является источником инфекции для окружающих. Однако известны случаи внутрибольнич-ных вспышек этого заболевания.
Ведущим механизмом передачи инфекции человеку от птиц является респираторный (воздушно-пылевой). Значительно меньшее значение имеет фекально-оральный механизм, но забывать о нем не следует. Не исключается инфицирование от больного человека воздушно-капельным путем, однако этот путь играет несравненно меньшую эпидемиологическую роль, чем воздушно-пылевой.
Орнитоз у птиц является преимущественно кишечной инфекцией с первичной локализацией возбудителя в органах брюшной полости и выделением его в основном с экскрементами, реже — с носовой слизью. Таким образом, основными факторами передачи инфекции являются загрязненные выделениями птиц перья и пух, сухие экскременты, которые током воздуха могут быть занесены на значительное расстояние от источника инфекции. Возможно заражение человека и алиментарным путем через загрязненные экскрементами птиц пищевые продукты и воду. Описаны групповые вспышки орнитоза при употреблении сырых инфицированных яиц. Однако эти факторы передачи имеют меньшее эпидемиологическое значение из-за высокой тропно-сти возбудителя орнитоза к эпителию дыхательных путей человека.
Описаны случаи заражения при попадании инфицированного материала на слизистые оболочки глаз, при укусах больной птицей. В этих случаях заболевание протекает атипично.
У животных при заражении Ch.psittaci развиваются самые разнообразные клинические формы болезни: пневмонии (у крупного рогатого скота, овец, свиней, лошадей, кошек и др.), полиартриты (у крупного рогатого скота, овец и свиней), аборты (у крупного рогатого скота и овец), энтериты (у крупного рогатого скота и зайцев) и др.
Восприимчивость людей к орнитозу высока, перенесенное заболевание не создает напряженного иммунитета и не предохраняет от реин-фекции. Часто наблюдаемое латентное носительство возбудителя ре-конвалесцентами, длительное выделение возбудителя с мокротой больными хронической формой не имеют, тем не менее, эпидемиологического значения. Вспышки орнитоза в окружении таких лиц не описаны.
Эпидемические вспышки орнитоза имеют профессиональный характер и обычно возникают у работающих на птицефабриках людей в возрасте от 16 до 40 лет. Спорадические случаи чаще всего возникают у охотников, любителей экзотических птиц, голубей.
Если спорадические случаи заболевания орнитозом учащаются в зимне-весенние месяцы, то случаи профессионального заражения, протекающие чаще всего в виде эпидемических вспышек, наблюдаются в основном в весенне-летний период.
Классификация. Общепринятой классификации орнитоза нет. В нашей стране предпочтение отдают классификации, предложенной А.П.Казанцевым (1973). Но классификация, рекомендованная экспертами ВОЗ (1969), на наш взгляд, более компактна и не менее информативна.
Соответственно классификации ВОЗ по длительности течения
выделяют такие манифестные формы:
острую;
хроническую.
Отдельно следует выделить бессимптомную (инаппарантную) форму орнитоза.
С учетом клинических особенностей заболевания различают следующие варианты (формы):
пневмонический,
гриппоподобный,
тифоподобный,
менингеальный.
Различают по тяжести: легкое, средней тяжести, тяжелое течение орнитоза.
Основными показателями, которые учитываются при оценке тяжести течения орнитоза, являются:
длительность и характер лихорадки;
степень интоксикации;
распространенность и характер процесса в легких;
— поражение наряду с легкими других органов и систем (сердца, ЦНС, периферических нервов, печени), т.е. полисистемность поражений;
степень и характер нарушений в этих органах;
появление аллергического компонента;
неблагополучный аллергологический анамнез;
наличие и характер осложнений;
— сопутствующие заболевания, особенно легочные, сердечно-сосудистые.
Нередко определить клиническую форму заболевания бывает сложно из-за полиморфизма клинических проявлений и сочетания признаков, характерных для нескольких форм.
Примерная формулировка диагноза. 1. Менингеальная форма острого орнитоза, течение средней тяжести.
2. Хроническая пневмоническая форма орнитоза, тяжелое течение. В связи с тем что клиническую форму четко выделить не всегда
возможно, как и определить длительность заболевания (особенно при предшествовавшей бессимптомной форме), допустим диагноз с указанием названия болезни, степени тяжести и характера осложнений:
3. Орнитоз, тяжелое течение, осложненный абсцессом легкого.
Патогенез. При орнитозе входными воротами для возбудителя наиболее часто является слизистая оболочка верхних дыхательных путей, хотя проникновение возбудителя возможно и через слизистые оболочки пищеварительного тракта при алиментарном пути заражения.
В этой фазе хламидии попадают в бронхи, бронхиолы и альвеолы, адсорбируются на поверхности эпителиальных клеток и проникают в них посредством пиноцитоза или фагоцитоза. Возможно, в процессе внутриклеточного проникновения определенную роль играют ферменты возбудителя.
Чем меньше частички пыли, содержащие вирус, тем глубже они проникают в дыхательные пути, достигая даже альвеол. Эпителиальные клетки дыхательных путей — наиболее чувствительны к действию вируса, в них происходит процесс первичного размножения и накопления хламидии.
Каждый цикл внутриклеточного размножения хламидии длится не менее 24—48 ч, что объясняет медленное накопление возбудителя и сравнительно длительный (по сравнению с другими ОРЗ) инкубационный период. Этот процесс происходит в цитоплазматических включениях инфицированных клеток. Цикл развития завершается выходом нового поколения хламидии из клеток и внедрением их в соседние. Основной патологический процесс сосредоточивается в легких (в альвеолах и интерстициальной ткани), где возникают лимфо-цитарная инфильтрация тканей, отек (особенно в нижних долях), участки некроза. Может развиться местный геморрагический синдром за счет повреждения мелких артерий и капилляров, в результате чего появляется кровь в мокроте. Отек интерстициальной ткани, повреждение альвеол, поражение и увеличение регионарных лимфатических узлов могут вызвать сдавливание бронхиол и бронхов, нарушение дыхания, хотя слизистая оболочка бронхов остается практически ин-тактной. Это в свою очередь способствует усилению гипоксии внутренних органов, особенно уязвимы паренхиматозные органы и ЦНС.
Вероятно, уже с первых дней заражения часть хламидии проникает с макрофагами в кровь и разносится по всему организму, оседая преимущественно в печени и селезенке, где формируются зоны размножения и накопления возбудителя, могут образовываться гранулема-тозные и некротические очаги. Печень и селезенка увеличиваются в размерах, возможно даже формирование гепатита, но функция печени при этом страдает мало.
Поступающие из очагов размножения в кровь хламидии частично гибнут, освобождая токсические субстанции, накапливаются постепенно и токсические вещества типа экзотоксина. Когда количество их превысит пороговый уровень, возникают начальные проявления болезни. Быстрота нарастания клинических симптомов коррелирует с концентрацией в крови хламидии и токсинов. На этом фоне продолжается активная диссеминация возбудителей в различные ткани.
Как полагают, множественность поражений обусловлена в значительной мере тем, что в острой фазе болезни возбудители не только не разрушаются макрофагами, но и транспортируются ими в различные органы и ткани, обеспечивая таким образом преодоление естественных защитных барьеров (в том числе гематоэнцефалического). В этой фазе эндотоксические, цитотоксические, гипоксические нарушения усугубляются нарастающей аллергизацией, обусловленной в значительной мере усилением синтеза в тучных клетках под воздействием токсинов медиаторов аллергических реакций — гистамина, серотонина, ацетилхолина, а также активацией синтеза кининов.
Возбудитель может проникать через гематоэнцефалический барьер. В результате его размножения в нейроглиальных макрофагах и рети-кулоэндотелиоцитах возникают отек и гиперемия мозговых оболочек и вещества мозга, дегенеративные изменения в сосудах с поражением их эндотелия, микротромбами, петехиальными кровоизлияниями.
Тромбозы и кровоизлияния могут возникать во всех органах — в почках, надпочечниках, печени, селезенке, мышце сердца.
На фоне повреждения макрофагов в острой фазе, их несостоятельности возможна активация бактериальной флоры в дыхательных путях, что приводит к развитию смешанного инфекционного процесса (хламидийно-бактериального).
В дальнейшем идет нарастание иммунных процессов и мобилизация защитных сил организма. Фагоцитоз постепенно приобретает завершенный характер. Нарастают титры специфических антител, в том числе антитоксических, хламидийнейтрализующих, комплементсвязы-вающих.
Фаза обратного развития болезни характеризуется или полным восстановлением функций органов с постепенным освобождением организма от возбудителя (но одновременно утрачивается и иммунитет к нему!), или длительной персистенцией хламидии с возникновением рецидивов, затяжным, а затем и хроническим течением болезни. В случаях затяжного или рецидивирующего течения болезни формируется особенно выраженная гиперчувствительность макроорганизма к антигенам хламидии.
При нетрадиционном, алиментарном пути заражения тоже развивается заболевание, но, как полагают, при этом легкие в процесс не вовлекаются. Принято считать, что патология в легких возникает лишь при заражении через дыхательные пути. Однако существует и другое мнение: так, Walter Е. Stamm, King К. Holmes (1994) высказывают предположение, что проникновение возбудителя в легкие происходит гематогенно, а не путем непосредственного распространения через дыхательные пути. Вероятно, истину выявят новые исследования.
Иммунитет при орнитозе нестойкий, нестерильный. В патогенезе хронической формы болезни, протекающей чаще всего с поражением легких, важная роль отводится не только несостоятельности гуморального иммунитета, аллергизации организма, но и развитию аутоимун-ных процессов с участием противоорганных аутоантител, фиксированных ИК. Затяжному течению, формированию хронической формы орнитоза часто способствуют как врожденные, так и приобретенные иммунодефициты (лечение цитостатиками, радиоактивное облучение, герпетическая, цитомегаловирусная, ВИЧ-инфекция).
Патогенетическую основу рецидивов орнитоза или его обострений составляет сохранение в организме человека возбудителя при отсутствии достаточно напряженного иммунитета с генерализацией инфекции на фоне наступившего под влиянием различных факторов снижения реактивности организма. Так, даже субинфекционная доза вируса гриппа стимулирует обострение или развитие первичного орнитозного процесса с распространенными органными поражениями. При более напряженном иммунитете генерализация инфекции не происходит, однако несостоятельность ферментных систем клеток рети-кулоэндотелиальной системы не позволяет полностью освободить организм от возбудителя. Длительная персистенция хламидии в рети-кулоэндотелиальных клетках, макрофагах приводит к возникновению хронической формы орнитоза.
Возможно, формирование хронической формы заболевания определяет и различная способность разных по вирулентности штаммов хламидии к образованию термолабильного токсина. Этот токсин вызывает дезинтеграцию лизосом макрофагов с последующим разрушением клеток, что может приводить к истощению этого важного звена системы клеточного иммунитета и формированию хронической формы заболевания.
Возбудитель орнитоза оказался малочувствительным к действию интерферона, поэтому система интерферона не играет существенной роли в защите организма от хламидии.
В патогенезе орнитоза еще много неизученного, и это затрудняет представление его в виде более или менее четкой схемы. Табл. 13 дает представление о связи ведущих клинических симптомов с некоторыми патогенетическими механизмами.
Следует всегда помнить, что в основе развития одного и того же клинического симптома или синдрома лежат часто разные патогенетические механизмы. От того, насколько грамотно врач определит эти механизмы, будет в значительной мере зависеть эффективность лечения. И табл. 13, не претендуя на исчерпывающее изложение всех причинно-следственных отношений, еще раз напоминает о необходимости помнить о них при оценке тяжести течения болезни и выборе лечебной тактики.
Клиника. При орнитозе инкубационный период составляет обычно 7—10 дней, иногда он затягивается до 30 дней.
У 20% больных заболевание начинается с продромального периода — появляются слабость, недомогание, снижение работоспособности, нарушение сна, умеренная боль в суставах. Такое состояние может продолжаться 1—4 дня.
В большинстве же случаев заболевание начинается остро с озноба,
Таблица 13. Патогенез основных клинических симптомов орнитоза
Симптом
Патогенез
Лихорадка
Гепатомегалия
Спленомегалия
Кашель
Одышка, затрудненное дыхание
Бледность, цианоз Головная боль
Изменение поведения
Рвота
Глухость сердечных тонов
Гипотензия
Брадикардия Сыпь геморрагическая
Мелкопятнистая, розеолезная
Токсическое действие на центр терморегуляции на фоне генерализации инфекции Размножение и накопление хламидии
Поражение легочной ткани Рефлекторный спазм бронхов
Нарушение проходимости бронхиол из-за отека ин-терстициальной ткани и сдавления их Бронхоспазм
Поражение легочной ткани
Гипоксия за счет поражения легких, нарушения дыхания
Проявление интоксикации
Повышение внутричерепного давления (при менин-
гизме, менингите)
Интоксикация
Изменение поведения может также быть одним из первых проявлений начинающегося энцефалита Интоксикация
Повышение внутричерепного давления
Токсическое раздражение желудка
Миокардит
Гипоксия
Миокардит
Поражение вегетативной нервной системы Поражение вегетативной нервной системы Повышенная проницаемость сосудов
Аллергия
резкого повышения температуры тела (уже к концу 1-х суток она может достигать 39 °С). Быстро нарастают симптомы общей интоксикации: миалгия, разлитая головная боль, боль в суставах, пояснице, тошнота, бессонница. Нередко появляется несильная боль при глотании.
Несмотря на то что легкие — основная мишень для возбудителя, первые дни симптоматика поражения легких может даже отсутствовать или проявляться периодическим сухим кашлем. В последующие дни кашель становится более выраженным, появляется скудная слизистая мокрота, в которой с конца 1-й недели заболевания при тяжелом течении можно обнаружить примесь крови. Нарастают явления дыхательной недостаточности: одышка, заметная даже в покое, усиливается при малейшей физической нагрузке, сопровождается бледностью кожи, цианозом. Может появиться боль в грудной клетке при дыхании. Тем не менее, физикальные данные довольно скудные. Если процесс идет преимущественно в интерстициальной ткани или в прикорневой зоне, перкуссия может не выявить изменений. При аускультации в пораженной зоне определяют лишь ослабленное дыхание, а сухие и необильные мелкопузырчатые хрипы выслушивают непостоянно. Более четкая картина вырисовывается, если процесс локализуется в нижних отделах легкого или поражает всю долю. Тогда определяются притупление звука при перкуссии, крепитация в зоне поражения. При вовлечении в процесс плевры (что бывает сравнительно редко при орнитозе, чаще это связано с активацией вторичной инфекции) появляется шум трения плевры. Наиболее отчетливая симптоматика поражения легких (одышка, тахипноэ, цианоз, кашель с мокротой, изменения в легких, выявляемые при рентгенологическом исследовании) проявляется с конца 1-й — начала 2-й недели болезни.
К этому времени уже наблюдается развернутая картина болезни с клиническими проявлениями поражений всех органов и систем, задействованных в патологическом процессе.
У многих больных выявляют признаки поражения мышцы сердца — глухость сердечных тонов, иногда — шум трения перикарда.
Печень и селезенка увеличены, их можно пропальпировать почти у каждого больного уже на 1-й неделе болезни. Сочетание поражения легких со спленомегалией — настолько нестандартный синдром, что при выявлении у больного пневмонией увеличенной селезенки в первую очередь нужно думать об орнитозе. Гепатомегалия может сопровождаться легкой иктеричностью кожи и склер.
На 2-й неделе заболевания на первый план выступают симптомы поражения нервной системы. Упорная разлитая головная боль является в это время одним из ведущих симптомов, который больше всего беспокоит больного. При тяжелом течении появляются загруженность, сонливость или эйфория, иногда возникают делириозные состояния. Эти явления могут быть обусловлены тяжелой интоксикацией, но куда опаснее ситуации, когда возбудитель, проникая через гематоэнцефалический барьер, вызывает непосредственно поражение ЦНС. В этих случаях возникает развернутая картина менингита, менингоэнцефалита: менингеальные знаки, потеря сознания, судороги. В особо тяжелых случаях может возникнуть коматозное состояние. В эти же сроки (конец 1-й — начало 2-й недели) возможно и поражение периферических нервов: больные отмечают онемение конечностей, иногда возникают невриты лицевого, тройничного нервов, полиневрит. Отчетливо и с большим постоянством проявляются признаки поражения вегетативной нервной системы — потливость, брадикардия, гипотензия. Кожа бледная, нередко ци-анотичная. Повышенная ломкость сосудов обусловливает положитель-
ные симптомы жгута, щипка, возможны кровоизлияния в кожу, слизистые оболочки конъюнктивы (петехиальные). Возможно появление полиморфной сыпи на коже туловища и конечностей — мелкопятнистой, розеолезной, папулезной, реже — кореподобной.
Нарушения функции пищеварительного тракта при орнитозе непостоянны и весьма умеренны: тошнота, снижение аппетита, иногда — расстройство стула.
Температура сохраняется 2—3 нед, носит постоянный или ремитти-рующий характер. Двугорбая температурная кривая наблюдается при обострении процесса или присоединении вторичной инфекции.
Степень выраженности и характер клинических проявлений, свидетельствующих о нарушении функции различных органов, неодинаковы у каждого отдельного больного, даже если речь идет о групповой вспышке заболевания (на птицефабрике), в значительной степени они зависят от индивидуальных особенностей человеческого организма. Это и дало основания выделить отдельные клинические формы (на наш взгляд, чисто условные), приведенные в классификации. Так, выраженная интоксикация, брадикардия, гепатолиенальный синдром, длительная лихорадка постоянного типа при скудных признаках поражения легких дают основание говорить о тифоподобной форме орнитоза, а лихорадка, интоксикация, признаки поражения ЦНС как ведущие — о менингеальной.
Лихорадка, интоксикация, сильный сухой кашель при минимально выраженных изменениях в легких (отсутствие аускультативных данных, рентгенологически — лишь усиление легочного рисунка) служат основанием для постановки диагноза «гриппоподобная форма орнитоза».
И наконец, типичные поражения в легких как ведущее проявление болезни позволяют говорить о пневмонической форме.
Следует помнить, что легкие никогда не бывают абсолютно интакт-ны при орнитозе, скорее, мы не всегда выявляем в них изменения. Кроме того, степень выраженности клинических проявлений поражения различных органов и систем может варьировать во времени.
При нераспознанном или нелеченном антибиотиками орнитозе интоксикация и все остальные симптомы могут сохраняться до 3—4 нед, лишь после этого постепенно начинается обратное развитие болезни. Если диагноз поставлен своевременно и назначено адекватное лечение, заболевание может приобрести абортивное течение, что придает ему атипичные черты.
Период реконвалесценции характеризуется снижением температуры (чаще постепенным, с последующим длительным субфебрилитетом), постепенным убыванием симптомов общей интоксикации. У больных уменьшаются головная боль, миалгия, появляется аппетит. Увеличение печени и селезенки может сохраняться еще в течение нескольких недель, как и признаки поражения мышцы сердца (глухость тонов, систолический шум). Длительнее других (иногда в течение нескольких месяцев) может сохраняться астенический синдром — повышенная утомляемость, слабость, потливость. У части больных в течение длительного времени бывает покашливание в сочетании с жестким дыханием.
Обострение заболевания возможно еще на фоне активно идущего процесса, чаще на 2—3-й неделе: повышается температура тела, усиливаются явления интоксикации, могут появиться новые органные поражения или усилиться воспалительный процесс в легких (чаще появляются новые пневмонические очаги в другом легком).
Ранние рецидивы болезни возникают в период начавшегося выздоровления, обычно после 4—5-го дня нормальной температуры. Наиболее часто при этом усиливается активность процесса в легочной ткани, поражения других органов и систем при этом менее типичны.
Поздние рецидивы (спустя 2—3 мес от начала болезни) характеризуются вялым, затяжным течением, когда на фоне повышенной температуры (чаще субфебрильной) и нерезко выраженной интоксикации преобладают симптомы поражения сердечно-сосудистой системы (миокардит, тромбофлебит), легких, печени. Астеновегетативные нарушения более стойки и более выражены, чем при обострениях и ранних рецидивах. Иногда рецидивы болезни отмечают и через 6—12 мес. Поскольку при таких поздних рецидивах инфекционный процесс в межрецидивный период не затихает полностью, а лишь проявляется в менее острой форме с преимущественным поражением сердечно-сосудистой системы и легких, реже — печени, правильней говорить о хронической рецидивирующей форме болезни.
Для хронической формы орнитоза характерны волнообразное, с периодическими обострениями течение, стойкий субфебрилитет, симптомы умеренной интоксикации, вегетососудистые нарушения, признаки обструктивного бронхита, нередко с астматическим компонентом. Процесс может продолжаться несколько лет.
Латентная (бессимптомная) форма орнитоза характеризуется отсутствием клинических симптомов, и выявляют ее лишь по иммунологическим сдвигам, свидетельствующим об имевшемся инфицировании. Возможность длительного персистирования возбудителя в организме не позволяет в этих случаях думать о полной завершенности процесса или возможном его обострении в клинически выраженной" форме.
Возрастные особенности. У грудных детей орнитоз протекает очень тяжело, чаще в виде пневмоменингоэнцефалита, пневмомиокардита, менингоэнцефаломиокардита. Чаще, чем у взрослых, у них бывают расстройства стула.
У детей более старшего возраста орнитоз протекает с преобладанием легких и бессимптомных форм.
Тяжело болеют пожилые люди, особенно имеющие хронические заболевания легких и сердца. У лиц с хронической патологией дигестив-ной системы орнитоз нередко протекает с тошнотой, рвотой, болью в животе.
Осложнения. Пожалуй, наиболее частыми осложнениями орнитоза являются те, которые связаны с присоединением или активацией бактериальной микрофлоры.
В первую очередь это касается легких. Возникшая хламидийно-бак-териальная пневмония протекает значительно тяжелее, сопровождается усилением интоксикации, легочной недостаточности. Физикальные данные становятся более информативными, мокрота приобретает сли-зисто-гнойный характер.
Воспалительные бактериальные процессы в ЛОР-органах на фоне орнитоза встречаются крайне редко, как и стафилококковый сепсис.
Течение орнитозного менингита может стать значительно тяжелее, если присоединяется вторичная бактериальная флора (смешанный по этиологии менингит). Течение его очень тяжелое, длительное. Выявляют это осложнение при исследовании спинномозговой жидкости, приобретающей гнойный характер.
При наличии у человека, заболевшего орнитозом, хронической герпетической инфекции может наступить ее обострение, что проявится либо герпетическими высыпаниями на губах, либо герпетическим ме-нингоэнцефалитом. Вирус герпеса может поражать ЦНС самостоятельно или вместе с хламидиями. Менингоэнцефалит такой смешанной этиологии обычно возникает у лиц с выраженной иммунодепрессией, он отличается затяжным течением, плохо поддается лечению.
При орнитозе возможно развитие геморрагического синдрома, вплоть до развернутой картины ДВС-синдрома, что чаще сочетается с ИТШ.
В острый период поражение сосудов, особенно у пожилых людей, может способствовать возникновению тромбофлебита. В отдельных случаях на этом фоне возможна тромбоэмболия легочной артерии с летальным исходом.
Поражения периферических нервов, связанные с поражением токсинами сосудов оболочек нервов, встречаются нечасто и носят обратимый характер.
В период реконвалесценции может развиться миокардит инфекци-онно-аллергического характера, при этом определяют высокий уровень аутоантител к миокарду. Такой миокардит протекает тяжело, может сопровождаться острой сердечно-сосудистой недостаточностью. О развитии миокардита позволяют судить тахикардия, экстрасистолия, усиление одышки при уменьшении процесса в легких, расширение границ сердца.
Частично аутоиммунными процессами, но при несомненном непосредственном патогенном действии хламидии, объясняется и развитие таких гораздо более редких осложнений периода рецидивов и обострений, как тиреоидитп, иридоциклиш, аутоиммунный гепатит. Этими же процессами обусловлено и формирование астматоидного бронхита с выраженным бронхоспастическим компонентом (нередким при затяжном орнитозе у детей).
Выраженная аллергизация организма при орнитозе обусловливает частое развитие лекарственной болезни, особенно при нерационально долгом применении лекарственных препаратов, полипрагмазии. Особенностями проявления лекарственной болезни на фоне орнитоза являются большая частота и полиморфизм кожных высыпаний, а также бронхоспазм.
У беременных женщин может наступить самопроизвольный аборт.
Исходы. При лечении тетрациклинами обычно наступает полное выздоровление. Реже (не более 5—9 % клинически выраженных случаев) отмечается исход в хроническую форму — хронический орнитоз с поражением легких или хронический внелегочный орнитоз. Хронические формы могут заканчиваться освобождением организма от хламидии через 2 года — 5 лет, завершаясь полным выздоровлением (редко) или с формированием остаточных явлений в виде хронической неспецифической пневмонии, обструктивного бронхита, бронхиальной астмы, пневмосклероза.
Реже формируются хронический гепатит, артрит, неврит, синдром Меньера.
В последние годы появились работы, свидетельствующие о связи ишемической болезни сердца (ИБС) с хламидиями.
Летальные исходы в последние годы регистрируют редко (0,2—0,5 %), и обусловлены они главным образом возникшими осложнениями.
Методы диагностики. Общеклинические методы исследования. В общем анализе крови в первые дни болезни отмечается небольшой лейкоцитоз, который уже через несколько дней сменяется лейкопенией. Лейкоцитоз в разгар болезни — свидетельство наличия вторичной инфекции. Формула крови характеризуется лимфоцитозом, моноцитозом (абсолютным и относительным). СОЭ увеличена с первых дней болезни и может достигать 50—60 мм/ч.
Общий анализ мочи без характерных изменений, могут проявляться лишь признаки токсического поражения почек (единичные эритроциты, цилиндры, следы белка).
При исследовании мокроты обнаруживают увеличенное количество лейкоцитов (в том числе моноцитов), эозинофилы и альвеолярные макрофаги, альвеолярный эпителий, иногда — эритроциты.
При орнитозном менингоэнцефалите прозрачная спинномозговая жидкость вытекает под давлением. Цитоз обычно не превышает 300— 500 клеток в 1 мкл. В первые дни в ней преобладают нейтрофилы, однако уже через несколько дней лимфоциты составляют 80—90%. Со-
СПЕЦИАЛЬНАЯ ЧАСТЬ 306
держание сахара и хлоридов в норме, уровень белка незначительно повышен. Изменения в спинномозговой жидкости могут сохраняться 3—4 нед.
Биохимические исследования. В разгар орнитоза повышается содержание С-реактивного протеина, относительный уровень гамма-глобулинов, что отражает активность воспалительного процесса. Кроме того, может повышаться содержание фибриногена и фибрина в плазме крови, увеличивается протромбиновый индекс. Стойкое повышение уровня фибриногена и протромбинового индекса предшествует развитию тромбофлебита. При осложнении орнитоза ДВС-синдромом отмечают характерные для него фазовые изменения в коагулограмме, повышенную агрегацию тромбоцитов и эритроцитов.
Даже при значительном увеличении печени и очень редкой при орнитозе желтушности активность АлАТ и АсАТ в сыворотке крови повышена незначительно и быстро нормализуется. Уровень холестерина, альбуминов умеренно снижен.
В разгар болезни иногда возникает тенденция к гипергликемии, понижается толерантность к глюкозе. Эти нарушения могут сохраняться и в период реконвалесценции.
Специфическая диагностика. У больных орнитозом возможно выделение хламидии из крови (в первые 7—10 дней болезни), из мокроты (до 20—30 дней и даже позже), реже — из смывов ротоглотки, из спинномозговой жидкости при появлении признаков поражения ЦНС. Культура хламидии может быть выделена путем внутрибрюшинного заражения белых мышей, а также куриных эмбрионов или культуры клеток (L-929, HLA и др.) с последующей идентификацией выделенного возбудителя. Но предварительно производят микроскопию исследуемого материала либо с окрашиванием по методу Романовского—Гим-зы, либо с использованием фазово-контрастной оптики. Может быть применен при исследовании мазков метод прямой и непрямой РИФ.
Методы выделения хламидии трудоемки, в связи с чем в практическом здравоохранении их не используют.
Возможно, более широкое применение получат хотя и дорогостоящие, но более точные и менее громоздкие методы определения видо-специфических антигенов хламидии в крови, спинномозговой жидкости, мокроте.
Серологическая диагностика. РСК с группоспецифическим орнитоз-ным антигеном является традиционным и широко распространенным методом диагностики. Комплементсвязывающие антитела появляются не ранее 4—б-го дня болезни, а иногда и не ранее 3—й недели (например, при рано начатой антибактериальной терапии). Максимальные титры антител регистрируют на 4—5-й неделе с дальнейшим быстрым их снижением. Исследуют парные сыворотки, диагностическое значение имеют титры 1:64 и выше.
Ценность реакции снижает возможность получения ложноположи-тельных результатов из-за наличия общих с другими хламидиями антигенов. РТГА является более специфичной и чувствительной, ложнопо-ложительных результатов не дает. Диагностическим титром в острый период считается 1:152 с последующим нарастанием титров не менее чем в 2 раза.
РНИФ пригодна для обнаружения антител, как группо-, так и типо-специфических, при этом она более специфична и точна, чем РСК. Диагностическое значение имеют титры 1:256 и выше. Ответ может быть получен через несколько часов, что является еще одним преимуществом перед РСК, при которой ответ можно получить не ранее чем через 24 ч.
Перспективно определение типоспецифических антител с помощью РИА, а также энзимиммунным методом, хорошо зарекомендовавшими себя в диагностике других хламидиозов. Эти методы наиболее специфичны, высокочувствительны, не сложны, хотя и относительно дорогостоящи.
Основным доказательством достоверности диагноза надо считать четырехкратное нарастание титра антител в ходе болезни. Однако большинство больных обычно впервые обследуют на 2—3-й неделе заболевания, когда часто наблюдается уже накопление антител в высоких титрах и при дальнейшем исследовании проб крови обнаружить убедительной динамики не удается. Это вызывает необходимость ввода дополнительного критерия — «минимальный титр», которым являются разведения 1:64, 1:152 и 1:256 для РСК, РТГА и РНИФ соответственно. Обнаружение этих и более высоких титров антител одновременно с положительной внутрикожной пробой на орнитозный аллерген является убедительным свидетельством орнитозной природы болезни.
Аллергологическая диагностика. Самым ранним методом диагностики орнитоза является постановка внутрикожной пробы с орнитозным аллергеном. Положительной внутрикожная проба при орнитозе становится уже со 2—3-го дня болезни, она остается положительной несколько месяцев и даже лет после выздоровления, что используют для ретроспективной диагностики и при эпидемиологических обследованиях. Недостатком пробы является возможность ложноположительных реакций за счет общих антигенов хламидии, возможность парааллер-гических реакций. Кроме того, проба не позволяет судить о давности заболевания.
Дополнительные методы диагностики. Наиболее часто больным орнитозом проводят рентгенографию легких, так как у большинства из них поражение легких можно выявить только с помощью этого метода. Характерным считается преимущественное поражение интерстициальной ткани, что проявляется на рентгенограммах сетчатым рисунком, лентовидными затемнениями вдоль сосудов и бронхов с наиболее частой локализацией процесса в прикорневых областях и в нижних долях легких. На этом фоне могут появиться инфильтраты различной величины и формы, одиночные или множественные, относительно быстро рассасывающиеся. После этого вновь отчетливо проявляются длительно сохраняющиеся, иногда даже на фоне наступившего полного клинического благополучия, интерстициальные изменения.
В начальный период болезни, до 2—3-го, а иногда и 5—6-го дня, при рентгенологическом исследовании изменения в легких могут не выявляться даже при наличии клинических признаков их поражения. У некоторых больных в разгар болезни рентгенологические изменения напоминают таковые при туберкулезе. Изменения корней легких в острый период выражены нерезко, но встречаются довольно часто в виде расширения и уплотнения. Значительное увеличение внутригрудных лимфатических узлов для орнитоза не характерно.
Описанные изменения стойко сохраняются и в период реконвалес-ценции, причем отсутствие положительной динамики может свидетельствовать о хронизации процесса.
ЭКГ особенно показана больным пожилого возраста как в острый период, так и в период реконвалесценции. Это позволяет вовремя диагностировать миокардит, иногда развивающийся и на 3—5-й неделях болезни. Обычно в острый период на ЭКГ фиксируются изменения, свидетельствующие о преимущественном поражении миокарда предсердий, отличающиеся стойкостью и позволяющие в большинстве случаев говорить о миокардиодистрофии. Изменения на ЭКГ могут выявляться и через 1—2 нед после нормализации температуры тела и уменьшения интоксикации, что может свидетельствовать о сохраняющейся гипоксии миокарда.
Критерии диагноза. Диагноз орнитоза основывается на эпидемиологических данных, свидетельствующих о возможном заражении от птиц, а также на таких клинических признаках:
острое начало болезни (в большинстве случаев);
высокая с первых дней, длительная температура постоянного типа или ремиттирующая;
выраженные явления общей интоксикации (слабость, разбитость, головная боль и др.);
увеличение печени и селезенки;
сухой кашель, нарушение дыхания;
весьма скудные изменения, выявляемые при обследовании легких, не соответствующие выраженности ни общетоксических проявлений, ни респираторного синдрома;
относительная брадикардия, гипотензия;
вероятность развития энцефалитического, менингеального синдромов с первых дней болезни;
частое появление полиморфных высыпаний в конце 1-й, начале 2-й недели;
эффективность лечения тетрациклином при отсутствии эффекта от других антибиотиков и сульфаниламидов;
— лейкопения, лимфо-, моноцитоз, увеличенная СОЭ.
Диагноз подтверждают рентгенологическими данными и результатами серологических исследований. Сочетание пневмонии с увеличенной селезенкой должно заставить врача в первую очередь думать об орнитозе.
Дифференциальный диагноз. Острое начало заболевания, высокая температура, выраженный интоксикационный синдром, катаральные явления дают основание в начальный период болезни проводить дифференциальную диагностику с гриппом.
Однако грипп от орнитоза отличают:
затрудненное носовое дыхание;
гиперемия и одутловатость лица («лицо заплаканного ребенка»);
склерит;
— выраженные явления трахеобронхита, сопровождающиеся чувством жжения за грудиной;
тахикардия;
отсутствие гепатолиенального синдрома;
СОЭ всегда остается нормальной или даже замедленной.
После 5—6-го дня болезни необходимость в дифференциальной диагностике с гриппом вообще отпадает, так как грипп к этому времени заканчивается.
Аденовирусные заболевания от орнитоза отличаются:
наличием гранулезного фарингита (иногда боль в горле — ведущий симптом), ринита;
нередко ■— фолликулярным или пленчатым конъюнктивитом (чаще односторонним);
— увеличением периферических лимфатических узлов;
— нормоцитозом или незначительным лейкоцитозом, нормальной или слегка увеличенной СОЭ.
Сходство PC-инфекции с орнитозом обусловлено наличием таких признаков, как острое начало, сухой кашель, скудные физикальные изменения в легких, обусловленные преимущественным поражением интерстициальной ткани, лихорадка, интоксикация.
Однако для PC-инфекции характерны:
— сильный, приступообразный кашель, напоминающий коклюшный;
отсутствие гепатолиенального синдрома;
преимущественное поражение бронхов.
Острое начало, интоксикация, лихорадка, поражение легких с развитием катарального синдрома, артралгии, сыпи характерны как для орнитоза, так и для микоплазменной пневмонии. При обоих заболеваниях весьма скудны физикальные данные.
Микоплазменную пневмонию от орнитоза отличают:
— характер кашля (упорный, приступообразный);
— характер мокроты (уже через несколько дней она приобретает слизисто-гнойный характер);
увеличение печени, но без увеличения селезенки;
инъекция сосудов склер, конъюнктивы;
боль в горле (один из наиболее постоянных симптомов);
вероятность возникновения ложного крупа;
умеренный нейтрофильный лейкоцитоз.
Длительность течения, скудные изменения в легких, выявляемые при физикальном исследовании, кашель с мокротой, а иногда и с примесью крови, интоксикация, потливость — признаки, общие для орнитоза и туберкулеза легких.
Туберкулез от орнитоза отличают:
меньшая выраженность интоксикации (больные значительно легче переносят температуру);
отсутствие гепатолиенального синдрома (особенно увеличения селезенки);
отсутствие высыпаний;
соответствие пульса температуре или умеренная тахикардия;
преобладание нейтрофилов в мокроте;
— умеренный лейкоцитоз, нейтрофилез, умеренно увеличенная СОЭ.
Большую помощь в диагностике оказывает рентгеноскопия (графия) легких, выявляя типичные для каждого заболевания изменения, а также обнаружение микобактерий туберкулеза в мокроте.
Учитывая основное место локализации патологического процесса при орнитозе (легкие), необходимо исключить и бактериальную пневмонию (прежде всего, пневмококковую).
Бактериальную пневмонию от орнитоза отличают:
кашель со слизисто-гнойной мокротой (обычно он появляется через несколько дней после начала болезни);
обилие выявляемых при аускультации изменений в легких, выраженность и характер которых зависят от локализации процесса, его распространенности и периода болезни;
отсутствие гепатолиенального синдрома и высыпаний;
возникающие лишь при обширном поражении легких явления дыхательной недостаточности;
характерная рентгенологическая картина (инфильтрация легочной ткани);
— лейкоцитоз, нейтрофилез с палочкоядерным сдвигом. Трудности могут возникать и при проведении дифференциальной диагностики между орнитозом и Ку-лихорадкой, так как при обеих инфекциях встречается большое разнообразие клинических симптомов: увеличение печени и селезенки, миалгия, артралгия, высокая температура тела, интоксикация, миокардит, острое начало, лейкопения, а также симптомы поражения легких. Ку-лихорадку от орнитоза отличают:
ремиттирующая лихорадка с ознобом и обильным потом;
ретроорбитальная боль и боль при движении глазных яблок;
выраженный склерит, гиперемия лица;
часто появляющаяся энантема;
тахикардия;
развитие на фоне болезни чаще не миокардита, а эндокардита;
нормальная или незначительно увеличенная СОЭ.
Острое начало, выраженная интоксикация, поражение легких наблюдают и при болезни легионеров.
Болезнь легионеров от орнитоза отличают:
— кашель со слизисто-гнойной мокротой в сочетании с такими фи-зикальными данными, как притупление перкуторного звука, хрипы, крепитация, шум трения плевры;
— при тяжелом течении — признаки поражения нервной системы;
— сочетание поражения легких и пищеварительного тракта (боль в животе, диарея), почек (повышение уровня мочевины, креатинина, олигурия или даже анурия);
— нормоцитоз или невысокий лейкоцитоз.
Причиной диагностических ошибок при проведении дифференциальной диагностики между орнитозом и бруцеллезом может стать переоценка диагностической значимости таких общих для обоих заболеваний симптомов, как длительная высокая лихорадка, артралгии, миал-гии, увеличение печени и селезенки, бледность кожи, полиморфная сыпь, брадикардия, гипотензия, лейкопения и значительное увеличение СОЭ.
Бруцеллез от орнитоза отличают:
эпидемиологический анамнез (возможность инфицирования от животных через продукты животного происхождения);
относительно неплохое самочувствие больных, несмотря на высокую температуру;
эйфория;
выраженная потливость;
микрополиаденит;
— возможность развития бурсита, фиброзита, миозита, целлюлита, тяжелых поражений суставов;
— отсутствие признаков поражения легких.
Дифференциальный диагноз орнитоза с желтушной формой леп-тоспироза несложен, учитывая наличие при лептоспирозе желтухи в сочетании с почечной недостаточностью, что не характерно для орнитоза.
Сложнее проводить дифференциальный диагноз с безжелтушной формой лептоспироза, учитывая его острое начало, выраженную интоксикацию, увеличение печени и селезенки, полиморфные высыпания (в том числе и геморрагические), возможность появления изменений в легких.
Безжелтушная форма лептоспироза от орнитоза отличается:
гиперемией кожи;
инъекцией сосудов склер;
сильной болью в икроножных мышцах;
рано развивающейся и быстро прогрессирующей почечной недостаточностью;
нейтрофильным лейкоцитозом.
Выраженная интоксикация, головная боль, длительная лихорадка, бледность кожи, высыпания, гипотензия, брадикардия, увеличение печени и селезенки наблюдаются как при орнитозе, так и при брюшном тифе.
Брюшной тиф от орнитоза отличают:
постепенное начало заболевания;
отсутствие выраженной миалгии;
отсутствие катарального синдрома;
мономорфная скудная розеолезная сыпь, возникающая не ранее 2-й недели болезни;
характерный вид языка — утолщенный, густо обложен белым налетом, с отпечатками зубов;
увеличение мезентериальных лимфатических узлов, дающих симптом Падалки;
препаратом выбора для лечения является не тетрациклин, а лево-мицетин.
Дифференцировать орнитоз с сыпным тифом и болезнью Брилля необходимо из-за наличия таких общих симптомов, как острое начало, лихорадка, интоксикация, поражение ЦНС, выражающееся упорной головной болью, увеличением печени и селезенки, экзантемой. Сыпной тиф имеет такие особенности:
на фоне интоксикации часто возникает возбуждение, нередко — устрашающие сновидения;
кожа гиперемирована, склеры инъецированы;
мелкоточечная сыпь появляется одномоментно на 4—5-й день болезни, подсыпаний нет;
температурная кривая имеет «врезы» на 4-й и 9-й день болезни;
лихорадка при неосложненном тифе не длится более 14—16 дней, отсутствуют обострения;
закономерны тахикардия, экстрасистолия;
пневмония не характерна;
умеренный лейкоцитоз.
Сходство сепсиса с орнитозом заключается в наличии интоксикации, лихорадки, бледности кожи, при обоих заболеваниях имеется гепатолиенальный синдром, возможно появление сыпи и развитие пневмонии.
Сепсис от орнитоза отличают:
— интермиттирующая или гектическая лихорадка;
— пневмония может быть первичной или метастатической, но во всех случаях ей присущи все черты бактериальной пневмонии;
— выраженный нейтрофильный лейкоцитоз до гиперлейкоцитоза.
Лечение. Госпитализация больных не обязательна, лечение при легкой форме может проводиться в домашних условиях под наблюдением участкового врача. Показана госпитализация при тяжелом течении заболевания, развитии или угрозе развития осложнений, рецидивирующем течении.
Строгой диеты не требуется, обычно назначают стол №2 или №5. Режим определяется тяжестью состояния, но в большинстве случаев (при отсутствии осложнений и гипертермии) строгий постельный режим не обязателен.
Этиотропная терапия. Препаратом выбора является тетрациклин. Его назначают в суточной дозе до 1,5—2 г, разделенной на 4 приема. Желательно, чтобы длительность лечения препаратом не превышала 10—12 дней. Обычно бывает достаточно, чтобы больной получал антибиотик в течение всего лихорадочного периода и еще 3—5 дней нормальной температуры. При тяжелом течении препарат назначают парентерально.
Эффективны и другие препараты тетрациклинового ряда — метаци-клин, доксициклин.
Однако, учитывая способность хламидии к внутриклеточному пара-зитированию, ни один из препаратов не гарантирует от рецидивов и формирования хронической формы.
Есть предложения сочетать внутримышечное или пероральное введение антибиотиков с ингаляционным (1/3—1/4 суточной дозы) и (или) путем электрофореза (1/4 дозы).
Левомицетин при орнитозе в 3—5 раз менее эффективен, чем тетрациклин. Но иногда его назначают при выраженном нарушении функции печени. Если возникает необходимость в назначении второго курса этиотропных препаратов (ранний рецидив, развитие на фоне разрешающейся орнитозной пневмонии таких осложнений, как миокардит, тромбофлебит), то после тетрациклина применение левомицетина не рационально из-за выраженного как иммунодепрессивного, так и вызывающего дисбактериоз действия. В этих случаях можно назначать эритромицин (или другие макролиды) внутрь по 0,5—1 г 4 раза в сутки.
Следует иметь в виду, что при выраженном ацидозе (в крови, тканевом) эритромицин не будет оказывать действия на хламидии. Но в последнее время появляются сообщения, что эритромицин по своей эффективности успешно конкурирует с тетрациклином, а менее выраженное его иммунодепрессивное действие заставляет отдавать ему предпочтение при лечении орнитоза, не сопровождающегося тяжелым ацидозом.
При формах орнитоза, протекающих с поражениями легких, можно назначать рифампицин (рифадин) по 0,3 г 2—3 раза в сутки.
При затяжном без обострений хроническом вялотекущем течении орнитоза назначение любых этиотропных препаратов противопоказано из-за их выраженного иммунодепрессивного действия. Из-за этого же следует избегать повторных курсов лечения этиотропными средствами. Следует также помнить, что все этиотропные препараты оказы^ вают на хламидии только бактериостатическое действие. Поэтому сохранение воспалительных изменений в легких (по данным рентгенографии) на фоне нормализации температуры и значительного улучшения общего состояния не является показанием к назначению второго курса антибактериальной терапии или продлению первого более чем до 5-го дня нормальной температуры.
Наоборот, сохраняющийся субфебрилитет, высокая СОЭ (или даже ее нарастание), стойкая лейкопения, увеличение печени и селезенки обычно свидетельствуют о близком рецидиве болезни и требуют назначения второго курса антибиотиков (эритромицин или рифампицин) в сочетании со стимулирующими иммуногенез средствами патогенетической терапии. К специфической вакцине как к стимулятору отношение осторожное из-за большого числа противопоказаний и возможности осложнений.
Для предупреждения грибковых осложнений лечение антибиотиками желательно сочетать с нистатином или леворином в обычных дозах.
Патогенетическая терапия. Оксигенация — обязательный компонент терапии, учитывая наличие частой гипоксии.
Склонность к аллергическим реакциям оправдывает назначение ан-тигистаминных препаратов (тавегил, супрастин, димедрол, но нужно помнить, что последний дает и гипотензивный эффект). Глюкокортикостероиды усиливают и без того имеющуюся иммунодепрессию, поэтому их можно назначать лишь в критических ситуациях (ИТШ, отек легких, анафилактоидные реакции, выраженный астматический компонент).
Сосудистые поражения, характерные для орнитоза, оправдывают назначение аскорбиновой кислоты, рутина, аскорутина, галаскорбина, глюконата кальция.
Улучшения микроциркуляции в очагах воспаления можно добиться, применяя трентал, курантил, продектин в общепринятых дозах.
При развитии дыхательной недостаточности, менингоэнцефалите, ИТШ, ДВС-синдроме проводят соответствующие мероприятия.
Дезинтоксикационную терапию при возможности лучше осуществлять перорально. Внутривенно ее следует проводить осторожно, чтобы не вызвать отека легких и мозга.
В период реконвалесценции назначают препараты, стимулирующие иммуногенез, особенно фагоцитоз (пентоксил, метилурацил, нуклеинат натрия). Вопрос о возможности назначения более сильных иммуностимуляторов и иммуномодуляторов (тимозин, Т-активин, левамизол и др.) изучается.
Порядок выписки из стационара. Учитывая большую частоту рецидивов и затяжных форм, возможность хронизации, не следует рекон-валесцентов выписывать из стационара раньше 10-го дня нормальной температуры даже при нетяжелом, неосложненном течении. Реконвалесценты подлежат диспансерному наблюдению в течение 2 лет, при этом 1 раз в 6 мес ставят РСК с орнитозным антигеном и проводят флюорографию легких. При необходимости осуществляют консультацию пульмонолога, невропатолога, кардиолога. Если клинические проявления болезни отсутствуют, рентгенологические изменения в легких не определяются, реконвалесцентов с диспансерного учета снимают.
Профилактика. Общая профилактика заключается в проведении прежде всего ветеринарно-санитарных мероприятий на птицефермах, птицефабриках, в местах скопления голубей. Необходимы регулярные выборочные обследования рабочих и служащих птицефабрик.
Надежная специфическая профилактика не разработана. Учитывая нестерильный, непродолжительный характер иммунитета, вряд ли следует ожидать высокой эффективности от имеющихся убитых инакти-вированных вакцин.
Микоплазмозы
Микоплазмозы — группа инфекционных заболеваний, вызываемых особыми микроорганизмами — микоплазмами, протекающих с поражением дыхательных путей, суставов, мочеполовой системы, внутриутробным повреждением плода, (лат. — mycoplasmosis, англ. — mycoplasma diseases).
Микоплазмы — мелкие грамотрицательные микроорганизмы, отличающиеся от бактерий отсутствием клеточной стенки, от вирусов — способностью роста на бесклеточных средах. Поэтому они занимают промежуточное положение между бактериями и вирусами. Это — повсеместно распространенные сапрофиты и паразиты животных и растений. Роль микоплазм в патологии человека изучена еще недостаточно. В настоящее время семейство микоплазм (Mycoplasmataceae) насчитывает уже более 100 видов, но в патологии человека доказана роль лишь нескольких из них — М.pneumoniae, M.hominis, M.fermentalis, M.arthritidis, M.genitalium и Ureaplasma urealyticum (этот микроорганизм отличается от других микоплазм наличием уреазной активности).
Так, М.pneumoniae является возбудителем первичной атипичной пневмонии (более современное название — респираторный микоплаз-моз), Ureaplasma urealyticum, M.hominis, M.genitalium могут быть причиной урогенитальных заболеваний, патологии плода и новорожденных, M.arthritidis и др. — поражений суставов (ревматоидный артрит).
Многие микоплазмы (M.salivarum, M.buccale, M.fermentans и другие) являются сапрофитами полости рта, мочеполовых путей человека.
Свое название «микоплазмы» возбудители получили от слова «mykos» (мягкий, греч.) за особую («мягкую») оболочечную структуру клетки. Отсюда общее название вызываемых ими заболеваний — «ми-коплазменные инфекции».
В клинике инфекционных болезней изучают патологию, вызываемую М.pneumoniae.
Респираторный микоплазмоз
Микоплазменная инфекция, вызываемая М.pneumoniae (респираторный микоплазмоз) — острое антропоноз-ное заболевание преимущественно с капельным механизмом передачи, характеризующееся избирательным поражением дыхательных путей (лат. — mycoplasmosis, англ. — respiratory mycoplasmosis, primary atypical pneumoniae).
Краткие исторические сведения. Первый представитель семейства микоплазм — Mycoplasma mycoides, вызывающий плевропневмонию у крупного рогатого скота, был изолирован еще в 1898 г. E.Nocard, E.R.Roux. В последующие годы из организма животных и объектов окружающей среды были выделены микроорганизмы, весьма сходные с М.mycoides, что послужило основанием дать всем им общее название — плевропневмониеподобные организмы (PPLO — pleuropneu-monia-like organisms — англ.). В 1944 г. M.Eaton выделил у человека фильтрующийся агент, который в условиях эксперимента вызывал пневмонию у хлопковых крыс и нейтрализовался сыворотками крови реконвалесцентов после первичной атипичной пневмонии. Возбудитель получил название «агент Итона». Только в 1962 г. R.Chanock, Hauflick, Barilie доказали, что этот микроорганизм относится не к вирусам, а является представителем самостоятельного семейства Mycoplas-mataceae.
В 1963 г. он получил новое название «Mycoplasma pneumoniae)), к которому к этому времени были отнесены и PPLO.
Актуальность. Респираторный микоплазмоз относится к инфекционным заболеваниям, учет которых не предусмотрен официальной медицинской документацией, из-за чего все сведения о заболеваемости могут быть получены в основном из научно-исследовательских работ.
В промышленно развитых странах как возбудитель острой пневмонии М.pneumoniae занимает 3-е место после пневмококка и Legionella pneumophila. Но и эти данные, по-видимому, не отражают истинной ситуации, поскольку пневмония, вызываемая микоплазмами, может протекать относительно легко, большинство заболевших переносят ее в виде «амбулаторной» пневмонии, и лишь незначительной части больных ставится правильный диагноз.
M.pneumoniae является одной из основных причин респираторных инфекций у школьников и молодых людей, пик заболеваемости приходится на возраст 10—17 лет. Еще недостаточно изучено ее влияние на организм в период полового созревания. Но доказана связь уродств развития плода, мертворождений, ранней детской смертности с микоплаз-менной инфекцией в результате внутриутробного заражения плода.
Течение гриппа, парагриппа и других вирусных заболеваний осложняется, если к ним присоединяется респираторный микоплазмоз. Так, имеются данные о том, что при смешанной микоплазменно-гриппоз-ной инфекции летальность может достигать 10%.
Этиология. Клетки микоплазм чрезвычайно полиморфны, они имеют вид кокковидных, шаровидных, кольцевидных, звездчатых образований, могут быть собраны в виде ветвящихся бус, но М.pneumoniae имеет преимущественно форму коротких нитей длиной до 2—5 мкм, диаметром до 0,3—0,8 мкм (они проходят через бактериальные фильтры). Высокая степень полиморфизма при развитии в тканях хозяина затрудняет их идентификацию.
Клетка микоплазм окружена трехслойной мембраной толщиной 7,5—10 нм. Отсутствуют характерные для других микроорганизмов выросты мембраны. На полюсе у клетки может формироваться терминальная структура, или «волдырь», который имеет сложное строение. Он обеспечивает прикрепление к чувствительной клетке.
Циркулярная двойная нить ДНК микоплазм отличается необычным химическим составом и малой массой (около 500 кД), она может содержать информацию примерно о 700 белках. В рибосомах микоплазм выявлены 3 вида информационных РНК.
Обладающая трехслойным строением мембрана клетки микоплазм имеет большее, чем у бактерий, значение из-за отсутствия клеточной стенки. Поэтому у них мембрана составляет значительную часть тела. Микоплазмы не способны к синтезу жирных кислот и холестерола, поэтому эти вещества обязательно должны содержаться в питательных средах, используемых для их выращивания. Считают, что в организме человека и животных липопротеиды сыворотки крови служат основным источником жирных кислот холестерола для микоплазм.
Микоплазмы, в отличие от вирусов, хорошо культивируются на специальных питательных средах — Хейфлика, «SP-4», «New-York city» и других. При этом необходимым условием роста является наличие холестерола, липопротеидов, достаточная влажность. Температурный оптимум для роста большинства микоплазм составляет 37 °С, а оптимальные условия рН — 6,0—8,0. М.pneumoniae растет медленнее, чем другие микоплазмы, колонии появляются через 5—10 дней и позже. Размножаются бинарным делением.
Микоплазмы весьма неустойчивы к действию неблагоприятных факторов окружающей среды. Так, на них губительно действует высушивание, прогревание во влажной среде до +45 °С в течение 3 ч приводит к их гибели. При температуре +56 °С микоплазмы теряют жизнеспособность через несколько минут. Микоплазмы разрушаются ульт-
развуком, переменным замораживанием и оттаиванием в дистиллированной воде. Они весьма чувствительны к 0,5% растворам формалина и фенола, хлорамину, к желчи, поверхностно-активным веществам, рентгеновскому и гамма-излучению.
Все штаммы М.pneumoniae принадлежат к одному серотипу. Они имеют общие антигены с некоторыми бактериями (стрептококк). У ми-коплазм выявляют три активных антигена, два из которых связаны с мембранами, а третий — с цельной клеткой. Мембранные антигены, главные антигенные детерминанты клеточной поверхности, по природе своей являются гаптенами. Мембранные гликолипиды содержат детерминанты, к которым у больных образуются антитела. Однако в тканях легких, печени, сердца, мозга, а также у стрептококков группы М имеются общие антигенные детерминанты с мембранными гликопро-теидами микоплазм, что может обеспечивать перекрестные реакции. Холодовые гемагглютинины класса IgM, которые образуются примерно у 50 % больных микоплазменной пневмонией, перекрестно реагируют с гликолипидными детерминантами антигена эритроцитов человека. Это затрудняет оценку полученных при обследовании больных результатов. Наличие у микоплазм антигенов, общих для них и человека, как полагают, сказывается на вирулентности определенных штаммов микоплазм, повышая ее.
Гликопротеиды микоплазм ответственны за реакции клеточного иммунитета при естественной экспериментальной микоплазменной пневмонии. У микоплазм имеется белок Р1, способствующий цитадгезии М.pneumoniae, он отсутствует у микоплазм-сапрофитов. Способность к адсорбции на клетках, продукция гемолизина также определяют степень вирулентности микоплазм. Антитела к белку Р1 препятствуют возникновению инфекционного процесса.
Отличительной особенностью М.pneumoniae является способность к продукции гемолизина. Большинство изученных штаммов М.pneumoniae обладают гемадсорбирующими свойствами.
Считают, что одним из основных токсических продуктов микоплазм является перекись водорода, которая, хотя и не относится к высокотоксичным веществам, но вырабатывается М.pneumoniae в огромных количествах. Даже меньшие количества перекиси водорода, действуя постоянно, способны вызывать окислительные поражения тканей: перекись водорода является основным гемолитическим фактором М.pneumoniae.
У микоплазм обнаружена потенциальная способность к обмену генетической информацией с вирусами. Однако не выяснено, происходит ли она в природе, например, при смешанной микоплазменно-виру-сной инфекции.
У микоплазм существуют факторы защиты от фагоцитоза, на что указывает наличие живых микоплазм внутри фагоцитов при экспериментальном моделировании инфекции. Фагоцитоз при микоплазмозе слабо выражен и заканчивается элиминацией микоплазм только в присутствии антител и комплемента. Вирулентные штаммы микоплазм образуют лейкотоксический фактор, который снижает интенсивность фагоцитоза и вызывает деструктивные изменения в ядре макрофагов. Этот фактор выделяется в окружающую среду и нейтрализуется специфической сывороткой. Вирулентные штаммы продуцируют его в большем количестве, чем менее вирулентные.
Разрушенные клетки М.pneumoniae являются слабым митогеном для лимфоцитов. При заболевании может наступать системная активация В-лимфоцитов, проявлением которой является неспецифическое повышение титров антител к вирусным антигенам, с которыми встречались люди до заболевания респираторным микоплазмозом. Полагают, что лимфоцитарные реакции, вызванные митогенами микоплазм, не являются защитными. Они, по-видимому, могут быть не только следствием гиперчувствительности к возбудителю, но и результатом поликлональ-ной активации лимфоцитов микоплазмами. Микоплазмы способны оказывать и прямое воздействие на иммунокомпетентные клетки.
Микоплазмы резистентны к антибиотикам, ингибирующим биосинтез клеточной стенки (природным и синтетическим пенициллинам, це-фалоспоринам, ванкомицину), к полимиксинам, рифампицину, сульфаниламидам, нитрофуранам. Они умеренно чувствительны к аминогли-козидам, левомицетину, чувствительны к макролидам, высокочувствительны к тетрациклинам.
Эпидемиология. В естественных условиях источником инфекции является только человек. Особенно опасны больные острой пневмонией в начале заболевания, когда кашель становится продуктивным и М.pneumoniae выделяется с респираторным секретом. Обнаружить возбудителя в секрете можно уже за 2—8 дней до начала клинических проявлений. За 1—2 дня до развития болезни и в первые 2—3 дня заболевания концентрация микоплазм в секрете особенно высока, затем начинает снижаться, но в небольших количествах М.pneumoniae могут обнаруживаться еще несколько недель (до 12—14).
Основной путь передачи возбудителя — воздушно-капельный. Воздушно-пылевой механизм заражения, видимо, не является распространенным, так как микоплазмы быстро погибают при высушивании и под воздействием различных факторов окружающей среды.
Для заражения микоплазмозом требуется тесный и длительный контакт с источником инфекции. Даже из контактирующих с больным членов семьи заболевают немногие. Тем не менее, через несколько недель или месяцев все контактировавшие лица, восприимчивые к этой инфекции, оказываются инфицированными. Наиболее часты заболевания микоплазмозом во вновь сформированных коллективах, при этом наибольшее значение для распространения инфекции имеет общение в спальных комнатах. Дети — основной источник респираторного ми-коплазмоза как в семье, так и при внесемейном распространении. Вспышки инфекции в детских коллективах, связанные с заражением от единого источника, крайне редки. Распространение респираторного микоплазмоза происходит последовательно от человека к человеку, что определяет растянутость вспышки во времени. Пик заболеваемости приходится на возраст 10—17 лет.
Вероятность заболевания человека респираторным микоплазмозом чрезвычайно вариабельна и зависит в первую очередь от патогенности и вирулентности возбудителя (варьирует у разных штаммов). Доказано повышение восприимчивости к респираторному микоплазмозу во время эпидемий гриппа. Неблагоприятный преморбидный фон (рахит, гипотрофия, анемия, экссудативный диатез) способствует развитию ми-коплазменной инфекции. В промышленно развитых странах дети в возрасте до 5 лет и взрослые старше 50 лет болеют редко.
В летнее время заболеваемость респираторным микоплазмозом возрастает. Есть сведения, что 50 % «летних» пневмоний вызываются М.pneumoniae.
Возрастание заболеваемости респираторным микоплазмозом в 1,5—2 раза по сравнению с обычным уровнем происходит с интервалом 5—6 лет. Эпидемический период продолжается 1—2 года, затем заболеваемость медленно снижается. Причины такой цикличности не установлены. При сопоставлении сведений о годовой заболеваемости гриппом, другими ОРЗ и респираторным микоплазмозом обнаружено, что эпидемический процесс при этих заболеваниях развивался без выраженной связи. Эпидемические циклы респираторного микоплазмоза в разных регионах не были синхронизированы.
Респираторный микоплазмоз широко распространен во всех странах мира, встречается во всех климатических поясах, но чаще регистрируется в зонах с умеренным климатом. На распространение инфекции могут оказывать влияние плотность населения и социально-экономические условия.
В разных странах и местностях состояние коллективного иммунитета при респираторном микоплазмозе неодинаково. Это, вероятно, отражает разную интенсивность циркуляции возбудителя в человеческих популяциях.
После перенесенной инфекции, как правило, формируется длительный иммунитет. Антитела класса IgM обнаруживают и через 2 года после перенесенного заболевания, a IgG даже через 10—12 лет. Исключение составляют больные с иммунодефицитом (особенно при нарушении синтеза секреторных IgA, Т-лимфоцитов-киллеров). Слабый иммунитет к микоплазменной инфекции формируется при сочетании ее с другими ОРЗ, в частности с гриппом.
Так как пожизненного иммунитета нет, возможны повторные зара-
жения, но при этом число бессимптомных и стертых форм увеличивается.
Механизм формирования иммунитета и его защитная роль недостаточно изучены. К заражению M.pneumoniae оказываются иногда невосприимчивыми лица, у которых отсутствуют в крови специфические антитела, вместе с тем наличие антител, даже в высоких титрах, не всегда защищает от заражения и заболевания. Безусловно, играет роль и генетический фактор, поскольку установлено, что лица с группой крови АВ (IV) реже заболевают респираторным микоплазмозом.
Классификация. Общепринятой классификации заболеваний, вызываемых M.pneumoniae, нет. Классификация ВОЗ (1978) предусматривает выделение микоплазменной пневмонии как отдельной формы.
Однако M.pneumoniae может поражать не только легкие, одновременно или изолированно в процесс вовлекаются бронхи, бронхиолы, трахея, гортань.
Более того, заболевание, вызываемое M.pneumoniae, может протекать как полисистемное с поражением почти всех органов и тканей.
Исходя из этого, наиболее приемлемой из множества существующих классификаций следует считать предложенную в 1977 г. С.В.Прозоровским и соавторами. В соответствии с этой классификацией выделяют следующие клинические формы микоплазмоза:
острое респираторное заболевание (микоплазменное);
микоплазменные пневмонии;
внереспираторные формы заболевания;
— сочетанные формы (микоплазменно-вирусные и микоплазменно-бактериальные) заболевания.
Острые респираторные микоплазменные заболевания могут протекать в виде ринита, фарингита (ринофарингита), трахеита или их сочетаний.
Внереспираторные формы микоплазмоза (менингит, менингоэнцефалит, миокардит, гепатит, панкреатит, артрит, поражения кожи, гемолитическая анемия) обычно сочетаются с микоплазменной пневмонией или ОРЗ. Как отдельную форму микоплазмоза можно выделить микоплазменные менингит и средний отит, которые могут быть самостоятельным проявлением инфицирования M.pneumoniae.
По степени тяжести выделяют легкое, среднетяжелое и тяжелое течение респираторного микоплазмоза.
Примерная формулировка диагноза. При формулировке диагноза необходимо учитывать клиническую форму, тяжесть течения, наличие осложнений.
Респираторный микоплазмоз (острый ринофаринготрахеит), течение средней тяжести.
Респираторный микоплазмоз (правосторонняя очаговая пневмония в нижней доле, правосторонний серозно-геморрагический мирин-гит), течение тяжелое.
Патогенез. Изучен недостаточно, так как нет полноценной экспериментальной модели.
С мелкими частичками аэрозоля, образующимися при кашле и чиханье больного, М.pneumoniae попадают в нижние отделы дыхательных путей — бронхи и бронхиолы. С помощью особого «прикрепляющего» фактора (Р) они фиксируются на специальных рецепторах эпителиальной клетки. Внутрь клеток микоплазма не проникает, но, располагаясь на мембранах эпителиальных клеток, начинает размножаться, постепенно проникая в более глубокие слои. Сохранению и накоплению возбудителя на поверхности мембран клеток способствуют незавершенный фагоцитоз, подавление микоплазмами активной подвижности макрофагов, а в дальнейшем и нарушение синтеза макрофагов из клеток-предшественников. Основной токсической субстанцией (токсическим фактором) микоплазм является перекись водорода. Она продуцируется в таких огромных количествах, что нарушает метаболизм соседствующих с микоплазмами клеток, а это в дальнейшем приводит к их гибели и некрозу. В зоне расположения микоплазм (в слизистой оболочке бронхов, бронхиол, альвеол, перибронхиальной ткани) возникает инфильтрация лимфоцитами и плазматическими клетками. Лейкоцитарная инфильтрация, достигающая к моменту появления клинических симптомов своего максимума, не способна купировать процесс. Распространение микоплазм вглубь и гибель окружающих клеток приводят к образованию очагов некроза. Тяжесть поражения в значительной мере определяется вирулентностью штамма микоплазм, дозой возбудителя, попавшего в организм, и состоянием иммунной системы больного.
Долгое время считали, что М.pneumoniae за пределы дыхательной системы не выходят, а повреждение других органов и систем обусловлено действием ИК и аутоантител. Однако многочисленные наблюдения показали, что микоплазмы, в частности М.pneumoniae, можно обнаружить практически во всех органах и тканях — в печени, почках, сердечной мышце, спинномозговой жидкости и веществе мозга, элементах кожных высыпаний, перикардиальной и внутрисуставной жидкости и т.д. Были обнаружены М.pneumoniae и в крови, что дает основание утверждать, что респираторный микоплазмоз может протекать как генерализованная инфекция с диссеминацией возбудителя и развитием полиорганных поражений, причем эти поражения могут сочетаться с респираторными проявлениями или даже выявляться самостоятельно, если процесс в дыхательных путях протекает субклинически. Внереспираторные проявления у больных, связанные с диссеминацией возбудителей и их непосредственным действием, можно обнаружить в течение первых 2—3 нед болезни. Более поздние бывают обусловлены действием ИК и аутоантител.
Иммунным реакциям при микоплазменной инфекции принадлежит особая роль. М.pneumoniae выделяет митогенный фактор, который вызывает поликлональную активацию как Т-, так и В-лимфоцитов. Одним из проявлений активации В-лимфоцитов является неспецифическое повышение титров антител к антигенам вирусов, с которыми больные встречались до заболевания микоплазмозом (поэтому возможны ошибки в трактовке результатов, полученных при обследовании больных: повышение титров антител против возбудителей гриппа, парагриппа, аденовирусов на фоне микоплазменной инфекции может быть показателем не инфекции-микст, а следствием «иммунологической пометки»).
Выздоровление наступает благодаря совместному действию факторов неспецифической (макрофаги) и специфической резистентности организма. Секреторные IgA — короткоживущие, именно с их появлением связано стихание местных проявлений болезни. IgG в секрете сохраняются более длительное время, хотя и в невысоких титрах, они защищают организм от повторного заражения. Но в этом процессе могут принимать участие и сывороточные антитела: они способны проникать в местный очаг воспаления (в легочную ткань, слизистую оболочку бронхов и бронхиол). В результате их нейтрализующего действия заболевание может приобретать стертое и абортивное течение (инфекция протекает с минимальным поражением клеток дыхательной системы).
При первичном заражении сывороточные антитела появляются позже, чем секреторные, и роль их в освобождении от инфекции менее существенна. О длительности сохранения сывороточных антител в организме точных данных нет (называют сроки от б мес до 2 лет для IgM, до 12 лет — для IgG). Напряженность иммунитета поддерживается частыми повторными инфицированиями, что можно определить по нарастанию титров сывороточных антител в 4 раза и более без развития клинических признаков заболевания.
Микоплазменная инфекция характеризуется появлением в крови ИК и антител к различным тканям — миокарду, перикарду, коже, сосудам, ЦНС и т.д., дополнительным мощным повреждающим фактором. Возникающие при их действии поражения различных органов уже расцениваются как осложнения микоплазменной инфекции.
Многое в патогенезе микоплазмоза еще остается неизвестным, нуждается в изучении и уточнении.
В патогенезе респираторного микоплазмоза еще много неясного. Тем не менее, патогенез ориентировочно можно представить в виде схемы (рис. 14).
Клиника. ОРЗ — одна из наиболее распространенных форм респираторного микоплазмоза.
Инкубационный период составляет 3—11 дней. Чаще заболевание начинается постепенно с познабливания, ломоты в мышцах и суставах, повышенной утомляемости, першения и царапания в горле, сухости в носу, иногда появляются нерезкая головная боль, субфебрилитет.
