
- •Болезни в трех томах
- •Общая часть
- •8 Список сокращений
- •Основные сведения об инфекционных болезнях
- •Классификация инфекционных болезней
- •2 Ж. Возианова
- •Принципы лечения инфекционных болезней
- •Характер взаимодействия с микро-и макроорганизмом
- •Возможные побочные реакции
- •II. Аминогли-козиды
- •III. Тетрацик-лины
- •Специфическая профилактика инфекционных болезней
- •Заболевания преимущественно с воздушно-капельным механизмом передачи
- •1Ейраминидаза
- •Действие на факторы клеточного и гуморального иммунитета
- •Формирование антитоксического иммунитетаСтимуляция местных факторов защиты, в том числе завершенного фагоцитоза
- •Функциональные нарушения
- •Механизмов защиты
- •Внедрение микоплазм в слизистую оболочку дыхательных путей
- •Заболевания преимущественно с фекально-оральным механизмом передачи
- •Размножение сальмонелл в тонкой кишке
- •Вегетативная нс
- •Заболевания, вызываемые иерсиниями
- •Желудке (высвобождение эндотоксина при этом незначительное)
- •Непосредственное повреждающее действие шигелл на слизистую оболочку толстой кишки
- •Серогруппа 01 (холерные)
- •Всасывание фрагментов вибрионов в кровь Образование различных факторов агрессии
- •Выработка вибриоцидных антител
- •Структура и функции печени
- •Методы диагностики, использующиеся при обследовании больных вг, и их оценка
- •21 Ж. Возианова
- •Особенности лечения больных вирусным гепатитом с затяжным течением
- •Заболевания, вызываемые вирусами
- •Энтеровирусами Паралитические формы (полиомиелитоподобные заболевания)
- •Асептический серозный менингит
- •Энтеровирусный энцефалит
- •Синдром Гийена—Барре (полирадикулоневрит)
- •Острые респираторные заболевания («летний грипп»)
- •Лихорадка с экзантемой
- •Везикулярный стоматит с экзантемой (ящуроподобный синдром)
- •Герпетическая ангина (герпангина)
- •Эпидемический конъюнктивит
- •Энтеровирусная диарея (летние гастроэнтериты)
- •Энтеровирусный гепатит
- •Эпидемическая миалгия (плевродиния, борнхольмская болезнь)
- •Энтеровирусная инфекция у новорожденных
- •Бессимптомная инфекция
- •Лечение нематодозов
- •Лечение цестодозов
- •Протозойные заболевания
- •1Нфекц1йн1 I паразитарн1 хвороби
Заболевания, вызываемые иерсиниями
Иереиниозы — группа инфекционных заболеваний, вызываемых возбудителями из рода Yersinia, семейства Enterobacteriaceae.
Известны 11 видов этого рода, но способность вызывать заболевания у человека доказана лишь у 3 из них: Y.pestis (возбудитель чумы), Y.enterocolitica и Y.pseudotuberculosis (возбудители заболеваний пищеварительного тракта, септических состояний). Несмотря на то что возбудители относятся к одному роду, механизм заражения, факторы передачи и клинические проявления различны. Более того, клиника заболеваний, вызываемых одним и тем же возбудителем, отличается большим полиморфизмом, что связано с полиорганностью поражений.
В данной главе будут рассмотрены относящиеся к группе кишечных инфекций зооантропонозные заболевания, вызываемые Y.enterocolitica и Y.pseudotuberculosis.
Краткие исторические сведения. Возбудитель псевдотуберкулеза был, по существу, случайной находкой ученых L.Malassez и W.Vignal в 1883 г., когда они проводили исследования с материалом, который, как они полагали, был получен от умершего от туберкулезного менингита ребенка. Термин «псевдотуберкулез» предложил K.Eberth в 1885 г. для обозначения заболевания животных, при котором в их органах находили изменения, аналогичные таковым при туберкулезе, но не обнаруживали туберкулезную палочку. Лишь в 1889 г. R.Pfeiffer подробно описал свойства выделенного им возбудителя.
Большой полиморфизм клинических проявлений затруднял изучение этой инфекции. Не случайно до 1972 г. возбудитель имел более 10 различных названий, а варианты клинического течения описывали как разные нозологические формы. Учитывая сходство возбудителя псевдотуберкулеза с возбудителем чумы, еще в 1944 г. J.I.Van Loghem предложил объединить их в один род — Yersinia (в честь первооткрывателя возбудителя чумы A.Yersin), но лишь в 1972 г. Международный комитет по систематике бактерий утвердил новое родовое название — Yersinia.
В СССР с 1959 г. заболевание регистрировали под названием «дальневосточная скарлатиноподобная лихорадка». В 1966 г. В.А.Знаменский и А.К.Вишняков установили, что возбудителем дальневосточной скар-латиноподобной лихорадки является Pasteurella pseudotuberculosis. В 1966 г. В.А.Знаменский произвел эксперимент на самом себе. Он, зара-
зив себя культурой возбудителя, привезенного с Дальнего Востока, перенес тяжелую форму дальневосточной скарлатиноподобной лихорадки и доказал, что она является одним из вариантов псевдотуберкулезной инфекции.
Еще в 1923 г. в США была описана клиника заболевания, получившего спустя много лет название «иерсиниоз». В 1933 г. R.Gilbert описал возбудителя этой болезни, которому дал сначала название "Bacterium enterocoliticum», а затем — «pasteurella pseudotuberculosis type В», «pasteurella X». В 1939 г. возбудитель, выделенный у больных людей с явлениями энтероколита, был изучен R.Shieleifstein, N.Goleman, которые обратили внимание на его сходство с возбудителем псевдотуберкулеза. Обнаруженный новый микроорганизм был определен как атипичный возбудитель псевдотуберкулеза. До 1966 г. вызываемое этим возбудителем заболевание считалось весьма редким, так как было описано лишь около 30 достоверных случаев этой болезни. Однако благодаря серии работ, проведенных в 1962—1966 гг. в Швеции, Франции, Бельгии, удалось значительно расширить представления об этой инфекции: в 1974 г. было уже зарегистрировано более 4000 случаев заболевания, которое получило название «кишечный иерсиниоз» по названию возбудителя — «yersinia enterocolitica». Тогда же были уточнены сходства и различия между возбудителем псевдотуберкулеза и иерсиниоза.
В СССР первый случай заболевания кишечным иерсиниозом был описан М.А.Беловой и Г.В.Ющенко в 1968 г.
Актуальность. Тенденция к росту числа заболеваний, вызываемых иерсиниями, отмечается почти во всех странах мира. Это обусловлено множеством причин, главные из которых следующие:
нарушение экологического равновесия между человеком и окружающей средой в результате ее загрязнения;
урбанизация, индустриализация сельского хозяйства, строительство больших животноводческих ферм промышленного типа, огромных холодильных установок, расширение сети предприятий общественного питания — все это нередко сопровождается нарушением санитарных норм и правил, увеличением числа синантропных грызунов, являющихся основным резервуаром инфекции;
часто развивающиеся у животных и людей дисбактериозы как результат неконтролируемого применения антибиотиков создают условия для внедрения и сохранения в кишечнике представителей патогенной и условно патогенной микрофлоры, в том числе и иерсиний;
очень высокая резистентность иерсиний к факторам окружающей среды позволяет им не только сохраняться, но и накапливаться вне организма человека и животных;
улучшение качества диагностики.
По данным ВОЗ, уже в 80-е годы XX ст. иерсиниозы в странах Заладной Европы занимали 3—4-е место среди кишечных инфекций, уступая лишь шигеллезу, сальмонеллезу, а в некоторых странах — кам-пилобактериозу. На территории СССР в 1989 г. было зарегистрировано около 25 ООО случаев заболевания кишечным иерсиниозом, т.е. около 3 % всех случаев острых бактериальных энтеритов. Выявлены многочисленные природные и антропургические очаги псевдотуберкулеза с устойчивой тенденцией к росту заболеваемости в Швеции, Финляндии, Бельгии, Голландии, Франции, России и других странах Западной и Восточной Европы.
Интерес к иерсиниозам обусловлен в значительной мере особенностями их течения (многообразие клинических форм), что затрудняет распознавание и изучение болезни, возможностью затяжного, рецидивирующего и даже хронического течения, частотой и характером осложнений. До настоящего времени отсутствует единая общепризнанная классификация иерсиний и иерсиниозов, недостаточно изучены патогенез вызываемых ими заболеваний, частота и причины развития отдельных вариантов болезни, причины хронизации, не уточнено, какая существует связь между иерсиниями и большими коллагенозами. Необходимы надежные и четкие рекомендации по лечению больных, профилактике осложнений и неблагоприятных исходов. Нуждается в совершенствовании и специфическая диагностика иерсиниозов.
Таким образом, сама жизнь ставит перед медиками, исследователями важную проблему — изучение иерсиниозов, поиски путей борьбы с этой инфекцией.
Этиология. Y.enterocolitica и Y.pseudotuberculosis относятся к семейству Enterobacteriaceae, роду Yersinia.
Иерсиний — короткие грамотрицательные палочки, хорошо красящиеся анилиновыми красителями. Спор не образуют, но Y.pseudotuberculosis имеет капсулоподобную субстанцию. Подвижны благодаря наличию жгутиков. Растут на обычных для всех энтеробактерий твердых и жидких питательных средах. Факультативные аэробы. Температурные условия, необходимые для роста, находятся в довольно широких пределах — от +3 °С до +37 °С, но температура оказывает существенное влияние на патогенность микроорганизмов: культуры, которые выращивались при температуре +12 ... +14 "С, обладают значительно большей агрессивностью, чем те, которые росли при температуре выше +30 "С. Иерсиний способны образовывать S- и R-формы, изменяя при переходе из одной формы в другую многие свои свойства.
Иерсиний обладают довольно высокой биохимической активностью. Но если у Y.enterocolitica существуют 5 биотипов, существенно различающихся по химической активности (биовары), то все Y.pseudotuberculosis обладают сходными биохимическими свойствами, не изменяющимися-7 даже при длительном культивировании или хранении культур.
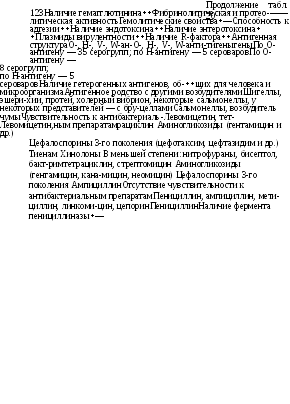
Иерсиний весьма устойчивы в окружающей среде, они способны размножаться и накапливаться в почве. Неприхотливость позволяет им длительное время сохраняться и даже размножаться в водопроводной воде. Они длительно сохраняются в холодильнике ( + 3 ... +4 °С). Но на иерсиний губительно действуют прямые солнечные лучи, они мгновенно погибают при кипячении. Y.enterocolitica и Y.pseudotuberculosis проявляют некоторые различия в чувствительности к антибиотикам (табл. 20). Формирующаяся резистентность к антибиотикам в значительной мере связана с наличием у них R-фактора.
Возбудители патогенны не только для человека, но и для многих теплокровных животных и птиц, а также рыб и моллюсков. Экспериментальной моделью служат белые мыши, морские свинки, кролики.
Для иерсиний характерна довольно сложная антигенная структура. Поверхностный О-антиген — термостабильный липополисахарид, выдерживающий кипячение в течение 2 ч, обладает высокой специфичностью. Он определяет принадлежность иерсиний к определенным серологическим группам. Н-антиген (термолабильный, жгутиковый) содержит общий для всех серологических вариантов компонент. Сочетания О- и Н-антигенов определяют особенности каждого штамма возбудителей.
Поверхностные V- и W-антигены (VW-комплекс), имеющие сходство с аналогичными антигенами чумных бактерий, в значительной мере определяют тяжесть течения болезни (антигены вирулентности). Их синтез детерминируется плазмидами иерсиний и зависит от температуры культивирования (наиболее активен он при температуре + 8 °С... +22 °С). Антигены вирулентности существенно повышают ин-вазивные и цитотоксические свойства иерсиний, увеличивают способность возбудителей размножаться в макрофагах и вероятность диссе-минации процесса. Штаммы, не имеющие плазмид, лишены способности образовывать V- и W-антигены. Наличие гетерогенных антигенов, общих с антигенами различных органов и тканей человека (печени, почек, кишечника, эритроцитов, лимфатических узлов и т.д.), обусловливает частоту развития аутоиммунных процессов, полиорганность поражений, вариабельность течения, неодинаковую тяжесть течения у больных с различными изоантигенами эритроцитов человека. Имеются также антигены, общие для иерсиний и других энтеробактерий. Наличие таких антигенов может быть причиной ложноположительных результатов при постановке серологических реакций.
Иерсиний имеют большой «набор» факторов патогенности. Помимо названных V- и W-антигенов, в развитии патологического процесса принимает участие эндотоксин (компоненты клеточной стенки, ассоциированной с О-антигеном). Он обладает всеми свойствами, присущими эндотоксинам кишечной палочки (общетоксическим, пироген-ным, действует на иммунную систему и т.д.).
Плазмиды ответственны не только за синтез V- и W-антигенов, но и различных экзотоксических субстанций (летальный токсин, цитоток-син, фактор нарушения проницаемости сосудов), которые облегчают внедрение возбудителя в организм и развитие патологического процесса. Ранее считалось, что способность к образованию энтеротоксина присуща только Y.enterocolitica, но сейчас доказано, что такой способностью обладает и Y.pseudotuberculosis, хотя ее энтеротоксин по силе действия уступает токсину Y.enterocolitica. В капсулоподобной субстанции Y.pseudotuberculosis содержатся антигены, снижающие активность лейкоцитов, тормозящие их миграцию в очаг воспаления, способствующие генерализации инфекции. Такими антигенами Y.enterocolitica не обладает. Значительно повышается инвазивность иерсиний благодаря наличию у них факторов адгезии (особых орга-нелл на поверхности бактериальной клетки).
Иерсиний образуют множество ферментов (гиалуронидазу, нейр-аминидазу и др.), облегчающих преодоление защитных барьеров и облегчающих проникновение их за пределы кишечника. Уреазная активность иерсиний проявляется усилением аммиачной интоксикации при развитии патологического процесса.
Табл. 20 дает представление о сходстве и различиях Y.enterocolitica и Y.pseudotuberculosis.
Эпидемиология. Иерсиний вызывают заболевания преимущественно у животных (домашних и сельскохозяйственных), грызунов, птиц, все они могут быть источником инфекции. Особая роль принадлежит грызунам (крысам, мышам), обитающим в сараях, погребах, кладовых, где они загрязняют и инфицируют овощи и фрукты. У взрослых грызунов заболевания нередко протекают субклинически или в виде носительства, тогда как молодые животные болеют тяжело и нередко погибают. При заболеваниях, вызываемых Y.enterocolitica, возможна передача инфекции от больного человека здоровому, тогда как человек, инфицированный Y.pseudotuberculosis, для окружающих не опасен.
Существует весьма важная эпидемиологическая особенность псевдотуберкулеза: источником (именно источником, а не фактором передачи) может быть почва. Это связано с психрофильностью Y.pseudotuberculosis — способностью выживать, размножаться и накапливаться в почве при относительно низкой ( + 4...+ 8 °С) температуре. Более того, культура возбудителей, выращенная в почве в условиях пониженной температуры, обладает более выраженными патогенными свойствами.
Основные факторы передачи — инфицированные иерсиниями мясо и мясные продукты, молоко (особенно некипяченое), овощи (особенно при псевдотуберкулезе), фрукты, если они не были как следует промыты. Хранение в холодильнике не исключает возможности размноже-

ния в инфицированном продукте иерсиний. Фактором передачи может послужить вода, поскольку в ней иерсиний могут не только сохраняться до 1 года, но и размножаться. Поэтому кипячение воды является важным условием профилактики иерсиниозов.
Заражение чаще всего происходит алиментарным путем — при попадании в пищеварительный тракт возбудителей с пищевыми продуктами, водой. Возможен контактно-бытовой путь передачи при уходе за больным животным, снятии шкуры. Трансмиссивный путь передачи не подтверждается.
Наиболее чувствительны к иерсиниозам дети младшего возраста, старики. Связано это с тем, что у детей меньшая инфицирующая доза вызывает заболевание. Но вероятность возникновения заболевания как у взрослого человека, так и у ребенка определяется не только дозой, но и в значительной мере вирулентностью возбудителя. Заболевание у человека наиболее часто вызывают серотипы 03, 08 и 09 Y.enterocolitica, а также серотип 1 Y.pseudotuberculosis. Регистрируются заболевания в виде вспышек (чаще обусловлены Y.enterocolitica), особенно в детских коллективах, и спорадических случаев (типично для Y.pseudotuberculosis).
Сезонный фактор достаточно отчетлив при иерсиниозах. Заболевания, вызываемые Y.enterocolitica, чаще возникают в холодное время года (осень, зима), что связано с массовой миграцией грызунов в складские помещения, инфицированием ими продуктов, благоприятными температурными условиями для размножения возбудителя в окружающей среде. Случаи заболевания псевдотуберкулезом обычно регистрируются в конце зимы и весной, когда в почве создается подходящая температура для размножения возбудителей, попадающих затем на первые ранние овощи.
Повторные заболевания редки.
Дальнейшее изложение сведений о псевдотуберкулезе и кишечном иерсиниозе проводится раздельно с учетом некоторых патогенетических и клинических их особенностей.
Псевдотуберкулез
Псевдотуберкулез (син. — дальневосточная скарлатина-подобная лихорадка) — зоонозная бактериальная инфекция с фекально-оральньш механизмом передачи, вызываемая Y.pseudotuberculosis, протекающая в локализованной и генерализованной формах и характеризующаяся большим полиморфизмом клинических проявлений с преимущественными признаками поражения желудочно-кишечного тракта, опорно-двигательного аппарата и кожи (лат. — pseudotuberculosis, англ. — pseudotuberculosis).
Классификация. До настоящего времени классификация псевдотуберкулеза не упорядочена, что объясняется в значительной мере поли-органностью поражений, большим полиморфизмом клинических проявлений. Предлагают выделять отдельные клинические формы в зависимости от выраженности признаков поражения отдельных органов и систем. С учетом этого выделяют такие клинические формы болезни:
гастроинтестинальную (протекает по типу гастроэнтерита, энтерита, терминального илеита);
абдоминальную (на первый план в клинике выступает болевой синдром, дающий клинику острого аппендицита, мезаденита);
желтушную;
артралгическую;
миалгическую;
экзантематозную (скарлатиноподобную);
катаральную;
менингеальную.
Заболевания с выраженной полиорганностью поражений рекомендуют рассматривать как генерализованные. При этом, к сожалению, не учитывают того, что в подавляющем большинстве случаев трудно бывает выделить какой-то ведущий синдром, да и в патогенезе псевдотуберкулеза бактериемия — достаточно частый компонент. Так что часто деление по принципу «ведущий синдром» — весьма субъективно и условно.
По длительности течения псевдотуберкулез условно делят на:
острый (длительность до 3 мес);
затяжной (до б мес);
хронический — более б мес.
Острый псевдотуберкулез может протекать:
— циклически (без обострений, рецидивов);
ациклически (с обострениями, с рецидивами). При затяжном псевдотуберкулезе выделяют:
непрерывную форму;
рецидивирующую форму.
Возможность развития и особенности течения хронических форм изучают.
По тяжести выделяют легкое, среднетяжелое и тяжелое течение псевдотуберкулеза.
Заболевание может протекать в стертой и латентной форме.
Примерная формулировка диагноза. При оформлении диагноза необходимо учитывать остроту процесса, клиническую форму, тяжесть течения, характер осложнений.
1. Острый псевдотуберкулез, гастроинтестинальная форма, легкое течение.
2. Затяжной псевдотуберкулезный мезаденит, среднетяжелое течение. Патогенез. Многие стороны патогенеза псевдотуберкулеза остаются
еще мало изученными и спорными. Установлено, однако, что особенности течения болезни в каждом конкретном случае определяются множеством факторов, главным из которых являются доза и свойства возбудителя (прежде всего его вирулентность), состояние иммунной системы, наличие и характер сопутствующих заболеваний у инфицированного человека, а также его генетические особенности.
Заражение происходит главным образом алиментарным путем, хотя не исключается и аэрогенный путь заражения (в этом случае входными воротами является слизистая оболочка дыхательных путей). Однако наиболее изучен патогенез при алиментарном пути заражения — проникновении возбудителя с пищей, водой в пищеварительный тракт. Уже в полости рта и двенадцатиперстной кишке начинается процесс адгезии микрорганизмов на слизистой оболочке, внедрение их в эпителиальные клетки, но особенно активно он происходит в терминальном отделе подвздошной кишки.
Есть сведения, что уже на самых ранних (через 10—20 мин после заражения) этапах развития патологического процесса бактерии обнаруживают в крови, откуда они быстро удаляются, захватываясь клетками РЭС. Кратковременная бактериемия не имеет никаких клинических проявлений, но уже на этом этапе начинается сенсибилизация организма. Основная масса микроорганизмов проникает в энтероциты, где происходит их размножение, накопление с последующей гибелью клетки. Этот процесс сопровождается развитием местной воспалительной реакции различной интенсивности — от катаральной до язвенно-некротической.
При заражении маловирулентными штаммами процесс может ограничиться местными изменениями в кишечнике и мезентеральных лимфатических узлах (гиперплазия лимфатических узлов, образование мелких гранулем). При этом гибель микробов происходит в зоне воспаления и генерализация процесса не наступает. Повреждение кишечника и лимфатических узлов сопровождается появлением боли, умеренно выраженной дисфункцией кишечника. Вероятно, в развитии диа-рейного синдрома принимает участие и энтеротоксин (но его энтеро-токсигенность, по-видимому, не велика).
При заражении вирулентными штаммами местные изменения в слизистой оболочке кишки, мезентериальных лимфатических узлах выражены значительнее (отек, гиперемия, очаговые некрозы). Способность микроорганизмов блокировать миграцию лейкоцитов в зону воспаления создает условия для размножения и накопления их в месте внедрения. Благоприятствуют этому различные факторы — цитоток-сичность возбудителей, несостоятельность факторов защиты, в которых существенная роль принадлежит генетическим особенностям человека. Так, псевдотуберкулез протекает тяжелее, чаще с генерализацией процесса у лиц с О (I) группой крови, что обусловлено родством некоторых антигенов микробных клеток и антигенов системы АВО эритроцитов человека и как следствие -— слабым иммунологическим надзором. Размножение возбудителей сопровождается в этих случаях образованием микроабсцессов (некротических гранулем). Наличие у возбудителей псевдотуберкулеза факторов, угнетающих функциональную активность лейкоцитов, приводит к незавершенному фагоцитозу, барьерные функции лимфатических узлов "не срабатывают", и наступает генерализация процесса. Током крови возбудители и инфицированные макрофаги заносятся в различные органы и ткани, формируя вторичные метастатические очаги (септическая форма псевдотуберкулеза).
Разрушение микроорганизмов сопровождается выходом в кровь эндотоксина, который обладает пирогенными свойствами, повышает проницаемость сосудов, активирует деятельность парасимпатической нервной системы, оказывает токсическое действие на сердце, печень и другие органы.
Повторные выходы возбудителей из очагов, где происходит их размножение и накопление, приводит к возникновению обострений и рецидивов, а длительное нахождение возбудителей псевдотуберкулеза и их токсинов в организме больного способствует сенсибилизации организма. В появлении новых клинических симптомов, связанных с поражением почек, сосудов, суставов, кожи и других органов, важная роль принадлежит ГЗТ, аутоантителам, иммунным комплексам. Антитела против возбудителей псевдотуберкулеза появляются поздно, лишь на 3—4-й неделе, что в значительной мере объясняет продолжительность болезни, частоту обострений и рецидивов. Освобождение от микроорганизмов наступает в результате совместного действия специфических антител и ГЗТ в очагах воспаления.
 Патогенез
наиболее типичных симптомов
псевдотуберкулеза представлен в
табл. 21.
Патогенез
наиболее типичных симптомов
псевдотуберкулеза представлен в
табл. 21.
 Клиника.
При псевдотуберкулезной инфекции
клиника отличается особым полиморфизмом.
Клиника.
При псевдотуберкулезной инфекции
клиника отличается особым полиморфизмом.
Инкубационный период составляет 7—10 дней, но возможны колебания от 24 ч до 4 нед. Разгар болезни приходится на 2—3-ю неделю.
Начинается заболевание в большинстве случаев остро, внезапно, с озноба и повышения температуры, хотя иногда бывают и продромальные явление (слабость, разбитость, головная боль) в течение 1—3 дней. В дальнейшем развиваются различной выраженности и в разных сочетаниях признаки заинтересованности отдельных органов и систем.
Лихорадка — одно из наиболее постоянных проявлений псевдотуберкулеза. Уже в первый день болезни температура может достигать 38,5 °С — 39 "С, но обычно своего максимума она достигает на 2—3-й день. Длительность лихорадочного периода — от 1 дня до 2—3 нед, иногда (при рецидивирующем течении) — до 1,5—2 мес и более. Лихорадка может быть ремиттирующей, интермиттирующей, при обострениях приобретать волнообразный характер. Обычно вторая волна лихорадки (при обострениях, рецидивах) бывает ниже и короче первой. Если заболевание приобретает рецидивирующий характер, вторая волна лихорадки может возникать через 1 и даже 3 нед после нормализации температуры. Затяжное течение нередко сопровождается длительным субфебрилитетом. Повышением температуры могут сопровождаться и аллергические реакции в период реконвалесценции. Обычно высота и длительность лихорадки коррелируют с тяжестью течения заболевания.
Выраженность общетоксических явлений отражает тяжесть состояния больного. Уже с первых часов заболевания появляются головная боль, нередко интенсивная, чаще разлитая, слабость, ломота в суставах, мышечная боль. Интенсивность боли может быть столь велика, что она становится ведущим симптомом. Сильная боль в мышцах брюшного пресса может симулировать острый аппендицит, холецистит.
В начальный период болезни суставные проявления носят характер артралгий. Суставы (чаще лучезапястные, коленные, голеностопные) не деформированы, кожа над ними не изменена. В более поздние сроки (спустя 2—3 нед) может возникать артрит с отеком и гиперемией, иногда (при аллергии) с кольцевидными высыпаниями в области суставов, местным повышением температуры. Нередко поражения суставов протекают по типу моноартрита, иногда — по типу полиартрита, в процесс вовлекаются как мелкие, так и крупные суставы. Появляется также боль в области позвоночника, крестца. Изменения в суставах могут сохраняться несколько недель. При пункции чаще получают серозную жидкость.
Признаки поражения пищеварительного тракта — самые различные. Рвота, диарея — непостоянные признаки, они наблюдаются лишь у части (10—15%) больных в начальный период болезни. Рвота обычно бывает 1—2 раза, стул — 2—5 раз в сутки, необильный, иногда с примесью слизи. Может определяться спазм сигмовидной кишки и болезненность ее. Но чаще боль локализуется в правой подвздошной области, она бывает интенсивной, иногда даже сопровождается симптомами раздражения брюшины, защитным напряжением мышц, в результате чего может возникнуть мысль о наличии острого аппендицита (абдоминальная форма псевдотуберкулеза). Причиной развития такого симптома является увеличение мезентериальных лимфатических узлов, нарушение кровообращения в червеобразном отростке. У взрослых в червеобразном отростке при этом практически никогда не развивается деструктивный процесс, а у детей, особенно младшего возраста, такие осложнения вполне возможны.
Интенсивная боль в животе, которая локализуется в эпигастральной области, в области пупка, правой половине живота, нередко носит перемежающийся характер (2—3-дневный период интенсивной боли сменяется затишьем в течение 1—3 дней, а затем боль снова усиливается). На этом фоне могут выявляться симптомы раздражения брюшины, вздутие живота, задержка стула. Иногда удается пальпировать увеличенные лимфатические узлы.
Кроме мезентериальных, можно обнаружить увеличенные и другие лимфатические узлы — чаще подчелюстные, реже — подмышечные, паховые. Увеличены лимфоузлы умеренно, они эластичны, безболезненны при пальпации.
Печень нередко вовлекается в патологический процесс. У большинства больных можно обнаружить увеличение не только печени, но и селезенки. Почти у половины больных развивается паренхиматозный гепатит, который может сопровождаться умеренной желтухой, нарушением функции печени. Желтушность может сохраняться до 2—3 нед, но наибольшая интенсивность ее обычно приходится на б—8-й день болезни.
Нарушение кровообращения, повышение активности протеолитиче-
ских ферментов приводят к поражению поджелудочной железы: появляется боль в зоне ее проекции, нередко интенсивная, иррадиирующая в поясницу, сопровождающаяся тошнотой, рвотой.
Поражение сердечно-сосудистой системы в разгар болезни проявляется глухостью сердечных тонов, брадикардией, гипотензией. Возможно развитие миокардита.
Поражение почек в начальный период обусловлено токсическим действием (альбуминурия, микрогематурия). В более поздние сроки, особенно при затяжном течении, патологическое действие оказывают ИК. Наиболее отчетливы изменения в конце 2-й недели болезни, выявляются они главным образом с помощью лабораторных тестов, но иногда становится положительным симптом Пастернацкого, в редких случаях даже возможно развитие ОПН.
Заболевание может начинаться с респираторного синдрома, когда уже в первые дни на фоне интоксикации появляются боль в горле, заложенность носа, кашель. При осмотре обнаруживают гиперемию (от незначительной до резко выраженной — «пылающий зев») и отечность слизистой оболочки мягкого и твердого нёба, иногда с энантемой на задней стенке глотки, увеличенные, разрыхленные миндалины. В легких ни при аускультации, ни при рентгеноскопии изменения обычно не выявляют. Однако имеются сообщения о способности Y.pseudotuberculosis вызывать пневмонию и даже абсцессы в легких, особенно при аэрогенном способе заражения. Высказывают даже мнение о пневмотропности отдельных штаммов возбудителя.
Характерен внешний видг больного: лицо одутловатое, гиперемиро-ванное, сосуды склер и конъюнктивы инъецированы. Иногда появляются герпетические высыпания на губах и крыльях носа. Язык в первые дни болезни покрыт сероватым налетом, к концу 1-й недели очищается, поверхность его к этому времени имеет характерный вид — «малиновый язык».
Один из наиболее ярких симптомов псевдотуберкулеза — сыпь, она появляется у 90—95% больных, чаще на 1—4-й день болезни, одномоментно или подсыпая. Типичная локализация ее — туловище и конечности, лицо и шея от высыпаний обычно свободны. Чаще всего это мелкоточечная сыпь на гиперемированном фоне, но могут быть пятнистые, папулезные и даже геморрагические высыпания. Держится она 1—10 дней в зависимости от характера высыпаний. На 2—3-й неделе болезни на месте высыпаний появляется пластинчатое шелушение, особенно заметное на пальцах верхних конечностей и подошвах. Иногда сыпь бывает очень скудной, локализуясь лишь в определенных участках (локтевые сгибы, подмышечные впадины, паховые складки), и ее можно обнаружить только при целенаправленном осмотре. Отечность и гиперемия кистей и стоп, получившие названия «симптом перчаток» и «симптом носков» соответственно, наиболее отчетливы в период высыпаний. Описывают также «симптом капюшона» — одутловатость и гиперемию лица и шеи.
Иногда с первых дней болезни, но чаще в более поздние сроки высыпания имеют характер узловатой эритемы, эритемы Розенберга, Тшамера.
Нервная система закономерно вовлекается в патологический процесс. Поражение ЦНС проявляется лихорадкой, слабостью, головной болью, гиперестезией, изменением поведения (больные возбуждены или заторможены). У некоторых выявляются менингеальные знаки, что может быть проявлением менингоэнцефалита с соответствующими изменениями в спинномозговой жидкости или менингизма. Иногда появляются признаки полирадикулоневрита. Активация тонуса n.vagus проявляется гиперемией кожи, снижением АД, брадикардией, вздутием живота.
При псевдотуберкулезе перечисленные изменения различных органов и систем встречаются в самых различных сочетаниях, частота и сроки появления отдельных симптомов варьируют. Обычно чем тяжелее и длительнее протекает заболевание, тем разнообразнее и богаче клиническая картина. Отдельные симптомы могут появляться только на второй волне лихорадки, некоторые — лишь на первой.
Основные критерии тяжести заболевания — выраженность интоксикационного синдрома, степень нарушения функции отдельных органов, длительность течения, характер и тяжесть осложнений. Длительность заболевания играет немаловажную роль, поскольку в значительной мере определяет степень сенсибилизации, частоту развития аутоиммунных реакций, а именно они лежат в основе большинства осложнений.
Встречается также стертая форма псевдотуберкулеза, при которой полиорганность поражений либо отсутствует, либо выражена настолько незначительно, что на них не фиксирует внимание ни врач, ни сам больной. Чаще отмечаются неопределенные, «смазанные» симптомы поражения отдельных органов на фоне субфебрилитета, небольшой интоксикации. Обычно такие случаи распознаются весьма редко и проходят под другими диагнозами. Тем не менее, они тоже могут давать обострения и генерализацию процесса.
Иногда первыми проявлениями болезни могут быть органные поражения (моно- или полиартрит, нефрит, миокардит, гепатит), и лишь очень скрупулезный сбор анамнеза позволяет у некоторых больных выявить предшествовавший катаральный или диспепсический синдром, лихорадку и даже наличие сыпи. Но в отдельных случаях возможно субклиническое течение начального периода (энтеральной фазы).
При форме, которую расценивают как генерализованную, выражена интоксикация, а полиорганные поражения с первых дней болезни подтверждают их инфекционный, а не аллергический характер. Лихорадка при этом носит ремиттирующий или даже гектический характер, сопровождается профузным потом, выраженными явлениями интоксикации, иногда нарушением сознания. Увеличены печень, селезенка, иногда появляется желтуха. Длится лихорадка от 2—3 нед до 2—3 мес и более. Течение болезни сопровождается появлением все новых клинических симптомов, отражающих прогрессирование количества и тяжести органных поражений.
Осложнения. При псевдотуберкулезе осложнения относительно редки, они бывают, как правило, при тяжелом и среднетяжелом течении, при поздней госпитализации и несвоевременно начатом или неполноценном лечении, наличии различных хронических заболеваний, особенно сопровождающихся угнетением иммунной системы.
В период разгара болезни:
наиболее грозным осложнением является ИТШ, особенностью которого при псевдотуберкулезе является редкое сочетание с ДВС-син-дромом и кровоизлиянием в кору надпочечников;
в этот же период может наступить отек и набухание головного мозга (чаще у детей);
местный воспалительный процесс в кишечнике бывает выражен значительно, при этом возникают глубокие язвы, возможны их перфорации с дальнейшим развитием перитонита;
аппендицит у взрослых бывает редко, несмотря на типичную боль в правой подвздошной области, у детей возможна деструкция червеобразного отростка, требующая оперативного вмешательства;
при диффузном илеите может развиться кишечная непроходимость;
возможно на фоне токсикоза развитие токсического миокардита;
возможно развитие различных аллергических реакций — отек Квинке, крапивница.
Менингит, артрит, пневмония, холецистит, панкреатит — проявления псевдотуберкулеза, а не осложнения, хотя возможно и присоединение вторичной инфекции на этом фоне, что изменяет клинические проявления и ухудшает прогноз.
В период реконвалесценции:
у больных иногда развивается спаечная непроходимость кишечника, преимущественно у тех, кто перенес тяжелый терминальный илеит, а также у оперированных по поводу острого аппендицита;
чаще у больных с затяжным течением в период обострений и рецидивов возникают различные осложнения аллергического и аутоиммунного генеза — очаговый гломерулонефрит, узелковый периартери-ит, серозный артрит, синдром Рейтера, хронический увеит.
Исходы. Полагают, что прогноз при псевдотуберкулезе в подавляющем большинстве случаев благоприятен. Летальные исходы бывают очень редко, главным образом при тяжелой генерализованной форме и развитии таких осложнений, как некрозы и перфорации кишок, перитонит. Полагают, что и затяжное течение в конечном результате заканчивается очищением организма и выздоровлением. Однако не исключается и вероятность хронизации.
Особого внимания заслуживает возможная связь таких аутоиммунных заболеваний, как узелковый периартериит, хронический увеит, болезнь Шенлейна — Геноха, тиреоидит, ревматоидный артрит, гемолитическая анемия, сакроилеит с псевдотуберкулезом. Эту проблему в настоящее время самым детальным образом изучают. Особой группой риска, подверженной аутоиммунным осложнениям после перенесенного псевдотуберкулеза, являются лица, содержащие антиген гисто-совместимости HLA В27.
Методы диагностики. Общеклинические методы. Общий анализ крови в разгар болезни характеризуется умеренным лейкоцитозом, сдвигом формулы влево (иногда до миелоцитов и метамиелоцитов), лимфопенией, моноцитозом, эозинофилией, тромбоцитопенией, иногда — анемией. СОЭ увеличена, иногда значительно. Эти изменения выражены тем значительней, чем тяжелее течение. При легком течении они бывают незначительны. Сохраняющиеся на фоне нормализации температуры лейкоцитоз, сдвиг формулы влево, медленное снижение СОЭ могут быть предвестниками рецидивов.
В анализе мочи в разгар болезни на фоне интоксикации выявляют изменения, типичные для токсического раздражения почек, — единичные эритроциты, следы белка. При тяжелом течении могут наблюдаться гипоизостенурия, цилиндрурия.
В копроцитограмме можно обнаружить повышенное количество лейкоцитов, иногда — слизь и эритроциты.
В спинномозговой жидкости при псевдотуберкулезном менингите выявляют нейтрофильный плеоцитоз, повышенное содержание белка.
Синовиальная жидкость, полученная при пункции пораженного сустава, редко бывает гнойной (лишь при метастатическом характере поражений).
Биохимические методы исследования. При псевдотуберкулезе часто уже в начальный период болезни повышается содержание аммиака в крови, что обусловлено высокой уреазной активностью возбудителя. Мочевино-аммиачный коэффициент, составляющий в норме 1,0, снижается до 0,3—0,15 и даже значительнее, степень снижения коррелирует с тяжестью течения болезни. Аммиачная интоксикация является весомым компонентом общетоксического синдрома.
При поражении печени может наблюдаться кратковременная, как правило, не очень высокая билирубинемия, при этом в несколько раз повышается активность АлАТ и АсАТ, а иногда и ЩФ (незначительно). Снижение общего количества белка, альбуминов, уровня про
тромбина, холестерина может выявляться при тяжелом течении псевдотуберкулеза.
Так как дегидратация не характерна, нарушений электролитного баланса обычно не бывает, но иногда в плазме снижается, а в эритроцитах повышается содержание Na + .
Специфическая диагностика. Y.pseudotuberculosis могут быть выделены из фекалий, крови, мочи, желчи, мокроты, ротоглоточной слизи, из удаленного червеобразного отростка. Посевы, сделанные в 1-ю неделю болезни, наиболее часто позволяют получить бактериологическое подтверждение диагноза. Их производят на обычные питательные среды. Медленный рост бактерий позволяет получить окончательный ответ лишь через 2—3 нед (предварительный ответ может быть дан на 2—9-е сутки). Применение жидкой индикаторной среды и плотной дифференциально-диагностической среды Серова позволяет ускорить сроки исследования почти в 2 раза.
Антигены иерсиний в различных средах организма можно обнаружить различными методами — РФА, РТНГА, РКоА.
РТНГА среди этих реакций — наиболее чувствительная, она позволяет обнаруживать антигены возбудителя уже с первого дня болезни и через 16— 18ч получить ответ (предварительный ответ может быть дан через 2 ч). Этим методом можно выявить антигены иерсиний и в моче, тогда как сам возбудитель в моче обнаруживается редко.
Существенным преимуществом РТНГА перед бактериологическим методом является не только возможность быстрого получения результатов, но и возможность обнаружить антигены возбудителя уже тогда, когда бактериологические методы оказываются несостоятельными (в частности, в период реконвалесценции).
РФА менее чувствительна, чем РТНГА. Методом пользуются не только при исследовании материала, полученного от больного, но и продуктов — предполагаемых факторов передачи инфекции. В отличие от РТНГА, МФА не дает возможности различать типовые и групповые антигены иерсиний.
РКоА (реакция коагглютинации) также позволяет обнаруживать О-антиген даже в составе иммунных комплексов в различных биологических жидкостях человека с первого дня болезни. Особую ценность представляет при рецидивах и затяжном течении. Метод высокочувствителен и специфичен.
Биологический метод. Материалом, взятым у больного человека, заражают морских свинок или белых мышей. Из крови и органов павших животных можно выделить культуру возбудителей. Исследуют также мазки-отпечатки с органов.
В более поздние сроки используют серологические методы, основанные на выявлении специфических антител в сыворотке крови больного. Используют наиболее часто РА и РНГА с псевдотуберкулезными ан
тигенами, а также РБЛ. Исследование проводят в динамике: при поступлении больного в стационар и на 3—4-й неделе (максимальные титры антител). РНГА превосходит РА в чувствительности, позволяет определять антитела уже с 3—4-го дня болезни, но нарастание титров антител улавливает не так отчетливо, как РА. РНГА может давать ложнополо-жительные результаты с сывороткой больных чумой.
РА — более проста в постановке, высокоспецифична, точнее отражает динамику титров антител. Главный ее недостаток — необходимость ставить реакции со всеми типами Y.pseudotuberculoris, так как РА моноспецифична.
Диагностический титр РНГА и РА — 1:100 и 1:200 соответственно, но оценивать их необходимо с учетом динамики нарастания титров антител.
РБЛ — высокочувствительна и специфична, позволяет обнаруживать специфические антитела с 3-го дня болезни, максимальные титры антител выявляются в конце 2-й недели. Ответ можно получить уже через 3—5 ч после начала исследования, поэтому РБЛ можно использовать в качестве экспресс-метода.
Весьма перспективна ПЦР, отличающаяся высокой чувствительностью и специфичностью.
Аллергологический метод. Используют диагностикум псевдотуберкулин для постановки внутрикожной пробы. Реакция считается положительной, если через 48 ч зона отека и гиперемии превышает 20 мм в диаметре. Проба достаточно специфична, позволяет распознать псевдотуберкулез в диагностически сложных случаях, а также при атипичной и стертой формах. Работа над улучшением качества диагностикума продолжается.
Дополнительные методы диагностики. Полиморфизм клинических проявлений, большой спектр дифференциальной диагностики определяют в каждом конкретном случае объем и характер дополнительных методов исследования (ЭКГ, ректороманоскопия, пункция лимфатических узлов, пункционная биопсия печени, УЗИ и т.д.).
Особого внимания заслуживают гистологические исследования пун-ктатов, позволяющие обнаружить типичные для псевдотуберкулеза некротические гранулемы.
Критерии диагноза. Диагностика псевдотуберкулеза сложна, обычно диагноз ставят с опозданием. При обосновании клинического диагноза «псевдотуберкулез» следует учитывать следующие особенности заболевания:
— характерный эпидемиологический анамнез, указывающий на употребление в пищу плохо промытых, не обработанных овощей, фруктов, особенно длительно хранившихся в складских помещениях;
острое внезапное начало;
полиморфизм клинических проявлений, иногда в самых необычных сочетаниях (например, боль в горле и расстройство стула, желтуха и менингеальный синдром, генерализованная лимфаденопатия и артрит);
— скарлатиноподобная сыпь в сочетании с симптомами «перчаток», «носков», «капюшона»;
— лейкоцитоз с эозинофилией;
— нередко волнообразное течение, с обострениями и рецидивами. Диагноз подтверждают обнаружением возбудителя, его антигенов в
биологических жидкостях и выделениях больного, выявлением специфических антител.
Дифференциальный диагноз. Полиморфизм клинических проявлений при псевдотуберкулезе является причиной очень большого числа диагностических ошибок.
Острое начало, интоксикацию, головную боль, кашель, насморк, гиперемию лица, инъекцию сосудов склер часто расценивают как грипп (отличают грипп кратковременность течения, характерный трахеит, отсутствие кишечных проявлений).
Лихорадка, интоксикация, увеличение печени, лимфаденопатия, сыпь, боль в горле заставляют думать об инфекционном мононуклеозе (главное отличие — характерные изменения в гемограмме).
Длительное повышение температуры, боль в горле, кашель, конъюнктивит, фарингит, увеличение печени наблюдают при аденовирусном заболевании (отличия — преимущественно односторонний конъюнктивит, отсутствие артрита, сыпи).
Катаральные явления, интоксикация, характерные высыпания бывают при кори и краснухе. Но эти заболевания отличают сроки появления сыпи, ее локализация и характер (при кори — этапность), кратковременность течения, отсутствие гастроинтестинального синдрома.
Лихорадка, интоксикация, боль в горле, «пылающий зев», «малиновый язык», скарлатинозные высыпания типичны и для скарлатины. Более того, у больных псевдотуберкулезом может быть даже отчетливо заметен, как и у больных скарлатиной, бледный носогубный треугольник. Но скарлатина не дает рецидивов, гепатолиенальный и гастроин-тестинальный синдромы отсутствуют.
Боль в горле, увеличение миндалин и подчелюстных лимфатических узлов служат основанием для постановки диагноза «ангина», но при истинной ангине (лакунарной, фолликулярной) видны характерные изменения на миндалинах, она не сопровождается гепатолиенальный синдромом.
Острое начало, при котором первыми проявлениями болезни служат тошнота, рвота, диарея, наводит на мысль о ПТИ, а при наличии слизи в кале — о шигеллезе. Но при этих заболеваниях отсутствуют катаральный синдром, высыпания, лимфаденопатия, артриты.
Длительная лихорадка, интоксикация, увеличение печени и селезенки, брадикардия, сыпь, вздутие живота, задержка стула наблюдаются и при тифо-паратифозных заболеваниях, но при них нет генерализованной лимфаденопатии, артритов и артралгии, нарушения функции печени, отличается по характеру сыпь.
Острое начало, интоксикация, выраженная мышечная боль, геморрагии на коже, инъекция сосудов склер, гиперемия кожи, увеличение печени и селезенки, нарушение функции почек типичны для иктеро-геморрагического лептоспироза. Но лептоспироз сопровождается ОПН, гемолизом, ДВС-синдромом, кишечные расстройства обычно слабо выражены.
Лихорадка, интоксикация, нарушение функции почек, геморрагии могут служить основанием для постановки диагноза ГЛПС, но для ГЛПС ведущие синдромы с первых дней — ОПН и ЛВС.
Начало с лихорадки, интоксикация, увеличение печени и селезенки, желтуха, нарушение функции печени, брадикардия служат причиной того, что псевдотуберкулез принимают за ВГА, но при ВГА лихорадка кратковременная, сыпь не характерна, повышение активности АлАТ и АсАТ значительное, в крови — лейкопения.
Острое начало, лихорадка, сильная головная боль, наличие менинге-альных знаков позволяют заподозрить менингит любой этиологии, а в сочетании с геморрагическими высыпаниями на коже — думать о менингококковой инфекции. Но менингококковая инфекция протекает очень бурно (особенно сепсис), часто с ИТШ и ДВС-синдромом, аллергический компонент не выражен.
Боль в животе в зависимости от ее локализации, напряжение мышц брюшного пресса в сочетании с лейкоцитозом требуют исключения острой хирургической патологии — острого аппендицита, холецистита, панкреатита, кишечной непроходимости. Как правило, это монопатология, она не сочетается с артритом, катаральным синдромом и т.д., но может быть одним из проявлений псевдотуберкулеза.
Лихорадка, боль в пояснице, положительный симптом Пастернацко-го, нарушение функции почек могут быть приняты за заболевания мочевых органов (пиелонефрит, пиелоцистит и др.). Главное отличие — выраженные изменения в моче с первых дней, отсутствие полиорганной симптоматики.
Острое начало, боль в горле, артрит, глухость сердечных тонов — основания для постановки диагноза «ревматизм», для которого не характерны генерализованная лимфаденопатия, гастроинтестинальный синдром, поражение крупных суставов, рано выявляющаяся патология со стороны сердца.
Как и при сепсисе любой другой этиологии, при псевдотуберкулезе наблюдаются ремиттирующая или интермиттирующая лихорадка, интоксикация, мышечная и суставная боль, увеличение печени и селезенки, могут выявляться отдельные органные поражения. Для сепсиса характерны лихорадка интермиттирующего или даже гектического типа, потливость, отсутствие симптомов «перчаток», «носков», «капюшона».
Перечень заболеваний, с которыми следует проводить дифференциальную диагностику при псевдотуберкулезе, еще можно продолжать. В каждом конкретном случае указать критерии различий невозможно, потому что вариантов сочетания отдельных клинических симптомов огромное количество. При проведении дифференциальной диагностики врач должен пользоваться такими правилами:
строго учитывать период болезни, так как цикличность инфекционных болезней определяет очередность появления отдельных симптомов, их выраженность, сочетание, динамику;
помнить о том, что ни при одном из перечисленных заболеваний не бывает такой богатой клинической симптоматики, такой полиорган-ности поражений, как при псевдотуберкулезе, поэтому выявляемые в начальный период типичные для этих заболеваний симптомы дополняются новыми, им уже не свойственными;
стараться реже прибегать к синдромальному диагнозу или обосновывать «нетипичные» симптомы наличием микст-патологии. Иначе у больного псевдотуберкулезом может быть, например, диагностирован одновременно ВГ, протекающий в сочетании со скарлатиной и менингитом.
Существенная роль в расшифровке диагноза принадлежит грамотной интерпретации лабораторных исследований (общеклинических, специфических, биохимических).
Пожалуй, наибольшие сложности представляет дифференциальный диагноз псевдотуберкулеза и иерсиниоза. Основные клинические различия — см. «Кишечный иерсиниоз». Но иногда только результаты бактериологического исследования позволяют верифицировать диагноз.
Лечение. Учитывая отсутствие существенной роли больного человека в эпидемическом процессе при псевдотуберкулезе, госпитализацию больных осуществляют только по клиническим показаниям. Госпитализации подлежат лица со среднетяжелым и тяжелым, затяжным и рецидивирующим течением псевдотуберкулеза. Наблюдение за больным с терминальным илеитом, псевдотуберкулезным мезаденитом возможно и рационально в условиях хирургического стационара при участии инфекциониста. Госпитализация больных генерализованной формой псевдотуберкулеза в крайне тяжелом состоянии (менингоэнцефалит, септицемия с развитием ИТШ) целесообразна в отделения общей или инфекционной реанимации.
Лица декретированных групп подлежат госпитализации при любой тяжести псевдотуберкулеза, как и при других кишечных инфекциях.
Выраженный полиморфизм клинических признаков при псевдотуберкулезе с частым вовлечением в процесс различных органов и систем, большое число рецидивов определяют индивидуализацию лечения
каждого больного псевдотуберкулезом с учетом патогенетических особенностей заболевания, характера и степени патологических изменений в организме в каждом отдельном случае.
Строгий постельный режим назначают в лихорадочный период и первые дни после нормализации температуры, что имеет большое значение для предупреждения поздних осложнений и рецидивов болезни. Особенно важен покой в конце лихорадочного периода и в первые дни после него, когда у больных прогрессирует гипотензия и может возникнуть коллаптоидное состояние при раннем расширении постельного режима.
Учитывая большую частоту поражения печени даже при отсутствии выраженной желтухи, всем больным следует назначать максимально щадящую диету (№5-а или №5). Диетический режим у таких больных ничем принципиально не отличается от такового при вирусных гепатитах, лишь, учитывая меньшую тяжесть процесса в печени и продолжительность желтухи при псевдотуберкулезе, расширять диету можно активнее. Однако следует учитывать возможность обострений и рецидивов, угроза развития которых определяет иногда необходимость более длительного (иногда до нескольких месяцев) соблюдения диеты.
Этиотропная терапия. При септическом варианте генерализованной формы псевдотуберкулеза, особенно с признаками ИТШ, препаратом выбора является левомицетина сукцинат растворимый. Вводят препарат внутривенно в суточной дозе до 50 мг/кг массы тела (в 2—3 приема). Целесообразно назначать препарат в указанной дозе в течение 6—7 сут. Более длительное применение его нежелательно из-за угнетающего действия на лейкопоэз и фагоцитоз. Затем еще 6—7 дней следует продолжать лечение гентамицином или другими аминоглико-зидами. Гентамицина сульфат назначают из расчета до 5 мг/кг массы в сутки (суточную дозу равномерно делят на 3 внутривенных или внутримышечных введения). Могут применяться и другие аминогликозиды (тобрамицин, сизомицин). Однако их применение нерационально (в отличие от левомицетина) в случаях развития псевдотуберкулезного менингоэнцефалита из-за низкой их концентрации в спинномозговой жидкости, опасно при ИТШ из-за их бактерицидного действия.
Курс антибиотикотерапии в течение 12—14 дней наиболее рационален, так как он значительно уменьшает число рецидивов. Более длительное лечение антибиотиками приводит к проявлению их нежелательных эффектов (развитие дисбактериоза, торможение иммуногенеза, процессов регенерации).
Не менее эффективны полусинтетические тетрациклины: метацик-лин (рондомицин), доксициклин (вибрамицин). Последний можно применять и внутривенно 1 раз в сутки в течение 5—6 дней при генерализованной форме псевдотуберкулеза, если отсутствуют признаки выраженного поражения печени. Бактериостатический характер действия позволяет применять доксициклин внутривенно при псевдотуберкулезной септицемии с явлениями ИТШ, а затем, через 6—7 дней, переходить на гентамицина сульфат (внутривенно или внутримышечно) через каждые 8 ч в течение еще 6—7 дней.
Существует мнение о большей эффективности комбинированной антибиотикотерапии при тяжелом течении псевдотуберкулеза. При непереносимости левомицетина рекомендуют сочетать гентамицин (по 80—120—160 мг 3 раза в сутки) с метациклином (0,3 г 2—3 раза в сутки) или доксициклином (по 0,2—0,1 г 1 раз в сутки). Эффективно сочетание этих антибиотиков с невиграмоном, бисептолом (сульфатоном), фуразолидоном в обычных дозах. Сочетанное лечение левомицетином и фуразолидоном допустимо при гастроинтестинальной форме, пока этиология заболевания еще не вполне ясна.
Можно сочетать также аминогликозиды и карбенициллин (взаимное потенцирование действия) или аминогликозиды и бета-лактамные антибиотики III поколения (цефотаксим, цефтриаксон, цефтазидим и др.).
К цефалоспоринам I—II поколений возбудители обычно устойчивы, поэтому применение их даже в комбинации с аминогликозидами нерационально при любой форме псевдотуберкулеза.
Данные в отношении эффективности стрептомицина противоречивы. Имеются сведения о том, что явления интоксикации ликвидируются достаточно быстро, но частота рецидивов выше, чем при лечении левомицетином (наиболее предпочтителен при лечении больных).
Целесообразность антибактериальной терапии при гастроинтестинальной форме признается не всеми. Полагают, что и без применения антибиотиков наступает выздоровление. Однако существует мнение о том, что и при локализованной форме назначение левомицетина, тетрациклина, фуразолидона, невиграмона или бисептола в обычных терапевтических дозах может уменьшить частоту рецидивов и осложнений. Курс лечения при этом также не менее 10—12 дней, после 5—6 дней лечения желательна замена антибактериального препарата.
Левомицетину и гентамицину отдают предпочтение, если у больного псевдотуберкулез протекает с нарушением функции печени.
Местное применение 20% раствора димексида в виде аппликаций с антибиотиком повышает эффективность лечения при псевдотуберкулезном артрите, синдроме Рейтера, сакроилеите.
К сожалению, при тяжелой генерализованной форме псевдотуберкулеза, как и кишечного иерсиниоза, от антибактериальной терапии не приходится ожидать выраженного эффекта.
Патогенетическая терапия. При легком и среднетяжелом течении в разгар заболевания для снятия токсикоза рекомендуют обильное питье (чай, фруктовые соки, щелочную минеральную воду). Возможно применение энтеросорбентов, а частности «Энтеросгеля», по 30—50 мл
3 раза в день в течение 5—7 дней. При необходимости курс лечения «Энтеросгелем» можно повторить. Несколько менее эффективно применение с той же целью угольных энтеросорбентов типа СКН-2Н, которые назначают по 30 г 3 раза в сутки через 1,5—2 ч после еды в течение 7—10 дней.
Показаниями к внутривенному введению дезинтоксикационных средств является тяжелое течение болезни с выраженным токсикозом, рвотой. Для снятия аммиачной интоксикации рекомендуется включать в комплекс лечения глутаминовую кислоту в сочетании с АТФ в сред-нетерапевтических дозах.
Регидратационную терапию при псевдотуберкулезе, учитывая редкость развивающегося выраженного обезвоживания, применяют гораздо реже, и объем ее обычно небольшой. Как и при других кишечных инфекциях, предпочтение следует отдавать пероральной регидратации глюкозо-солевыми растворами «Оралит», «Регидрон», «Перораль».
К внутривенному введению солевых растворов «Ацесоль», «Дисоль», «Хлосоль», «Лактосоль» при псевдотуберкулезе прибегают редко и в основном не для регидратации, а в комплексе дезинтоксикационных мер, соблюдая необходимое соотношение вводимых коллоидных и солевых растворов, для коррекции КОС и электролитного баланса.
Десенсибилизирующая терапия должна обязательно применяться в комплексе патогенетических средств с учетом большой частоты развития аллергических и аутоиммунных процессов.
При назначении антигистаминных препаратов следует отдавать предпочтение мало токсичным для печени препаратам (тавегил, диазо-лин, фенкарол, супрастин) в обычных терапевтических дозах. Рациональна замена одного антигистаминного средства другим через 7—10 дней при необходимости длительного лечения.
Перспективно применение и других противоаллергических средств, не обладающих антигистаминным свойством, например, задитена (ке-тотифена) внутрь по 1—0,5 мг 2 раза в сутки во время еды для предупреждения прогрессирования аллергических реакций.
Подобные антиаллергические препараты менее эффективны при рецидивах псевдотуберкулеза и затяжном его течении, когда на передний план выходят аутоиммунные процессы. В таких случаях помимо десенсибилизирующей терапии должны применяться противовоспалительные средства.
Учитывая особенности действия токсинов (активация синтеза про-стагландинов, лейкотриенов), наиболее рационально в качестве противовоспалительных средств применять их антагонисты. Выбор препаратов обусловливается вариантом течения псевдотуберкулеза (преобладание артрита, гепатита или миокардита).
Из таких противовоспалительных средств наиболее эффективен индометацин (метиндол) в дозе 0,05 мг 2—3 раза в сутки после еды. Дли-16* тельность курса зависит от формы и тяжести течения псевдотуберкулеза (от 3—5 дней для купирования артралгий до 3—4 нед при лечении миокардита, увеита, сакроилеита). Учитывая иммунодепрессивный эффект препарата, лечение индометацином должно проводиться на фоне антибактериальной терапии.
Противопоказаниями к назначению индометацина и других нестероидных противовоспалительных средств являются наличие язвенных процессов в двенадцатиперстной и тонкой кишках, а также терминальный илеит. Показаниями к их назначению являются гастроэнтеритиче-ская форма с симптомами дегидратации (не более трех-четырехднев-ного курса), артрит, миокардит, синдром Рейтера, узловатая эритема, сакроилеит, увеит.
При генерализованной форме заболевания также следует отдавать предпочтение применению препаратов типа индометацина перед глю-кокортикостероидами, учитывая важную роль активированного эндотоксинами иерсиний синтеза простагландинов, лейкотриенов в генезе воспалительных реакций, интоксикации, микроциркуляторных нарушений и органных поражений.
Кроме индометацина, можно назначать мефенамовую кислоту по 0,5 г 3—4 раза в сутки после еды, вольтарен, ибупрофен (бруфен) в обычных дозах.
При сочетании желтухи и артрита предпочтение следует отдавать менее гепатотоксичным — ибупрофену и мефенамовой кислоте.
Индометацин, ортофен, ибупрофен, мефенамовая кислота оказывают и дезагрегационное действие, тем самым восстанавливая нарушенную при тяжелой форме псевдотуберкулеза микроциркуляцию.
Глюкокортикостероиды, учитывая их выраженное угнетающее иммуногенез действие, должны иметь в терапии псевдотуберкулеза строго ограниченные показания. Они показаны лишь при развитии ИТШ, отека и набухания головного мозга, выраженных аллергических и аутоиммунных реакций, не купируемых другими средствами. Это препараты ургентности. Назначать их с противовоспалительной и дезинток-сикационной целью не следует.
В период реконвалесценции после перорального применения антибиотиков широкого спектра действия для устранения дисбактериоза можно в зависимости от его характера использовать колибактерин, би-фидумбактерин, бификол, лактобактерин (дозы определяют индивидуально).
При симптомах ферментативной недостаточности с заместительной целью назначают фестал или мезим-форте, оразу, панкреатин.
При метеоризме дают отвар ромашки аптечной, мяты перечной, фенхеля, карболен или энтеросорбенты.
Сильный болевой синдром, сопровождающий псевдотуберкулезный артрит, требует иногда дополнительного назначения анальгетиков
(реопирин, анальгин). Однако их применение противопоказано при боли в животе.
Учитывая выраженную аллергизацию организма и несмотря на полиморфизм клинической картины и полисистемность поражений, во избежание полипрагмазии следует назначать лишь самые необходимые препараты, выделяя главное патогенетическое звено в каждом конкретном случае, заменяя препараты, действующие узконаправленно, на разносторонне действующие, позволяющие при небольшом количестве применяемых средств воздействовать на разные стороны патологического процесса. Всегда следует помнить, что полипрагмазия неблагоприятно влияет на течение и исход псевдотуберкулеза.
Особое место занимает хирургическая тактика в лечении больных псевдотуберкулезом. При появлении перитонеальных или аппендикулярных симптомов требуется наблюдение хирурга, решающего вопрос о необходимости оперативного вмешательства. До операции и после нее до окончательного выздоровления проводят соответствующую этиотропную и патогенетическую терапию.
Порядок выписки из стационара. Порядок выписки реконвалесцен-тов из стационара, сроки допуска к работе, учебе, в детский коллектив аналогичны таковым при кишечном иерсиниозе и других острых кишечных инфекциях.
Реконвалесцентов, не относящихся к декретированным категориям, выписывают после клинического выздоровления (но не ранее 10—*12-го дня нормальной температуры из-за возможности рецидивов). Обязательное бактериологическое исследование с учетом его длительности не требуется, вопрос решают индивидуально. Перед выпиской желательно исследовать иммунологический статус, помня о возможности рецидивов.
Через 1—2 дня после окончания антибактериальной терапии проводят бактериологическое исследование однократно лишь работникам пищевых предприятий и лицам, к ним приравненным, детям, посещающим детские дошкольные учреждения, школы-интернаты, санатории. Учитывая длительные сроки бактериологических исследований, при клиническом выздоровлении больных выписывают до получения из лаборатории результатов. Вопрос о сроках допуска к работе решают индивидуально.
Из-за возможности рецидивов, предполагаемой связи с аутоиммунными заболеваниями целесообразно совместное наблюдение инфекциониста, ревматолога, иммунолога за лицами, переболевшими псевдотуберкулезом с тяжелым, затяжным и рецидивирующим течением (особенно при поздно начатой антибактериальной терапии), при аутоиммунных проявлениях (стойкий артрит, вялотекущий миокардит, нефрит, сакроилеит, увеит). Так как рецидивы и аутоиммунные заболевания могут возникнуть и у перенесших псевдотуберкулез с легким тече
нием, следует после выписки из стационара в течение ближайших месяцев за всеми реконвалесцентами обеспечить наблюдение участкового врача.
Профилактика. Общая профилактика при псевдотуберкулезе та же, что и при других кишечных инфекциях, но ее проводят с учетом особенностей эпидемиологии псевдотуберкулеза. Важное значение имеет предупреждение инфицирования грызунами пищевых продуктов, улучшение условий хранения овощей и фруктов в больших овощехранилищах. Необходимо соблюдение технологии приготовления овощных блюд. Исключается употребление без термической обработки овощей и фруктов, имеющих следы контакта с грызунами, а также немытых.
Для предупреждения вспышек заболевания следует ежемесячно проводить бактериологический контроль продуктов, находящихся в овощехранилищах.
В очагах инфекции следует кипятить молоко, особенно при длительном его хранении.
На объектах питания и водоснабжения обязательна регулярная дератизация.
Раннее выявление и изоляция больных, наблюдение за контактными с ними лицами и бактериовыделителями, возможно, не имеют при псевдотуберкулезе такого эпидемиологического значения, как при других острых кишечных заболеваниях.
Специфическая профилактика псевдотуберкулеза не разработана, но есть мнение о ее бесперспективности, что связано со значительным количеством гетерогенных антигенов у иерсиний псевдотуберкулеза и присутствием так называемых блокирующих изоантител у людей некоторых изогеногрупп — тяжелое течение инфекции у лиц 0(1) изоанти-генного типа. Избирательный характер иммунитета лишь у части переболевших делает создание вакцины малоцелесообразным.
Кишечный иерсиниоз
Кишечный иерсиниоз — зоонозная бактериальная инфекция с фекально-оральным механизмом передачи, вызываемая Y.enterocolitica. Характеризуется преимущественным поражением кишечника с тенденцией к генерализации процесса с поражением различных органов и систем, полиморфизмом клинических симптомов, склонностью к затяжному и хроническому течению (лат. — yersiniosis, англ. — Y.enterocolitica infection).
Свое название — «кишечный иерсиниоз» — болезнь получила по названию возбудителя — Yersinia enterocolitica.
Нечеткость существующей терминологии, с одной стороны, проявляется и в этом названии болезни: далеко не все клинические формы ее сопровождаются гастроинтестинальными проявлениями, поэтому термин «кишечный иерсиниоз» видится не всегда логичным. С другой стороны, пользоваться привычным и широко распространенным термином «иерсиниоз» не совсем правильно с учетом того, что он подразумевает более широкое, родовое название определенной группы болезней. Мы предпочитаем пользоваться термином «кишечный иерсиниоз», поскольку путь заражения, несмотря на различия в клинических проявлениях, одинаков, всегда имеется энтеральная фаза заболевания.
Классификация. Классификация кишечного иерсиниоза, как и псевдотуберкулеза, не упорядочена.
Экспертами ВОЗ (1981 г.) предложена следующая классификация манифестных форм кишечного иерсиниоза:
Мезентериальный аденит.
Энтерит.
Септицемия.
Полиартрит.
Узловатая эритема.
Синдром Рейтера.
Экстрамезентериальные формы:
острый менингит,
пневмония, плеврит,
гнойный артрит и остеомиелит,
абсцессы печени, селезенки.
Но уже сама эта классификация отражает существующие в ней противоречия: септицемия — также экстрамезентериальная форма, синдром Рейтера может возникнуть при любой из перечисленных форм, кишечные проявления наблюдаются в начальный период заболевания практически всегда. В нашей стране наибольшее распространение получила классификация кишечного иерсиниоза, предложенная в 1989 г. Н.Д.Ющуком и соавторами (табл. 22).
Таблица 22. Классификация кишечного иерсиниоза (Н.Д.Ющук и соавт., 1989)
|
Клиническая форма |
Вариант течения |
Тяжесть течения |
Особенности течения |
|
Гастроинтести-нальная |
Гастроэнтерит Энтероколит Гастроэнтероколит Мезентериальный лимфаденит Терминальный илеит Острый аппендицит |
Легкое, среднетяжелое, тяжелое |
Стертое, субклиническое Острое (до 3 мес) Затяжное (до 6 мес) Хроническое (более 6 мес) |
|
Генерализованная |
Смешанный Септический Септикопиемический |
То же |
То же |
|
Вторично-очаговая |
Артрит Узловатая эритема Синдром Рейтера Пневмония Гепатит Миокардит Менингит |
То же |
То же |
Как видим, классификация Н.Д.Ющука отличается от классификации ВОЗ большей детализацией и более четкой связью с характером процесса (локализованный, генерализованный).
Артрит, узловатая эритема, синдром Рейтера могут быть проявлением ГЗТ, а не реакцией на местное внедрение возбудителя. Тяжесть течения при кишечном иерсиниозе определяют не только выраженность интоксикационного синдрома, но и степень дегидратации.
Примерная формулировка диагноза. При оформлении диагноза необходимо учитывать остроту процесса, клиническую форму, вариант, тяжесть течения, характер осложнений. Например:
Острый кишечный иерсиниоз, гастроинтестинальная форма, эн-тероколитический вариант, течение среднетяжелое.
Затяжной рецидивирующий кишечный иерсиниоз, вторично-очаговая форма (полиартрит), течение среднетяжелое.
Затяжной генерализованный кишечный иерсиниоз, септикопиемический вариант, иерсиниозный менингоэнцефалит, тяжелое течение. Осложнение: отек мозга.
Патогенез. В патогенезе псевдотуберкулеза и кишечного иерсиниоза очень много общего. Совпадают механизм и пути внедрения возбудителя в организм, характер местной реакции в лимфатических узлах, механизм генерализации и образования вторичных метастатических очагов, характер иммунологических реакций.
Однако имеется ряд отличий, основные из них следующие.
Y.enterocolitica обладает энтеротоксином, механизм действия которого сходен с таковым энтеротоксина других грамотрицательных бактерий, в частности E.coli. Он вызывает активацию аденилатциклазы энтероцитов с последующим повышением проницаемости их мембран для воды и электролитов. Следствием этого является диарея, нередко значительная, которая может привести к тяжелой гиповолемии. Вероятно, повышением активности аденилатциклазы в эпителии дыхательных путей объясняется и частое развитие экссудативного фарингита, не свойственного псевдотуберкулезу. Как полагают, существенная роль в развитии диарейного синдрома принадлежит простагландинам, динамика и соотношение которых различны при различных кишечных инфекциях. При кишечном иерсиниозе во все периоды болезни повышен уровень простагландина Е, связанного с аллергическими реакциями, это подтверждает и роль аллергии в патогенезе болезни.
Генерализованная форма развивается при заражении иерсиния-ми серовара 03, несущими плазмиды вирулентности. При отсутствии у возбудителей этих плазмид генерализация не наступает, процесс ограничивается незначительно выраженными местными изменениями. При заражении иерсиниями серовара 09 чаще возникают локализованные формы, генерализация наступает редко и преимущественно у лиц с отягощенным анамнезом.
Если при псевдотуберкулезе возможность формирования хронической формы признается не всеми, то при кишечном иерсиниозе хроническое течение считается доказанным. При остром течении с 3—4-й недели уменьшается частота обнаружения О-антигена, который полностью исчезает на 10—12-й неделе. При затяжном и хроническом течении длительно (на протяжении многих месяцев) можно обнаруживать в крови и биологических жидкостях не только О-антиген, но и возбудителя, сохраняется высокий уровень антител (классов IgG и IgM), специфических ИК.
Частое развитие аутоиммунных реакций, как и при псевдотуберкулезе, обусловлено повреждением различных органов и тканей возбудителями и фиксированными ИК, в результате чего обнаруживаются «скрытые» тканевые антигены. Циркуляция их в крови сопровождается появлением специфических противоорганных антител.
Схематично фазы патогенеза кишечного иерсиниоза можно представить следующим образом:
I фаза — заражение (внедрение возбудителя в организм);
II — проникновение иерсиний в кишечник, размножение и накопле- ние их;
— местная воспалительная реакция (терминальный илеит, аппендицит); действие энтеротоксина (диарея);
— проникновение иерсиний за пределы кишечника в регионарные лимфатические узлы с развитием мезентериального лимфаденита (мезаденита);
— при несостоятельности местных факторов защиты и высокой вирулентности возбудителя наступает генерализация процесса — бактериемия (проявляется она общетоксическим синдромом);
— паренхиматозная диффузия (незавершенный фагоцитоз и торможение миграции активных лейкоцитов в зону воспаления способствуют формированию метастатических очагов, где происходит размножение и накопление возбудителя); клинически это проявляется увеличением печени и селезенки, признаками поражения тех органов, в которых формируются очаги воспаления;
— повторная генерализация из сформировавшихся очагов воспаления ведет к формированию новых очагов воспаления (вторично-очаговые формы), что проявляется рецидивами и обострениями с реакцией соответствующих (пораженных) органов и систем; уже на этом этапе отчетливым становится аллергический, аутоиммунный компоненты;
— иммунологическая перестройка на фоне циркуляции возбудителя в организме:
а) освобождение от инфекции наступает в результате повышения фагоцитарной активности лейкоцитов, появления специфических ан- тител против бактериальной клетки и ее компонентов (антигенов) с по- следующим образованием и выведением ЦИК, стимуляции ГЗТ в месте внедрения иерсиний;
б) наряду с этим возникают дополнительные повреждающие факто- ры: аутоантитела, повреждение сенсибилизированных тканей Т-лим- фоцитами (ГЗТ), действие фиксированных ИК. Все это сопровождает- ся развитием аллергических реакций в коже, синовиальных оболочках, различных органах. Частота развития этих реакций при кишечном иерсиниозе больше, чем при псевдотуберкулезе.
Таким образом, идущие, как видим, по одному типу фазы инфекционного процесса при обоих заболеваниях протекают с некоторыми качественными различиями, связанными с особенностями возбудителей.
Клиника. Клинические проявления при кишечном иерсиниозе и псевдотуберкулезе сходны настолько, что во многих случаях лишь бактериологическое исследование позволяет уточнить этиологию заболевания. Тем не менее, можно выявить и некоторые различия, имеющие иногда немаловажное дифференциально-диагностическое значение.
Инкубационный период при иерсиниозе короче (от нескольких часов до 4—5 дней), чаще, чем при псевдотуберкулезе, бывает продром.
Энтерит или гастроэнтерит — один из наиболее постоянных синдромов, он наблюдается у большинства больных. Рвота, диарея часто бывают первыми симптомами болезни. Стул очень частый, до 15 раз в сутки и более. Выраженный диарейный синдром может сопровождаться значительной дегидратацией, приводящей даже к гиповолемическо-му шоку. В стуле обнаруживают иногда не только слизь, но и кровь.
При иерсиниозе часто наблюдают тахикардию, особенно в случаях, протекающих с выраженной дегидратацией.
Довольно часто, уже в 1—2-ю неделю болезни, возникают признаки поражения почек. ОПН может быть не только следствием поражения почек ИК, но и выраженной гиповолемии.
Значительно реже, чем при псевдотуберкулезе, в процесс вовлекается слизистая оболочка ротоглотки. «Пылающий зев» не характерен, хотя энантема и даже эрозии на мягком нёбе могут быть. Более типичным является экссудативный фарингит, а не тонзиллит. Язык обычно сухой, покрыт бурым налетом; «малиновый язык» не характерен.
Гиперемия кожи бывает значительно реже, чем бледность. Вероятно, это обусловлено более выраженным диарейным синдромом с потерей жидкости и компенсаторным спазмом сосудов кожи.
Высыпания появляются реже, чем при псевдотуберкулезе, они бывают самыми различными — мелкоточечные, розеолоподобные, пятнистые, пустулезные, геморрагические, возникают они в различные сроки. Редко сыпь напоминает скарлатинозную, особенно если появляется на бледном фоне.
Четче очерчена органная симптоматика, что и отражает классификация.
Все остальные признаки, перечисленные в разделе «Псевдотуберкулез», характерны и для кишечного иерсиниоза.
Выделение отдельных клинических форм, перечисленных в классификации, зесьма условно, тем более, что заболевание, начинаясь как иерсиниозный энтерит, может переходить в септикопиемическую форму с развитием вторичноочаговой формы (например, иерсиниозный гепатит). Поэтому очень важно детально собрать анамнез: обычно вторичноочаговые формы проявляются в конце 2—3-й недели и даже позже. Однако гастроинтестинальные симптомы бывают столь незначительны, что больные иногда не фиксируют на них свое внимание, поэтому создается впечатление о первичном поражении печени, сердца, почек и других органов. Иногда признаки гастроинтестинальной фазы действительно отсутствуют, заболевание может начинаться остро, внезапно, как острый сепсис, или с органных или полисистемных проявлений.
Клинические проявления таких гастроинтестинальных вариантов течения, как мезаденит, терминальный илеит, острый аппендицит, весьма сходны с симптомами псевдотуберкулеза. Иногда эти варианты объединяют в отдельную «абдоминальную» форму заболевания. Гастроэнтерит, энтероколит, гастроэнтероколит протекают более бурно, чем при псевдотуберкулезе, они могут быть единственными проявлениями кишечного иерсиниоза, напоминать сальмонеллез, эшерихиоз, шигеллез, иногда сопровождаясь значительным обезвоживанием. Но иногда диспепсические явления сочетаются с различной степени выраженности катаральным, общетоксическим (иногда более значительным, чем диспепсический), дизурическим синдромами и артралгией. Экзантема при гастроинтестинальной форме наблюдается редко, может носить перемежающийся характер.
При генерализованной форме наиболее отчетливо проявляются по-лиорганность поражений и полиморфизм клинических проявлений. Для этой формы характерны острое начало, сочетание общетоксического, диспепсического и катарального синдромов с первых дней заболевания, у большинства больных в разные сроки болезни появляется сыпь самого различного характера и локализации. Артралгия, а позже и полиартрит или моноартрит сочетаются с генерализованной лимфа-денопатией, увеличением печени, изменениями сердечно-сосудистой системы, вегетативными расстройствами (потливость, парестезии, головокружение, похолодание конечностей), дизурическими явлениями. Длительность течения — от нескольких дней до нескольких месяцев. Чем длительнее протекает заболевание, тем красочнее клиническая картина, отчетливее органные поражения. Сроки появления отдельных симптомов, очередность вовлечения в процесс различных органов значительно варьируют.
Септический и септикопиемический варианты протекают тяжело, давая высокую летальность, тем более, что они, как правило, развиваются у лиц с тяжелыми хроническими заболеваниями, сопровождающимися иммунодепрессией. Характерны бурное начало, гектическая лихорадка, профузный пот, генерализованная лимфаденопатия, гепа-тоспленомегалия, нередко желтуха. На этом фоне выявляют пневмонию, миокардит, менингит, нефрит, артрит. Сыпь носит чаще геморрагический характер. Часто в начальный период наблюдается диспепсический синдром, впоследствии — сильная боль в животе, наводящая на мысль об остром хирургическом заболевании. Септическая форма протекает длительно (иногда в течение многих месяцев), с обострениями и рецидивами, плохо поддается антибактериальной терапии.
При псевдотуберкулезе такая форма развивается значительно реже, чем при кишечном иерсиниозе.
Течение вторичноочаговой формы напоминает таковое при псевдотуберкулезе. Возникает она на фоне или после гастроинтестинальной или генерализованной форм (конец 2-й — 3-я неделя болезни и позже). Эту причинно-следственную связь установить удается не всегда, но при сборе анамнеза следует особое внимание обращать на возможный предшествовавший диспепсический синдром. В патогенезе вторичноочаговой формы существенная роль принадлежит аллергическому компоненту, что объясняет ее длительность, почти закономерное сочетание с кожными высыпаниями.
Частота возникновения отдельных клинических форм различается в отдельных возрастных группах:
в возрасте от 1 года до 10 лет заболевание протекает преимущественно по типу гастроэнтероколита;
от 10 до 19 лет — чаще встречается аппендикулярная форма, при этом одновременно с признаками острого аппендицита бывает высокая температура с первых дней болезни, нередко — диарея, иногда сыпь, артралгия, катаральные явления;
от 20 до 29 лет — преобладает терминальный илеит, при котором боль в животе, вздутие кишечника, признаки раздражения брюшины сочетаются с артралгией, катаральным синдромом, сыпью; начинается заболевание часто с диареи;
от 30 до 49 лет — характерен моно- или полиартрит, возникающий через 2—3 нед после кратковременной незначительной диареи (появляется припухлость суставов, гиперемия, нередко высыпания в области суставов); часто одновременно возникают генерализованная лимфаденопатия, высыпания на других участках, поражение сердца (миокардит, протекающий доброкачественно);
в возрасте 50 лет и старше нередко выявляют узловатую эритему преимущественно у женщин.
Осложнения, исходы заболевания такие же, как при псевдотуберкулезе. Течение в большинстве случаев доброкачественное. Исключение составляет септическая форма, дающая высокую летальность.
Методы диагностики кишечного иерсиниоза аналогичны таковым при псевдотуберкулезе, за исключением аллергологического метода.
Но если возбудители псевдотуберкулеза дают перекрестные ложно-положительные результаты с возбудителем чумы, то и при кишечном иерсиниозе наличие общих антигенов с сальмонеллами, шигеллами, кишечной палочкой дает большой процент перекрестных реакций с этими возбудителями.
Поскольку характер патологического процесса зависит от наличия плазмид вирулентности, обнаружение в выделениях больного иерсиний без определения у них этих плазмид не может считаться абсолютным доказательством иерсиниозной природы заболевания, так как возможно нахождение иерсиний в кишечнике абсолютно здоровых людей.
Эозинофилия при иерсиниозе наблюдается главным образом в период вторичноочаговых поражений.
Критерии диагноза. В пользу иерсиниозной природы заболевания свидетельствуют следующие признаки:
— эпидемиологический анамнез (употребление в пищу овощей и фруктов, к которым могли иметь доступ грызуны, общение с больным, имеющим клинические проявления иерсиниоза);
— сезонность (осенне-зимний период);
—■ острое начало, в большинстве случаев с гастроинтестинальных проявлений;
сочетание респираторного и диспепсического синдромов с кожными проявлениями уже в первые дни болезни;
полиорганность поражений (наиболее отчетливая при длительном течении заболевания);
— наклонность к затяжному и хроническому течению.
Подтверждают диагноз обнаружением иерсиний, особенно имеющих плазмиды вирулентности в исследуемом материале. Серологические исследования следует проводить в динамике (3—4 раза), особенно информативны результаты, полученные на 3-й неделе заболевания и позже.
Дифференциальный диагноз. Наиболее сложен дифференциальный диагноз между псевдотуберкулезом и кишечным иерсиниозом. Пожалуй, нет ни одного симптома, который встречался бы только при одном из этих заболеваний и не наблюдался при другом. Безусловно, частота выявления отдельных симптомов различна при кишечном иерсиниозе и псевдотуберкулезе, но в каждом конкретном случае ориентироваться на «больше-меньше», «чаще-реже» не приходится. Пожалуй, наибольшую ценность при постановке предварительного диагноза имеют эпидемиологический анамнез и почти закономерное развитие диа-рейного синдрома в первые дни болезни при иерсиниозе, скарлатино-подобное течение без диареи — при псевдотуберкулезе.
Дифференциальную диагностику кишечного иерсиниоза проводят с теми же заболеваниями, что и при псевдотуберкулезе. Наиболее важно учитывать при этом период болезни, выявление наиболее характерных для каждого заболевания симптомов.
Лечение. С учетом небольшой роли больных кишечным иерсиниозом в эпидемиологическом процессе их госпитализуют по клиническим показаниям. Обязательной госпитализации подлежат больные с тяжелым, затяжным и рецидивирующим течением кишечного иерсиниоза. Наблюдение за больными с абдоминальной формой кишечного иерсиниоза, особенно с ее аппендикулярным вариантом, рационально проводить в условиях хирургического стационара. Больных с генерализованной формой, осложненной ИТШ, и больных с гастроинтестинальной формой, осложненной гиповолемическим шоком, нужно госпитализировать в отделения инфекционной реанимации.
Постельный режим назначают в лихорадочный период и в первые дни после нормализации температуры, что имеет значение для предупреждения рецидивов и поздних осложнений.
Учитывая большую частоту гастроэнтерита, энтероколита у больных кишечным иерсиниозом, им обычно назначают диету №13. При резко выраженном гастроэнтерите после промывания желудка и кишечника назначают «голодную» водно-солевую паузу на 12—24 ч с последующим назначением диеты №4. С учетом возможных обострений и рецидивов щадящая диета должна соблюдаться не менее чем 3—4 нед после стихания явлений энтероколита, мезаденита, терминального илеита.
В случаях, протекающих с явлениями иерсиниозного гепатита, применяют диету №5-а с переходом на №5.
Этиотропная терапия. При генерализованной форме кишечного иерсиниоза эффективным считается лечение гентамицином в суточной дозе 5 мг/кг массы тела с обязательным введением препарата внутривенно при септикопиемическом и септическом вариантах. Продолжительность курса лечения — не менее 10 дней, даже при условии быстрой (на 2-е—3-й сутки лечения) нормализации температуры. В эквивалентных дозах можно назначать другие аминогликозиды (брулами-цин, тобрамицин). Левомицетин применяют в суточной дозе 50 мг/кг массы тела в 3—4 приема. По некоторым данным, лечение левомицети-ном менее эффективно, чем аминогликозидами или даже полусинтетическими тетрациклинами. Однако при ИТШ, иерсиниозном менинго-энцефалите он пока считается препаратом выбора, длительность курса лечения левомицетином должна составлять не менее 10 дней. Можно применять и доксициклин (вибрамицин) в дозе не менее 2,5 мг/кг массы тела в 1-е сутки лечения с последующим переходом на суточную дозу 1,25 мг/кг массы тела в два приема. Курс лечения — 7—10 дней. Парентеральное введение доксициклина не имеет преимущества перед его приемом внутрь в случаях, протекающих без неукротимой рвоты. При шоке препарат должен назначаться внутривенно.
Могут применяться и цефалоспориновые антибиотики 3-го и 4-го поколений, однако отсутствует единое мнение об оптимальных суточных дозах и длительности курсов лечения. Имеются сведения о высокой эффективности абактала, возможно применение и других хиноло-нов и оксихинолонов (норфлоксацина, офлоксацина и др.), а также би-септола (бактрим, ориприм, сульфатон). Не следует применять «чистые» сульфаниламиды без сочетания их с триметопримом, а также ампициллин (в отличие от псевдотуберкулеза), карбенициллин, амокси-циллин, цефалоспорины 1-го — 2-го поколений.
Существуют данные о большей эффективности комбинированной антибиотикотерапии при генерализованной форме. При отсутствии
ИТШ рекомендуют сочетать гентамицин (в суточной дозе до 0,5 г внутривенно или внутримышечно) с доксициклином (в суточной дозе 0,2 г). Можно сочетать каждый из указанных антибиотиков с неграмом (не-виграмоном), таревидом и другими оксихинолонами, бисептолом, нит-рофуранами в обычных терапевтических дозах. Возможны сочетания аминогликозидов (гентамицин, бруламицин, сизомицин) в обычных дозах и цефалоспоринов 3-го поколения (цефотаксим, цефтазидим, цеф-триаксон и др.).
Все больше сторонников находит мнение о нерациональности антибактериальной терапии при легком течении гастроинтестинальной формы, экссудативном фарингите.
При различных вариантах абдоминальной формы (мезаденит, аппендицит, терминальный илеит) показана антибактериальная терапия — левомицетин (0,5 г 4 раза в сутки) или тетрациклин (0,3 г 4 раза в сутки), особенно при подозрении на аппендицит. Она должна проводиться еще не менее 7 дней после оперативного вмешательства, если таковое производилось, учитывая частоту обострений, рецидивов, осложнений, но в общей сложности до 12 дней. Антибактериальная терапия показана при вторичноочаговых формах. Обычно назначают те же антибиотики, что и при генерализованной форме.
При полиартрите, сакроилеите рекомендуют местное применение в виде компрессов повязок с 20% раствором димексида, антибиотиков, которые больной получает внутрь или парентерально. Применение димексида в сочетании с левомицетином, доксициклином, цефалоспори-нами 3-го поколения может увеличить эффективность лечения абсцессов, вызванных кишечными иерсиниями.
Патогенетическая терапия. В отличие от псевдотуберкулеза при гастроинтестинальной форме кишечного иерсиниоза может наблюдаться выраженная дегидратация вплоть до развития гиповолемического шока. Патогенетическое лечение в таких случаях приобретает решающее значение и заключается в немедленном восполнении потерь воды и электролитов. Как при холере и ПТИ, при отсутствии неукротимой рвоты и явлений гиповолемического шока предпочтение отдают перо-ральному приему глюкозо-солевых растворов (оралит, регидрон) в количествах, соответствующих степени дегидратации. При развитии гиповолемического шока, неукротимой рвоте производят внутривенную регидратацию солевыми растворами «Лактасоль», «Ацесоль» и другими. Следует подчеркнуть, что в отличие от псевдотуберкулеза регидра-тационная терапия при кишечном иерсиниозе применяется гораздо чаще.
Порядок выписки из стационара реконвалесцентов, допуска их на работу, учебу, в детский коллектив такой же, как и при псевдотуберкулезе. По тем же показаниям проводят диспансеризацию.
Профилактика. Общая профилактика кишечного иерсиниоза отли-
чается от профилактики псевдотуберкулеза, так как в ряде случаев больной кишечным иерсиниозом может быть источником инфекции для окружающих. Особую осторожность следует соблюдать детям при общении с такими больными, а также лицам с врожденными и приобретенными иммунодефицитами. Необходимо помнить, что больных кишечным иерсиниозом можно обнаружить среди лиц, находящихся на лечении по поводу вирусного гепатита, сепсиса, а также в ревматологических и хирургических отделениях.
Источником инфекции при кишечном иерсиниозе могут быть сельскохозяйственные животные, больные или бактериовыделители, а также домашние животные (кошки, собаки). В выявлении патологии у них важная роль принадлежит ветеринарной службе.
Обязательным компонентом профилактики является уничтожение грызунов.
Специфическая профилактика не разработана.
Кампилобактериоз
Кампилобактериоз — зоонозное инфекционное заболевание, вызываемое возбудителями рода Campylobacter, характеризующееся преимущественным поражением кишечника (по дизентериеподобному или холероподоб-ному варианту), а также способностью вызывать генерализованные формы (септическую и септикопиемичес-кую) (лат. — campylobacteriosis; англ. — Campylobacter infection).
Краткие исторические сведения. Возбудитель абортов домашних животных, выделенный впервые из плаценты абортировавших овец в 1909 г., получил сначала название «Vibrio fetus» (fetus — аборт). Однако дальнейшие исследования показали его существенные отличия от других представителей рода Vibrio, что послужило основанием для выделения их в отдельный новый род Campylobacter. Долгое время представители этого рода считались патогенными лишь для животных, но связь их с патологией человека была доказана работами R.Vinzent (1947), выделившего из крови беременной женщины микроорганизм, получивший впоследствии название Campylobacter fetus. В 1972 г. удалось выделить аналогичный возбудитель из фекалий больных диареей. В настоящее время проводится активное изучение заболеваний, вызванных возбудителями рода Campylobacter.
Актуальность. Острые кишечные инфекции остаются одной из актуальнейших проблем здравоохранения всех стран. Численность микроорганизмов, способных вызывать диарею у человека, с каждым годом растет. Кампилобактерии принадлежат к числу «новых» возбудителей диарейных заболеваний и привлекают к себе особое внимание клиницистов, что связано с такими особенностями этой инфекции:
широкое повсеместное распространение;
к возбудителям рода Campylobacter чувствительны теплокровные животные, в том числе птицы, а также человек;
как оказалось, во многих регионах, даже в развитых странах, эти возбудители являются причиной диареи даже чаще, чем сальмонеллы и шигеллы;
создание крупных животноводческих комплексов повышает вероятность распространения инфекции среди животных и заражения людей;
— число представителей рода Campylobacter постоянно пополняет-
ся, причем патогенез, клинические проявления и исходы вызываемых ими заболеваний могут весьма существенно различаться;
кампилобактерии являются одной из основных причин развития «диареи путешественников»;
многие вопросы патогенеза кампилобактериозов и систематики возбудителей остаются еще нерешенными.
Этиология. В настоящее время род Campylobacter насчитывает 13 видов, но наибольшая роль в патологии человека принадлежит Campylobacter jejuni, Campylobacter coli и Campylobacter fetus.
По своим свойствам C.jejuni и С.coli очень сходны, С.fetus имеет некоторые отличия, проявляющиеся в отношении к температуре, чувствительности к антибактериальным препаратам, биохимической активности.
Кампилобактерии — грамотрицательные палочки изогнутой или спиралевидной формы, ширина их 0,2—0,5 мкм, длина — 0,5—0,8 мкм. Подвижны благодаря наличию двух биполярно расположенных жгутиков. Характерные движения кампилобактерии (стремительные штопо-рообразные) являются одним из отличительных признаков, позволяющих идентифицировать их уже при микроскопии. Спор и капсул не образуют. Хорошо окрашиваются всеми анилиновыми красителями.
Оптимальные условия роста для всего рода кампилобактерии — рН 4,8—7,8, температура +37 °С, но C.jejuni хорошо растут и при температуре + 42 °С, которая непригодна для роста других кампилобактерии. Все представители этого рода — микроаэрофилы, требующие для своего роста специального газового состава с пониженным содержанием кислорода (оптимальный состав — 5% кислорода, 10% углекислого газа, 85% азота). Для выращивания микроорганизмов этим газовым составом заполняют пластиковые мешки, куда помещают питательные среды (мясные, печеночные, кровяные с добавлением к ним антибиотиков, угнетающих рост других микроорганизмов, но не оказывающих действия на кампилобактерии, — триметоприм, бацитрацин, новобио-цин). Для выделения культуры микроорганизмов необходимо около 4 дней. C.jejuni чувствительны к налидиксовой кислоте, С.fetus к ней резистентны.
Кампилобактерии длительно, в течение нескольких недель, сохраняются при температуре +4 °С, но быстро погибают при температуре выше 45 °С, низких и высоких рН, при высушивании и действии прямых солнечных лучей.
В молоке при температуре +25 °С кампилобактерии выживают 3—4 дня, + 4 °С — до 3 нед. Могут долго сохраняться в речной и даже водопроводной воде. Стандартные дезинфицирующие растворы в обычных концентрациях быстро уничтожают их.
Кампилобактерии имеют сложную антигенную структуру. Иммуно-генное действие оказывают липополисахарид, белки наружной мембраны и жгутиков. Многообразием антигенов объясняется наличие большого количества серологических групп (так, у С.jejuni их по О-ан-тигену более 60, по Н-антигену более 50). Различные сочетания термолабильных и термостабильных антигенов определяют штамм. Термолабильные и термостабильные антигены выявляют в РНГА и РА соответственно.
Кампилобактерии обладают способностью к адгезии, связанной с наличием жгутиков и адгезинов на поверхности клетки, благодаря чему они легко проникают в эпителиальный слой. Они способны к внутриклеточному размножению.
Токсические субстанции кампилобактерии изучаются. Наиболее изучены энтеротоксин и цитотоксин. Как оказалось, кампилобактерии, выделенные от бактерионосителей, токсинов не содержали. Энтеротоксин, имеющий некоторое антигенное сходство с холерным токсином и термолабильным токсином E.coli, продуцируют штаммы, вызывающие у человека секреторную диарею. Он быстро разрушается в кислой и щелочной среде. Цитотоксины обнаруживают у штаммов, выделенных от больных с дизентериеподобным синдромом. Некоторые штаммы продуцируют фактор проницаемости, повышающий проницаемость сосудов.
Эпидемиология. Кампилобактериоз — зооноз. Основной источник инфекции — сельскохозяйственные и дикие животные, птицы, в меньшей степени — домашние животные. В кишечнике зараженных животных кампилобактерии могут обнаруживаться как комменсалы. C.jejuni, C.coli чаще изолируют от свиней, С.fetus — от коз и овец. Тяжело заболевание протекает у цыплят: у недельных оно сопровождается бактериемией, диссеминацией во внутренние органы, у более старших — диареей. Источником инфекции может стать больной человек (1 г фекалий больного содержит 1010 возбудителей), а также бактерионоситель. Они имеют меньшее значение в распространении инфекции, однако еще остается малоизученным вопрос, как долго возбудитель может оставаться в организме человека.
Место и значение больных и носителей в эпидемическом процессе, частота инфицирования населения кампилобактериями неодинаковы в развитых и развивающихся странах, основные эпидемиологические различия кампилобактериоза в этих регионах представлены в табл. 23.
До настоящего времени еще нет ответа на вопрос, являются ли клинические различия у больных кампилобактериозом, проживающих в развитых и развивающихся странах, следствием инфицирования различающимися по свойствам штаммами кампилобактерии или обусловлены широким распространением кампилобактерии в развивающихся странах и высоким уровнем там коллективного иммунитета. Не исключено, что роль играют и другие, в том числе и генетические, факторы.
Кампилобактериоз
— типичная кишечная инфекция с
фекально-оральным механизмом
передачи, поэтому социальными условиями
в значительной мере объясняется разница в распространенности заболеваний в развитых и развивающихся странах.
Основные факторы передачи возбудителя — загрязненная пища (преимущественно мясные и молочные продукты) и вода. Можно заразиться при прямом контакте с больными или бактерионосителями (животными и людьми).
Восприимчивы к кампилобактериозу все люди, не имеющие иммунитета против кампилобактерии. На восприимчивость влияют возраст и реактивность организма. Так, тяжелое септикопиемическое течение при инфицировании С.fetus возникает исключительно у лиц, страдающих тяжелыми заболеваниями (туберкулез, сахарный диабет, лейкоз, ВИЧ-инфекция).
Заболевания, вызываемые C.jejuni, возникают в виде спорадических случаев и групповых вспышек, вызываемые С.fetus — преимущественно в виде спорадических случаев. Кампилобактерии — ведущий этиологический фактор «диареи путешественников».
Для кампилобактериоза, как и для других кишечных инфекций, характерна сезонность — пик заболеваемости приходится на лето и осень.
После перенесенного заболевания развивается иммунитет: нарастает уровень специфических IgA в секрете кишечника, появляются специфические IgM и IgG в сыворотке крови. Повторные заражения лиц, проживающих в странах, где распространена эта инфекция, поддерживают иммунитет на высоком уровне, что способствует более легкому течению инфекционного процесса при повторных заражениях и постепенному освобождению организма от возбудителя. Более того, при попадании вирулентных кампилобактерии в иммунный организм возможна утрата ими факторов вирулентности.
Классификация. Общепринятой классификации кампилобактерио-за нет. Наиболее приемлемой в настоящее время можно считать попытку выделить отдельные клинические формы с учетом характера, локализации, тяжести, длительности процесса.
По выраженности клинических проявлений выделяют формы:
манифестную,
субклиническую,
бактерионосительство.
По локализации процесса различают:
а) кишечную форму (вызываемую преимущественно C.jejuni и С.fe- tus), которая может протекать:
по дизентериеподобному варианту;
по холероподобному варианту (холероподобный энтерит);
б) генерализованную форму:
септическую (вызываемую С.fetus, реже — C.jejuni, C.coli),
септикопиемическую (вызываемую С.fetus).
По тяжести выделяют легкое, среднетяжелое и тяжелое течение заболевания.
По длительности течения кампилобактериоз бывает острым, затяжным и хроническим.
Примерная формулировка диагноза. В диагнозе указывают клиническую форму, тяжесть и длительность течения, серотип возбудителя, вызвавшего заболевание. Например:
Острый кампилобактериоз (C.jejuni), кишечная форма, дизентерие-подобное течение, средняя степень тяжести.
Острый кампилобактериоз (С.fetus), септикопиемическая форма, тяжелое течение.
Патогенез. Многие вопросы патогенеза кампилобактериозов остаются неизученными.
Характер течения патологического процесса в значительной мере обусловлен тем, каким штаммом произошло инфицирование — энте-роинвазивным (обладающим цитотоксичностью) или энтеротоксигенным (имеющим энтеротоксин). Корреляция между энтеротоксично-стью и инвазивностью отсутствует.
Тяжесть течения заболевания определяется наличием местного и общего иммунитета против кампилобактерии, кислотностью желудочного сока. Нормальная микрофлора является антагонистом кампилобактерии, поэтому назначение антибиотиков, угнетающих микрофлору кишечника, но не влияющих на кампилобактерии, отягощает течение болезни. Материнские антитела не предупреждают заболевание, так как не препятствуют колонизации кишечника кампилобактериями.
Кампилобактерии, проникшие в кишечник, благодаря наличию жгутиков и адгезинов фиксируются на слизистой оболочке, колонизируя кишечник на всем протяжении — от двенадцатиперстной до прямой кишки, особенно много их в слепой кишке. Наличие жгутиков дает возможность активно перфорировать клеточную мембрану энтероци-тов, проникать внутрь клетки, где кампилобактерии обнаруживают уже через 12 ч после заражения, а через 24 ч они достигают lamina propria.
В результате размножения в них кампилобактерии энтероциты погибают, в зоне такого местного повреждения возникают инфильтраты из лимфоцитов, полинуклеаров, плазматических клеток, формируются микроабсцессы с последующим их вскрытием и образованием эрозий и язв. Такое повреждение в зоне расположения кровеносных сосудов приводит к возникновению кровотечений, проявлением чего является кровь в кале. Кампилобактерии проникают также в лимфатические фолликулы и мезентериальные лимфатические узлы, где могут размножаться и накапливаться. В большинстве случаев процесс ограничивается слизистой оболочкой и лимфоидным аппаратом кишечника, но в отдельных случаях может возникать бактериемия. Способствуют этому низкий уровень местного иммунитета (IgA), несостоятельность макрофагов. Однако попавшие в кровь бактерии высоко чувствительны к бактерицидным свойствам ее, а также к циркулирующим специфическим антителам (вот почему в регионах с высоким уровнем заболеваемости септические формы кампилобактериоза даже у младенцев — большая редкость).
Попавшие в кровь кампилобактерии могут заноситься в различные органы и ткани, где возникают гнойные очаги. Низкая чувствительность кампилобактерии к желчи приводит к тому, что они, попадая в желчный пузырь, могут вызывать местный воспалительный процесс (холецистит). Способность проникать через плаценту приводит к инфицированию плода и выкидышам или (если заражение происходит в III триместре беременности) рождению ребенка с врожденным кампи-лобактериозом (колит, сепсис). Повторные поступления возбудителей из сформировавшихся очагов в кровь сопровождаются обострениями и рецидивами болезни, а длительная циркуляция кампилобактерии и их антигенов приводит к развитию аллергических реакций различного характера (ГЗТ, аутоиммунные реакции, действие ИК). Выздоровление наступает благодаря активации защитных функций макрофагов, повышению уровня секреторных и сывороточных антител, развитию ГЗТ. Особое значение при кампилобактериозе приобретает содержание Т-лимфоцитов: снижение соотношения Т-хелперы/Т-супрессоры создает условия для хронизации даже при достаточно высоком уровне циркулирующих антител.
При заражении энтеротоксигенными штаммами процесс носит преимущественно местный характер, при этом инвазия бактерий в стенку кишечника не наступает. Энтеротоксин, повышая уровень цАМФ в эн-тероцитах, в конечном результате приводит к значительной секреции жидкости и электролитов в просвет тонкой кишки с нарушением обратного всасывания в толстой кишке. Следствием этого является водянистая диарея с возможным значительным обезвоживанием. Лимфатический аппарат при этом остается интактным.
Для кампилобактериоза, вызываемого C.jejuni и C.coli, характерны главным образом дизентериеподобное течение и секреторная диарея, т.е. кишечная форма, а генерализация наступает редко.
Кампилобактериоз, возникающий при заражении С.fetus, чаще протекает с преобладанием септического (септикопиемического) компонента.
Клиника. Клиника кампилобактериоза, вызываемого C.jejuni и C.coli. Инкубационный период — от нескольких часов до 10 дней (чаще 2—5 дней).
Заболевание может начинаться остро, внезапно с рвоты, боли в животе, диареи, повышения температуры тела. Но нередко первыми признаками заболевания, еще до развития диареи, являются общеинтоксикационные проявления — повышение температуры, головная боль, слабость, миалгия, что расценивается как продром. Интоксикация может быть весьма значительной, особенно у маленьких детей, сопровождаясь судорогами, спутанностью сознания, бредом. Температура бывает различной —от субфебрильной до высокой (39—40 °С). В отдельных случаях лихорадка может быть единственным проявлением болезни. Длительность ее — от нескольких часов до 4—5 дней, а иногда и более.
Боль в животе (преимущественно в надчревной области, но иногда и по всему животу) возникает почти одновременно с рвотой (которая бывает как однократной, так и многократной, а у некоторых больных может даже отсутствовать) и диареей. Боль приступообразная, она временно стихает после акта дефекации. Нередко боль в животе сохраняется и после прекращения диареи. У отдельных больных боль бывает единственным признаком заболевания, ее интенсивность иногда такова, что заставляет думать об остром аппендиците и часто таких больных госпитализируют в хирургическое отделение. Но во время операции редко обнаруживают деструкцию червеобразного отростка, чаще выявляют увеличенные регионарные лимфатические узлы.
Стул в первые часы, а иногда и в первые 1—3 дня заболевания — жидкий, слегка окрашенный желчью, с неприятным запахом, но может быть и водянистым. На 2—3-й день болезни в кале появляется примесь крови, нередко настолько значительная, что возникает мысль о кишечном кровотечении, а в сочетании с сильной болью в животе — о перфорации кишечника. Частота стула — от 2—3 до 10 раз и более в сутки, у отдельных больных диарея может сопровождаться дегидратацией. При гемоколите ректороманоскопия позволяет выявить отек, гиперемию, кровоизлияния, поверхностные эрозии и даже глубокие язвы на слизистой оболочке прямой и сигмовидной кишок, а колоноско-пия — аналогичные изменения на всем видимом протяжении кишечника.
Дегидратация хотя и возможна при дизентериеподобном течении, но не очень характерна. Значительно чаще она развивается при холе-роподобном энтерите, при котором рвота бывает относительно редко, а обильный частый стул является основным проявлением заболевания. Выявляемые при ректороманоскопии изменения минимальны (возможны лишь отек и гиперемия слизистой оболочки).
Длительность диарейного синдрома обычно не превышает 2—3 дня, общая длительность болезни — до 1 нед, иногда несколько больше. У большинства больных излечение наступает самопроизвольно.
Генерализация процесса, сопровождающаяся лихорадкой гектичес-кого типа, выраженной интоксикацией, признаками поражения различных органов и систем (менингоэнцефалит, артрит и др.), возникает редко, не более чем у 1% больных. Как полагают, холецистит, панкреатит, цистит кампилобактериозной природы — не всегда проявление гематогенной диссеминации, а могут быть следствием местного (лимфо-генного) распространения инфекции. Полиморфные высыпания на коже, а иногда и узловатая эритема, реактивный артрит могут возникать на 2—3-й неделе болезни, то есть уже после исчезновения диарейного синдрома, и быть проявлением сенсибилизации. Группой риска генерализации процесса являются лица с антигеном гистосовместимости HLA В27.
Критериями тяжести при кишечной форме являются степень интоксикации и (или) дегидратации. Генерализация всегда является показателем тяжелого течения заболевания. Затяжное течение бывает редко.
Клиника кампилобактериоза, вызываемого С.fetus. С.fetus вызывает манифестную форму болезни главным образом у лиц с иммунодефицитом. Заболевание протекает преимущественно в форме септицемии или септикопиемии. Несмотря на то что возбудитель проникает в организм через пищеварительный тракт, признаки его поражения в большинстве случаев слабо выражены или даже могут отсутствовать. Боль в животе различной интенсивности нередко сочетается с общетоксическим синдромом, но диарея развивается менее чем у половины больных, выражена она в этих случаях весьма умеренно, стул жидкий без крови и слизи.
Заболевание может начинаться бурно — с озноба, головной боли, повышения температуры тела до 39 °С и выше, впоследствии лихорадка приобретает интермиттирующий или даже гектический характер. Больных беспокоят слабость, потливость, мышечная боль, у некоторых появляется заторможенность, спутанность сознания. Пульс частый, АД снижено. Уже в конце 1-й недели у многих больных можно обнаружить увеличение печени и селезенки, иногда — небольшую иктерич-ность склер и даже кожи. Таким образом, клинические проявления не отличаются от сепсиса, вызванного другими грамотрицательными бактериями. Иногда такая септицемия может разрешаться спонтанно, гнойные очаги в других органах не возникают. Протекать она может бурно, с быстрым наступлением смерти или может приобретать затяжное (в течение нескольких недель) волнообразное течение. Лихорадка может затягиваться, формируя синдром длительной лихорадки неясного генеза.
У некоторых больных уже с первых дней четко прослеживают симптомы, свидетельствующие об избирательном поражении отдельных органов и систем. Иногда такие органные поражения проявляются позже, спустя несколько дней или даже 1—2 нед. Описаны менингит, перикардит, пневмония, артрит, сальпингит, эмпиема плевры, абсцессы мозга и легких, инфекция мочевыводящих путей, холецистит, гнойное поражение кожи (пустулы, абсцессы, флегмоны). Обычно формирование гнойных очагов значительно отягощает течение и ухудшает прогноз. С.fetus проявляет тропизм к сосудистой стенке, что приводит к некрозу сосудов, создает условия для образования тромбов и развития тромфофлебита любой локализации. Иногда тромбофлебит является основным и даже единственным клиническим проявлением генерализованной формы кампилобактериоза, вызванного С.fetus. Поражение сосудистой стенки может проявляться также в форме субарахноидального кровоизлияния, субдурального и плеврального выпота.
Тяжело протекает кампилобактериозный сепсис у беременных, часто вызывая помимо выраженного токсикоза и органных поражений гибель плода и выкидыши. Тяжело болеют дети первого года жизни, давая высокую летальность.
Критериями тяжести при кампилобактериозе, вызванном С.fetus, служат длительность и высота лихорадки, наличие и характер органных поражений, степень компенсации нарушенных функций, осложнения.
Осложнения. Диссеминация кампилобактерии по всему организму и образование гнойных очагов в различных органах, формирование в них кампилобактериозных флегмон, абсцессов и развитие перикардита, менингита, холецистита, панкреатита и другого не расцениваются как осложнения. Это проявление различных вариантов течения заболевания.
Кампилобактпериоз, вызванный C.jejuni и С. coli, в ранних стадиях болезни (обычно 1-я неделя) может сопровождаться такими осложнениями:
кишечное кровотечение,
перфорация кишечника, перитонит;
деструкция червеобразного отростка (редко);
в отдельных случаях развивается выраженная дегидратация;
— при выраженной интоксикации могут появиться симптомы ме-нингизма, отек-набухание головного мозга.
В более поздние (2-я неделя и позже) сроки возникают нарушения, характерные для аутоиммунных и аллергических реакций:
реактивный артрит (моно- и полиартрит);
различная сыпь, в том числе узловатая эритема;
синдром Гийена—Барре (острый полирадикулоневрит).
При кампилобактериозе, вызванном С. fetus, кишечные осложнения и дегидратация возникают крайне редко. Но при этом могут развиваться:
— ИТШ;
токсическое поражение ЦНС с судорогами, потерей сознания, ме-нингизмом и даже отеком мозга;
токсическое поражение печени (может сопровождаться нарушением ее функций, умеренной желтухой);
поражение сосудов (с возникновением тромбофлебитов различной локализации);
— у беременных — гибель плода, самопроизвольные аборты.
На 2—3-й неделе заболевания и позже могут возникать осложнения аллергического и аутоиммунного характера, как и при кампилобактериозе, вызванном C.jejuni.
Исходы. Прогноз зависит от клинической формы заболевания и состояния макроорганизма (прежде всего его иммунной системы).
Заболевание, вызываемое C.jejuni и С.coli, протекает обычно благоприятно, самопроизвольное излечение без антибактериальной терапии наступает у большинства больных. При наличии таких осложнений, как кровотечение и перфорация, прогноз зависит от своевременного распознавания их и лечения. Хронизация наступает редко, хотя и возможна у больных с иммунодефицитом.
Более серьезный прогноз при кампилобактериозе, вызванном С.fetus, обусловлен частой генерализацией процесса, который может приобретать к тому же затяжное и хроническое течение. Часты летальные исходы у беременных женщин и маленьких детей.
Особой группой риска тяжелого течения и неблагоприятных исходов являются больные с антигеном гистосовместимости HLA В27.
Методы диагностики. Общеклинйческие методы. В общем анализе крови в разгар болезни выявлают обычно умеренный лейкоцитоз, нейтрофилез, умеренно увеличенную СОЭ. Выраженность этих изменений коррелирует с тяжестью течения, но гиперлейкоцитоз обычно не характерен даже для тяжелой генерализованной формы. Возможен и нормоцитоз. СОЭ быстро нормализуется в период реконвалесценции при отсутствии гнойных очагов.
Анализ мочи — без особенностей. При тяжелом течении могут появляться единичные эритроциты, следы белка. При кампилобактериоз-ном цистите возникает лейкоцитурия, обнаруживаются эритроциты в значительном количестве.
В копроцитограмме при кишечной форме выявляют эритроциты (при дизентериеподобном течении кровь заметна и без микроскопии), слизь. При секреторном энтерите эритроциты не обнаруживают.
При исследовании спинномозговой жидкости больного с кампилоба-ктериозным менингоэнцефалитом обнаруживают нейтрофильный ци-тоз и незначительно повышенное содержание белка.
Биохимические методы. Электролитные нарушения и дисбаланс КОС при кишечном кампилобактериозе бывают редко, главным образом при дегидратации. При тяжелой генерализованной форме могут развиваться декомпенсированный ацидоз, гипокалиемия.
При токсическом поражении печени бывает умеренное повышение уровня билирубина и небольшое — активности АлАТ и АсАТ.
Специфическая диагностика. Кампилобактерии, имеющие весьма характерную форму и движение, могут быть идентифицированы при помощи фазовоконтрастной микроскопии в суспензии фекалий или биопсийного материала. Можно с использованием обычной микроскопии исследовать мазки фекалий, окрашенные 1 % водным раствором фуксина в течение 10—20 с (не более!). При этом хорошо окрашиваются только кампилобактерии, быстро воспринимающие краску. В натив-ном мазке они видны в виде S-образных или С-образных цепочек. Но микроскопический метод является лишь вспомогательным, так как эффективен только при большом количестве возбудителей в исследуемом материале.
Бактериологический метод исследования — основной при кампилобактериозе. Кампилобактерии могут быть выделены из фекалий, а при генерализованной форме — из мочи, крови, спинномозговой жидкости, гнойников, флегмон. Культивирование их требует определенных условий: атмосферы с пониженным содержанием кислорода и повышенным — углекислого газа, а также наличия антибиотиков, которые подавляют рост другой микрофлоры. Наиболее часто используют содержащие кровь среды Скирроу, Бутцлера и др. Наличие колоний выявляют уже через 24—48 ч, но еще до 5—10-го дня продолжают наблюдение за ростом колоний и ежедневное изучение выделенных микроорганизмов (микроскопия, серотипирование и другие исследования).
Допустимо исследуемый материал хранить в холодильнике при температуре + 4 °С не более 2 дней.
Серологические методы диагностики применяют широко, но они еще нуждаются в совершенствовании. Возможны ошибки при постановке реакций за счет наличия общих антигенов с другими микроорганизмами (например, с нейссериями, листериями, возбудителями псевдотуберкулеза), за счет часто встречающейся микст-патологии (с сальмонеллезом, шигеллезом и т.д.). Возможно получение ложноположи-тельных результатов, но обычно в невысоких титрах и при обследовании здоровых людей. Наиболее часто пользуются РА, РСК, РИФ, РНГА.
Агглютинины появляются в конце 1-й недели болезни, но нарастание их титров идет очень медленно (на 2-й неделе титры часто не превышают 1:8, лишь через 1,5—3 мес они достигают разведений 1:64 и более). Диагностическим титром РА считают 1:32. Но, как и все серологические реакции, РА должна оцениваться в динамике, тем более, что возможны неспецифические реакции. Это — штаммоспецифическая реакция, поэтому постановка ее одновременно с несколькими штаммами кампилобактерии позволяет четче оценить полученные результаты.
РСК — видоспецифическая реакция, она становится положительной с конца 1-й — начала 2-й недели. Диагностический титр — 1:32. Однако возможны ложноположительные реакции с листериями, нейссериями, возбудителями псевдотуберкулеза за счет наличия общих антигенов. При исследовании в динамике титры антител к кампилобакте-риям нарастают значительно быстрее.
Высокой чувствительностью обладает РНГА (видоспецифическая реакция), с помощью которой антитела у многих больных выявляются уже с 4—7-го дня болезни. Диагностический титр — 1:200. У некоторых больных к 4—б-й неделе болезни титры достигают 1:1600 — 1:3200. Сыворотки крови здоровых людей также могут давать положительные реакции, но титры антител при этом не превышают 1:100.
РИФ (непрямая модификация) уступает по чувствительности РНГА, но превосходит РА. В титрах 1:4 — 1:8 она бывает положительной и у здоровых людей. Диагностический титр — не менее 1:64. Для повышения достоверности результатов рекомендуют ставить одновременно несколько серологических реакций, например, РА и РСК, РИФ и РНГА.
Наиболее чувствительна и специфична — РИСАФ. С ее помощью можно не только обнаруживать антитела к кампилобактериям, но и раздельно определять наличие антител классов IgM и IgG. Реакция отличается хорошей воспроизводимостью результатов, позволяет исследовать большое число проб одновременно. Чаще применяется иммуно-диффузионная модификация РИСАФ. Ограничивает пока широкое применение этих методов в практике их довольно высокая стоимость.
Высокой специфичностью и чувствительностью отличается и РИА.
При кишечной форме кампилобактериоза серологические методы имеют нередко лишь ретроспективное значение, так как диагностические титры антител выявляют иногда лишь на 2—4-й неделе болезни. Тем не менее, серологические исследования, проведенные в динамике, позволяют более чем в 90% случаев подтвердить кампилобактериозную природу болезни, тогда как бактериологические методы дают более низкие результаты.
Значительно большую роль эти методы играют при распознавании генерализованной формы, при клинических формах, протекающих с рецидивами, обострениями и хронизацией.
Дополнительные методы диагностики. При кампилобактериозе нередко прибегают к ректороманоскопии. При этом выявляют характерные изменения слизистой оболочки прямой и сигмовидной кишок. При необходимости исследуют биоптат, взятый при ректороманоскопии.
Критерии диагноза. Кишечную форму кампилобактериоза с дизен-териеподобным течением можно заподозрить на основании следующих признаков:
соответствующий эпидемиологический анамнез (употребление в пищу термически плохо обработанных продуктов животного происхождения, профессиональный или бытовой контакт с больными животными, а также пребывание на территории, неблагополучной по кампи-лобактериозу);
острое начало, интоксикация;
непродолжительная лихорадка;
интенсивная, разлитая, схваткообразная боль по всему животу;
жидкий стул — сначала водянистый, затем — с примесью крови и слизи;
возможность затяжного течения, когда к диарейному синдрому присоединяются признаки поражения различных органов, кожные высыпания.
Для кампилобактериозного холероподобного энтерита характерны:
соответствующий эпидемиологический анамнез;
острое начало;
боль в животе;
обильный водянистый стул, редко сопровождающийся обезвоживанием;
со 2-й недели возможны органные проявления, кожные высыпания.
Генерализованную форму диагностируют на основании таких особенностей:
соответствующий эпидемиологический анамнез;
наличие у больного тяжелого фонового заболевания, сопровождающегося иммунодефицитом;
острое начало, высокая длительная лихорадка;
наличие в первые дни заболевания боли в животе, нередко — умеренной диареи;
выраженный интоксикационный синдром, потливость;
различные органные (нередко полиорганные) поражения;
наклонность к тромбообразованию, тромбофлебиты;
полиморфная кожная сыпь — макулезная, папулезная, пустулезная и пр.
Диагноз подтверждают:
обнаружением кампилобактерии в исследуемом материале при фазовоконтрастной макроскопии (экспресс-метод);
выделением культуры возбудителя;
результатами серологических исследований, проведенными в динамике, свидетельствующими о нарастании титров специфических антител (ретроспективный метод).
Любой из этих методов может быть достаточным, чтобы обосновать диагноз при наличии соответствующей клиники (но следует помнить о возможности ложноположительных реакций, выделении кампилобактерии у здоровых).
Дифференциальный диагноз. Дизентериеподобное течение кампилобактериоза требует дифференциальной диагностики с шигеллезом, сальмонеллезом, эшерихиозом, кишечным иерсиниозом, неспецифическим язвенным колитом, инвагинацией кишок.
Ведущими общими симптомами для всех этих заболеваний являются боль в животе, гемоколит, различной степени выраженности интоксикационный синдром.
Шигеллез (особенно Флекснера и Зонне) от кампилобактериоза с дизентериеподобным течением позволяют отличить:
локализация боли преимущественно в левой подвздошной области;
отсутствие водянистого стула во все периоды болезни;
спазм сигмовидной кишки;
отсутствие признаков поражения других органов и систем аллергического характера;
отсутствие высыпаний.
Локализованную форму сальмонеллеза характеризуют:
— диарея, для которой характерен жидкий зловонный стул, могут появляться прожилки крови (обильная примесь крови не свойственна при отсутствии осложнений);
боль, локализующаяся преимущественно в эпигастрии;
часто — наличие рвоты, с которой заболевание обычно начинается;
нередко увеличенная печень. При эшерихиозе:
заболевание нередко начинается по типу ПТИ — с рвоты;
— часто лихорадка может отсутствовать, несмотря на наличие интоксикации;
— ведущим симптомом может быть рвота, а не диарея;
аллергические проявления не характерны. Неспецифический язвенный колит отличается тем, что:
развивается постепенно;
полиорганные поражения не характерны;
отсутствуют аллергические реакции, сыпь.
Для инвагинации кишок в отличие от дизентериеподобного кампилобактериоза характерны:
внезапное бурное начало;
преобладание болевого синдрома над диарейным;
симптомы раздражения брюшины;
— определяющееся при рентгенографии брюшной полости резкое вздутие кишечника выше зоны препятствия;
— гиперлейкоцитоз;
— острое, быстро прогрессирующее течение, при отсутствии соответствующей помощи может быстро наступить смерть.
При холероподобном кампилобактериозном энтерите прежде всего проводят дифференциальную диагностику с холерой, которая отличается тем, что:
не начинается с рвоты;
болевой синдром для холеры не характерен;
температура остается нормальной или даже бывает субнормальной;
диарея часто сопровождается быстро прогрессирующим обезвоживанием;
аллергические проявления (артралгия, серозный артрит, высыпания и др.) не характерны.
Генерализованная форма, протекающая по типу септицемии или септикопиемии, очень сходна с сепсисом любой другой этиологии. О кампилобактериозе можно думать при наличии соответствующего эпидемиологического анамнеза, а также указания на предшествовавший диарейный синдром (чаще дизентериеподобный).
В дифференциальной диагностике с генерализованной формой сальмонеллеза, которой тоже может предшествовать диарейный синдром различной выраженности и характера, помогает иногда пробная терапия соответствующим антибиотиком, дающая быстрый эффект при кампилобактериозе и значительно менее отчетливый — при сальмонеллез е.
Очень сложно бывает установить этиологию заболевания тогда, когда отчетливо выявляются лишь органные поражения (печени, легких, сердца, суставов, ЦНС). Тщательно собранный анамнез позволяет выявить иногда предшествовавшие диарею или «необъяснимую» лихорадку у больного с отягощенным анамнезом. Полиорганностъ поражений у больных с тяжелой пневмонией, туберкулезом, ревматизмом и т.д. требует исключения кампилобактериоза.
Сильная боль в животе, особенно при ее локализации справа, может послужить причиной направления больного в хирургическое отделение с диагнозом «острый аппендицит». Но такие симптомы, сочетающиеся с гемоколитом и невысоким лейкоцитозом, высокая лихорадка и интоксикация с первых часов заболевания позволяют некоторое время наблюдать за больным, прежде чем прибегнуть к операции. Однако кампилобактериоз действительно может сопровождаться развитием острого аппендицита. Поэтому при нарастании лейкоцитоза, усилении боли приходится прибегать к диагностической лапарото-мии.
Но во всех случаях диагноз кампилобактериоза должен быть верифицирован специфическими методами исследования.
Лечение. Показания к госпитализации больных такие же, как и при других кишечных инфекциях. Режим больного определяется тяжестью состояния. Необходимость в обязательном постельном режиме возникает при выраженной интоксикации, обезвоживании, признаках поражения сердца и сосудов (тромбофлебит).
Лечебное питание должно быть обеспечено во все периоды болезни. При дизентериеподобном течении и холероподобном энтерите назначают диету №4а, №4; при признаках поражения печени — №5а, №5; при поражении сердца — №10. Диету больному подбирают индивидуально с учетом ведущих клинических проявлений. При затяжной и генерализованной формах необходима диета, обеспечивающая повышенную потребность организма в витаминах, белках, углеводах.
Этиотропная терапия. Если необходимость назначения антибиотиков не вызывает сомнения при генерализованной форме, то целесообразность их при кишечной форме, особенно легком ее течении, признается не всеми с учетом того, что часто выздоровление наступает самопроизвольно. Однако есть наблюдения, подтверждающие, что назначение эритромицина сокращает длительность диареи при любой тяжести течения кишечной формы кампилобактериоза, уменьшает вероятность возникновения осложнений. Эритромицин в суточной дозе 1 —1,5 г назначают на срок не менее 5—7 дней. Чувствительны кампилобактерии также к тетрациклину, доксициклину, мономицину, левомицетину, аминогликозидам, фуразолидону. В том случае, если заболевание приобретает септическое течение, следует переходить на парентеральное введение гентамицина или левомицетина сукцината растворимого (в обычных терапевтических дозах). Эти препараты эффективны при генерализованной форме заболевания, вызванного C.jejuni, C.coli и С.fetus. Длительность курса лечения не менее 3—4 нед. При кампилобактериозном менингоэнцефалите предпочтение отдают левомицетина сукцинату растворимому, который лучше проникает через гематоэнцефалический барьер. Следует помнить, что к ампициллину, пенициллину, цефалоспоринам кампилобактерии резистентны. Длительное (более 1 нед) применение антибиотиков требует назначения нистатина. При хроническом течении проводят повторные курсы антибиотикотерапии, меняя антибиотики.
Патогенетическая терапия. Дезинтоксикацию при легком и сред-нетяжелом течении кишечной формы при отсутствии рвоты осуществляют перорально (обильное питье, при необходимости — глюкозо-со-левые растворы, оралит).
При выраженной интоксикации показана внутривенная дезинток-сикационная терапия («Ацесоль», 5% раствор глюкозы). Парентеральную детоксикацию при возможности сочетают с пероральной.
Обезвоживание требует восполнения жидкости и электролитов солевыми растворами («Трисоль», «Дисоль», «Ацесоль»).
Так как генерализованная форма возникает почти исключительно у больных с иммунодефицитом, можно назначать средства, стимулирующие специфическую и неспецифическую реактивность организма, — метилурацил, витамины. Но иммунокорригирующую терапию, особенно левамизол, тималин, Т-активин, следует назначать весьма осмотрительно, тщательно взвесив все показания и противопоказания, и лишь при возможности осуществления иммунологического контроля лечения. Бесконтрольное назначение этих препаратов может принести больше вреда, чем пользы.
Несмотря на возможность развития аллергических реакций при кампилобактериозе, применение преднизолона противопоказано, так как он может еще больше усугубить тяжесть состояния из-за иммуно-депрессивного действия, способствовать возникновению затяжной формы, генерализации процесса. Его можно применять кратковременно лишь при ИТШ, который при кампилобактериозе возникает крайне редко. Как десенсибилизаторы назначают диазолин, тавегил. Препараты кальция (глюконат кальция, хлорид кальция) следует применять с осторожностью, помня о частом возникновении тромбофлебита.
Длительная антибиотикотерапия нередко приводит к дисбактерио-зу. Борьбу с ним с учетом характера дисбактериоза проводят уже в период реконвалесценции, после отмены антибактериальных препаратов.
Порядок выписки из стационара. Реконвалесцентов выписывают из стационара после наступления клинического выздоровления. Желательно контрольное исследование кала на наличие кампилобактерии.
Профилактика. Общая профилактика включает меры ветеринарные (борьба с кампилобактериозом сельскохозяйственных и домашних животных и птиц) и санитарно-эпидемиологические (контроль за соблюдением санитарных норм забоя животных и птиц, хранением, обработкой и реализацией продуктов животного происхождения, охрана от загрязнения источников водозабора, выявление и санация больных). С учетом всевозрастающей миграции населения необходимо особое внимание обратить на тех, кто выезжает в туристические или деловые поездки в развивающиеся страны. Все они должны быть самым тщательным образом проинструктированы о мерах защиты от кишечных инфекций (в том числе от кампилобактериоза) во время поездки.
Меры специфической профилактики не разработаны.
Хеликобактериоз
Хеликобактериоз — инфекционное заболевание с фе-кально-оральным механизмом передачи, вызываемое возбудителями рода Helicobacter, для которого характерно поражение желудка и двенадцатиперстной кишки, ведущее к развитию гастрита и язвенной болезни (лат. — helicobacteriosis; англ. — helicobacteriosis, helir cobacter disease).
Краткие исторические сведения. Первые сообщения о нахождении спиралевидных бактерий на слизистой оболочке желудка у больных гастритом относятся еще к 40—50-м годам нашего столетия, но этим находкам не придавали особого значения.
В 1983 г. Warren и Marshall подробно описали обнаруженные ими в эпителии желудка больного хроническим гастритом бактерии, которым они дали название Campylobacter pylori. Они тогда же высказали предположение о возможной причинно-следственной связи вновь описанных микроорганизмов с гастритом. В 1986 г. Marshall проводит эксперимент по самозаражению этими бактериями с целью доказать правильность своей теории.
В последующие годы появляются работы, свидетельствующие о частом обнаружении спиралевидных бактерий на слизистой оболочке желудка при гастрите (в том числе эрозивном), язвенной болезни желудка и двенадцатиперстной кишки. Морфологическое сходство с возбудителями рода Campylobacter, а также наличие некоторых общих антигенов, сходные условия культивирования и т.д. позволили на начальном этапе изучения «новых» микроорганизмов отнести их тоже к этому роду.
Однако дальнейшие исследования показали, что С.pylori генетически не связаны с другими кампилобактериями, и поэтому в 1991 г. они были выделены в самостоятельный род — Helicobacter.
Актуальность. Установлена отчетливая связь между колонизацией Н.pylori слизистой оболочки пищевода, желудка, двенадцатиперстной кишки и частотой развития гастрита, дуоденита, язвенной болезни. В настоящее время теория инфекционного генеза язвенной болезни желудка и двенадцатиперстной кишки приобретает все больше сторонников. Доказана возможность длительного (пожизненного) персистиро-вания возбудителя в организме человека. Имеются данные, свидетельствующие о возможном участии хеликобактерий в патологии не только пищеварительного тракта.
Учитывая чувствительность Н.pylori к некоторым антибактериальным препаратам, открываются новые пути в лечении больных гастритом и язвенной болезнью.
Этиология. Род Helicobacter имеет 2 вида — Н.pylori и H.mustelae. В патологии человека наибольшее значение имеет Н.pylori. Этот возбудитель несколько крупнее, чем кампилобактерии (2,5—4 «0,5 мкм). Н.pylori имеют спиралевидную форму, но при длительном культивировании (5—7 дней) они приобретают овоидную форму; 4—7 ее жгутиков расположены на одном конце, заканчиваясь утолщениями. Н.pylori — грамотрицательные бактерии. Температурный оптимум роста +37 "С, диапазон температуры, при которой Н.pylori могут расти, +33 ... + 41 "С. Для культивирования наиболее пригодны кровяной и шоколадный агар, необходимы аэрофильные условия. При росте Н.pylori образуется сероводород. Большинство штаммов обладают уреазной активностью, некоторые — гемолитической. У Н.pylori обнаружено множество различных ферментов (транспептидазы, кислая и щелочная фо-сфатазы, эстеразы, протеаза и др.), а также цитотоксический канцерогенный белок и другие вещества, вызывающие воспалительные, атро-фические и деструктивные изменения слизистой оболочки желудка.
Н.pylori имеют более высокое содержание гуанина и цитозина, чем кампилобактерии, отличаются от них они и по составу жирных кислот, биохимической активности, а также антигенной структуре.
Антигенная структура Н.pylori изучена еще недостаточно, но уже доказана антигенная неоднородность, вариабельность этих бактерий.
Эпидемиология. Эпидемиология инфекции, вызванной Н.pylori, подобна таковой при кампилобактериозе.
Классификация до настоящего времени не разработана.
Патогенез. Исследования, проведенные с момента обнаружения Н.pylori у больного гастритом, показали, что существует отчетливая связь между колонизацией желудка и двенадцатиперстной кишки Н.pylori и заболеваниями этих органов (острый и хронический гастрит, язвенная болезнь). При этом возбудитель закономерно обнаруживался лишь в зонах железистой метаплазии эпителия желудка и двенадцатиперстной кишки, реже — пищевода, но его не удавалось выявить в эпителии других отделов кишечника. Выделяли Н.pylori и у здоровых лиц. В настоящее время существует 3 основных взгляда на связь Н.pylori с определенными заболеваниями человека:
— Н.pylori — сапрофиты, их наличие не дает оснований говорить об инфекционной природе имеющейся патологии. Главный аргумент сторонников этой теории — широкое распространение этого микроорганизма: частота встречаемости Н.pylori в отдельных популяциях достигает 50 %;
— Н.pylori лишь осложняют течение возникших без их участия заболеваний (т.е. выполняют функцию неблагоприятного патогенетического фактора);
— Н.pylori вызывают острые и хронические поражения желудка и двенадцатиперстной кишки. Эта точка зрения имеет самое большое количество сторонников.
Как полагают, существует генетическая предрасположенность к заболеваниям, вызываемым Н.pylori.
Попавшие в желудок Н.pylori, благодаря спиралевидному движению, способны легко перемещаться в слизи, покрывающей поверхность желудка. Достигнув эпителиальных клеток, Н.pylori, обладающие адгезивными свойствами, прикрепляются к ним и начинают размножаться. При этом наиболее активной колонизации подвергается слизистая оболочка тела и антрального отдела желудка, проксимального отдела двенадцатиперстной кишки. Колонизация сопровождается проникновением возбудителей в крипты и железы, разрушением защитного слоя слизи, уменьшением толщины эпителиального слоя, скоплением полиморфноядерных лейкоцитов. В результате нарушения защитного слоя создаются благоприятные условия для проникновения соляной кислоты к слизистому слою и его повреждению. Сами Н.pylori надежно защищены слизью от действия соляной кислоты, так как располагаются в слое слизи вблизи клеток, эту слизь вырабатывающих.
Проникновение в зону поражения полинуклеаров сопровождается местной воспалительной реакцией, инфильтрацией. Из гемоглобина капиллярных эритроцитов образуются мочевина и гемин, которые выходят за пределы кровеносных сосудов в зоне поражения Н.pylori. Обладающие уреазной активностью H.pylori превращают мочевину в аммиак, который оказывает повреждающее действие на слизистую оболочку. Вместе с тем, аммиак нейтрализует соляную кислоту вокруг бактериальной клетки, создавая локальное ощелачивание и благоприятные условия для существования H.pylori. В развитии местных повреждений играют роль биологически активные вещества, выделяющиеся при разрушении эпителиальных клеток и фагоцитов (гистамин, аце-тилхолин, серотонин и др.), ферменты H.pylori, также его токсин, оказывающий некротизирующее действие на слизистую оболочку желудка. Местные воспалительные реакции могут сопровождаться в отдельных случаях мезаденитом и перитонеальным выпотом. При значительном повреждении слизистой оболочки в крови могут появляться специфические антитела.
Вероятно, нарушение процессов пищеварения в результате поражения желудка и двенадцатиперстной кишки является основной причиной развития диареи и неязвенной диспепсии, поскольку в других отделах кишечника H.pylori не выявляются. При заболеваниях, вызываемых H.pylori, изменяется кислотность желудочного сока, рН в пищеводе. Поскольку в слизистой оболочке пищевода H.pylori также не обна-
руживают, не исключено, что явления эзофагита, возникающие у некоторых больных, могут быть обусловлены местным снижением рН.
Возбудители могут оставаться в слизистой оболочке желудка и двенадцатиперстной кишки пожизненно, вызывая периодически обострения. Назначение этиотропных средств приводит к гибели Н.pylori, исчезновению морфологических изменений в слизистой оболочке и выздоровлению. Повторные заражения сопровождаются возвратом клинических и морфологических проявлений.
Считают, что Н.pylori является причиной развития не только гастрита, язвы желудка и двенадцатиперстной кишки, но и мальтомы (лимфо-мы желудка низкой степени злокачественности) и рака желудка.
Клиника. Инкубационный период при заражении Н.pylori может весьма варьировать. Так, существует мнение, что Н.pylori могут длительное время не проявлять своего действия и лишь при определенных благоприятных для них условиях активно размножаться и вызывать поражение желудка и двенадцатиперстной кишки. При экспериментальном заражении добровольцев инкубационный период составлял около 7 дней.
Первыми проявлениями заболевания могут быть неприятные ощущения и чувство тяжести в эпигастральной области после еды, иногда тошнота и даже рвота. Эти симптомы не сопровождаются общеинтоксикационными проявлениями, повышением температуры тела. Иногда бывают послабления стула, вздутие живота. Как правило, такие больные в начальный период редко обращаются к врачу, и лишь тогда, когда признаки заболевания становятся отчетливее и заставляют прибегать к диете, они обращаются к врачу, который диагностирует обычно «хронический гастрит». Традиционные препараты, применяющиеся для лечения больных гастритом, оказываются в большинстве случаев малоэффективными, процесс может прогрессировать, приводя к развитию язвенной болезни с типичной клинической картиной.
Может развиваться также клиника эзофагита: боль за грудиной сжимающего характера, чувство жжения за грудиной. Иногда возникает диарейный синдром. При этом жидкий стул 2—3 раза в сутки не сопровождается болью в кишечнике, морфологическими изменениями в слизистой оболочке тонкой и толстой кишок.
Осложнения. Наиболее типично такое осложнение, как кровотечение (из язв). Возможны перфорация язв, нарушение проходимости пищи при рубцевании язв и образовании стенозов в антральном отделе. На фоне длительного поражения желудка и двенадцатиперстной кишки могут развиваться заболевания соседних органов — поджелудочной железы, желчевыводящих путей (холецистит, дискинезия, панкреатит). Упорная боль заставляет больных ограничивать себя в питании, что может привести к истощению. Нередко на фоне заболевания возникает дисбактериоз.
Исходы. При своевременно начатом адекватном этиотропном лечении возможны полная санация, исчезновение признаков гастрита, стойкое рубцевание язв, нормализация кислотности.
Методы диагностики. Общеклинические методы. Анализы крови, мочи, кала обычно не позволяют отличить поражения желудка и двенадцатиперстной кишки, вызванные H.pylori, от патологии, обусловленной другими причинами (стрессы, нерациональное питание и т.д.).
При исследовании кислотности желудочного сока обнаруживают ее повышение у большинства больных.
Уреазный тест с биоптатами эпителия желудка может быть достаточно информативным, так как для заболеваний, вызываемых H.pylori, характерна высокая уреазная активность.
Специфическая диагностика. H.pylori могут быть обнаружены благодаря характерному виду в биоптате эпителия желудка при окрашивании их гематоксилином и эозином, акридиновым оранжевым или по способу Гимзы, Генте. Следует помнить, что гнездность расположения H.pylori на слизистой оболочке объясняет тот факт, что их не всегда удается выявить. Биоптаты следует брать в области антрального отдела желудка, где чаще всего локализуется патологический процесс. Забор биоптатов производят во время эзофагогастродуоденоскопии. Иногда удается обнаружить H.pylori в биоптатах при фазовоконтраст-ной микроскопии.
Для выделения культуры H.pylori биоптат, взятый во время эзофагогастродуоденоскопии, засевают на питательные среды. Методика культивирования H.pylori такая же, как и кампилобактерии. По некоторым данным, с помощью этого метода H.pylori были выделены у 90% больных гастритом и у 100% больных язвенной болезнью двенадцатиперстной кишки. Можно культивировать также материал, полученный при дуоденальном зондировании, однако по чувствительности он уступает культивированию биоптатов.
Наличие H.pylori можно выявить с помощью косвенных методик — дыхательного и уреазного тестов.
Дыхательный тест основан на способности H.pylori образовывать уреазу, под действием которой расщепляется меченая мочевина, введенная больному, в выдыхаемом воздухе появляются выделяющиеся при этом изотопы 13С или 14С.
На способности H.pylori к уреазообразованию основан и уреазный тест, при этом в биоптате слизистой оболочки желудка, помещенном в специальную среду, определяют уреазную активность по изменению цвета индикатора, содержащегося в среде.
Серологические методы позволяют уточнить этиологию хронических заболеваний желудка и двенадцатиперстной кишки, особенно в период обострений. У здоровых лиц антитела к H.pylori либо отсутствуют, либо обнаруживаются в невысоких титрах. Уровень антител в период ремиссии в значительной мере определяется сроками, прошедшими с момента очередного обострения.
В период обострения в РСК титры антител достигают 1:320 — 1:640, в РНГА — 1:320 и выше. При иммунологическом исследовании желудочного сока с помощью РИСАФ определяют высокий уровень IgA.
Серологические исследования помогают прогнозировать рецидивы заболеваний, поскольку повышение уровня антител может наступать раньше, чем клинические проявления болезни.
Критерии диагноза. О Н.pylori как возможной причине острого и хронического гастрита, особенно антрального, эзофагита, язвенной болезни желудка и двенадцатиперстной кишки следует помнить всегда, особенно в тех случаях, когда традиционная терапия этих заболеваний без применения антибиотиков не дает видимого улучшения, а включение в комплекс лечебных средств антибактериальных препаратов сопровождается заметным улучшением состояния больного. Правда, нередко и врачом и самим больным это расценивается как результат действия на сопутствующее заболевание — хронический холецистит, который нередко является спутником болезней желудка и кишечника. Именно поэтому решающую роль приобретают методы лабораторной диагностики, позволяющие уточнить природу болезни.
Дифференциальный диагноз. Острый гастрит, обусловленный Н.pylori, иногда приходится дифференцировать с ПТИ, для которой ведущими симптомами в ряде случаев являются лишь боль в животе и рвота без повышения температуры тела и диареи. Главными отличиями пищевой токсикоинфекции являются:
нередко групповой характер заболевания;
преимущественно кратковременное течение;
значительное улучшение самочувствия (вплоть до полного исчезновения симптомов) после промывания желудка и кишечника;
отсутствие положительного эффекта от антибактериальной терапии: она не только не облегчает течение заболевания, но может даже способствовать более длительному его течению;
— при тяжелом течении возможна генерализация процесса.
При проведении в этих случаях бактериологического исследования следует учитывать особенности культивирования Н.pylori.
При эзофагите, сопровождающемся болью за грудиной сжимающего характера, может возникнуть мысль об инфаркте миокарда. В этих случаях ЭКГ быстро помогает в дифференциальной диагностике, к тому же назначение антибактериальных средств способствует довольно быстрому купированию боли.
При хроническом гастрите (преимущественно антральном), дуодените, язве желудка и двенадцатиперстной кишки всегда следует проводить бактериологические исследования на наличие Н.pylori, поскольку этот возбудитель удается обнаружить у 50—90% больных. Бактериологическое исследование биоптатов должно быть первым этапом при обследовании больных, поскольку позволит в зависимости от полученных результатов более четко определить дальнейшую лечебную или диагностическую тактику. Отсутствие заметного эффекта от лечения гастрита и язвенной болезни только традиционными методами и заметное улучшение состояния больных после включения в комплекс лечебных мероприятий антибиотиков — достаточно весомый аргумент в пользу этиологической связи заболевания с H.pylori.
В последние годы появились сообщения о возможном участии в развитии гастрита, язвенной болезни и других микроорганизмов. В частности, при этих заболеваниях обнаруживали одножгутиковые микроорганизмы, отличающиеся от H.pylori чувствительностью к антибактериальным препаратам и некоторыми биохимическими свойствами. Но эта проблема находится в стадии изучения.
Лечение. Больных с острым гастритом, вызванным H.pylori, госпитализируют в инфекционные отделения, с хроническими заболеваниями — в гастроэнтерологические или общетерапевтические стационары. Однако функции инфекционистов и гастроэнтерологов распределены пока неравномерно: патологией, вызываемой H.pylori, сейчас занимаются только гастроэнтерологи, тем более, что о степени остроты процесса в большинстве случаев говорить бывает очень сложно.
При язвенной болезни, антральном гастрите в период обострения назначают диету № 1 а, № 1.
Этиотропная терапия. При остром гастрите, вызванном H.pylori, независимо от тяжести течения показана антибактериальная терапия. Так как возбудитель чувствителен к пенициллину, эритромицину, ампициллину, амоксициллину, циметидину, фуразолидону, метронидазо-лу можно назначить один из этих препаратов в обычных терапевтических дозах в течение 1 нед.
При «неязвенной диспепсии», обусловленной нарушением переваривания пищи при заболевании желудка и двенадцатиперстной кишки, вызванных H.pylori, следует начинать лечение с препаратов висмута — субсалицилата висмута или пепто-бисмола — по 2 таблетки 4 раза в сутки. Курс лечения — 3—4 нед. Так как препараты висмута токсичны и могут на фоне лечения давать осложнения, необходимо обеспечить наблюдение за больным, что возможно только в стационаре. Если такое лечение малоэффективно, на 1—2 нед дополнительно назначают антибиотик. Назначая препарат, следует учитывать особенности его взаимодействия с организмом человека. Так, к эритромицину H.pylori высокочувствительны, но назначать его не следует, так как он малоэффективен в кислой среде желудка.
Хороший эффект при язвенной болезни и гастрите дает сочетанное применение препаратов висмута и метронидазола, препаратов висмута и антибиотика, амоксициллина и тинидазола. Можно назначать отдель-
но и тинидазол по 600 мг 2 раза в сутки или амоксициллин по 500 мг 3 раза в сутки в течение 2 нед.
Патогенетическая и симптоматическая терапия такая же, как и при хроническом гастрите, язвенной болезни желудка и двенадцатиперстной кишки.
Порядок выписки из стационара. Выписывают переболевших по клиническим показаниям.
Профилактика. Общая профилактика предполагает такие же мероприятия, как и при других кишечных инфекциях, хотя конкретные мероприятия при инфекции Н.pylori практически не разработаны. Но учитывая то, что заражение может происходить и через недостаточно стерилизованный эндоскопический инструментарий, рекомендуется тщательная его стерилизация.
Специфическая профилактика не разработана.
524
Шигеллез
Шигеллез — острое антропонозное заболевание с фекаль-но-оральным механизмом передачи, вызываемое бактериями рода Shigella и характеризующееся поражением кишечника (преимущественно дистального отдела) и интоксикацией. Синоним — дизентерия бактериальная (лат. — dysenteria, англ. — bacillary dysentery, shigellosis).
Краткие исторические сведения. Еще в V ст. до н.э. Гиппократ описал «кровавый понос», дав ему название «дизентерия» (от греческих слов «dys» — нарушение, «enteron» — кишечник). Однако тогда под этим термином подразумевалось любое заболевание, при котором дисфункция кишечника и боль в животе сопровождались появлением крови в кале. В I ст. до н.э. греческий врач Аретей подробно описал болезнь, назвав ее «натужный понос».
Лишь в XIX ст., когда была обнаружена дизентерийная амеба (1875 г.), а позже и бактерии, вызывающие «кровавый понос», стали писать о бактериальной дизентерии как о самостоятельном заболевании.
В 1888 г. A.Chantemesse и F.Widal описали первого возбудителя бактериальной дизентерии. Почти одновременно с ними в 1889 г. П.И.Кубасов сообщил о найденных им в испражнениях и органах людей, умерших от дизентерии, «каких-то длинных бацилл». В 1891 г. русский военный врач-прозектор А.В.Григорьев выделил, изучил и подробно описал микроорганизмы, сходные с описанными ранее, выделенные из кала больных дизентерией и внутренних органов умерших от этого заболевания. Он тогда же делает вывод, что именно эти микробы являются причиной болезни. К такому же заключению, независимо от А.В.Григорьева, приходит японский микробиолог K.Shiga (1897), проведя аналогичные исследования во время эпидемии дизентерии в Японии. В честь первооткрывателей выделенный микроорганизм был назван «бактерия Григорьева — Шиги», а группа бактерий со сходными свойствами, выделенных в последующие годы, — «шигеллы». В дальнейшем были выделены и изучены новые дизентерийные возбудители: бактерии Флекснера (C.Flexner, 1906), Зонне (K.Sonne, 1915), Штуцера—Шмитца (М.И.Штуцер, 1916, K.Schmitz, 1916), Ньюкасла (F.Clayton, S.Warren, 1929) и другие. Сейчас известно уже около 40 серотипов шигелл, различающихся по антигенной структуре. Выявлены также различия их в то-ксинообразовании, биохимической активности.
В настоящее время термин «бактериальная дизентерия», и тем более «дизентерия», заменен в соответствии с рекомендацией ВОЗ термином «шигеллез».
Актуальность. Шигеллез относится к числу наиболее распространенных во всем мире кишечных инфекций. В большинстве стран Африки, Латинской Америки, Азии она является одной из основных причин смерти детей в возрасте до 5 лет. В последние годы отмечена тенденция к росту заболеваемости шигеллезом не только в этих странах, но и в странах Восточной Европы, в республиках бывшего СССР, в том числе в Украине.
В развивающихся странах преобладает шигеллез, вызываемый ши-геллами Флекснера, в связи с ведущей ролью там водного пути передачи инфекции. В развитых странах при преобладании пищевого пути передачи чаще встречается шигеллез Зонне.
В начале 50-х годов считалось, что проблема наиболее тяжело протекающего шигеллеза, возбудителями которого являются шигеллы Григорьева—Шиги, решена, но в конце 60-х — начале 70-х годов он широко распространился в Латинской Америке, затем — в странах Юго-Восточной Азии и в Африке, приняв в отдельных регионах характер настоящих эпидемий.
Во время такой эпидемии в Мексике (1969—1972 гг.) летальность достигала 32%, что эксперты Центра Контроля за болезнями в США объясняли не только большим числом диагностических ошибок, но и частой неэффективностью противомикробной терапии из-за возрастающей полирезистентности шигелл к антибиотикам.
Широко распространен шигеллез и в развитых странах. Так, в США в середине 80-х годов заболеваемость составляла 9,15 на 100 000, незначительно уступая лишь сальмонеллезам в структуре кишечных инфекций. И хотя летальность от шигеллеза в США в целом составляет менее 0,1%, но у детей она доходит до 1%, а в странах Центральной Америки даже до 8—13%, несмотря на довольно квалифицированную медицинскую помощь.
Борьба с шигеллезом сложна из-за полиморфизма клинических проявлений, многообразия факторов передачи возбудителей, всеобщей восприимчивости при непродолжительности видоспецифического иммунитета после перенесенной болезни, из-за высокой адаптационной способности шигелл с выработкой быстрой полирезистентности к антимикробным средствам.
Свидетельством актуальности проблемы кишечных инфекций, среди которых шигеллез играет особо важную роль, является принятие ВОЗ в 1978 г. международной программы борьбы с диарейными заболеваниями.
Этиология. Шигеллез вызывается несколькими биологически родственными между собой бактериями, объединенными в род Shigella, входящий в семейство Enterobacteriaceae. В настоящее время известно около 40 серотипов шигелл, объединенных в 4 серогруппы (А, В, С, D), отличающихся по своим биохимическим свойствам и характеристикам
О-антигенов. В пределах каждой группы (кроме группы D) имеются виды, серотипы и подсеротипы. Наиболее изучены следующие представители шигелл, чаще других вызывающие заболевание.
Серогруппа А имеет 12 сероваров (серотипов). Общее видовое название этой серогруппы — Sh.dysenteriae. В пределах вида Sh.dysenteriae наиболее часто заболевание вызывают шигеллы 1—7 сероваров (Григорьева—Шиги, Штуцера—Шмитца, Ларджа—Сакса). Шигеллы этой серогруппы маннит не ферментируют, антигенные связи между серотипами слабо выражены, каждый серотип имеет свой особый типовой антиген.
Серогруппа В (вид Sh.flexneri) объединяет б серотипов (по типоспе-цифическим антигенам I—VI), которые с учетом состава групповых антигенов делятся еще и на подсеротипы. Кроме того, в состав этой серогруппы входят 2 антигенных варианта (X и У), не имеющие типоспеци-фических антигенов. Представители этой серогруппы сходны по групповым антигенам, которые обнаруживаются в их составе в разных комбинациях, все они ферментируют маннит (кроме шигелл Ньюкасла). Чаще других представителей вида Sh.flexneri заболевания вызывают шигеллы Флекснера, Ньюкасла.
Серогруппа С (вид Sh.boydii) включает 18 серотипов, антигенные связи между которыми слабо выражены. Как и представители серогруппы А (вид Sh.dysenteriae), каждый серотип вида Sh.boydii имеет свой главный типовой антиген, все они обладают способностью ферментировать маннит.
Серогруппа D (вид Sh.sonnei) включает только один серотип, который ферментирует маннит и способен медленно ферментировать лактозу и сахарозу. Но по способности ферментировать рамнозу, мальтозу и ксилозу они делятся на 14 биохимических типов и подтипов, а по особенностям роста колоний — на две фазы — I и II (соответственно содержащие и не содержащие плазмиды, определяющие вирулентность шигелл Зонне).
Серовары обозначаются арабскими цифрами, подсеровары — латинскими буквами и арабскими цифрами (1а, ЗЬ, Зс и т.д.).
Шигеллы — грамотрицательные неподвижные палочки с закругленными концами длиной 2—3 мкм и шириной 0,5—0,7 мкм. Все они отличаются малой биохимической активностью (за исключением Sh.sonnei), не ферментируют лактозу.
Шигеллы — факультативные аэробы, они хорошо растут на обычных питательных средах, оптимальная температура роста +37 "С, рН 7,2.
Все шигеллы имеют клеточную стенку, спор и капсул не образуют. У некоторых сероваров Sh.flexneri при электронной микроскопии были обнаружены реснички, которые предположительно улучшают потребление питательных веществ и кислорода бактериями, способствуют их адгезии на клетках эпителия кишки. Некоторые из этих шигелл обладают и «половыми» ресничками, служащими конъюгационными каналами при передаче генетического материала.
К воздействию некоторых физико-химических факторов шигеллы относительно устойчивы. Ультрафиолетовое облучение они переносят до 10 мин, прямой солнечный свет — до 30 мин. При температуре + 100 °С они погибают мгновенно, при +60 °С — выживают до 30 мин, в каловых массах сохраняют жизнеспособность несколько часов. Под действием 1% раствора фенола гибнут через 30 мин. В окружающей среде, в том числе в воде, а также в пищевых продуктах шигеллы могут сохранять свою жизнеспособность от нескольких дней до 1 мес. В почве некоторые штаммы шигелл могут сохраняться до 3 мес летом и до 5 мес зимой, в воде — до 3 мес, на овощах, хлебе — до 2 нед.
Основными антигенами шигелл являются О- и К-антигены.
О-термостабильный соматический антиген клеточной стенки, представляющий собой липополисахаридно-протеиновый комплекс, каждый компонент которого имеет свою функцию: липид определяет ток-сигенность, полисахарид — антигенную специфичность. О-антиген достаточно устойчив к действию химических веществ. О-антигены различаются по степени специфичности на общие для всего семейства Enterobacteriaceae, родовые, видовые, групповые и типоспецифичес-кие.
К—капсульный (оболочечный) термолабильный антиген, обладающий большой специфичностью. У шигелл вида Зонне он отсутствует. К-антиген обеспечивает защиту шигелл от фагоцитоза совместно с ли-пополисахаридом и некоторыми другими антигенами.
У шигелл выявлено антигенное родство с некоторыми другими микроорганизмами, в частности с холерными вибрионами, лептоспирами, что может быть причиной ложноположительных реакций при проведении серологических исследований.
Особенности развития патологического процесса при шигеллезе определяются наличием у шигелл различных факторов патогенности, соотношение которых различается у отдельных представителей. Так, шигеллы обладают способностью к адгезии, проникновению в клетки эпителия слизистой оболочки толстой кишки и внутриклеточному размножению в них, а также в макрофагах. Фактор проницаемости шигелл способствует повышению проницаемости сосудов. Некоторые шигеллы (Зонне и Флекснера) продуцируют биологически активные вещества — колицины, образование которых у представителей нормальной кишечной микрофлоры является одним из механизмов естественной резистентности к патогенным микробам, а у патогенных — дополнительным фактором агрессии. К факторам патогенности шигелл относят и наличие у них фермента муциназы, принимающего участие в нарушении целостности кишечной мембраны вследствие разрушения елизи. Кроме того, шигеллы обладают способностью вырабатывать такие ферменты, как гиалуронидаза, плазмокоагулаза, фибринолизин и другие, оказывающие повреждающее действие на структуры организма человека. Местное цитотоксическое и энтеротоксическое действие, возникающее при размножении шигелл в энтероцитах и макрофагах, контролируется генами плазмиды и хромосомными генами шигелл. Многие шигеллы имеют R-фактор, обеспечивающий быструю выработку резистентности к антибактериальным препаратам.
Однако основным фактором патогенности шигелл является способность их к токсинообразованию. Как уже было сказано, шигеллы имеют эндотоксин, связанный с О-антигеном клеточной стенки бактерий и выделяющийся при их разрушении. Он обладает общими для всех энтеробактерий свойствами. У животных в эксперименте он вызывает диарею, лихорадку, гликогенолиз, гипергликемию, понижение функции надпочечников, повреждение сосудов, развитие коллапса. В отличие от других бактериальных липополисахаридов, эндотоксину шигелл свойственен особый тропизм к эпителию слизистой оболочки толстой кишки. Липид А эндотоксина шигелл оказывает к тому же иммуносуп-рессивное действие.
Кроме того, шигеллы Григорьева—Шиги способны вырабатывать мощный экзотоксин, обладающий выраженным нейротоксическим свойством, энтеро- и цитотоксической активностью. Энтеротоксич-ность компонента В экзотоксина проявляется в усилении диарейного синдрома в результате активации аденилатциклазы, увеличения экскреции воды и электролитов в просвет кишечника; цитотоксичность компонента А — в повреждении мембран энтероцитов, гибели клеток. Как выяснилось, аналогичный экзотоксин, но в значительно меньших (в 100—1000 раз) количествах, способны образовывать шигеллы Флекс-нера и Зонне, а также некоторые сальмонеллы.
Сопоставление вирулентности представителей различных групп шигелл выявило наиболее высокую вирулентность у шигелл Григорьева—Шиги, наименьшую — у шигелл Зонне. Однако в последние годы появились сообщения о выделении у некоторых больных высоковирулентных шигелл Зонне, вызывающих заболевания, протекающие с явлениями тяжелого нейротоксикоза, гемоколита и даже генерализацией процесса.
Шигеллы устойчивы к пенициллину, оксациллину, линкомицину, эритромицину. Многие антибиотики, проявляющие активность против шигелл in vitro, оказались неэффективными in vivo (цефалексин, кана-мицин). Все больше появляется штаммов шигелл, устойчивых к тетрациклинам, левомицетину, гентамицину, ампициллину, амоксициллину, сульфаниламидам, включая комбинации сульфаметоксазола и тримето-прима. Еще сохраняется чувствительность большинства шигелл к нит-рофуранам (фуразолидон, фурадонин), соединениям хинолина, включая производные налидиксовой кислоты (неграм, невиграмон), хиноло-нам и оксихинолонам (норфлоксацин, офлоксацин, ципрофлоксацин), полимиксинам.
Высокой устойчивостью к антибиотикам отличаются шигеллы Зонне, характеризующиеся также высокой ферментативной активностью, высокой колициногенностью (способностью подавлять рост нормальной кишечной палочки).
Эпидемиология. Единственным источником инфекции при шигелле-зе является больной человек или бактериовыделитель. У реконвалес-цента выделение шигелл может продолжаться в течение нескольких недель или даже месяцев. Следует подчеркнуть, что все же длительное (годами) носительство шигелл не характерно. В начале болезни больной выделяет с фекалиями наибольшее количество шигелл. В современных условиях наибольшую эпидемиологическую опасность представляют больные с невыявленными, стертыми, субклиническими, легкими формами, особенно если они по роду своей работы связаны с приготовлением, хранением, переработкой и транспортировкой пищевых продуктов. Большую роль в распространении шигеллеза играют и реконвалесценты, не получившие адекватной этиотропной терапии, следствием чего является более длительное выделение шигелл.
Шигеллез распространяется только при помощи фекально-орального механизма передачи, который реализуется в основном водным, пищевым и бытовым путями. Существуют убедительные данные об относительной эпидемиологической самостоятельности возбудителей шигеллеза и о наличии для каждого вида шигелл главных и дополнительных путей передачи инфекции. Таким главным путем распространения инфекции для шигелл Григорьева—Шиги является бытовой, Флексне-ра — водный, а Зонне — пищевой.
Соответственно при шигеллезе Зонне основными факторами передачи являются инфицированные молоко, сметана, творог, а также блюда, куда эти продукты входят в виде составных частей (картофельное пюре, салаты, винегреты, творожные изделия, кремы и т.п.). Реже факторами передачи могут быть и другие продукты — компоты, заливные блюда, котлеты, различные подливки, хлебный квас. В жидких и полужидких пищевых продуктах шигеллы Зонне способны не только длительно сохраняться, но и размножаться и накапливаться, что весьма существенно для эпидемического процесса. Для шигелл Зонне мини-
![]()
мальная инфицирующая доза составляет 10 микробных тел, а такая концентрация возбудителя возможна лишь при накоплении его в процессе размножения в пищевых продуктах. Однако в последние годы появились сообщения о случаях возникновения заболевания, вызванного шигеллами Зонне, при меньших инфицирующих дозах — до 105 микробных тел.
Для шигелл Григорьева—Шиги минимальная инфицирующая доза может составлять всего 10 микробных тел, что объясняет возможность реализации при этом шигеллезе бытового пути инфицирования.
Минимальная инфицирующая доза для шигелл Флекснера — 180—200 микробных тел, поступление в организм такого количества шигелл с загрязненной водой (водный путь передачи) вполне реально.
Но существует возможность реализации и дополнительных путей передачи различных шигелл. Так, зарегистрированы «пищевые» вспышки шигеллеза Флекснера, «водные» вспышки шигеллеза Зонне. Во время пандемии шигеллеза Григорьева-Шиги в странах Центральной Америки, Юго-Восточной Азии и Центральной Африки преобладал не бытовой, а водный путь передачи. Мушиный фактор особую роль приобретает в распространении шигеллеза Григорьева—Шиги.
В промышленно развитых странах, в частности в США, вспышки шигеллеза встречаются в основном среди лиц, проживающих в условиях с низким уровнем санитарной культуры, находящихся в психиатрических и гериатрических клиниках, приютах для инвалидов и безработных, иногда — в детских дошкольных учреждениях. Все чаще сообщают о случаях распространения шигеллеза среди гомосексуалистов при анально-оральных контактах. Известны также случаи заражения шигеллезом сотрудников бактериологических лабораторий.
Групповые вспышки чаще вызываются шигеллами Зонне, возникают они в большинстве случаев в результате загрязнения пищевых продуктов работниками предприятий общественного питания, у которых заболевание протекает субклинически.
Возможность «здорового» носительства при шигеллезе в настоящее время подвергают сомнению. Случаи носительства шигелл рассматриваются как стертое и субклиническое течение болезни. У лиц с выраженным врожденным или приобретенным иммунодефицитом (ВИЧ, последствия лучевой болезни, постоянного недоедания и т.п.) выделение шигелл иногда продолжается несколько месяцев, у них же шигеллез может сопровождаться формированием впоследствии стойких нарушений функции пищеварительного тракта, которые часто фигурируют под диагнозом «хроническая дизентерия», хотя шигеллы и не обнаруживаются. У нелеченых больных выделение шигелл с фекалиями продолжается 1—4 нед, но иногда может затягиваться до 5—б нед и более.
При шигеллезе Зонне формируется «феномен айсберга»: число диагностированных случаев заболевания значительно меньше, чем число зараженных, что объясняется преобладанием при этом шигеллезе легких и стертых форм, а также тем, что больные к врачам не обращаются. Эксперты ВОЗ считают, что такие скрытые источники инфекции могут приобретать особое значение в эпидемиологическом процессе в развивающихся странах.
К шигеллезу отмечена высокая восприимчивость представителей всех возрастных групп, однако особенно часто и тяжело болеют дети в возрасте от б мес до 2 лет. Тяжелее болеют люди, страдающие хроническими заболеваниями органов пищеварения, особенно с выраженной секреторной недостаточностью желудка, кишечника, дисбактерио-зами. Повышают восприимчивость к шигеллезу голодание, гиповитаминоз. Именно у таких лиц описана так называемая хроническая дизентерия.
Для шигеллеза характерна та же сезонность, что и для большинства других кишечных инфекций. Наибольшее число заболеваний в нашей стране регистрируют в июле — сентябре (примерно половина всей заболеваемости за год). Вспышки шигеллеза Зонне, связанные с инфицированием пищевых продуктов, могут возникать и в холодное время года.
После перенесенного шигеллеза формируется непродолжительный видо- и типоспецифический иммунитет.
Классификация. Как и при многих других заболеваниях, классификация шигеллеза не унифицирована. Многообразие предложенных вариантов отражает и отсутствие единой позиции, касающейся патогенеза шигеллезов.
С учетом рекомендаций ВОЗ (1981) мы считаем наиболее приемлемой для практической работы следующую классификацию. По длительности течения шигеллез бывает:
острым (до 2 мес),
затяжным (более 2 мес).
«Хроническая дизентерия (шигеллез)» признается не всеми. Далеко не во всех случаях при длительном течении болезни можно исключить возможность повторного заражения, а вот дисбактериоз с последующим нарушением функции кишечника нередок. Мы полагаем, что термин «постдизентерийный колит» более точно отражает суть процесса, развивающегося у некоторых лиц, перенесших такую самолимитирующуюся инфекцию, как шигеллез.
По характеру течения различают:
гастроэнтероколитическую,
энтероколитическую,
колитическую формы заболеваний.
По тяжести заболевания выделяют течение:
субклиническое (носительство);
стертое (очень легкое),
легкое,
среднетяжелое,
тяжелое,
очень тяжелое.
Критерии тяжести — степень токсикоза (до ИТШ), или степень обезвоживания (I—IV, до гиповолемического шока), или наличие осложнений (кровотечение, перфорация и др.).
Очень расплывчат термин «транзиторное носительство», поскольку провести грань между этим состоянием и субклиническим течением болезни практически невозможно, как невозможно установить в этом случае и длительность пребывания возбудителя в организме человека (нет надежной точки отсчета времени).
Примерная формулировка диагноза. В диагнозе помимо длительности, клинической формы и тяжести течения болезни следует отражать наличие и характер осложнений, тип возбудителя, вызвавшего заболевание. Если возбудитель выделить не удается, правомочен диагноз «шигеллез (клинически)».
1. Острый шигеллез Зонне, колитическая форма, легкое течение.
Острый шигеллез Флекснера, энтероколитическая форма, тяжелое течение. Осложнение: кишечное кровотечение.
Острый шигеллез (клинически), колитическая форма, среднетяжелое течение.
Патогенез. Существовал и существует ряд теорий патогенеза шигеллеза: бактериемическая (Семерау), токсическая (Шига—Бауэр), аллергическая (А.А.Колтыпин, В.О.Мохнач), нейрорефлекторных поражений (Н.С.Четвериков, М.Балш и др.), внутриклеточного паразитирова-ния шигелл (М.В.Войно-Ясенецкий, В.И.Бухаташвили), инфекционно-иммуногенетическая (А.Ф.Блюгер, Х.М.Векслер) и др. В.И.Покровский и соавторы (1994) считают, что все факторы, названные авторами отдельных теорий, имеют место и играют определенную роль в патогенезе различных форм шигеллеза.
Очевидно, что особенности патогенеза шигеллеза в каждом конкретном случае зависят от биологических свойств возбудителей, факторов передачи инфекции, исходного состояния и реакции макроорганизма.
Известно, что шигеллез возникает только тогда, когда заражение шигеллами происходит через рот. Попытки воспроизвести заболевание при заражении другими путями, даже через фистулу в кишечнике, не увенчались успехом. Возможность развития болезни при одной и той же инфицирующей дозе у разных лиц различна, она в значительной мере определяется исходным состоянием их естественных защитных барьеров (химических, механических, биологических). Химические барьеры — соляная кислота желудка, желчь, панкреатические ферменты и др. Функцию механического барьера выполняют перистальтика, угнетение которой способствует внедрению шигелл, целостность кишечного эпителия, нарушение которого при хронических воспалительных процессах, голодании, лучевой болезни ведет к уменьшению дозы, способной вызвать заболевание. Среди биологических факторов важная роль принадлежит нормальной кишечной микрофлоре, которая, конкурируя с шигеллами, выделяет вещества, подавляющие рост шигелл. Большое значение имеют факторы естественной резистентности — лизоцим и бета-лизины копрофильтратов и слизистой оболочки дистального отдела толстой кишки, секреторные IgA, гуморальные факторы.
В фазе внедрения возбудителя происходит проникновение шигелл (иногда уже вместе с эндо- и экзотоксинами в случаях, протекающих по типу ПТИ) в желудок и верхние отделы кишечника. Часть из них гибнет в верхнем отделе пищеварительного тракта под действием соляной кислоты, желчи, пищеварительных ферментов. При нормальной и тем более повышенной кислотности желудочного сока, да еще и при замедленном пассаже инфицированной пищи, поступающей в желудок небольшими порциями, создаются крайне неблагоприятные условия для выживания шигелл. Уже через 10—15 мин они погибают. Вот почему соблюдение правил — не спешить во время еды, хорошо пережевывать пищу и не запивать ее водой — уменьшает и вероятность проникновения в кишечник таких патогенных микробов, как шигеллы.
Таким образом, возбудители могут быть полностью уничтожены еще в желудке. В этом случае (при малой их дозе) либо никакие патологические симптомы не развиваются, либо (при большой дозе возбудителя) за счет общего и местного действия экзо- и эндотоксина возникнут кратковременные клинические проявления, напоминающие ПТИ, а инфекционный процесс закончится без кишечной фазы.
Но обычно гибнет только часть микробов. Освобождающийся при этом эндотоксин оказывает местное раздражающее действие на слизистую оболочку желудка и, всасываясь в кровь, вызывает общетоксические явления различной интенсивности, которые особенно усиливаются при совместном действии экзо- и эндотоксина. Особенностью действия токсина шигелл является повышение проницаемости сосудов, сенсибилизирующее и токсическое воздействие на слизистую оболочку толстой кишки, которая как бы «подготавливается» к встрече с возбудителем. Вероятно, такая «подготовка» толстой кишки играет немаловажную роль в патогенезе заболевания, поэтому и вызвать заболевание, вводя шигеллы per rectum в эксперименте, не удается.
Оставшиеся в живых шигеллы попадают в тонкую кишку, где могут задерживаться от нескольких часов до нескольких суток и, как полагают, могут даже накапливаться. Однако существенного повреждения тонкой кишки они, как правило, не вызывают. Связано это с различными факторами. Во-первых, в тонкой кишке энтероциты защищены от инвазии панкреатическими ферментами, которые инактивируют шигелл, временно удаляя с их наружных мембран белки, способствующие проникновению шигелл в энтероциты. Кроме того, на энтероци-тах отсутствуют специфические рецепторы адгезии шигелл. Даже если возникает местная воспалительная реакция, она быстро купируется благодаря комплексу защитных реакций с участием лейкоцитов, интерферона, секреторных IgA и других факторов. Однако, если токсин поступает в тонкую кишку в большом количестве, то действие его на мембраны энтероцитов вызывает активацию простагландинов определенных классов, следствием чего является увеличение внутриклеточного содержания цАМФ и активный транспорт воды и электролитов в просвет кишечника. Развивается выраженный диарейный синдром, подобный таковому при ПТИ и сальмонеллезе.
При шигеллезе основной патологический процесс разыгрывается в толстой кишке. Пусковым механизмом является адгезия шигелл на поверхности сенсибилизированных энтероцитов. У шигелл имеются специфические белки наружной мембраны, которые, взаимодействуя с рецепторами плазмолеммы энтероцитов, способствуют внедрению микроорганизма в клетку. Шигеллы способны даже размножаться внутри пораженных клеток, разрушая их. Разбухание, некроз, отторжение ворсинок кишечника сопровождаются местной воспалительной реакцией, тем сильнее выраженной, чем большей вирулентностью и инва-зивностью обладает возбудитель. Этот местный воспалительный процесс усугубляется действием эндотоксина и биологически активных веществ живых возбудителей, а также различных медиаторов воспаления. Зона повреждения распространяется вглубь, захватывая все новые слои клеток, она может доходить до мышечного слоя и даже (при особо тяжелых формах) повреждать его. Все это приводит к образованию язв (поверхностных или глубоких) и даже их перфорации.
Важную роль в развитии патологического процесса играет повреждение вегетативной иннервации толстой кишки, что сопровождается нарушением ее трофики, микроциркуляции во всех оболочках кишки, процессов регенерации, перистальтики. Возникает своеобразное спастическое состояние толстой кишки, проявляющееся «кровавым запором». Полагают, что в разгар болезни ведущим фактором в патогенезе повреждений толстой кишки является поражение нервно-сосудистых образований толстой кишки токсином, а не непосредственное действие возбудителя. Кроме того, определенная роль принадлежит патологическим импульсам, поступающим из ЦНС, где создаются патологические очаги возбуждения вследствие проникновения туда токсина. В этот период также происходит угнетение токсинами синтеза пищеварительных ферментов, особенно протеолитических. А ведь эти ферменты способны, воздействуя на шигеллы, уменьшать их инвазивные свойства.
Морфологические изменения выявляются главным образом в слизистой оболочке толстой кишки, характер их определяется свойствами возбудителя, тяжестью и длительностью течения патологического процесса.
В начальный период болезни чаще обнаруживают дистрофию поверхностного эпителия, реактивную инфильтрацию его лимфоцитами и нейтрофилами, отек.
В разгар болезни выявляют утолщение кишечной стенки, отек, диффузную гиперемию, эрозии и язвы (поверхностные и/или глубокие), инфильтрацию лейкоцитами. В сосудах могут возникать сосудистые тромбы. Экссудат, содержащийся в язвах, содержит нейтрофилы и продукты их распада, иногда — примесь фибрина.
При шигеллезе возникают нарушения практически во всех органах и тканях, обусловленные как действием самого токсина, так и метаболическими и циркуляторными расстройствами, нарушением нервной регуляции.
При этом происходит нарушение кислотообразующей, секреторной и эвакуаторной функций желудка. Клинически это проявляется чувством тяжести и боли в эпигастрии, иногда — тошнотой, рвотой. У подавляющего числа больных рвота возникает в том случае, если фактором передачи является продукт со значительным содержанием токсина, оказывающего на желудок раздражающее действие.
В тонкой кишке наступают снижение ферментативной активности, отек слизистой оболочки, нарушение всасывания, усиление моторики. У больного может появиться обильный стул, обезвоживание.
Толстая кишка — основное место локализации патологического процесса. Грубые нарушения целости слизистой оболочки толстой кишки сопровождаются нарушением всасывания воды и электролитов, спазмом, дискинезией, развитием в дальнейшем дисбактериоза и дефицита витаминов. Клиническими признаками этих процессов являются схваткообразная боль внизу живота, преимущественно в левой подвздошной области, своеобразный стул (скудный с примесью крови, слизи).
Действие на поджелудочную железу проявляется снижением ее внешнесекреторной функции, что сопровождается нарушением пищеварения. Повреждение инкреторного аппарата приводит сначала к ги-пер-, а затем — к гипогликемии.
Происходит угнетение функциональной активности печени, нарушение концентрационной способности желчного пузыря, возникает дискинезия желчевыводящих путей.
В результате действия на надпочечники период кратковременной стимуляции симпатико-адреналовой системы сменяется угнетением, нарушается нервно-сосудистая регуляция, снижается тонус сосудов. Возникающие нарушения микроциркуляции коррелируют с тяжестью течения заболевания, они усугубляются нарушением сократительной способности миокарда.
Основным результатом действия токсина на нервную систему является дискоординация вегетативной нервной системы с преобладанием тонуса парасимпатической ее части. При этом, несмотря на низкое АД, у больного может появляться брадикардия.
При поражении гломерулярных мембран почек появляется незначительная или умеренная альбуминурия, но если возникает ОПН, она имеет преренальную природу (низкое АД).
В фазе обратного развития патологического процесса происходит нарастание синтеза секреторных IgA, которые препятствуют адгезии шигелл на эпителиальных клетках, проникновению их в клетки, принимают участие в предупреждении иммунологических повреждений кишки. Имеются сведения о том, что лимфоциты, выделенные из эпителия кишечника, имеющие рецепторы к специфическим секреторным IgA, приобретают способность угнетать рост шигелл. В этой фазе наступает также активация естественных киллеров и продукции ин-терферонов. Угнетенная в разгар болезни фагоцитарная активность лейкоцитов в этой фазе постепенно восстанавливается.
Отмечаются изменения факторов гуморального иммунитета. В сыворотке крови появляются специфические IgG (на 2-й неделе), а на 3—4-й неделе они уже преобладают над специфическими IgM, обнаруживаемыми в начальный период болезни.
При формировании затяжного шигеллеза отмечены стойкое снижение уровня Т- и В-лимфоцитов, диспропорции соотношения иммуноре-гуляторов (снижение содержания Т-хелперов и абсолютное или относительное увеличение числа Т-супрессоров), резкое усиление сенсибилизации к антигенам толстой кишки.
Процессы регенерации слизистой оболочки толстой кишки начинаются с первых дней болезни (таким образом, процессы восстановления и повреждения идут параллельно, но на начальных этапах последние явно преобладают). При катаральных формах повреждения (при этом в разгар болезни обнаруживают отек и гиперемию слизистой оболочки, что характерно для легкого течения) регенерация заканчивается к концу 2-й — началу 3-й недели болезни. При катарально-геморрагической и катарально-эрозивной формах эрозии и кровоизлияния исчезают обычно в те же сроки, но признаки воспаления и сосудистые расстройства могут определяться до конца 4—6-й и даже 8-й недели. При тяжелом язвенном поражении процесс регенерации затягивается иногда на несколько месяцев — очень медленно происходят эпителизация, грануляция язв, восстановление микроциркуляции. Долго сохраняются дистрофические изменения в ганглиозных клетках нервного аппарата кишечника.
Важное место в патогенезе шигеллеза занимает развивающийся или усиливающийся в острый период болезни дисбактериоз кишечника. Микробные ассоциации, образующиеся при дисбактериозе, могут обладать высокой токсигенностью. Они способны снижать эффективность применяемых для лечения дизентерии антибактериальных препаратов, так как могут передавать шигеллам свои плазмиды, детерминирующие устойчивость к тем или иным антибиотикам. Образующиеся микробные ассоциации могут существенно снижать местный иммунитет. Особого внимания заслуживает тот факт, что нарушение микрофлоры кишечника при шигеллезе носит характер общего дисбиоцено-за, а не ограничивается нарушением микрофлоры только толстой кишки.
Течение шигеллеза в значительной мере определяется свойствами возбудителя. Наиболее тяжело протекает шигеллез Григорьева—Шиги, для которого характерны выраженный токсикоз, обусловленный наличием и действием как эндо-, так и экзотоксина, бактериемия, усугубляющая токсикоз, тяжелые повреждения толстой кишки с развитием язвенно-некротического и язвенно-дифтеритического процесса.
Наиболее легко протекает обычно шигеллез Зонне, при котором чаще развивается катаральный или (реже) катарально-эрозивный прок-тосигмоидит.
Шигеллез Флекснера по тяжести занимает промежуточное положение между шигеллезом Григорьева — Шиги и Зонне. У больных может развиваться не только катаральный, но и катарально-геморрагический или язвенный колит.
При шигеллезе может также обнаруживаться поражение слизистой оболочки желудка (от катарального до эрозивного), тонкой кишки (обычно в форме катарального энтерита).
В значительной мере патогенез заболевания, вызванного одним и тем же возбудителем, определяется инфицирующей дозой: при малой дозе возбудителя заболевание проявляется преимущественно общеинтоксикационным и колитическим синдромами, при большой — более тяжелыми клиническими синдромами, вплоть до ИТШ и гиповолемиче-ского шока.
Основные этапы патогенеза развития заболевания при различной инфицирующей дозе схематически представлены на рис. 21 и 22.
Перенесенный шигеллез оставляет после себя кратковременный постинфекционный иммунитет на срок от нескольких месяцев до 1,5 года — 2 лет. Кроме того, формируется специфическая местная сенсибилизация (ГЗТ). При шигеллезе сенсибилизация может быть обусловлена не только шигеллезными антигенами, но также антигенами других микроорганизмов, обитающих в кишечнике, и аутоантигенами. Все эти факторы играют неблагоприятную роль при повторных заражениях шигеллами или другими энтеробактериями.
Клиника. Инкубационный период при остром шигеллезе составляет в среднем 2—3 дня, но может колебаться от 3—12 ч до 7—10 дней. Длительность инкубационного периода зависит от инфицирующей дозы возбудителя, условий инфицирования (поступление в организм только загрязненного продукта или такого, где произошло накопление возбу-
Внедрение шигелл
Разрушение части шигелл в
