
- •Болезни в трех томах
- •Общая часть
- •8 Список сокращений
- •Основные сведения об инфекционных болезнях
- •Классификация инфекционных болезней
- •2 Ж. Возианова
- •Принципы лечения инфекционных болезней
- •Характер взаимодействия с микро-и макроорганизмом
- •Возможные побочные реакции
- •II. Аминогли-козиды
- •III. Тетрацик-лины
- •Специфическая профилактика инфекционных болезней
- •Заболевания преимущественно с воздушно-капельным механизмом передачи
- •1Ейраминидаза
- •Действие на факторы клеточного и гуморального иммунитета
- •Формирование антитоксического иммунитетаСтимуляция местных факторов защиты, в том числе завершенного фагоцитоза
- •Функциональные нарушения
- •Механизмов защиты
- •Внедрение микоплазм в слизистую оболочку дыхательных путей
- •Заболевания преимущественно с фекально-оральным механизмом передачи
- •Размножение сальмонелл в тонкой кишке
- •Вегетативная нс
- •Заболевания, вызываемые иерсиниями
- •Желудке (высвобождение эндотоксина при этом незначительное)
- •Непосредственное повреждающее действие шигелл на слизистую оболочку толстой кишки
- •Серогруппа 01 (холерные)
- •Всасывание фрагментов вибрионов в кровь Образование различных факторов агрессии
- •Выработка вибриоцидных антител
- •Структура и функции печени
- •Методы диагностики, использующиеся при обследовании больных вг, и их оценка
- •21 Ж. Возианова
- •Особенности лечения больных вирусным гепатитом с затяжным течением
- •Заболевания, вызываемые вирусами
- •Энтеровирусами Паралитические формы (полиомиелитоподобные заболевания)
- •Асептический серозный менингит
- •Энтеровирусный энцефалит
- •Синдром Гийена—Барре (полирадикулоневрит)
- •Острые респираторные заболевания («летний грипп»)
- •Лихорадка с экзантемой
- •Везикулярный стоматит с экзантемой (ящуроподобный синдром)
- •Герпетическая ангина (герпангина)
- •Эпидемический конъюнктивит
- •Энтеровирусная диарея (летние гастроэнтериты)
- •Энтеровирусный гепатит
- •Эпидемическая миалгия (плевродиния, борнхольмская болезнь)
- •Энтеровирусная инфекция у новорожденных
- •Бессимптомная инфекция
- •Лечение нематодозов
- •Лечение цестодозов
- •Протозойные заболевания
- •1Нфекц1йн1 I паразитарн1 хвороби
Методы диагностики, использующиеся при обследовании больных вг, и их оценка
Объем исследований и оценка лабораторных показателей, которые изучаются при ВГ, будут более понятными, если их рассматривать в тесной связи с разделом «Структура и функции печени». Привести их здесь тем более целесообразно, что при описании отдельных клинических форм ВГ будут даваться постоянно ссылки на отдельные лабораторные тесты, их динамику. Изменения приведенных здесь биохимических показателей практически однотипны при всех ВГ, если же имеются какие-либо различия, они отражены в соответствующих разделах (ВГ различной этиологии).
/. Общеклинические методы исследования. Общий анализ крови в острый период характеризуется нормальным количеством эритроцитов, умеренной лейкопенией, лимфомоноцитозом. Возможен на этом фоне небольшой сдвиг формулы крови влево, свидетельствующий об остроте процесса. СОЭ нормальная или замедленная в результате нарушения соотношения белков.
При начинающейся печеночной энцефалопатии возможны лейкоцитоз, сдвиг формулы крови влево, увеличенная СОЭ. Нередко такие изменения сочетаются с подъемом температуры до 38—39 °С, что неопытным инфекционистом принимается за банальный воспалительный процесс и влечет за собой неадекватную терапию. Такие изменения, выявленные при исследовании крови, следует оценивать с учетом клинических данных (обращается внимание на поведение больного, консистенцию печени) и динамики биохимических тестов.
При затяжных формах, холестазе возможна умеренная анемия за счет повышенного распада эритроцитов. Но бывает быстро прогрессирующая анемия и вследствие аплазии костного мозга, сочетается она со значительным ухудшением общего состояния и не сопровождается повышением уровня как прямого, так и непрямого билирубина.
Анализ мочи. Еще в преджелтушный период можно обнаружить повышение в моче уровня желчных пигментов и уробилина (продукта превращения билирубина, попавшего с желчью в кишечник), которые, частично всасываясь в кишечнике и поступая в кровь, не захватываются пораженной печенью. При развитии желтухи, особенно при полном холестазе, моча становится темной за счет растворимого прямого билирубина, поступающего непосредственно в кровь, а уробилин исчезает, так как на высоте желтухи в кишечник желчь не поступает. В моче уровень белка остается нормальным, могут появиться единичные измененные эритроциты. Повышение уровня белка в сочетании с повышенным содержанием креатинина в крови может свидетельствовать о нефротическом компоненте как иммунокомплексном осложнении ВГ. Лейкоцитурия не характерна ни при какой форме ВГ. Увеличиваться количество эритроцитов вплоть до умеренной гематурии может при развитии тяжелого геморрагического синдрома (ДВС-синдром).
Кал в разгар болезни приобретает сероватую окраску за счет отсутствия в нем стеркобилина (отрицательная реакция на стеркобилин). При геморрагическом синдроме, наличии кровоточащей язвы, эрозивном гастрите может появиться кровь в кале, иногда по типу мелены. Поэтому врач должен сам осматривать кал: если на фоне постоянно темной мочи он приобретает темную окраску, это должно вызвать тревогу. В таком случае необходимы микроскопия кала, постановка реакции Грегерсена. Иногда диета больного сказывается на окраске стула: съеденная свекла может симулировать кровотечение.
2. Биохимические методы исследования. Огромное количество процессов, происходящих в печени, их нарушение у больных ВГ послужило причиной разработки множества биохимических тестов, позволяющих в комплексе оценивать степень и характер поражения печени. Обычно каждая большая клиника имеет свой набор тестов, однако существуют и универсальные, которые используются практически всеми, что очень важно при сопоставлении результатов, преемственности в лечении больного (оценка тяжести, эффективности лечения и пр.).
При оценке цитолитического синдрома обычно определяют активность ферментов АлАТ, АсАТ, ЛДГ, ГлДГ и др.
АлАТ (аланинаминотрансфераза) — цитоплазматический фермент, содержащийся в основном в гепатоцитах. Норма — 0,1—0,7 ммоль/ (ч • л) — при определении колориметрическим методом или 5—40 ЕД — при определении кинетическим методом. Повышение активности АлАТ в сыворотке крови свидетельствует о повреждении ге-патоцитов (повышении их проницаемости или цитолизе). При ВГ активность АлАТ начинает повышаться еще в конце инкубационного периода, достигая наиболее высоких показателей в преджелтушный период и в первые дни желтухи; затем она начинает постепенно снижаться даже на фоне продолжающегося подъема уровня билирубина. Активность АлАТ в острый период может в 50—100 раз превышать нормальные показатели, что является важным диагностическим и дифференциально-диагностическим критерием. Получение достоверного
результата зависит от метода, который применяли для определения активности этого фермента: при использовании кинетического метода можно сразу получить истинную степень повышения его активности, колориметрического — она будет резко занижена (несоответствие уровня ферментемии стандартному количеству реактива), что может послужить причиной серьезной диагностической ошибки. Чтобы ее избежать, необходимо перед постановкой реакции сыворотку больного развести в 10 раз (методика изложена в соответствующих руководствах по клинической ферментологии), при этом у больных ВГ активность АлАТ резко повышается. У больных с механической желтухой или желтухой другого генеза, но без цитолиза она остается прежней (как до разведения), незначительно повышается или даже снижается. Активность АлАТ может резко снижаться при тяжелом гепатонекрозе, что отражает тотальное глубокое поражение гепатоцитов. Такое несоответствие тяжести состояния больного и снижающейся активности фермента (при определении его в динамике!) является тревожным признаком, может служить предвестником развития печеночной комы.
АсАТ (аспартатаминотрансфераза) — фермент множественной локализации. Он содержится не только в гепатоцитах, но и в клетках других органов (сердце, поджелудочная железа, скелетные мышцы). В норме активность АсАТ составляет 0,1—0,45 ммоль/(ч«л) при колориметрическом методе или 10—25 ЕД при кинетическом. При ВГ его активность также значительно повышается, но в меньшей степени, чем активность АлАТ. Методы определения активности АсАТ те же, что и при исследовании АлАТ. Обычно соотношение АлАТ/АсАТ больше единицы. Чем тяжелее течение ВГ, тем меньше разница между уровнем активности этих ферментов. При тяжелом гепатонекрозе соотношение АлАТ/АсАТ становится меньше единицы.
При обычном циклическом течении ВГ активность этих ферментов к моменту исчезновения желтухи и выписки больного из стационара приближается к норме или незначительно (в 1,5—3 раза) превосходит ее. Затяжная гиперферментемия (более 3—6 мес) свидетельствует о незавершенности патологических процессов в печени и возможности перехода процесса в хронический.
ГлДГ (глутамилдегидрогеназа) относится к индикаторным ферментам. Наибольшая активность ее определяется в печени, где она содержится в митохондриях, что и определяет ее диагностическую ценность.
В норме активность ГлДГ в крови не определяется или не превышает 0,9 мкмоль/(ч• л). Повышение активности этого фермента наблюдают при тяжелом повреждении печеночных клеток, выраженном некрозе и является грозным прогностическим признаком. Однако то, что активность этого фермента резко (в 15—20 раз) повышается и при механической желтухе, значительно снижает ее диагностическую ценность: при ВГ ее значимость следует оценивать лишь в сочетании с активностью АлАТ.
ЛДГ (лактатдегидрогеназа) — фермент, катализирующий обратимую реакцию преобразования пировиноградной кислоты в молочную. Он содержится во многих органах — в печени, почках, сердце и др. Норма в сыворотке крови — до 7 ммоль/(ч«л). Активность фермента повышена при активном процессе в печени, но низкая специфичность фермента снижает его диагностическую ценность.
Значительно более ценным для диагностики острых ВГ и определения активности процесса является исследование уровня одной из фракций ЛДГ—ЛДГ5, которая содержится преимущественно в печени, в норме она составляет около 2 % от общей ЛДГ. Ее активность повышается уже в 1-й день болезни, сохраняется высокой в течение 1—2 нед, а затем постепенно снижается до нормы к 6—8-й неделе. При угрозе хронизации процесса активность ее остается стабильной многие недели. Активность фракции ЛДГ5 является четким индикатором состояния печени и может служить и показателем эффективности лечения.
Синтетическую способность печени характеризует прежде всего уровень общего белка (норма 65—85 г/л), в норме преобладает альбумин (35—50 г/л), соотношение альбумина к глобулинам (А/Г-коэффи-циент) — 1,2—1,5. Так как альбумин синтезируется в печени, а глобулины вырабатываются в костном мозге и лимфатических узлах, при ВГ возникают гипоальбуминемия и как ее следствие — гипопротеинемия, а А/Г-коэффициент при тяжелом течении составляет меньше 1. Чем тяжелее течение ВГ, тем ниже уровень общего белка и меньше соотношение А/Г. При начинающемся выздоровлении эти показатели постепенно выравниваются, а к моменту выписки больного из стационара у большинства из них они нормализуются.
Уровень протромбина, синтез которого происходит в печени, также снижается (в норме протромбиновый индекс составляет 80—100 %). Снижение его ниже 60 % предупреждает о возможности развития геморрагического синдрома.
При ВГ удлиняется протромбиновое время (норма 12—16 с), что указывает на неспособность печени синтезировать факторы свертывания крови и абсорбировать витамин К.
Фибриноген синтезируется в печени (норма 2—4 г/л). Его уровень при ВГ снижается.
Тимоловая проба отражает устойчивость глобулинов в плазме. Норма — до 4 ЕД. При уменьшении числа альбуминов устойчивость снижается. При ВГА тимоловая проба обычно повышена, при ВГВ, ВГО, ВГС имеет тенденцию к снижению.
Холестерин — один из продуктов липидного обмена, предшественник желчных кислот, стероидных гормонов и других метаболитов. Норма — 3,1—6,5 ммоль/л. Его уровень снижается при среднетяжелом и тяжелом течении ВГ. Это признак печеночно-клеточной недостаточности.^
Но повышение уровня холестерина может быть показателем внутри- и внепеченочного холестаза. Поэтому диагностическая и прогностическая ценность этого показателя увеличивается при исследовании в динамике с одновременным определением активности ферментов цитолиза и уровня экскреторных ферментов (прежде всего ЩФ). Ги-перхолестеринемия — косвенный показатель увеличения в крови количества желчных кислот.
Выделительную функцию печени можно оценивать прежде всего:
по уровню билирубина в крови. Билирубин образуется в процессе гемолиза эритроцитов и разрушения гемоглобина (свободный, или непрямой, билирубин). В комплексе с альбумином плазмы он захватывается гепатоцитами и, связываясь с глюкуроновыми кислотами, превращается в растворимый прямой (связанный) билирубин, который выделяется из организма с желчью. Норма — 8,5—20,5 мкмоль/л, преимущественно за счет непрямой фракции. При ВГ он повышается, иногда значительно (в 10—20 раз и более), главным образом за счет прямого (связанного) билирубина. Чем больше разница в соотношении прямого и непрямого билирубина, тем благоприятнее течение. Более быстрое нарастание количества непрямого билирубина по сравнению с прямым свидетельствует о тяжелом повреждении гепатоцитов, не успевающих связывать поступающий из крови непрямой билирубин и превращать его в прямой. Уровень билирубина не всегда коррелирует с тяжестью заболевания, особенно при холестазе. Но длительная ги-пербилирубинемия неблагоприятно сказывается на течении болезни, так как при этом усиливается токсическое действие билирубина (особенно непрямого) на ЦНС, увеличивается гемолиз эритроцитов. Снижение уровня билирубина в большинстве случаев является показателем начинающегося выздоровления. Как правило, к моменту выписки больного из стационара при циклическом течении болезни уровень билирубина нормализуется (нередко раньше, чем активность цитолити-ческих ферментов);
по динамике содержания уробилина и стеркобилина (см. выше);
по уровню ЩФ (щелочной фосфатазы) — фермента, катализирующего гидролиз органических фосфатных эфиров при оптимальной щелочной рН. Основное количество ЩФ выделяется с желчью, поэтому при нарушении оттока желчи уровень ее повышается. В норме в крови содержится ее не более 1—3 мкм/(ч«л.). При ВГ уровень ЩФ повышается незначительно, а при холестазе — в 10 раз и более. Это — основной фермент, позволяющий диагностировать холестаз и его тяжесть. Снижение уровня ЩФ при холестазе совпадает со снижением уровня билирубина и стиханием желтухи.
3. Инструментальные методы диагностики. Пункционная биопсия печени позволяет уточнить особенности изменений в печени (проводят гистологическое и электронно-микроскопическое исследование пунктатов), этиологию ВГ. Однако широкое распространение этот метод получил еще не повсеместно, прежде всего из-за определенных технических сложностей. Но в солидных клиниках пункционная биопсия является обязательной при обследовании больных с хронической патологией печени, так как лишь она позволяет с высокой степенью точности судить об активности и характере процесса в печени.
Весьма полезным в дифференциальной диагностике ВГ и надпечено-чных и постпеченочных желтух является УЗИ, особенно при исследовании в динамике. Оно позволяет оценить размеры и структуру не только печени, но и поджелудочной железы, желчевыводящих путей, определяя фон, на котором развивается ВГ.
Метод инфракрасной термографии позволяет выявить наличие скрытых воспалительных очагов в желчевыводящих путях и своевременно назначить соответствующее лечение.
От таких методов диагностики, как рентгеноскопия желудка и кишечника, панкреатография, дуоденальное зондирование, в острый период ВГ следует отказаться, тем более, что информативность их невелика, а опасность возникновения осложнений после процедур не исключена.
4. Специфические методы исследования. При ВГ в крови и других биологических жидкостях можно обнаруживать целые вирусные частицы или их фрагменты. Диагностическая и прогностическая значимость выявления маркеров вирусов гепатитов в различные периоды болезни при ВГ будет рассмотрена в соответствующих разделах, посвященных отдельным ВГ.
В диагностике и этиологической расшифровке ВГ особая роль принадлежит определению специфических антител различных классов. Сроки появления их, сероконверсия позволяют определять не только этиологию ВГ, но и прогнозировать возможную хронизацию.
Выявление аутоантител к печеночному липопротеиду позволяет судить о роли аутоиммунного компонента в патогенезе ВГ (с учетом титров антител, их динамики). При развитии хронического ВГ аутоантите-ла можно обнаружить и к другим органам (почки, селезенка, поджелудочная железа и т.д.).
В крови больных ВГ выявляют ИК (антиген вируса + антитела). Длительно циркулирующие ИК могут оказывать повреждающее действие не только на печень, но и на другие органы и ткани (так, в настоящее время ВГВ рассматривают как иммунокомплексное заболевание с полиорганными поражениями).
Безусловно, перечень приведенных в данном разделе диагностических методов и тестов является далеко не полным. Но очень важно, чтобы при всех исследованиях были четко отработаны и унифицированы методики, использовались одни и те же диагностические тест-системы. Тогда и минимальный объем исследований будет весьма информативным.
Классификация вирусных гепатитов сложна, громоздка, и, как многие другие, не универсальна. Вариантов течения ВГ множество, частота их возникновения при ВГ различной этиологии различается. Но тем не менее, все они укладываются в единую схему, которая еще раз подтверждает наличие в организме универсальных механизмов развития патологических процессов и выздоровления. Сходство вариантов течения и многих звеньев патогенеза при ВГ различной этиологии послужило основанием для того, чтобы объединить сведения о ВГ в одной главе, а не так, как следовало бы с учетом механизма передачи (ВГА, ВГЕ — в группе кишечных инфекций, ВГВ, ВГС, BTD — кровяных).
 Табл.
31 дает представление об основных
вариантах течения ВГ. Она позволяет
сопоставить сходства и различия в
течении и исходах ВГ.
Табл.
31 дает представление об основных
вариантах течения ВГ. Она позволяет
сопоставить сходства и различия в
течении и исходах ВГ.
Патогенез вирусных гепатитов (общие закономерности). При всех ВГ основной клеткой-мишенью является гепатоцит. Учитывая многообразие функций гепатоцитов, можно представить себе, насколько «разлаживается» работа всего нашего организма при повреждении печени, а попытки активно вмешаться в течение болезни назначением различных препаратов могут повлечь за собой цепь непредсказуемых реакций в самой печени и в организме в целом.
В норме печеночная клетка живет до 150 дней. Вирус, проникший в клетку, уменьшает ее жизнеспособность, но гибель клетки связана не столько с нарушением метаболических процессов в ней в результате непосредственного действия вируса, сколько с повреждающим действием цитотоксических Т-лимфоцитов и ИК. Степень нарушения метаболизма в человеческом организме зависит в значительной мере от степени повреждения гепатоцитов, их количества.
С повреждением гепатоцитов связано возникновение одного из наиболее ярких признаков ВГ — желтухи. Гепатоцит имеет два полюса — билиарный (прилежит к желчному канальцу) и синусоидальный (примыкает к кровеносному синусоиду). Через билиарный полюс в желчные капилляры выделяются желчные пигменты, желчные кислоты и другие компоненты желчи, через синусоидальный — продукты метаболизма в кровь, лимфу. В результате некроза клеток нарушается такое разделение функций, происходит смешение желчи, крови, лимфы, компоненты желчи поступают в кровь. Но если вспомнить многообразие деятельности печеночных клеток, можно говорить о тотальном дисбалансе ее функций.
Повреждение гепатоцитов приводит к выходу в кровь различных клеточных ферментов, наличие и уровень которых являются индикаторами повреждения гепатоцита, степени этого повреждения. Более того, общность системы кровоснабжения органов дигестивной системы, появление в кровяном русле биологически активных веществ приводят к закономерному нарушению функций всех органов этой системы. В результате возникают:
отек, гиперемия, мелкие кровоизлияния, а иногда и поверхностные эрозии в слизистой оболочке желудка и двенадцатиперстной кишки, нередко снижается кислотность, что обусловливает нарушение пищеварения;
отек слизистой оболочки желчного пузыря, нарушение процесса концентрации желчи, на этом фоне в дальнейшем возможно обострение хронического воспалительного процесса в желчном пузыре, когда туда перестает поступать желчь, обладающая антибактериальным свойством;
дисфункция кишечника вследствие нарушения поступления желчи, нарушение переваривания пищи; в более поздние сроки — кишечный дисбактериоз;
— закономерное нарушение функции поджелудочной железы, так как в результате отека ее развивается реактивный панкреатит, а накапливающиеся при этом трипсин, химотрипсин, эластаза, коллагеназа и другие ферменты усиливают повреждающее действие на гепатоцит, формируется дополнительный порочный круг.
Таким образом, подтверждается общее правило: при заболевании любого органа дигестивной системы не могут в той или иной степени в патологический процесс не вовлекаться органы той же системы, то есть формируется своеобразный «синдром коммунальной квартиры». Это должен учитывать каждый врач, курирующий больного ВГ, потому что степень взаимного влияния печени и других органов дигестивной системы при ВГ в значительной мере определяется преморбидным состоянием этих органов.
При ВГ иногда может возникнуть холестаз — нарушение оттока желчи из печени и появление различных ее компонентов в избыточном количестве в крови при относительно невысоком цитолитическом компоненте. Холестаз может быть внутрипеченочным и внепеченоч-ным (значительно реже). Внутрипеченочный холестаз формируется или на уровне гепатоцита (внутриклеточный) или на уровне желчных ходов (внеклеточный). Основой внутриклеточного холестаза является экскреторная недостаточность печеночных клеток, в результате чего нарушается экскреция желчи в желчные канальцы, происходит накопление желчных пигментов в гепатоцитах. Внеклеточный холестаз обусловлен повреждением желчеотводящей системы на любом уровне (чаще всего на уровне междольковых желчных протоков), портальные желчные протоки, однако, при этом остаются нормальными. Возникают желчные тромбы, что может стать причиной некроза гепатоцитов. Длительно существующий холестаз может привести к отложению ли-пидов в гепатоцитах, сужению желчных протоков. Клинически внутри-печеночный холестаз проявляется интенсивной желтухой с явным преобладанием прямого билирубина в крови, зудом кожи.
Внепеченочный холестаз при ВГ обусловлен сдавлением печеночного протока увеличенной головкой поджелудочной железы (при реактивном панкреатите) либо выраженной дискинезией желчевыводящих путей, отеком в области большого сосочка двенадцатиперстной кишки. Такой холестаз является наиболее частой причиной диагностических ошибок и направления больных в хирутический стационар.
Циркуляция вируса в крови, повреждение клеток печени, денатурация собственных белков вызывают защитные реакции организма (образование противовирусных антител, которые способствуют элиминации вируса и его выведению), но, вместе с тем, возникают и патологические реакции против собственных тканей, роль которых в развитии заболевания неоднозначна при ВГ различной этиологии и поэтому будет рассмотрена в соответствующих разделах. Сила иммунного ответа в значительной мере детерминирована генетическими факторами.
Наиболее тяжелые формы ВГ связаны с развитием печеночной недостаточности. Факторы, вызывающие глубокие поражения печени, различны. Главные из них:
массовая гибель печеночных клеток в результате непосредственного действия вируса, действия цитотоксических Т-лимфоцитов, ИК, развития аутоиммунных процессов;
изменение функций печени в результате нарушения соотношения электролитов в субклеточных структурах, проникновения внутрь клетки токсических веществ;
нарушение энергетического баланса клеток с повышением их проницаемости;
жестокая гипоксия печени в результате отека ее и затруднения поступления в нее крови.
Таким образом, в основе развития болезни лежит повреждение и гибель печеночных клеток, нарушение множественных их функций. Следствием этого является нарушение деятельности практически всех органов и систем, что в свою очередь усугубляет возникшие дисфункции.
Механизм возникновения многих клинических симптомов одинаков при ВГ различной этиологии, поэтому, чтобы не повторяться при раздельном изложении сведений о ВГ различной этиологии, соответствующие данные изложены в табл. 32.
Каждый из этих симптомов в определенный период болезни имеет диагностическое или прогностическое значение, но еще важнее наличие определенной совокупности их. Если строить диагноз, основываясь только на одном симптоме, можно допустить серьезные ошибки. Даже такой наиболее яркий признак, как желтуха, не является принадлежностью только ВГ.
Некоторые клинические особенности вирусных гепатитов. ВГ, несмотря на определенные различия в течении при различной этиологии, обусловленные особенностями патогенеза, имеют немало общих черт, о которых следует знать.
Субклиническая форма обычно выявляется случайно при диспансеризации, обследовании доноров и контактных по ВГ лиц. При этом жалобы у больного отсутствуют, желтухи нет. Но при внимательном обследовании выявляется гепатомегалия (реже — гепатоспленомегалия), при биохимическом исследовании крови — повышение активности ци-толитических ферментов. Диагноз можно подтвердить выявлением соответствующих маркеров (см. далее). Несмотря на легкость течения, субклиническая форма ВГВ, ВГС, BrD может приводить к хронизации.
Безжелтушная форма характеризуется отсутствием главного симптома ВГ — желтухи, тем более, что лишь повышение уровня билирубина более чем в 1,5 раза дает этот симптом. Для безжелтушной формы

|
Продолжение табл. 32 | |
|
1 |
2 |
|
Кожный зуд |
Высокий уровень в крови компонентов желчи, прежде всего желчных кислот (показатель холестаза) Аллергия |
|
Гиперемия кожи, в результате чего желтуха приобретает оранжевый оттенок |
Расширение кожных сосудов под действием биологически активных веществ |
|
Брадикардия |
Результат действия желчных кислот на n.vagus |
|
«Сосудистые звездочки» |
Накопление в коже вазоактивных веществ, местное действие на сосуды |
|
Геморрагии, кровотечения из десен |
Нарушение синтеза протромбина и других факторов свертываемости крови в печени |
|
Нарушение менструального цикла |
Нарушение метаболизма гормонов в печени, в том числе эстрогенов |
|
«Печеночный» запах изо рта |
Нарушение обмена аминокислот и ароматических соединений |
|
Отеки, асцит |
Нарушение функции печени, почек Накопление альдостерона |
характерно наличие большинства клинических проявлений ВГ: асте-новегетативного синдрома, диспепсического (отсутствие аппетита, тяжесть в подреберье, тошнота), увеличение печени. Такие больные чаще обращаются к терапевту (гастроэнтерологу), который диагностирует, как правило, гастрит, холецистит. Однако при внимательном осмотре у таких больных можно выявить кроме увеличения печени и увеличенную селезенку, а при исследовании крови — повышение активности печеночных ферментов, свидетельствующее о цитолизе. В моче обнаруживают незначительное повышение уровня уробилина. Течение такой формы, как правило, легкое, длительность клинических проявлений — до 1—5 нед, но нормализация уровня ферментов наступает несколько позже. Однако при нерациональном или излишне активном лечении (слепые зондирования, желчегонные травы, глюкокортико-стероиды, физметоды и т.д.) процесс может затягиваться.
Наиболее типичной является желтушная циклическая форма течения ВГ, при которой отчетливо можно выделить основные периоды болезни: инкубационный, преджелтушный, желтушный, реконвалесценции.
В табл. 33 представлены соотношения по времени основных периодов болезни, характерных для ВГ различной этиологии при циклическом течении заболевания.
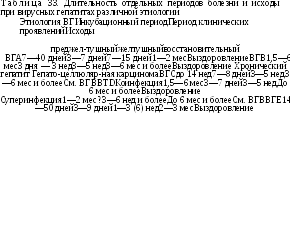 Длительность
инкубационного периода определяется
этиологией ВГ, заражающей дозой и
реактивностью организма.
Длительность
инкубационного периода определяется
этиологией ВГ, заражающей дозой и
реактивностью организма.
Преджелтушный период может протекать в виде различных вариантов.
Астеновегетативный вариант характерен для всех видов гепатитов (А, В, С, D, Е). Проявляется он общим недомоганием, слабостью, снижением работоспособности, повышенной утомляемостью, иногда нарушением сна. Часто возникает отвращение к курению. Об астенове-гетативном варианте преджелтушного периода можно говорить, если он является ведущим или даже единственным.
Диспепсический (абдоминальный) вариант бывает при ВГ любой этиологии: исчезает аппетит, возникают отвращение к еде, чувство тяжести в надчревной области, иногда — вздутие кишечника, понос или запор.
Артралгический вариант характерен преимущественно для ВГВ, ВГС, BTD. Появляется боль в суставах, обычно в крупных, без изменения их конфигурации и цвета кожи над суставами, без повышения температуры тела.
4. Псевдогриппозный (гриппоподобный) вариант встречается при ВГА и ВГЕ, часто служит причиной диагностических ошибок. Ката- ральный симптом, как правило, отсутствует, поэтому термин «псевдо- гриппозный» более приемлем. Внезапно повышается температура тела, возникают головная боль, ломота во всем теле, может выявляться гипе- ремия кожи. Длительность лихорадки не более 2—3 дней, желтуха воз- никает чаще спустя 1—2 дня после нормализации температуры тела.
Аллергический (один из наиболее редких вариантов) характеризуется появлением уртикарных высыпаний, сопровождающихся кожным зудом, повышением температуры. Чаще наблюдается при ВГВ, ВГС, BrD, а при отягощенном аллергологическом анамнезе может сопровождать ВГ любой этиологии.
В большинстве случаев встречается смешанный вариант преджел-тушного периода, когда сочетаются признаки двух-трех вариантов.
В желтушный период выделяют:
а) период нарастания клинических проявлений (желтухи, интокси- кации);
б) разгар болезни; переломный момент разгара — желчный криз (на высоте желтухи увеличивается количество мочи, она светлеет, а желту- ха с этого дня идет на убыль);
в) период стихания желтухи и клинических проявлений, он начина- ется за желчным кризом (иногда криз проходит незамеченным).
Желтуха появляется в то время, когда уровень билирубина в крови в 1,5 раза и более превышает норму. Больные сначала обращают внимание на изменение цвета мочи (она темнеет). При внимательном осмотре больного можно заметить и легкую иктеричность склер, уже на следующий день кожа нередко приобретает желтушный оттенок. В последующие дни интенсивность желтухи продолжает нарастать, при этом ее интенсивность не всегда коррелирует с тяжестью состояния больного, выраженностью интоксикационного синдрома.
Для желтушного периода в большинстве случаев наиболее характерны снижение аппетита, повышенная утомляемость. У всех больных увеличена печень. У большинства пальпируется селезенка. АД имеет наклонность к снижению, пульс — к брадикардии. Моча темная (тем темнее, чем выраженнее желтуха). Кал нередко светлее обычного (светло-желтого или сероватого цвета) или даже обесцвечен.
Нередко еще в преджелтушный период, а чаще в желтушный (в различные его фазы) в патологический процесс вовлекаются другие органы дигестивной системы, что, наслаиваясь на клинические проявления ВГ, приводит к появлению дополнительных симптомов, нередко существенно изменяющих клинику ВГ. Наиболее часто (в 70—80 % случаев) можно обнаружить признаки поражения поджелудочной железы. Об этом свидетельствуют появление боли над пупком или слева от него (в зависимости от того, какой участок поджелудочной железы поражен в большей степени), положительный симптом Воскресенского, а иногда (при увеличении головки железы) — нарушение оттока желчи, что может давать клинику внепеченочного холестаза и приводить к диагностическим ошибкам. У некоторых больных, особенно имеющих группу крови А(П), могут возникать язва двенадцатиперстной кишки с соответствующей клиникой, эрозивный гастрит, гастродуоденит. Дискине-зия желчевыводящих путей проявляется болью (нередко весьма интенсивной) в правом подреберье. Нарушение переваривания пищи приводит к вздутию кишечника и (или) послаблению стула.
Первыми признаками начинающейся реконвалесценции, помимо уменьшения явлений общей интоксикации и улучшения аппетита служат изменения окраски мочи (ночная моча еще темная, а днем и к вечеру она заметно светлеет), окрашивание кала (приобретает естественную окраску).
В фазе угасания желтухи постепенно исчезают клинические симптомы болезни, больные становятся активнее, появляется аппетит, желтуха постепенно исчезает, размеры печени нормализуются, уменьшается активность цитолитического процесса в печени, что подтверждается печеночными тестами.
Период реконвалесценции — время от момента начала клинического выздоровления до нормализации всех клинических и биохимических показателей. Длительность и особенности течения ВГ обычно определяются его этиологией, тяжестью заболевания, реактивностью организма.
Под влиянием самых различных факторов (нарушение диеты, стресс, нерациональное лечение, нарушение режима и т.д.) в желтушный период и период начинающейся реконвалесценции может наступить обострение болезни. Оно может проявляться только усилением цитолиза без клинических проявлений (определяется по биохимическим тестам) или усилением наряду с этим клинических проявлений (нарастают желтуха, интоксикация и т.д.).
О рецидиве можно говорить тогда, когда после выздоровления у больного наблюдается возврат болезни со всеми его клиническими проявлениями, что может свидетельствовать о сохранении возбудителя в организме. Для ВГА и ВГЕ рецидивы не характерны. Если все-таки вдруг возникнет такая ситуация, следует подумать о правильности первоначального диагноза или о возможности инфицирования другим вирусом.
В значительной степени клинические проявления ВГ определяются характером преобладающего патологического процесса в печени — цитолиза гепатоцитов или нарушения оттока желчи.
В большинстве случаев ВГ протекают с преобладанием цитолитического синдрома. Клинически это проявляется преобладанием синдрома интоксикации, обусловленного печеночной недостаточностью, над признаками, обусловленными нарушением оттока желчи. У таких больных даже на фоне высокого уровня билирубина отсутствует кожный зуд, кал может быть обесцвечен не полностью. При исследовании ферментов выявляют высокую активность цитолитических ферментов и незначительно (в 1,5—2,5 раза) повышенную активность экскреторных ферментов (ЩФ и др.).
В том случае, если возникает холестат и чески й синдром, клинически к умеренно выраженному интоксикационному синдрому добавляются признаки, свидетельствующие о нарушении оттока желчи: растет интенсивность желтухи, которая может не коррелировать с выраженностью интоксикации, появляется кожный зуд, который иногда бывает мучительным, при этом больные не могут спать, становятся раздражительными, беспокойными, на коже возникают расчесы. Моча у таких больных очень темная, кал нередко полностью обесцвечен. Высокая активность цитолитических ферментов в этих случаях сочетается со значительным повышением активности экскреторных ферментов, уровень билирубина резко (в 10 раз и более) повышается за счет прямого билирубина. В зависимости от степени повышения активности цитолитических или экскреторных ферментов можно говорить о ВГ с преобладанием цитолиза или ВГ с преобладанием холестаза.
Особым вариантом течения ВГ является холестатическая форма, при которой интоксикационный синдром, обусловленный цитолизом, практически отсутствует, активность ферментов цитолиза, значительно повышенная в первые дни болезни (важный дифференциально-диагностический признак!) быстро снижается, иногда приближаясь даже к норме в последующие дни. А вот активность экскреторных ферментов резко (в 10—15 раз) повышается. Желтуха бывает очень яркая (оранжевая), быстро нарастает и стойко держится, а при длительном холестазе приобретает сероватый оттенок. Ведущий симптом — сильнейший кожный зуд, который лишает больного покоя, на коже появляются множественные расчесы до крови. Холестаз может сохраняться длительно (1—2 мес и более). Это приводит к полному физическому и психическому истощению больного. В результате повышенного гемолиза эритроцитов под действием длительно циркулирующих желчных кислот в крови повышается уровень не только прямого, но и непрямого билирубина, выявляется умеренная анемия, постепенно нарастает интоксикация.
Критерии тяжести течения вирусных гепатитов. Печень обладает огромными компенсаторными возможностями, поэтому в разгар болезни не всегда наблюдается соответствие жалоб больного объективным данным, полученным при клиническом обследовании больного (размеры печени, выраженность цитолитического синдрома и др.). Поэтому при оценке тяжести состояния больного главным является его самочувствие, а не лабораторные показатели.
Особого внимания заслуживают такие жалобы больного:
нарастающая слабость;
головокружение;
чувство «проваливания»;
отвращение к еде;
упорная тошнота;
рвота повторная или рвота, возникающая даже при запахе пищи.
Выраженность этих клинических проявлений, длительность их, характер сочетаний имеют существенное значение для оценки тяжести процесса.
Из объективных данных должны насторожить:
мягковатая консистенция печени;
уменьшение ее размеров на фоне нарастающей желтухи;
геморрагический синдром (кровотечения из десен);
геморрагии на коже, носовые кровотечения;
нарушение поведения больного.
Каждый из этих признаков, даже если он определяется изолированно, требует самого пристального внимания.
О легком течении ВГ позволяют судить такие особенности: :— интоксикационный синдром выражен слабо;
тошнота, рвота отсутствуют;
печень эластична, безболезненна, умеренно увеличена;
пульс в норме, возможна незначительная брадикардия;
— желтуха незначительная или умеренная, кратковременная. Для среднетяжелого течения ВГ характерны:
выраженная интоксикация (упорная тошнота, но без рвоты, полное отсутствие аппетита, слабость);
выраженная желтуха;
неприятные ощущения в области печени при пальпации;
брадикардия, снижение АД.
Тяжелое течение ВГ характеризуется следующими клиническими проявлениями:
нарастающая интоксикация (резкая слабость, адинамия);
постоянная тошнота, повторная рвота;
консистенция печени мягковатая, она чувствительна при пальпации;
тахикардия сменяет брадикардию;
возможно появление геморрагии на коже, бывают носовые кровотечения;
иногда возникает «асептическая» лихорадка;
возможно изменение поведения больного (сонливость или бессонница, эйфория или адинамия).
Лабораторные показатели при оценке тяжести течения играют существенную роль, если они сделаны в динамике. О переходе заболевания в более тяжелую форму свидетельствуют:
— темпы роста в крови уровня непрямого билирубина больше, чем прямого (но при ВГ уровень прямого билирубина все же всегда преобладает!); уровень общего билирубина не всегда коррелирует с тяжестью заболевания;
снижение активности АлАТ и АсАТ на фоне нарастающей интоксикации и роста уровня билирубина;
уменьшение соотношения АлАТ/АсАТ;
снижение уровня общего белка; А/Г коэффициент < 1;
снижение уровня протромбина.
Наиболее прогностически неблагоприятны фульминантные формы ВГ (молниеносные, внезапно развивающиеся). Они возникают обычно в первые 2—4 нед (иногда позже — на 8-й неделе) с момента первых клинических проявлений болезни (отсюда и деление на раннюю и позднюю) и характеризуются быстрым нарастанием (в течение нескольких дней, иногда — часов) печеночной недостаточности и как ее следствия — печеночной энцефалопатии. Стадия печеночной энцефалопатии служит надежным критерием для оценки тяжести поражения печени.
Клинически различают четыре стадии ОПЭ.
I стадия (прекома, начальный период), для нее характерны:
изменение поведения больного (эмоциональная нестабильность);
сонливость днем, бессонница ночью;
«хлопающий тремор».
II стадия (прекома, заключительный период) быстро сменяет I ста- дию, если не была больному оказана помощь. Для нее характерны:
нарушение ориентации;
спутанность сознания;
психомоторное возбуждение.
III стадия (начальный период комы) характеризуется утратой конта- кта с больным при сохранении его реакции на болевые раздражители.
В ГУ стадии (глубокая кома) реакция на окружающее, даже на болевые раздражения, полностью отсутствует. При ОПЭ:
в спинномозговой жидкости повышается содержание аммиака, снижается уровень сахара, появляется билирубин;
на ЭЭГ регистрируется прогрессирующее замедление а-ритма, появление трехфазных дельта-зубцов.
Клинику печеночной недостаточности так описывал Гиппократ еще 2,5 тыс. лет назад: «Больной безумствует, сердится, говорит некстати, лает, как собака. Его ногти делаются красными, глаза не видят, волосы на голове стоят дыбом и острая лихорадка охватывает его».
Эти нарушения функции ЦНС сочетаются с другими проявлениями, свидетельствующими о тяжелом повреждении печени и нарушении ее функции:
— сначала при первых признаках ОПЭ отмечают небольшое уменьшение размеров печени, а затем ее столь значительное сокращение,
что при перкуссии над ее проекцией по срединно-ключичной линии в области нижних ребер определяется тимпанит («похоронный звон»);
появляются кровоизлияния на коже, возможны массивные носовые, желудочные кровотечения (развивается ДВС-синдром);
прогрессируют биохимические нарушения, характеризующие тяжелое течение ВГ;
у молодых людей в стадии энцефалопатии II—III стадии развивается чаще метаболический ацидоз, у пожилых — алкалоз (учитывать при назначении лечения!);
— возможно повышение температуры тела до 38 °С и выше.
При развитии ОПЭ III—IV стадии летальность достигает 90.
Исходы вирусных гепатитов. Течение ВГ непредсказуемо, и в процессе лечения больного и наблюдения за ним не всегда можно предугадать вероятность возникновения обострений, рецидивов, неблагоприятных исходов, определить заранее сроки пребывания больного в стационаре. Тезис «чем легче течение болезни, тем быстрее наступает выздоровление, реже возникают осложнения и неблагоприятные исходы» — далеко не всегда применим к ВГ (особенно ВГВ и ВГС).
Возможные исходы ВГ с учетом их этиологии представлены в табл. 34.
Таблица 34. Исходы вирусных гепатитов
|
Исход |
Этиология ВГ | ||||
|
ВГА |
ВГВ |
ВГС |
BrD |
ВГЕ | |
|
Полное выздоровление |
+ |
+ |
+ |
+ |
+ |
|
Смерть |
+ |
+ |
|
|
|
|
Носительство вируса |
— |
+ |
|
+ |
— |
|
Хронический гепатит |
— |
|
|
+ |
— |
|
Цирроз печени |
— |
+ |
+ |
+ |
— |
|
Рак печени (гепатоцеллюлярная карцинома) |
— |
+ |
+ |
+ |
— |
|
Хронические воспалительные заболевания дигестивной системы |
+ |
+ |
+ |
|
+ |
|
Хронические заболевания органов дигестивной системы (панкреатит, гастрит, язвенная болезнь и др.) |
+ |
+ |
+ |
|
+ |
|
Манифестация синдрома Жильбера |
+ |
+ |
+ |
+ |
+ |
Далее будут рассмотрены особенности течения ВГ разной этиологии.
вирусный гепатит а
Вирусный гепатит А, син. — инфекционный гепатит (лат. — hepatitis infectiosa, hepatitis А; англ. — infectious hepatitis, hepatitis A).
Термин «гепатит А» предложен Ф.О.Мак-Каллумом в 1947 г., вытеснив такие прежде принятые названия болезни, как «болезнь Боткина», «инфекционный гепатит» и др.
Этиология. Возбудитель ВГА относится к роду Enterovirus семейства Picomaviridae, но по мере изучения HAV выявляются все большие отличия его, связанные главным образом с начальным этапом репликации вируса. В отличие от других пикорнавирусов HAV имеет большое количество неспецифических рецепторов. Именно поэтому репликация вирусов может происходить не только в клетках печени, но и в эн-тероцитах, клетках желчевыводящих путей.
Как и другие вирусы, HAV способны образовывать вирусы-мутанты, обладающие слабой иммуногенностью. Свойства HAV, их вирулентность определяются комбинацией генов. HAV имеет размеры 25— 27 нм, форму многогранника. Его генетический материал — одноцепо-чечная РНК, находящаяся внутри белковой оболочки.
HAV представлен лишь одним серотипом, имеющим несколько штаммов. Эти штаммы отличаются по чувствительности к ним лабораторных животных (такой лабораторной моделью являются некоторые виды обезьян). Вирус удается культивировать в различных линиях эпителиальных клеток. Он достаточно устойчив к дезинфицирующим средствам (в частности, резистентность к хлору позволяет ему проникать в водопроводную воду через очистные сооружения), но вирус быстро инакти-вируется при кипячении. Может сохраняться несколько месяцев при + 4 "С, несколько лет — при —20 °С. Устойчив к действию кислот.
Эпидемиология. ВГА — типичный антропоноз с фекально-оральным механизмом передачи. Факторы передачи — чаще всего вода (в нашей стране описаны водные вспышки этого заболевания, охватывавшие сотни человек), в меньшей степени — инфицированные пищевые продукты, возможен бытовой путь заражения, так как вирус весьма устойчив во внешней среде, куда он выделяется с калом.
В испражнениях больного вирус в большом количестве появляется за 10—14 дней до начала желтухи (т.е. еще в инкубационный период) и обнаруживается в фекалиях еще не менее 2 нед на фоне желтушного периода. В это время больные наиболее заразны. С мочой вирус выделяется в незначительных количествах. Другие биологические жидкости вируса не содержат, хотя можно заразиться парентеральным путем — при переливании крови, взятой у донора в последние дни инкубационного периода (так как в это время вирус имеется и в крови такого донора). Инкубационный период в этом случае резко сокращается (до 7—10 дней), а течение заболевания может быть очень тяжелым. Трансплацентарный путь передачи не доказан.
В связи с высокой восприимчивостью к инфекции и повсеместным ее распространением наиболее уязвимы дети. В странах с низким состоянием санитарной культуры успевают переболеть практически все дети в возрасте до 5—7 лет и, учитывая стойкость иммунитета после перенесенного заболевания, взрослые практически не болеют. В Украине ВГА — преимущественно болезнь детей и лиц молодого возраста, хотя заболеть может практически каждый, не имеющий иммунитета. Группой риска являются путешественники, особенно приезжающие в регионы с низкой санитарной культурой, а также наркоманы и гомосексуалисты.
Для ВГА с учетом особенностей механизма и факторов передачи характерна сезонность — рост заболеваемости регистрируется в летнее и осеннее время.
Носительство HAV не доказано. Перенесенное заболевание оставляет пожизненный иммунитет. Однако в настоящее время это положение подвергается сомнению: получены данные о возможности повторных заболеваний ВГА, носительства и даже хронизации. Этот вопрос еще требует изучения и уточнения. Поэтому в дальнейшем будет излагаться пока традиционное отношение к проблеме ВГА.
Особенности патогенеза ВГА. ВГА относят к острым циклическим инфекциям, проходящим последовательно определенные фазы.
Первая фаза — внедрение, когда с пищей или водой возбудитель попадает в тонкую кишку.
Вторая фаза — энтеральная. При электронной микроскопии в энте-роцитах зараженного организма удалось обнаружить характерные структурные изменения. Полагают, что изменения в энтероцитах обусловлены как действием Т-лимфоцитов (реакция на внедрившийся вирус), так и вирусом.
Третья фаза — регионарный лимфаденит. Есть данные, свидетельствующие о том, что в энтероцитах и клетках лимфатических узлов идет первичное накопление вируса.
Четвертая фаза — первичная генерализация. В крови возбудитель можно обнаружить за 1—2 нед до появления клинических симптомов и в течение первой недели болезни.
Таким образом, первые три фазы и часть четвертой соответствуют инкубационному периоду. Наиболее выраженная вирусемия совпадает с началом клинических проявлений (лихорадка, интоксикационный синдром). В это же время уже активно идет следующая фаза.
Пятая фаза — гепатогенная. Вирус из крови попадает на печеночную клетку, связывается с ее рецепторами, а затем проникает в цитоплазму клетки, где активно размножается. Новые вирусы выходят из клетки в желчные канальцы и в кровь, их выход сопровождается разрушением печеночной клетки. О механизме разрушения печеночной клетки при ВГА существует две точки зрения:
а) размножение вируса приводит к гибели клетки (то есть вирус оказывает прямое цитопатическое действие на клетку) в результате на- рушения метаболических процессов в гепатоцитах;
б) при размножении вируса в гепатоцитах возникает местная за- щитная реакция с накоплением Т-лимфоцитов и интерферона. Инфи- цированная клетка становится мишенью для цитотоксических Т-лим- фоцитов и в результате их действия погибает (то есть имеет место опо- средованный цитотоксический эффект). Первым звеном защиты при этом являются мононуклеары, которые вступают в действие букваль- но с первых часов болезни, блокируя рецепторы чувствительных кле- ток. В настоящее время вторая теория (иммунная гибель гепатоцитов) приобретает все больше сторонников. В зоне внедрения и размноже- ния HAV развивается значительная клеточная инфильтрация с зонами некроза (фокальный, пятнистый или зональный). В отдельных случаях возможно даже разрушение пограничной пластинки, формируются яв- ления холестаза. Степень и характер изменений в значительной степе- ни зависят от генетических особенностей инфицированного человека.
При ВГА в крови появляются специфические противовирусные антитела класса IgM (уже в фазе первичной генерализации), которые способствуют постепенному очищению организма от вируса. Такие IgM можно обнаруживать в крови при остром ВГА до 3 мес, при затяжных формах — до 6 мес от начала болезни.
Поддерживает высокий уровень анти- HAV IgM поступление вируса в кровь в результате цитолиза клеток (вторичная вирусемия). Одновременно идет нарастание в крови анти-HAV IgG, высокий уровень которых защищает от повторного заражения. Достоверных сведений о повторном заболевании ВГА нет, однако не исключают, что при низком уровне IgG это возможно.
В крови при ВГА также можно выявить лимфоциты, сенсибилизированные к тканям печени человека, что позволяет думать о возможном их участии в развитии затяжных форм и аутоиммунных процессов в печени.
Тяжелее ВГА протекает у девочек-подростков в фолликулиновую фазу менструального цикла и беременных. Это связано с особенностями гормональной деятельности.
Клиника. Наиболее частым вариантом преджелтушного периода является псевдогриппозный. Острое начало, лихорадка (температура может повышаться до 38 °С и более), общеинтоксикационный синдром (слабость, ломота в теле, головная боль) нередко служат причиной диагностических ошибок. Чаще всего, несмотря на отсутствие катаральных явлений, врач ставит диагноз «ОРВИ» такому больному. Отсутствие аппетита, чувство тяжести в надчревной области, тошнота могут проявиться уже в первые дни преджелтушного периода, но иногда запаздывают.
Длительность преджелтушного периода составляет чаще 3—6 дней, высокая температура может держаться 1—4 дня, затем снижается критически. Более длительная, чем 3 дня, лихорадка заставляет врача подумать о дополнительной причине (обострение хронических воспалительных заболеваний, микст-инфекция, аллергия и др.). Увеличение печени можно обнаружить с первых дней преджелтушного периода: обычно она умеренно увеличена, эластична, безболезненна при пальпации. Селезенку в преджелтушный период пальпировать почти никогда не удается.
Нередко желтуха проявляется сразу после снижения температуры, но возможны 2—3 безлихорадочных дня до ее появления. Именно в эти дни (последние дни преджелтушного периода) наиболее отчетливо выявляются клинические симптомы, свидетельствующие о нарушении функции печени — отсутствие аппетита, тяжесть в надчревной области, иногда — тошнота. При легком и даже среднетяжелом течении болезни выраженность общетоксических симптомов с момента появления желтухи уменьшается и, таким образом, отсутствует корреляция между нарастающей желтухой и степенью интоксикации.
Более редким вариантом преджелтушного периода является диспепсический, не сопровождающийся лихорадкой.
ВГА проходит все фазы, характерные для других ВГ, но течение его обычно более доброкачественное, тяжелое течение бывает редко, хотя возможны даже фульминантные формы ВГА. Длительность заболевания — чаще 2—3 нед. Соотношение безжелтушных и желтушных форм 3:1.
При ВГА возможны обострения болезни. В этих случаях в период реконвалесценции активность АлАТ и АсАТ не достигает нормы, а спустя 1—2,5 мес после нормализации уровня билирубина и общего состояния снова значительно повышается активность ферментов цитолиза, уровень билирубина, в кале появляется HAV. Клиника напоминает первую волну болезни. Иногда такое течение заболевания расценивается как рецидив. Но отсутствие полной нормализации активности АлАТ и АсАТ в период между двумя волнами болезни дает основание говорить скорее об обострении, а не рецидиве.
Осложнения. Фульминантные формы, ОПЭ возникают редко.
После перенесенного ВГА или на его фоне возможно обострение или возникновение таких воспалительных заболеваний, как холецистит, холангит, панкреатит, гастрит, язвенная болезнь и др. Возможна манифестация синдрома Жильбера. На фоне обострений ВГА возможны артриты, криоглобулинемия, васкулиты (в основе — аутоиммунные процессы). Описаны случаи постгепатитного нефротическо-го синдрома.
Исходы. У 90 % больных реконвалесценция идет нормально, без обострений, у 10 % больных возникает затяжная реконвалесценция. Летальность — менее 0,05 %. Вероятность возникновения хронического гепатита весьма проблематична, не исключают возможности ее в редких случаях за счет развития аутоиммунных процессов (вопрос требует детального изучения и убедительного доказательства, имеющиеся данные противоречивы). Возможно кратковременное носительство вируса после перенесенного заболевания, при этом в кале HAV появляется непостоянно.
Специфическая диагностика. Диагноз ВГА подтверждают выявлением в крови специфических антител, для этого чаще всего используют РФА или РИА.
Наиболее информативно выявление в крови антител класса IgM (ан-ти- HAV IgM). Они появляются в крови еще в инкубационный период и сохраняются 3—6 мес (длительнее при затяжных формах). У взрослых IgM сохраняются дольше, чем у детей. Анти-HAV IgM являются показателями остроты процесса, его активности, то есть свидетельствуют об остром ВГА. Отсутствие антител этого класса исключает недавнее инфицирование. Исследование следует проводить в динамике, так как возможны ложноположительные результаты из-за того, что в реакцию вступают аутоантитела с Fc-фрагментами IgG («ревматоидный фактор»).
Несколько позже появляются в крови IgG. Они сохраняются длительное время, создавая противовирусный иммунитет. Наличие их в крови при отсутствии IgM свидетельствует о перенесенной в прошлом инфекции и не может служить подтверждением активности процесса (рис.26)
В лабораториях часто производят определение суммарных антител против HAV (анти-HAV), давая заключение лишь о наличии или отсутствии их. Никакой диагностической ценности этот метод не имеет, поскольку не дает представления о соотношении IgM и IgG в сыворотке крови больного. Однако диагностическая ценность метода повышается, если определять количество антител и исследование производить в динамике с интервалом не менее 2 нед: нарастание титров антител в 4 раза является убедительным доказательством остроты процесса.
Методом ПЦР можно определять вирусную РНК в крови (в конце инкубационного периода и в первые 1—3 нед клинических проявлений) и в фекалиях (за 1—2 нед до начала болезни и 1—2 нед желтухи). Но в крови вирусная РНК обнаруживается не у всех больных.
HAV можно обнаружить в фекалиях больного в последнюю неделю инкубационного периода и в первую неделю болезни, когда концент-
Клинические проявления
Анти- HAVIgC
Анти
- HAV
IgM
Пороговый уровень в крови
Недели
после
заражения
2
3
4
5
6
7
8
9
10
Рис. 26
ВГА, динамика маркеров
рация вируса в исследуемом материале достататочно высокая. Для выявления вируса используют иммуноэлектронную микроскопию фекалий и РФА, однако эти методы доступны лишь специальным лабораториям.
Критерии диагноза ВГА, как и ВГ другой этиологии, см. в разделе «Дифференциальная диагностика желтух».
Примерная формулировка диагноза. 1. Острый вирусный гепатит А (клинически), желтушная форма, легкое течение.
2. Затяжной вирусный гепатит А (анти-HAV IgM +), ациклическое (с обострениями) среднетяжелое течение.
Порядок выписки из стационара. Лечение больных ВГА проводят в нашей стране пока только в стационаре, хотя во многих западных государствах этих больных лечат амбулаторно, госпитализации подлежат лишь больные с тяжелым течением и наличием осложнений. Длительность пребывания в стационаре зависит от тяжести течения болезни, но обычно она не менее 3 нед. Основанием для выписки является исчезновение клинических симптомов, нормализация уровня билирубина (допускается его превышение не более чем в 1,5 раза). Активность АлАТ, АсАТ при выписке не должна превышать норму более чем в 2 раза.
После выписки из стационара за реконвалесцентом наблюдает лечащий врач (контрольный осмотр через каждые 10—14 дней) до полного выздоровления. При малейших признаках обострения необходима госпитализация. При нормализации всех показателей реконвалесценты могут быть выписаны на работу. Даже если у реконвалесцента при вы
писке все показатели нормальны, то на работу его допускают не ранее чем через 2 нед. Возможно продление больничного листка на 1 мес и более после выписки, если в этом возникает необходимость. Порядок госпитализации, диспансеризации и выдачи больничных листков ре-конвалесцентам регламентируются как и при других ВГ специальными санитарными актами, которые периодически пересматриваются.
Профилактика ВГА. Общая профилактика заключается в соблюдении санитарных норм и правил, выявлении и лечении больных.
Специфическая профилактика осуществляется путем вакцинации. Известны плазменная и рекомбинантная вакцины. Во Франции изготавливают плазменную вакцину из цельного вириона, адсорбированного на гидроокиси алюминия. Вакцина испытана в 1988 г. в 11 странах, подтверждена ее высокая иммуногенность. Вводят вакцину внутримышечно или подкожно. После однократного введения ее антитела появляются уже через месяц и сохраняются до года, при ревакцинации (через 6—12 мес) иммунитет пролонгируется до 10 лет.
Схемы вакцинации определяются особенностями используемой вакцины.
Показаниями к вакцинации служат проживание в эпидемически неблагоприятных по ВГА регионах, выезд в такие места на работу или в командировку на длительное время, при эпидемических вспышках ВГА. В настоящее время вакцинацию против ВГА начали проводить и в нашей стране.
Пассивную иммунизацию проводят донорским иммуноглобулином, содержащим анти-HAV IgG в высоких титрах. Вводят его внутримышечно в дозе 0,02 мг/кг массы тела. Препарат не противопоказан и беременным женщинам. Наиболее эффективно применение иммуноглобулина в первые дни после контакта с больным, но введение его уже через 2 нед и позже малоэффективно. Полагают, что во многих случаях иммуноглобулин не защищает от ВГА, а значительно облегчает его течение (возникают стертые, легкие формы).
,_, СПЕЦИАЛЬНАЯ ЧАСТЬ ООО
вирусный гепатит в
Вирусный гепатит В, син. — сывороточный гепатит (лат. — hepatitis serosa, hepatitis В; англ. — hepatitis В).
Этиология. Возбудитель ВГВ относится к семейству Hepadnaviridae. Это небольшой (d = 42 нм), ДНК-содержащий вирус со сложной антигенной структурой (рис. 27).
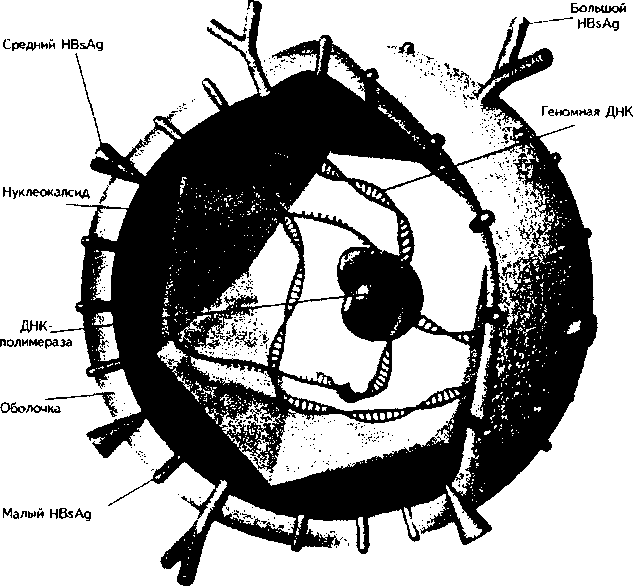
Рис. 27
Структура вируса гепатита В (по изд. GlaxoWellcome; схема)
HBV (частица Дейна) имеет оболочку и нуклеокапсид. Основным антигеном оболочки является HBsAg — поверхностный антиген вируса. Различия в биохимических и физико-химических свойствах HBsAg позволяют выделить несколько серологических субтипов вируса, которые, тем не менее, не различаются морфологически и создают при заражении перекрестный иммунитет. Имеются, однако, данные о возможности возникновения гибридной инфекции при одномоментном или последовательном заражении разными субтипами. Различные регионы имеют свои субтипы HBsAg, что позволяет четче проводить эпидемиологический анализ.
HBsAg имеет различную структуру (нитчатую, сферическую). В состав его входят белки, липиды, углеводы. HBsAg обнаруживают в цитоплазме пораженного гепатоцита, где происходит его образование, в сыворотке крови больного и вирусоносителя. Доказана возможность репликации вируса в клетках селезенки, костного мозга, лимфатических узлов, мононуклеарах и в других органах и тканях.
Обычно HBsAg образуется в избыточном количестве, поэтому такой антиген, не входящий в состав частицы Дейна, не инфекциозен. По своей антигенной структуре HBsAg неоднороден. Антигенный комплекс «S» (от «superficial» — поверхностный) имеет 4 основных субтипа — adw, adr, ayw, аут, в которых одна детерминанта (а) — группоспе-цифическая. Но изучение этих субтипов имеет значение главным образом для эпидемиологов, поскольку частота выявления их в разных регионах неодинакова. Значительно большее значение имеет появление среди обычных («диких») штаммов вируса мутантных вариантов. Особенностью их является замена HBsAg стандартной аминокислоты в определенном положении на какую-либо другую. Этого уже становится достаточно для того, чтобы мутантный штамм не улавливался циркулирующими антителами, что имеет особенно важное значение при проведении вакцинаций. Сейчас во многих регионах земного шара вирусы-мутанты (pre-s-мутантные штаммы) обнаруживают даже чаще, чем «дикие» штаммы. Кроме HBsAg оболочка вируса содержит особый альбуминовый рецептор, облегчающий проникновение вируса в гепа-тоцит.
Нуклеокапсид (ядро) HBV окружен двухслойной оболочкой. Он содержит генетический материал вируса — ДНК и ДНК-полимеразу, которая принимает участие в репликации вирусной ДНК при проникновении их в ядро гепатоцита. Существуют так называемые дефектные вирусы, не имеющие в ядре ДНК. Такие вирусы лишены инфекционных свойств. В ядре вируса содержится еще один компонент — ядерный антиген НВсАд, отличный по структуре от HBsAg, не имеющий типов и подтипов. Он не обнаруживается в крови в свободном виде, его можно выявить лишь в ядрах гепатоцитов инфицированной печени, где происходит его образование. Он тоже подвержен мутациям, но в меньшей степени, чем другие антигены HBV.
В ядре HBV содержится еще один антиген — НВеАд, существуют по меньшей мере 3 серотипа его. НВеАд состоит из белков, растворимых в сыворотке, поэтому его можно обнаружить в крови больного. НВеАд обычно связан с ДНК-полимеразой, что дает основание считать НВеАд антигеном инфекционности. Его наличие в крови свидетельствует об активной репликации вируса, активности процесса. НВеАд кодируется pre-соге геном и подвержен тоже значительным мутациям. В результате этих мутаций нарушается структура НВеАд, который тоже «ускользает» от иммунологического надзора. Такие мутанты чаще формируют хронические формы заболеваний.
Сборка вируса и образование полноценной вирусной частицы происходят в протоплазме гепатоцита.
В настоящее время считают, что сведения о структуре HBV, количестве и свойствах его антигенов еще далеко не полные. Известно более 15 маркеров HBV, патогенетическую и диагностическую роль которых изучают. Выделен Х-Ag, который, как полагают, ответствен за раковое перерождение печени. Доказано, что геном HBV, содержащий Х-Ag, не только усиливает малигнизацию в гепатоцитах, но и способствует быстрому росту опухолей любой локализации. HBV обладает высокой степенью изменчивости под влиянием различных факторов, в том числе длительного противовирусного лечения. Образующиеся при этом вирусы-мутанты не распознаются циркулирующими в крови антителами, что способствует длительной персистенции вирусов, формированию хронических гепатитов.
Антигены HBV (кроме НВсАд) и антитела к ним можно обнаружить в крови больных и вирусоносителей. Наличие тех или других антигенов и антител, сроки их появления имеют диагностическую и прогностическую ценность.
HBV устойчив: при замораживании до температуры —20 °С он сохраняет инфекционность до 15 лет, устойчив при размораживании и повторных замораживаниях. Он сохраняет активность при температуре 30— 32 °С в течение 6 мес. Выдерживает кипячение в течение 30—40 мин, ав-токлавирование в течение 30 мин. Обнаружены интересные взаимоотношения между гепадна- и ретровирусами. Так, при ассоциации HBV и ВИЧ более чем в 10 раз повышается активность репликации ВИЧ.
Эпидемиология. Источник инфекции — больной ВГВ, носитель HBV. Больной наиболее заразен в последние недели инкубационного периода и первые 2—3 нед болезни.
Механизм заражения — парентеральный. Все биологические жидкости больного и вирусоносителя содержат вирус, хотя концентрация различна. Наибольшее количество вируса содержится в крови. Заразиться можно при переливании инфицированной крови, при различных парентеральных манипуляциях.
Группы риска по ВГВ составляют медицинские работники хирургических специальностей, манипуляционные сестры, больные и врачи отделений гемодиализа, а также наркоманы, гомосексуалисты.
Факторы передачи HBV — кровь, плазма, человеческие иммуноглобулины (при современных технологиях — в меньшей степени). Вирус может содержаться в материнском молоке. Плохо простерилизован-ные иглы, системы для переливания крови могут привести к заражению ВГВ. Описаны случаи возникновения ВГВ при использовании при проведении массовых прививок безыгольных инъекторов (вспышка
ВГВ в Калифорнии), так как возможна контаминация насадки инъекто-ра кровью или тканевой жидкостью.
Основные пути передачи ВГВ—инъекции, операции, парентеральные манипуляции, работа с различными выделениями больных.
Инфицированная беременная женщина может инфицировать плод до и во время родов, после родов — грудного ребенка во время кормления грудью (при наличии трещин сосков, ссадин на слизистой оболочке полости рта у ребенка). Вирус может содержаться, хотя и в небольшом количестве, в материнском молоке.
Вероятность передачи ВГВ половым путем усугубляется и тем, что вирус может обнаруживаться в сперматозоидах.
Частота здорового носительства HBsAg в некоторых регионах (Азия) очень высока и достигает 50 %.
Особенности патогенеза ВГВ. Механизм передачи возбудителя обеспечивает проникновение его непосредственно в кровь, таким образом возникает первичная вирусемия. В диссеминации вируса принимают участие инфицированные лимфоциты и мононуклеары первого звена защиты.
С помощью имеющихся на поверхности рецепторов вирусы фиксируются на клетках-мишенях (гепатоцитах) — наступает паренхиматозная диффузия. Оставляя на поверхности гепатоцита оболочку, вирус проникает в клетку и затем в ядро гепатоцита.
У вирусной частицы, проникшей в ядро, есть 2 основных пути развития:
интегративный, при этом вирусная ДНК интегрирует с ДНК гепатоцита, что приводит к изменению его функции, но жизнеспособность клетки не нарушается. В крови можно обнаружить неинфекционные «пустые» частицы, т.к. HBsAg, образуясь в цитоплазме гепатоцита в избыточном количестве, поступает в кровь; болезнь не развивается, но формируется носительство;
репликативный, обусловливающий развитие болезни. При этом в ядре гепатоцита происходит репликация вирусной ДНК при участии ДНК-полимеразы. В цитоплазме параллельно идет синтез белковых компонентов вириона и его сборка. Процесс носит несбалансированный характер, в результате чего наряду с полноценными вирусами образуются дефектные вирусные частицы и избыточные оболочечные структуры. Все эти образования выбрасываются в кровь, обеспечивая вторичную генерализацию (вторичную вирусемию). При этом полноценные частицы Дейна инфицируют новые и новые клетки печени, способствуя распространению процесса в печени. Но репликация вируса в гепатоцитах далеко не основная причина гибели клеток, их цитолиза. Особенностью ВГВ является то, что активность процесса гибели клеток зависит главным образом от интенсивности иммунных реакций. Приводят в действие иммунные механизмы находящиеся в крови вирусы, их компоненты, а в дальнейшем — фрагменты разрушенных клеток и другие факторы.
Таким образом, повреждение гепатоцитов при ВГВ обусловлено:
— иммунным цитолизом. В этом случае Т-киллеры разрушают клетки, содержащие НВсАд и HBsAg, если последний содержится на поверхности гепатоцита. У больных ВГВ с легким течением («малым повреждением печени») HBsAg обнаруживается преимущественно в цитоплазме;
— антителозависимым иммунным цитолизом. В этом варианте Т-лимфоциты разрушают клетки, на которых фиксирован комплекс антиген + антитело. К тому же В-лимфоциты стимулируют продукцию аутоантител к печеночному липопротеиду, что способствует усилению гибели клеток;
— непосредственным действием вируса, нарушающего метаболизм инфицированной клетки.
Аутоиммунные процессы на ранних этапах направлены на уничтожение вирусиндуцированных компонентов клеток. Однако в дальнейшем по мере прогрессирования заболевания они приобретают патологические черты, уничтожая не только инфицированные вирусом клетки, но и здоровые. При аутоиммунных процессах отмечено повышенное содержание Т-супрессоров, низкое — Т-хелперов.
Острый ВГВ возникает в условиях адекватного иммунного ответа. В различные периоды и фазы болезни в печеночных инфильтратах меняется соотношение цитотоксических и супрессорных клеток, что влияет на остроту и тяжесть болезни. При злокачественном течении болезни резко снижено количество Т-хелперов, отмечена гиперпродукция антител. Аутоиммунные процессы в свою очередь усиливают повреждение гепатоцитов. Для тяжелого течения болезни характерно наличие большого количества циркулирующих ИК.
При ВГВ развиваются обычно более массивные зоны некроза, чем при ВГА (наряду с зональным нередко обнаруживается и мостовидный тип некроза), что в значительной мере объясняет большую тяжесть течения ВГВ.
Конечным результатом взаимодействия вируса и организма является либо очищение его от возбудителя, либо сохранение вируса в клетках печени в форме носительства или хронического процесса. Длительная циркуляция вируса ассоциируется с развитием хронического гепатита, цирроза печени, первичной гепатокарциномы и внепеченоч-ных иммунокомплексных заболеваний (полиартрит, гломерулонефрит, поли артериит и др.).
После перенесенного ВГВ формируется стойкий, по-видимому пожизненный, иммунитет.
Получены данные о том, что вирусная ДНК может проникать в сперматозоид, в результате чего происходит интеграция вирусной
ДНК в геном сперматозоида. Такой ген, передаваясь потомству, способствует внутриутробному повреждению печени плода, ребенок рождается с хроническим ВГВ. Хронический ВГВ может формироваться у ребенка, рожденного от матери — носителя HBsAg или перенесшей ВГВ во время беременности.
У ребенка, инфицированного во время родов, длительно, в течение многих лет, может определяться антигенемия и повышается риск развития гепатоцеллюлярной карциномы.
При здоровом вирусоносительстве в цитоплазме гепатоцита образуется только HBsAg, при этом повреждение гепатоцита практически отсутствует. Но если возникает в результате каких-то факторов активация процесса и начинается продукция НВсАд в ядре, развивается заболевание со всеми присущими ему механизмами повреждения гепатоцитов. Иммунный клеточный ответ направлен против НВсАд и НВеАд в большей степени, чем против HBsAg.
Клиника. ВГВ присущи все клинические формы, перечисленные в разделе «Классификация».
По сравнению с ВГА при ВГВ значительно чаще встречаются затяжные формы, ациклическое течение, холестатические и фульминантные формы.
Инкубационный период при ВГВ длительный — он может достигать 6 мес (в среднем 2—3 мес). Наиболее частыми вариантами преджелтушного периода являются артралгический, диспепсический и аллергический. Лихорадка в преджелтушный период не характерна, хотя и возможна (чаще при наличии выраженной сенсибилизации). Тем не менее к такой лихорадке следует всегда относиться настороженно, поскольку чаще она бывает проявлением смешанной патологии. Преджелтушный период нередко протекает по смешанному типу.
Заболевание обычно начинается постепенно, иногда первые признаки болезни настолько нерезко выражены, что началом болезни многие больные считают день появления желтухи.
Желтушный период, в отличие от такового при ВГА, характеризуется нарастанием клинических симптомов. Интоксикация обычно выражена сильнее (нередко соответствует среднетяжелому течению). В большинстве случаев астеновегетативный синдром, отсутствие аппетита сохраняются в течение всего периода нарастания желтухи. Кожный зуд, наблюдающийся примерно у 1/4—1/3 больных, в эти сроки связан либо с аллергическими проявлениями (в этом случае он может сопровождаться различной интенсивности и характера кожными высыпаниями), либо холестатическим компонентом. У большинства больных удается пальпировать увеличенную не только печень, но и селезенку.
Общая длительность желтушного периода составляет обычно 3—4 нед. В период реконвалесценции у больных могут длительно (до 6 мес и более) сохраняться гепатомегалия, умеренная гиперферментемия.
