
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Окислительно-восстановительные электроды
Существуют растворы, содержащие в своем составе два вещества, в которых атомы одного и того же элемента находятся в разной степени окисленности. Такие растворы называются иначе окислительно-восстановительными системами или редокс-системами (от латинского «reduction» – восстановление и «oxydation» – окисление).
Присутствующие в растворе молекулы или ионы, содержащие в своем составе атомы элемента с более высоким значением степени окисления, называются при этом окисленной формой, а те частицы, в состав которых входят атомы элемента с меньшей степенью окисления – восстановленной формой.
Редокс-системы часто записываются в виде дроби, причем окисленная форма помещается в числитель, а восстановленная – в знаменатель. Наиболее распространенными редокс-системами являются растворы двух солей, в которых атомы одного и того же металла имеют разную степень окисления, например:
1) раствор FeCl2 и FeCl3 ( Fe3+ / Fe2+ )
окисленная восстановленная
форма форма
2) раствор K4[Fe(CN)6] и K3[Fe(CN)6]([Fe3+(CN)6]3–/[Fe2+(CN)6]4–
окисленная восстановленная
форма форма
3) SnCl2 и SnCl4( Sn4+ / Sn2+ )
окисленная восстановленная
форма форма
4) MnSO4 и KMnO4( Mn+7O4– / Mn2+ )
окисленная восстановленная
форма форма
5) K2Cr2O7 и Cr2(SO4)3 (Cr2+6O72–/2Cr3+)
окисленная восстановленная
форма форма
В водном растворе обе эти формы могут обратимо превращаться друг в друга с установлением между ними динамического равновесия. Протекающие при этом процессы бывают двух видов.
1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
Fe3+ + ē Fe2+
[Fe3+[(CN)6]]3– + ē [Fe2+(CN)6]4–
Sn4+ + 2ē Sn2+
2. Переход окисленной формы в восстановленную, кроме обмена электронами, сопровождается участием в этом процессе других частиц, чаще всего ионов Н+ и молекул Н2О:
Mn+7O4– + 8H+ + 5ē Mn2+ + 4H2O
Cr2+6O72– + 14H+ + 6ē 2Cr3+ + 7H2O
Br+O– + H2O + 2ē Br– + 2OH–
Если в водный раствор, содержащий окислительно-восстановительную систему, опустить пластинку из инертного по отношению к её компонентам электропроводящего материала: благородного металла (Au, Pt) или графита – на ней будет наблюдаться образование электрического заряда за счет обмена электронами:
Red
![]() Pt
Pt![]() Ox
Ox
восстановленная окисленная
форма форма
При этом данная пластинка (например, платиновая) выступает в качестве посредника при обмене электронами между окисленной и восстановленной формами. Конечно, возможен обмен электронами между ионами и напрямую, но для его совершения требуются гораздо большие энергетические затраты, чем при переходе электронов от восстановленной формы на инертный металл и затем с поверхности металла на окисленную форму.
В случае избыточного содержания в растворе восстановленной формы (донора электронов) часть перешедших на пластинку электронов так и останутся невостребованными и задержатся на ней, сообщая пластинке отрицательный, относительно раствора, электрический заряд.
При избытке окисленной формы (акцептора электронов) в ходе установления состояния равновесия на её частицы перейдет и часть собственных электронов платины. В результате этого на пластинке образуется положительный, относительно раствора, электрический заряд.
Систему, состоящую из пластинки инертного металла, опущенной в раствор, содержащий окисленную и восстановленную формы одного и того же элемента, называют окислительно-восстановительным электродом (редокс-электродом), а возникающий на ней потенциал – окислительно-восстановительным потенциалом или редокс-потенциалом.
Характерной особенностью такого электрода является то, что металлическая пластинка не претерпевает в происходящих процессах никакого химического изменения и выполняет роль лишь передатчика электронов. Ионы или атомы металла пластинки в химическое взаимодействие с компонентами раствора не вступают. Их самопроизвольный переход с поверхности пластинки в раствор за счет действия молекул растворителя настолько мал, что им можно пренебречь.
Таким образом, величина редокс-потенциала будет зависеть от природы частиц, образующих редокс-систему (т.е. от того, насколько легко восстановленная форма отдает свои электроны и насколько прочно эти электроны удерживает окисленная форма), и от их концентрации в растворе.
Рассчитать величину редокс-потенциала можно с помощью уравнения Нернста-Петерса или просто уравнения Петерса (в честь немецкого физико-химика Р. Петерса, показавшего применимость уравнения Нернста не только к металлическим электродам, но и к окислительно-восстановительным системам):
E
= E0 +
![]()
где Е – редокс-потенциал, B; Е0 – стандартный или нормальный редокс-потенциал, возникающий в системе с одинаковой активностью (либо концентрацией для разбавленных растворов) окисленной (Ox) и восстановленной (Red) форм; n – число электронов, которые принимают одна молекула или ион окисленной формы, превращаясь в восстановленную форму.
Для окислительно-восстановительных систем Fe3+/Fe2+, MnO4–/Mn2+, Cr2O72–/2Cr3+, BrO–/Br– n равно, соответственно, 1, 5, 6 и 2.
Если в процессе перехода окисленной формы в восстановленную, кроме электронов, принимают участие и другие частицы, то их равновесные активности или концентрации тоже должны находиться под знаком логарифма в уравнении Петерса. Исключение составляют молекулы Н2О, т.к. в разбавленных растворах можно считать, что их концентрация при протекании химических реакций изменяется крайне незначительно.
Для окислительно-восстановительной системы MnO4–/Mn2+, в которой осуществляется следующий электродный процесс:
MnO4– + 8H+ + 5ē Mn2+ + 4H2O
редокс-потенциал рассчитывается по формуле:
E
= E0 +
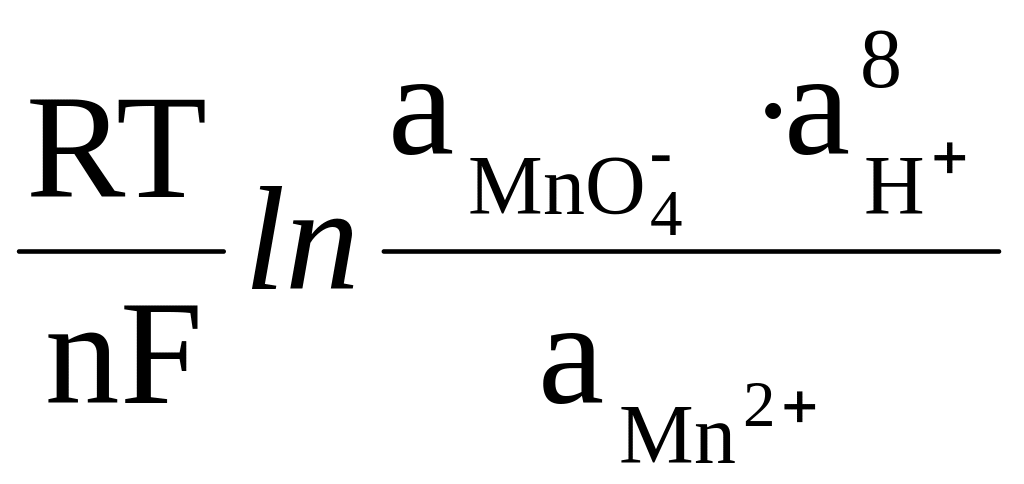
Соответственно, для редокс-системы с электродным процессом:
BrO– + H2O + 2ē Br– + 2OH–
редокс-потенциал можно рассчитать по формуле:
E
= E0 +
![]()
Если измерения редокс-потенциалов осуществляются при температуре 298K (25оС), то при переходе от натурального логарифма к десятичному и подстановке значений постоянных величин R и T уравнение Петерса принимает вид:
E
= E0 +
![]()
Значения Е0 для редокс-электродов определяют экспериментально относительно стандартного водородного электрода или какого-нибудь другого электрода сравнения (хлорсеребряного либо каломельного).
При этом активности окисленной и восстановленной форм редокс-системы должны быть одинаковыми, а активность других частиц, принимающих участие в реакции (Н+, ОН–) – равной 1 моль/дм3.
Экспериментально полученные величины Е0 редокс-электродов помещают в специальные справочники в виде таблиц, в которых обычно указывают состав редокс-системы и протекающую электродную реакцию (табл. 22).
Таблица 22. Стандартные редокс-потенциалы некоторых окислительно-восстановительных систем
Редокс-система |
Протекающая электродная реакция |
Е0, В |
Fe3+/Fe2+ |
Fe3+ + ē Fe2+ |
0,771 |
Sn4+/Sn2+ |
Sn4+ + 2ē Sn2+ |
0,153 |
[Fe3+(CN)6]3–/ [Fe2+(CN)6]4– |
[Fe3+(CN)6]3– ē [Fe2+(CN)6]4– |
0,36 |
MnO4–/Mn2+, |
MnO4– +8H+ + 5ē Mn2+ + 4H2O |
1,51 |
BrO–/Br– |
BrO– + H2O 2ē Br– + 2OH– |
0,76 |
ClO3–/Cl– |
ClO3– + 6 H+ + 6ē Cl– + 3H2O |
1,45 |
Cr2O72–/2Cr3+ |
Cr2O72– + 14H+ + 6ē 2Cr3+ + 7H2O |
1,33 |
MnO4–/MnO42– |
MnO4– + ē MnO42– |
0,56 |
Cl2/2Cl– |
Cl2 + 2ē Cl– |
1,36 |
HBrO/Br– |
HBrO + H+ + 2ē Br– + H2O |
1,34 |
Cu2+/Cu+ |
Cu2+ + ē Cu+ |
0,16 |
Зная Е0 для редокс-системы, можно с помощью уравнения Нернста рассчитать величину редокс-потенциала в том случае, когда содержание окисленной и восстановленной форм в растворе не будут равны друг другу.
Величины Е0 для окислительно-восстановительных систем можно использовать для определения направления протекания окислительно-восстановительных реакций, т.к. они характеризуют относительную окислительную способность системы.
Система, редокс-потенциал которой имеет большее значение, выступает в роли окислителя по отношению к системе, редокс-потенциал которой имеет меньшее значение.
