
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Внутренняя энергия системы
Важнейшей характеристикой термодинамической системы является величина ее внутренней энергии.
Все термодинамические системы представляют собой совокупность какого-то числа различных частиц: молекул, атомов, ионов и т.д. Частицы эти находятся в состоянии движения (поступательного, колебательного или вращательного) и, следовательно, обладают некоторым количеством кинетической энергии. Кроме того, они взаимодействуют друг с другом, т.е. обладают определенным запасом потенциальной энергии.
В самом общем виде можно определить внутреннюю энергию системы как сумму потенциальной и кинетической энергии всех составляющих ее частиц.
Это определение не позволяет, однако, дать однозначный ответ на вопрос о том, чему равна энергия конкретной системы, состоящей из определенного числа структурных единиц, например, молекул. На первый взгляд кажется, что данная задача решается достаточно просто. Для этого необходимо учесть кинетическую энергию движения молекул и потенциальную энергию их взаимодействия между собой. Но энергией молекулы не исчерпывается энергия системы. Существует потенциальная и кинетическая энергия атомов, входящих в состав каждой молекулы. Если учесть и эту энергию, то возникает вопрос, учитывать ли энергию электронов, принадлежащих атомам, и надо ли учитывать энергию атомных ядер? А так как сложность элементарных частиц неисчерпаема, то ни на каком уровне этой сложности нет оснований останавливаться.
Таким образом, в рамках термодинамики задача определения абсолютного значения внутренней энергии системы не имеет решения и в связи с этим не рассматривается. Первостепенное значение приобретает другой вопрос: как изменится энергия системы в результате осуществления термодинамического процесса.
Если мы обозначим энергию системы в каком-нибудь исходном состоянии символом U1, а в любом другом состоянии символом U2, то задача сводится к вычислению разности:
U = U2 – U1
В такой постановке она сразу приобретает четкость и допускает строгий ответ.
Величина U считается положительной, если внутренняя энергия системы при протекании процесса возрастает, и отрицательной – если убывает.
Внутренняя энергия не включает в себя кинетическую энергию системы (ЕК), которая присуща ей в результате движения как единого целого во внешней среде, и потенциальную энергию (ЕП), обусловленную действием на систему внешних силовых полей: гравитационного, электромагнитного и пр.
Таким образом, внутренняя энергия системы является составной частью полной или общей энергии системы Е:
Е = ЕК + ЕП + U
Первые два слагаемых данного равенства составляют предмет рассмотрения в механике.
Величина внутренней энергии системы определяется лишь ее состоянием, но не зависит от способа достижения данного состояния (рис. 5), поэтому U принадлежит к термодинамическим параметрам, которые называются иначе функциями состояния.

Рис. 5. Схема, иллюстрирующая независимость изменения внутренней энергии системы от пути протекающего в ней процесса
Форма обмена энергии с окружающей средой
При протекании термодинамических процессов внутренняя энергия системы может увеличиваться или уменьшаться. В первом случае говорят, что система поглотила часть энергии из внешней среды, во втором случае, наоборот – передала часть своей энергии в окружающую среду. Существуют две основные формы (способа) обмена энергией между системой и внешней средой: теплота и работа.
Теплота – это процесс обмена энергией через неупорядоченное хаотическое движение структурных единиц вещества: молекул, ионов.
Из данных частиц состоит как сама система, так и ее граница раздела (стенки системы), а также окружающий систему внешний мир. В результате столкновения частиц системы и внешнего мира с частицами, образующими стенки, энергия одного коллектива частиц (например, частиц системы), может возрасти, а другого коллектива (расположенного во внешнем мире), соответственно, уменьшиться. Микроскопический механизм этого процесса состоит в обмене энергией при каждом единичном столкновении частиц. Пользуясь макроскопическими понятиями, говорят, что какая-то порция энергии перешла в систему из окружающей среды в форме теплоты.
Система может обмениваться энергией с окружающей средой в форме теплоты и без столкновения молекул, путем поглощения или излучения лучистой энергии. В этом случае излучение или поглощение единичного кванта есть аналог единичного столкновения частиц. Обмен макроскопическими порциями энергии есть результат излучения либо поглощения огромного числа квантов.
Под термином «теплота» часто понимают не сам процесс, а количество передаваемой таким способом энергии (Q).
Если система получает из внешнего мира некоторое количество энергии в форме теплоты, то Q считают положительной величиной. При переходе энергии в противоположном направлении величину Q считают отрицательной (рис. 6).
Работа – это процесс обмена энергией в результате организованного макроскопического перемещения частей системы друг относительно друга или макроскопического изменения свойств системы либо ее частей. Работа может быть механической, электрической, химической.
Примером механической работы является расширение или сжатие системы, примером электрической работы является перенос заряда в электрическом поле.
Мерой количества механической работы служит произведение действующей силы (точнее, проекции силы на направление движения) на величину перемещения (l). Если действующая сила (F) при этом перемещении остается постоянной, то работа (А) определяется следующим образом:
А = F · l
Работа может совершаться внутренними силами системы против внешних сил, т.е. над окружающей средой (расширение системы) или, наоборот, внешними силами против внутренних (сжатие системы).
В первом случае она считается положительной величиной (при этом энергия переходит из системы во внешнюю среду). Во втором – отрицательной (энергия переходит из внешней среды в систему) (рис. 6).
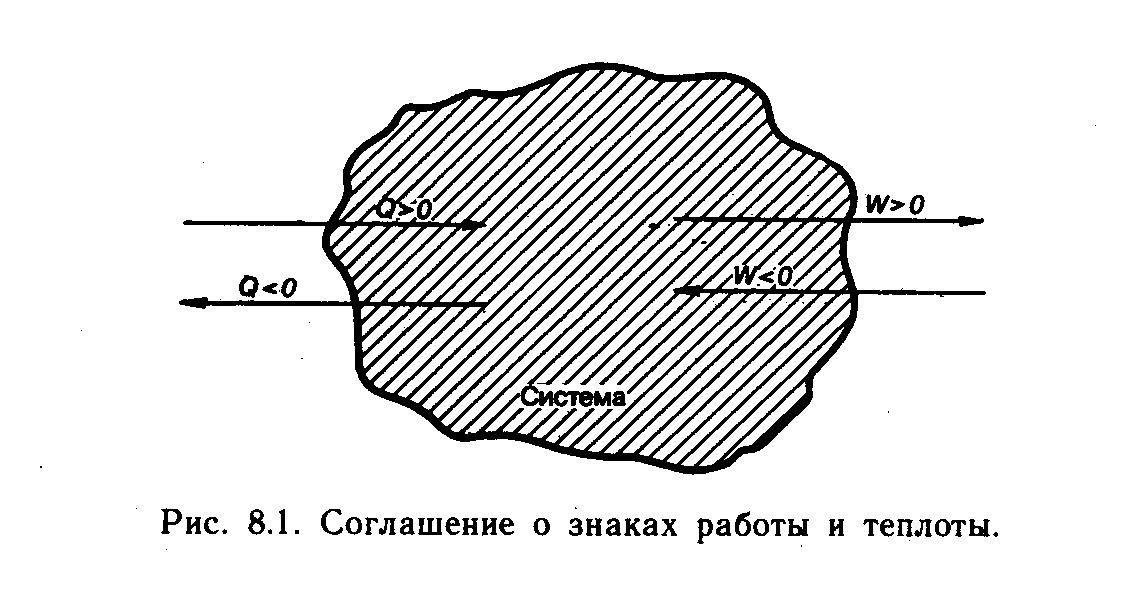
Рис. 6. Соглашение о знаках работы и теплоты
Следует учитывать, что энергия открытых систем может изменяться не только за счет совершения работы или передачи теплоты, но еще и третьим способом – за счет перехода в систему из окружающей среды (или наоборот) некоторого количества вещества. В результате этого число молекул того или иного вида в системе изменяется, а, следовательно, изменяется сумма кинетической и потенциальной энергии частиц, т.е. изменяется общий запас энергии в системе.
Процесс обмена энергией системы и окружающей среды только в форме теплоты, т.е. через хаотическое движение частиц вполне реален. Для этого достаточно окружить систему, заключенную в жесткую (непроницаемую для вещества) оболочку, средой с более высокой или более низкой температурой.
В то же время, невозможно реализовать ни один процесс, в котором обмен энергией совершался бы только в форме работы. Тепловое движение частиц в любой системе существует, и поэтому неизбежен обмен энергией также и в форме теплоты. Кроме того, всякое механическое перемещение частей системы обязательно сопровождается трением, а это тоже означает участие тепловой формы обмена энергией при механических процессах.
В термодинамике часто вводится представление о том, что система может быть окружена идеально нетеплопроводными стенками, непрозрачными также и для лучистой энергии. В этом случае обмен энергией с окружающей средой в форме теплоты невозможен, но совершение работы над системой возможно. Такие системы называются адиабатными системами, а процесс их перехода из одного состояния в другое называют адиабатным процессом.
В отличие от внутренней энергии, теплота и работа зависят от пути или способа совершения процесса и поэтому функциями состояния не являются. В связи с этим определяют абсолютные значения Q и А, а не их изменения.
