
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Химические источники электрического тока. Гальванические элементы
Химические источники электрического тока или гальванические элементы преобразуют энергию, выделяющуюся при протекании окислительно-восстановительных реакций, в электрическую энергию. Гальванические элементы служат источниками постоянного тока. Они подразделяются на химические и концентрационные.
Простейший химический гальванический элемент можно составить из двух металлических электродов, имеющих различные электродные потенциалы, и соединенных в замкнутую цепь.
На электроде, который имеет меньшее значение электродного потенциала, будет происходить процесс окисления. Такой электрод называется иначе анодом.
На электроде, который имеет большее значение электродного потенциала, будет происходить процесс восстановления. Такой электрод называется иначе катодом.
Рассмотрим более подробно принцип работы гальванических элементов на примере элемента, составленного из цинкового и медного электродов. Такой элемент называется иначе элементом Якоби-Даниэля (рис. 94).

Рис. 94. Схема медно-цинкового гальванического элемента
Каждый электрод состоит из металлической пластинки, опущенной в раствор соли: ZnSO4 и CuSO4, соответственно.
Растворы солей отделены друг от друга пористой перегородкой, сквозь которую легко могут проходить ионы металлов и SO42-. Часто вместо пористой перегородки используют «солевой мостик» – стеклянную изогнутую трубку, заполненную насыщенным раствором KCl (рис. 95). В этом случае электроды не контактируют друг с другом, каждый из них находится в отдельном сосуде, которые соединяются с помощью солевого мостика.
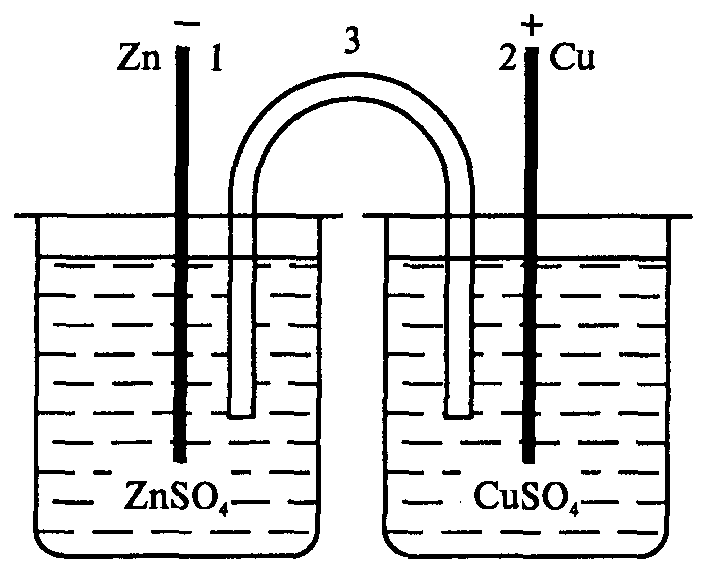
Рис. 95. Схема медно-цинкового элемента с солевым мостиком: 1 – цинковая пластинка; 2 – медная пластинка; 3 – солевой мостик
При этом на цинковом электроде происходит процесс окисления:
Zn0 – 2ē = Zn2+,
в результате которого ионы цинка с пластинки переходят в раствор. Избыточные электроны по металлическому проводнику с цинковой пластинки переходят на медную и восстанавливают содержащиеся в растворе ионы Cu2+
Cu2+ + 2ē = Cu0,
которые в виде нейтральных атомов оседают на пластинке. Остающиеся свободные сульфат-ионы медного электрода и появившиеся в избытке ионы Zn2+ цинкового электрода через пористую перегородку или солевой мостик перемещаются навстречу друг другу. Таким образом, в цепи осуществляется перенос электрических зарядов и возникает электрический ток.
В этом элементе электрическая энергия получается в результате протекания химической реакции
Zn + CuSO4 = Cu + ZnSO4
Основной характеристикой гальванического элемента является электродвижущая сила (э.д.с.), от которой зависит сила тока в цепи. Она равна разности электродных потенциалов
э.д.с. = Е2 – Е1
где Е1 и Е2 – соответственно, потенциал анода и катода.
Для гальванического элемента Якоби-Даниэля электродвижущая сила равна
э.д.с. = ЕCu – EZn
Чем выше значение э.д.с. элемента, тем больше сила тока в его цепи.
Согласно уравнению Нернста, потенциал медного и цинкового электродов рассчитывается по формулам:
ECu
= ECu0
+
![]()
EZn
= EZn0
+
![]()
Вычитая второе уравнение из первого получим выражение для расчета э.д.с. медно-цинкового гальванического элемента
э.д.с. = ECu0
– EZn0
+
![]() =
=
= ECu0
– EZn0
+
![]()
Для любого другого элемента, составленного из двух металлических электродов, и в основе работы которого лежит химическая реакция, электродвижущая сила может быть вычислена по формуле:
э.д.с. = E20
– E10 +
![]()
где Е20 и Е10 – стандартные электродные потенциалы, соответственно, катода и анода; n2 и n1 – величины зарядов ионов, участвующих в полуреакциях, которые протекают на катоде и аноде; а2 и а1 – активности ионов металла в растворах у катода и анода, соответственно).
Для температуры 298K, при подстановке значений констант R и F и при переходе от натурального логарифма к десятичному наше уравнение запишется иначе:
э.д.с. = E20
– E10 + 0,059
![]()
Гальванические элементы можно обозначать в виде схемы. Слева обычно приводится электрод или полуэлемент с меньшим значением электродного потенциала (анод), а справа – с большим значением электродного потенциала (катод).
При записи электродов сперва указывают твердую фазу (например, металл в случае металлического или редокс-электрода), а затем – вещества, растворенные в жидкой фазе. Фазы отделяются друг от друга одной вертикальной чертой. Если в одной фазе содержится несколько компонентов, то они записываются через запятую.
Границу раздела между растворами двух электродов изображают пунктирной вертикальной чертой или двумя сплошными линиями (если растворы отделяются друг от друга солевым мостиком).
В соответствии с вышеизложенными правилами, схема элемента Якоби-Даниэля выглядит следующим образом:
Zn ZnSO4 CuSO4 Cu
Гальванический элемент может быть составлен и из двух редокс-электродов, имеющих разное значение редокс-потенциала. Такие элементы называются иначе окислительно-восстановительными гальваническими элементами. Они тоже относятся к химическим гальваническим элементам, т.к. в основе их действия лежит протекание химической реакции.
Гальванический элемент, в котором источником энергии является не химическая реакция, а работа выравнивания концентраций (активностей) ионов, называется концентрационным. Он может состоять из двух одинаковых металлических электродов, погруженных в растворы одной и той же соли, но с различной концентрацией (активностью) ионов металла (рис. 96), например:
Zn ZnSO4 ZnSO4 Zn или Ag AgNO3 AgNO3 Ag
a1 a2 a1 a2
a1 < a2
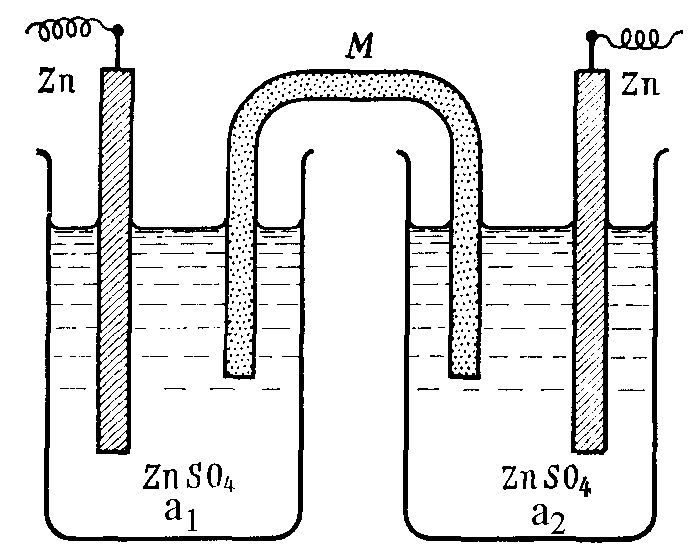
Рис. 96. Цинковая концентрационная цепь: М – солевой мостик, содержащий хлорид калия
Электрод, находящийся в более разбавленном растворе, растворяется, его ионы переходят в раствор:
Zn – 2ē Zn2+
Ag – ē Ag+
Сам электрод при этом заряжается отрицательно.
На электроде, погруженном в более концентрированный раствор, наоборот, осаждаются ионы металла, и он заряжается положительно. Таким образом, на обоих электродах протекают процессы, приводящие к выравниванию концентрации ионов металла в растворах.
Потенциалы электродов при этом равны:
E1
= E0 +
![]() ; E2
= E0 +
; E2
= E0 +
![]()
Вычитая первое уравнение из второго, получим формулу для подсчета э.д.с. с концентрационного элемента:
э.д.с.
= E2 – E1
=
![]()
или
э.д.с.
=
![]()
Концентрационный элемент будет работать до тех пор, пока активности ионов металлов в обоих растворах не сравняются; при а1 = а2 его э.д.с. будет равна 0.
