
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Свойства растворов высокомолекулярных соединений
Свойства растворов высокомолекулярных соединений тесно связаны со строением, размерами и гибкостью макромолекул, а также с энергией их взаимодействия с растворителем. Последний фактор является особенно важным, т.к. сродство полимера к растворителю в значительной мере определяет форму и способ существования в растворе его макромолекул. При большом сродстве полимера к растворителю (т.е. при совпадении их полярности) его макромолекулы обычно вытянуты и гибки, способны при тепловом движении легко изменять свою форму и образовывать множество конформаций.
Растворы, в которых макромолекулы свернуты в клубок, в большей степени проявляют не свойства истинных растворов, а золей. Это связано с тем, что частицы дисперсной фазы в них можно рассматривать как зародыши новой фазы, поскольку наружные и внутренние части клубка находятся в разных условиях. Такие системы образуются, если полярность растворителя и полимера существенно отличаются друг от друга.
Осмотическое давление растворов вмс
Как любые высокодисперсные системы, частицы которых подвержены тепловому движению, растворы ВМС обладают осмотическим давлением. Оно определяется концентрацией полимера, но практически всегда имеет очень малое значение даже в сравнительно концентрированных растворах. Это объясняется тем, что вследствие большой средней молярной массы число частиц дисперсной фазы в единице объема раствора полимера на несколько порядков меньше числа молекул в растворах низкомолекулярных соединений с аналогичной массовой долей растворенного вещества.
Однако даже в сравнительно разбавленных растворах ВМС измеренное осмотическое давление (кривая 1 на рис. 75) оказывается большим, чем вычисленное по уравнению Вант-Гоффа (росм. = cRT) (кривая 2 на рис. 75).
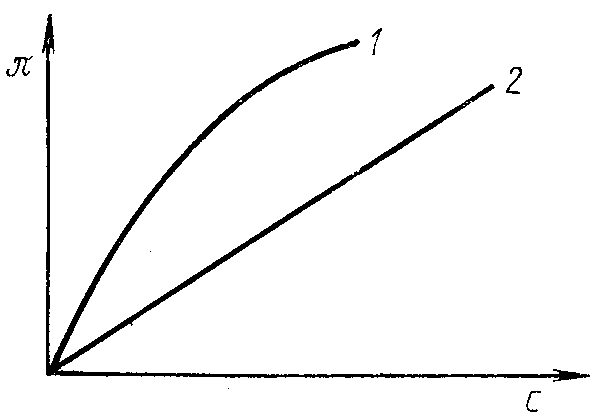
Рис. 75. Зависимость осмотического давления от концентрации раствора ВМС: 1 – определенная экспериментально; 2 – рассчитанная по уравнению Вант-Гоффа.
Отклонение это оказывается более заметным в растворах с гибкими макромолекулами. Объясняется это тем, что для длинных гибких макромолекул характерна так называемая сегментарная форма молекулярно-кинетического движения. Отдельные части макромолекулы (сегменты), расположенные сравнительно далеко друг от друга, оказываются независимыми в своем тепловом движении. Это приводит к тому, что макромолекула ведет себя в растворе как несколько молекул меньшего размера или несколько отдельных кинетических элементов. Чем более гибкой и асимметричной является макромолекула в растворе, тем больше измеренное осмотическое давление отличается от теоретически вычисленного, и тем сильнее оно возрастает при увеличении концентрации. Чтобы использовать закон Вант-Гоффа, в него нужно для каждого полимера вводить свой поправочный коэффициент β (определяется опытным путем), учитывающий форму макромолекул в растворе, их гибкость и сродство к растворителю.
росм. =
![]() + βс2
+ βс2
где с – весовая концентрация полимера; М – средняя молярная масса полимера.
Онкотическое давление крови
Осмотическое давление в биологических жидкостях: крови, лимфе, внутри- и межклеточной жидкости – обусловлено не только содержанием в них различных низкомолекулярных веществ, но и наличием растворенных высокомолекулярных соединений, главным образом, белков и некоторых полисахаридов. Часть осмотического давления крови, создаваемая растворенными в ней белками, называется онкотическим давлением. В норме оно составляет примерно 0,5% от общего осмотического давления данной жидкости, т.е. сравнительно невелико, но, тем не менее, играет важную роль в процессах распределения воды и минеральных веществ между кровью и тканями, которые протекают в капиллярах. Стенки их проницаемы для воды, солей, других низкомолекулярных веществ, но не для полимеров. Если по одну сторону капиллярной стенки будет находиться плазма крови, богатая белками, а по другую – тканевая жидкость, имеющая меньшую концентрацию белков, то возникают условия для осмотического проникновения из тканевой жидкости в кровь воды и низкомолекулярных соединений. Эти процессы активно протекают в венозной части капилляров.
В артериальной части капилляров, благодаря онкотическому давлению крови, наоборот, создаются условия для проникновения воды и низкомолекулярных соединений в тканевую жидкость (рис. 76).
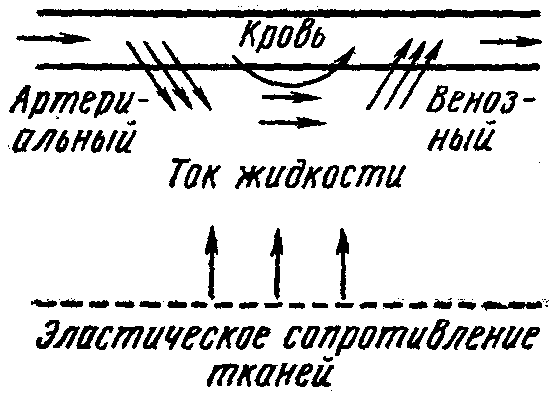
Рис. 76. Передвижение жидкости между плазмой в капилляре и межклеточным пространством в зависимости от величины онкотического давления крови
Аналогичные процессы имеют место и в почках при образовании мочи.
При понижении содержания белка в крови, т.е. при гипопротеинемиях, вследствие голодания, нарушений деятельности пищеварительного тракта или потери белка с мочой при заболеваниях почек возникает обратная разница в онкотическом давлении между тканевой жидкостью и кровью. В этом случае вода через капилляры устремляется в сторону более высокого давления, т.е. в ткани. Это приводит к образованию так называемых онкотических отеков подкожной клетчатки, называемых иначе «голодными» или «почечными» отеками.
