
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Термохимия. Закон Гесса
Раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, называют термохимией.
Значение термохимии велико, т.к. знание тепловых эффектов необходимо для составления тепловых балансов различных процессов (в том числе и биохимических, протекающих в клетках человека, животных и растений), а также при исследовании химических равновесий.
Тепловым эффектом химической реакции в термохимии называют максимальное количество теплоты, которое выделяется или поглощается в необратимом процессе (чаще всего протекающем при максимальных температуре и давлении) при условии, что продукты реакции и исходные вещества имеют одинаковую температуру и в системе отсутствуют другие виды работ, кроме расширения или сжатия.
При таких ограничениях QР = Н должен вести себя как функция состояния, т.е. его величина не будет зависеть от пути процесса, а станет определяться только начальным и конечным состоянием системы. Данная закономерность называется иначе законом Гесса, по фамилии русского ученого Г.И. Гесса, который установил и доказал ее экспериментально.

Герман Иванович (Герман Генрих) Гесс (1802–1850). Прибыл в Россию вместе с семьей в 1805 г, и здесь получил образование, посвятив научную деятельность своей второй родине. Он учился на медицинском факультете в Дерпте и под влиянием Г. Озанна увлекся химией. Некоторое время работал в лаборатории Я. Берцелиуса в Стокгольме (1826–1827). По возвращении в Россию был врачом, одновременно исследовал минералы и принимал участие в ряде экспедиций, В 1828 г. был избран адъюнктом академии и по возвращении в Петербург развил здесь активную научную деятельность. В 1830 г. Г.И. Гесс стал академиком, заняв одновременно должность профессора Технологического института. Преподавал также химию в Главном педагогическом институте, в Горном институте и в других учебных заведениях. Г.И. Гессу принадлежит учебник химии «Основания чистой химии», служивший почти 40 лет основным пособием при изучении химии русскими студентами.
Представим, что процесс превращения исходных веществ в продукты реакции осуществляется различными путями (рис. 8):
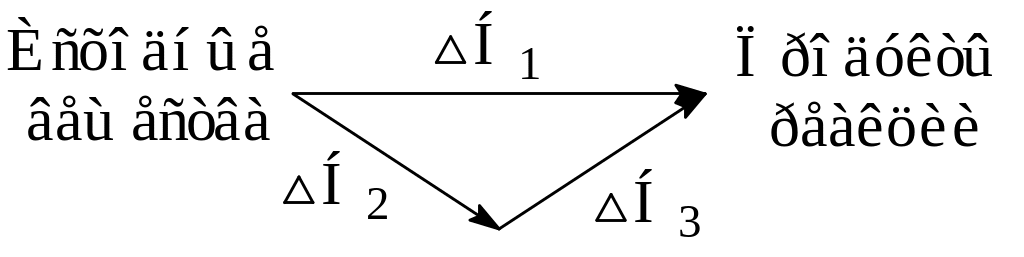
Рис. 8. Схематическое изображение химического процесса, способного осуществляться двумя способами
1) непосредственной реакцией (протекающей в одну стадию), тепловой эффект которой равен ΔН1;
2) реакцией, протекающей в две стадии, тепловые эффекты которых равны ΔН2 и ΔН3.
В соответствии с законом Гесса ΔН1 = ΔН2 + ΔН3, т.е. независимо от пути получения продуктов реакции суммарный тепловой эффект процесса всегда будет одним и тем же.
Для различных расчетов в термохимии пользуются не химическими уравнениями реакций, а термохимическими.
В термохимических уравнениях химические формулы всегда обозначают один моль вещества, поэтому стехиометрические коэффициенты при химических формулах веществ могут быть дробными. В термохимических уравнениях отмечают также агрегатное состояние каждого вещества (г – газообразное, ж – жидкое, т – твердое, р – растворенное), его кристаллическую модификацию и условия проведения реакции ( в частности, температуру).
Поясним это примером. В химии для описания реакции образования воды из водорода и кислорода достаточно было написать:
2Н2 + О2 = 2Н2О
В термохимии этого недостаточно. Энергия системы в исходном состоянии – это энергия двух моль Н2 и одного моля О2, в конечном состоянии – энергия 2 моль Н2О. Эта энергия различна в зависимости от того, будут ли в результате реакции получены жидкая вода, водяной пар либо лед. Точно так же и исходные вещества могут быть взяты в различных агрегатных состояниях. В каждом случае тепловые эффекты будут различными.
Существуют две формы записи термохимических уравнений и соответственно этому две формы знаков тепловых эффектов: термохимическая и термодинамическая.
В термохимической форме теплота считается положительной, если она выделяется в результате реакции. В термодинамической форме указывается изменение энтальпии химической реакции, и в случае выделения теплоты ΔН имеет знак «–» (рис. 9). Например:
2Н2(г) + О2(г) = 2Н2О(ж) + 284,25 кДж (Т = 298К)
термохимическая форма записи;
2Н2(г) + О2(г) = 2Н2О(ж); ΔН298К = –284,25 кДж
термодинамическая форма записи.
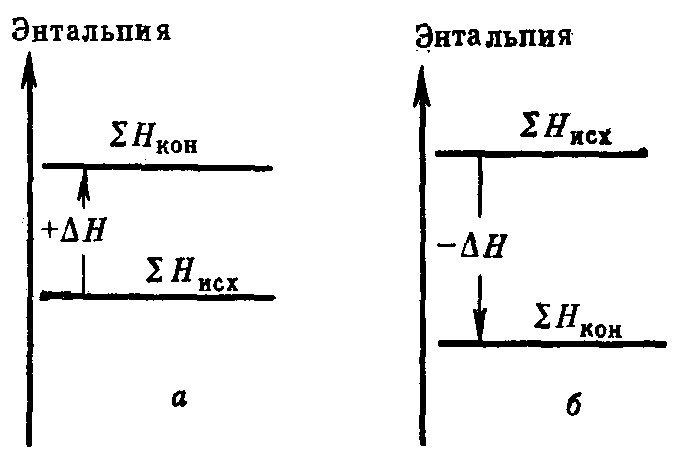
Рис. 9. Энтальпийная диаграмма: а – эндотермический процесс (Н>0); б – экзотермический процесс (Н<0)
С помощью закона Гесса определяют тепловые эффекты процессов, которые непосредственно на практике точно измерить сложно или невозможно. Покажем это на следующем примере. Углекислый газ из графита можно получить 2 способами:
а) С (графит) + ½ О2 (г) = СО (г); ΔН1
СО(г) + ½ О2 (г) = СО2 (г); ΔН2
б) С (графит) + О2 (г) = СО2 (г); ΔН
Представим эти реакции следующей схемой:

Очевидно, Н = Н1 + Н2
Измерив Н и Н2, можно рассчитать величину Н1 = Н – Н2. Опытным путем Н1 найти нельзя, т.к. при сгорании С по данной реакции в общем случае получается не одно вещество (угарный газ), а смесь СО и СО2, и каким именно образом наблюдаемое выделение теплоты распределяется между образовавшимися продуктами, решить трудно.
Таким образом, с термохимическими уравнениями можно производить те же действия, что и с обычными алгебраичными уравнениями, т.е. умножать или делить их на какое-либо число, складывать либо вычитать.
Тепловой эффект химической реакции можно непосредственно измерить, осуществив ее в специальных устройствах, называемых калориметрическими бомбами или калориметрами, либо рассчитать теоретически, используя следствия, вытекающие из закона Гесса.
Наиболее важными из них являются следующие:
1. Тепловой эффект (или изменение энтальпии) химической реакции равен сумме теплот образования (энтальпий образования) конечных веществ за вычетом суммы теплот образования (энтальпий образования) исходных веществ с учетом их стехиометрических коэффициентов.
2. Тепловой эффект (или изменение энтальпии) химической реакции равен сумме теплот сгорания (энтальпий сгорания Нсгор.) исходных веществ за вычетом суммы теплот сгорания (энтальпий сгорания Нсгор.) продуктов реакции.
Первое следствие имеет общее значение, второе особенно важно для органических соединений.
Теплотой образования или энтальпией образования сложного вещества называется тепловой эффект (изменение энтальпии) химической реакции образования одного моля сложного вещества из соответствующих простых.
Например, тепловой эффект реакции
3/2 Н2 (г) + 1/2 N2 (г) = NН3 (г)
является теплотой образования одного моля газообразного NН3.
Теплоты или энтальпии образования сложных веществ, как правило, определяются экспериментально (если возможно осуществить соответствующую реакцию) и их значения помещают в специальных справочниках или таблицах (табл. 1). Причем эти значения приводятся для строго определенных условий: р = 101 325 Па (101,325 кПа), Т = 298,15 K. Если химическая реакция осуществляется не между чистыми веществами, а их растворами, то концентрация продуктов реакции должна быть равна 1 моль / дм3.
Данные условия называются иначе стандартными условиями.
Определенные таким образом энтальпии образования веществ называются стандартными энтальпиями образования (Но298). Они измеряются в кДж/моль.
Теплоты или энтальпии образования простых веществ приняли равными нулю. Если химический элемент может образовать несколько простых веществ, то нулю равна энтальпия образования только его самой устойчивой аллотропной модификации при стандартных условиях. Теплоты образования остальных модификаций не равны нулю.
Например, химический элемент кислород образует 2 простых вещества: О2 (кислород) и О3 (озон). При этом
Но298 (О2 (г) = 0, а Но298 (О3 (г) = 142,256 кДж/моль.
Для углерода
DНо298 (С графит) = 0, а DНо298 (С алмаз) = 1,828 кДж/моль (табл. 1).
Таким образом, если известны теплоты или энтальпии образования конечных и исходных веществ, тепловой эффект химической реакции можно рассчитать теоретически, т.е. не осуществляя ее.
Таблица 1. Стандартные энтальпии образования некоторых веществ (кДж/моль)
Вещество |
∆H°298 |
Вещество |
∆H°298 |
Вещество |
∆H°298 |
Вещество |
∆H°298 |
Al (г.) Al3+ (р.) AlF3 (тв.) AlBr3 (тв.) Al2O3(тв.) Fe (г.) Fe3+(р.) FeO (тв.) Fe2O3 (тв.) Ca(OH)2(тв.) |
326,3 -530,0 -1510 -513,4 -1874 416,31 -46,39 -272,4 -822,2 -985,6 |
Cl (г.) Cl-(р.) HCl(г.) HCl(р.) ClO2(г.) Cl2O(г.) HBr(г.) HI (г.) ICl (г.) CO2(г.) |
121,3 -167,2 -91,8 -166,9 105 75,7 -34,1 26,57 17,41 -393,5 |
NH3 (г.) NH4+(р.) NH4Cl(тв.) N2H4(г.) NO (г.) NO2 (г.) N2O4 (г.) HNO3(г.) NO3-(р.) PCl3(ж.) |
-45,8 -132,4 -314,2 95,4 90,4 34,2 9,66 -135,1 -207,5 -319 |
H2O(г.) H2O(ж.) H2O(тв.) H+(р.) OH-(р.) O3 (г.) SO2 (г.) SO3 (г.) H2S (г.) CaO (тв.) |
-241,82 -285,83 -291,85 0 -230,19 142,3 -296,9 -395,4 -20,15 -634,9 |
Покажем это на примерах следующих реакций:
1. Al2O3 (т) + 3SO3 (г) = Al2(SO4)3 (т)
DНо298 (химической реакции) = DНо298 (Al2(SO4)3 (т)) – (DНо298 (Al2O3 (т) + 3DНо298 (SO3 (т)) = –3439 – (–1874 +3(–395,4) = –579,1 кДж.
2. 4 NH3 (г) + 5O2 (г) = 4NO (г) + 6H2O (ж)
DНо298 (химической реакции) = 4DНо298 (NO (г)) + 6DНо298 (H2O (ж) – (4DНо298 (NH3 (г)) + 5DНо298 (O2 (г)) = 4 · 90,4 + 6 · (– 285,8) – (4 · (– 45,8) + 5 · 0) = 361,6 – 1714,8 + 183,2 = 1170 кДж.
Подавляющее большинство органических соединений нельзя синтезировать непосредственно из простых веществ, в связи с чем невозможно экспериментально определить теплоту образования этих соединений. Однако можно осуществить реакцию их полного сгорания.
Теплотой или энтальпией сгорания органического вещества называется тепловой эффект реакции полного сгорания 1 моля данного соединения в кислороде (О2) до образования СО2 (г) и Н2О(ж).
Если в состав органического вещества кроме углерода, водорода и кислорода входят атомы других элементов (N, Cl, S, P), то продукты их окисления оговариваются отдельно. Например, оксиды SO2 и Р2О5 для серы и фосфора и простые вещества N2 и Cl2 для азота и хлора.
Теплоты сгорания негорючих неорганических веществ (H2O, CO2, O2, N2, F2, Cl2) приняты равными нулю.
Теплоты или энтальпии сгорания, как и теплоты образования веществ, определяют для стандартных условий и измеряют в кДж/моль.
Так, для реакции:
СН3СООН (ж) + С2Н5ОН (ж) = СН3СООС2Н5 (ж) + Н2О (ж)
DНо298 (химической реакции) = DНо298 (сгор.) (СН3СООН (ж)) + DНо298 (сгор.) (С2Н5ОН (ж)) – DНо298 (сгор.) (СН3СООС2Н5 (ж)),
поскольку DНо298 (сгор.) (Н2О) = 0
