
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Эквивалентная электропроводность растворов
Эквивалентной электропроводностью называется электрическая проводимость раствора электролита толщиной 1 м, находящегося между одинаковыми электродами с такой площадью, чтобы объем жидкости, заключенный между ними, содержал 1 моль химического эквивалента растворенного вещества.
Таким образом, если удельная электропроводность характеризует проводимость единичного объема раствора электролита (в системе СИ – 1 м3), в котором содержание данного вещества может быть различным, то эквивалентная электропроводность характеризует электрическую проводимость раствора, содержащего один моль химического эквивалента растворенного вещества. Причем объем самого раствора может изменяться в широких пределах вплоть до бесконечного при бесконечном разбавлении.
Общее же количество электролита, определяющее величину его эквивалентной электропроводности, остается одним и тем же при любой концентрации и в любом объеме раствора. Схема, объясняющая связь между удельной и эквивалентной электропроводностью вещества, представлена на рис. 83.
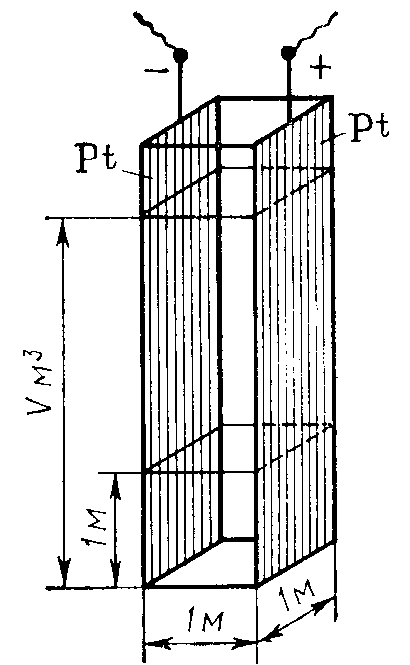
Рис. 83. Зависимость между удельной и эквивалентной электрическими проводимостями
Эквивалентная электропроводность обозначается греческой буквой λV (ламбда), причем индексом внизу показывают обычно объем раствора (в м3), в котором содержится 1 моль химического эквивалента электролита.
Эквивалентная электропроводность равна удельной электропроводности 1 м3 раствора, умноженной на объем (V) этого же раствора (в м3), содержащий 1 моль химического эквивалента электролита
λV = ϰ ∙ V
Учитывая, что 1/V = С (молярная концентрация эквивалента электролита в растворе, моль/м3)
λV = ϰ/C
Эквивалентная электропроводность измеряется в См ∙ моль–1 ∙ м2 или Ом–1 ∙ моль–1 ∙ м2. В справочной литературе эквивалентную электропроводность часто приводят в единицах измерения См ∙ моль–1 ∙ см2 или Ом–1 ∙ моль–1 ∙ см2. (При этом удельная электропроводность ϰ выражается в Ом–1 ∙ см–1 или См ∙ см–1, молярная концентрация эквивалента в моль/см3).
Эквивалентная электропроводность зависит от тех же факторов, что и удельная.
Для сильных и слабых электролитов λV возрастает с уменьшением концентрации раствора, достигая максимального значения при достаточно большом разбавлении V (рис. 84). Она называется иначе предельной электрической проводимостью и обозначается λ∞.
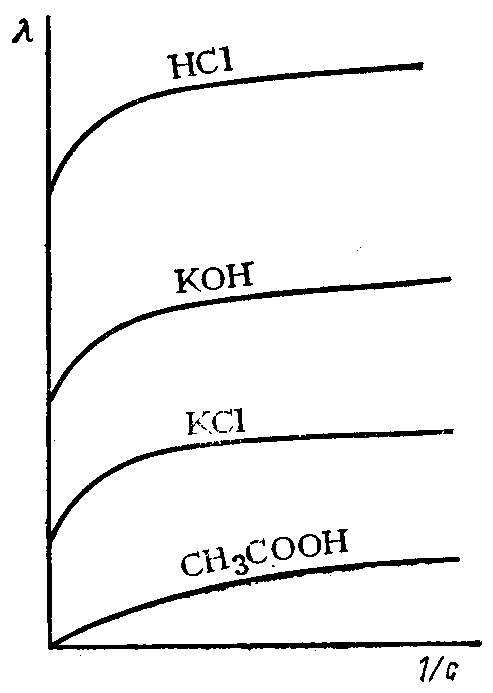
Рис. 84. Зависимость эквивалентной электропроводности растворов электролитов от степени разбавления
В таких условиях в растворах сильных электролитов ионы находятся на достаточно больших расстояниях друг от друга, электростатические взаимодействия между ними отсутствуют, ионные атмосферы не образуются.
В растворах слабых электролитов степень диссоциации достигает своей максимальной величины ( = 1) и все молекулы распадаются на ионы.
Следовательно, λ∞ в таких условиях зависит только от скорости движения ионов.
Кольрауш установил, что при таком разведении катионы и анионы проводят электричество независимо друг от друга, т.к. силы взаимодействия между ними отсутствуют. В этом случае эквивалентная электропроводность раствора будет равна сумме электропроводностей катионов (λк) и анионов (λа)
λ∞ = λк + λа
Данное равенство называется законом независимого движения ионов или законом Кольрауша.
Величины λк и λа называются иначе подвижностями катионов и анионов. Они, соответственно, равны
λк = F ∙ uк λа = F ∙ ua
где F – постоянная Фарадея, равная 96500 k; uк и ua – абсолютные скорости движения (м/с), соответственно, катионов и анионов при приложенной разности потенциалов 1 В/м.
В таком случае закон Кольрауша можно записать иначе
λ∞ = F ∙ uк + F ∙ ua = F ∙ (uк + ua)
Таким образом, эквивалентная электропроводность электролита при бесконечном разбавлении пропорциональна сумме абсолютных скоростей движения его ионов.
