
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Классификация сложных реакций
Большинство химических реакций, протекающих в окружающем нас мире и используемых в промышленности, являются сложными. В зависимости от механизма они подразделяются на обратимые, параллельные, последовательные, сопряжённые, цепные.
К обратимым относятся реакции, которые при данных условиях могут самопроизвольно протекать как в прямом, так и в обратном направлении. В общем виде химическое уравнение обратимой реакции записывается следующим образом:
аА + bB + … ↔ cC + dD + …,
где а, b, с, d, …. – стехиометрические коэффициенты перед формулами исходных (А, В, ….) и конечных (С, D, …) веществ.
Примером обратимого процесса, протекающего в живых организмах, может служить реакция этерификации:
R1 – COOH + HO – R2 ↔ R1 – С(O)O – R2 + H2O,
а используемого в промышленности – синтез аммиака из азота и водорода:
3 Н2 + N2 ↔ 2NH3
Cкорость обратимой реакции равна разности между скоростями прямой и обратной реакций.
Параллельными реакциями называются реакции вида:
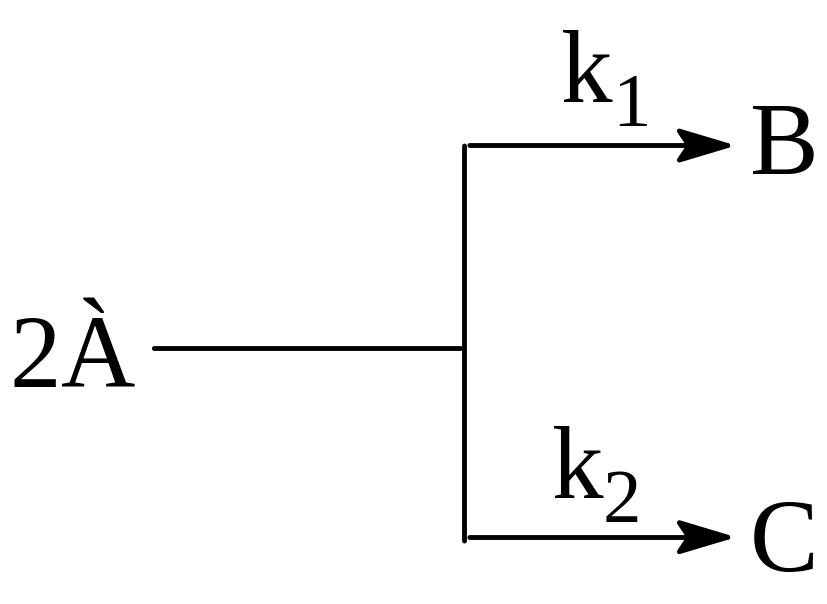
т.е., при которых одни и те же исходные вещества, одновременно реагируя между собой, образуют разные продукты.
Примером подобного типа реакций является реакция разложения бертолетовой соли KClO3, способная протекать при определённых условиях в двух направлениях
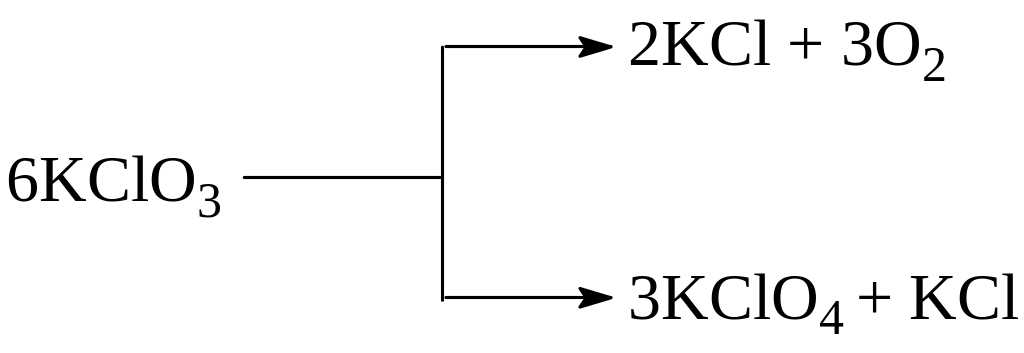
Параллельно по двум и более механизмам может протекать распад ядер атомов некоторых радиоактивных элементов. Особенно часто параллельные реакции встречаются в органической химии. Например, при сульфировании толуола серной кислотой могут одновременно образоваться орто- и парасульфопроизводные:
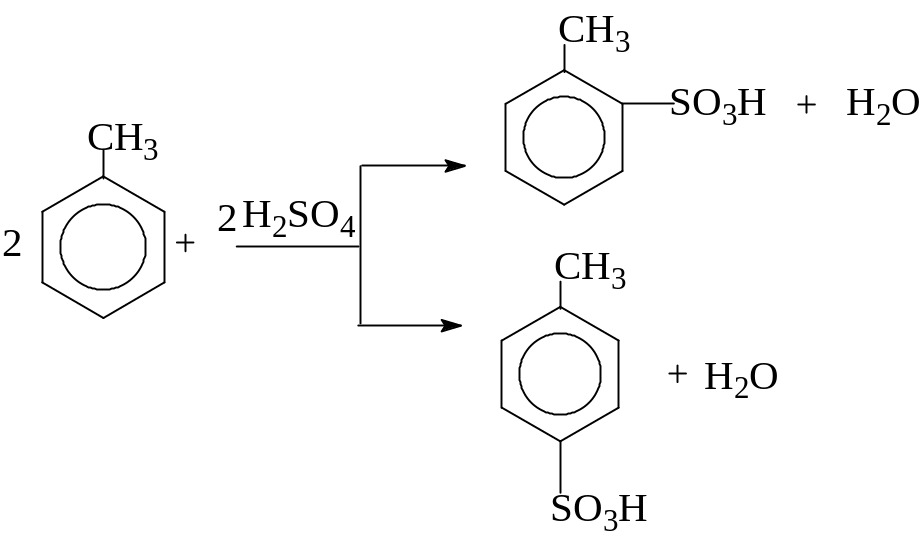
В некоторых случаях параллельными могут быть и биохимические реакции, протекающие в клетках живых организмов. Например, ферментативное брожение глюкозы:
1) С6H12O6![]() 2
С2H5OH
+ 2CO2 ↑
2
С2H5OH
+ 2CO2 ↑
спиртовое брожение
2) С6H12O6 СH3 – CH(OH) – COOH
молочнокислое брожение
При определённых условиях многие параллельные реакции могут протекать преимущественно только в каком-нибудь одном направлении.
Скорость параллельной реакции определяется скоростью наиболее быстрой её стадии.
Последовательными называются такие реакции, в которых образование конечного продукта из исходных веществ происходит не непосредственно, а обязательно через ряд промежуточных стадий, протекающих одна за другой в строго определённой последовательности. Схематически такой процесс можно изобразить следующим образом:
А → В → С → D,
где каждой буквой обозначается отдельная стадия процесса. В общем случае число таких стадий в последовательных реакциях может быть самым разным (от нескольких единиц до нескольких десятков). Причём каждая из стадий, в свою очередь, не обязательно является простой моно- или бимолекулярной реакцией, но может быть и сложной.
Последовательные реакции распространены в природе и особенно часто они наблюдаются в биохимических процессах, протекающих в живых организмах, растениях. В качестве примера таких реакций можно привести фотосинтез и биологическое окисление глюкозы, гидролиз олиго- и полисахаридов и т.д.
Расчёт кинетики последовательных реакций сложен и достаточно точно может быть осуществлён лишь для сравнительно простых процессов, состоящих из небольшого числа стадий.
Однако, если одна из стадий последовательной реакции обладает значительно меньшей скоростью, чем все остальные, то общая скорость реакции будет определяться скоростью именно этой стадии, которая в данном случае называется лимитирующей.
Например, реакция хлорирования оксида азота (II)
2NO + Cl2 = 2NOCl
состоит из двух стадий:
1) NO + Cl2 = NOCl2;
2) NOCl2 + NO = 2NOCl
Первая стадия протекает быстро с образованием нестойкого продукта NOCl2. Вторая стадия является медленной и лимитирующей. Скорость всей реакции описывается кинетическим уравнением
=
k
![]() · CNO
· CNO
и общий порядок данной реакции равен 2.
Сопряжёнными называют реакции, протекающие по следующей схеме:
А + В М
А + С D
Одна из этих реакций может протекать самостоятельно, а вторая реакция осуществима только в присутствии первой. Таким образом, протекание одной реакции инициирует осуществление второй.
Сопряжённые реакции возможны в биохимии. Они протекают в клетках, причём энергию, необходимую для течения второй реакции с ΔG2 > 0, доставляет первая реакция, для которой ΔG1 < 0. Причём │ΔG1│> │ΔG2│, т.е. весь процесс в целом протекает с уменьшением энергии Гиббса. Подобные биохимические реакции иначе называются тандемными.
Часто механизм сопряжённых реакций заключается в образовании на первой стадии активных промежуточных частиц (радикалов или ионов), которые инициируют протекание всех остальных реакций.
Схему сопряженных реакций такого типа можно в общем виде представить следующим образом:
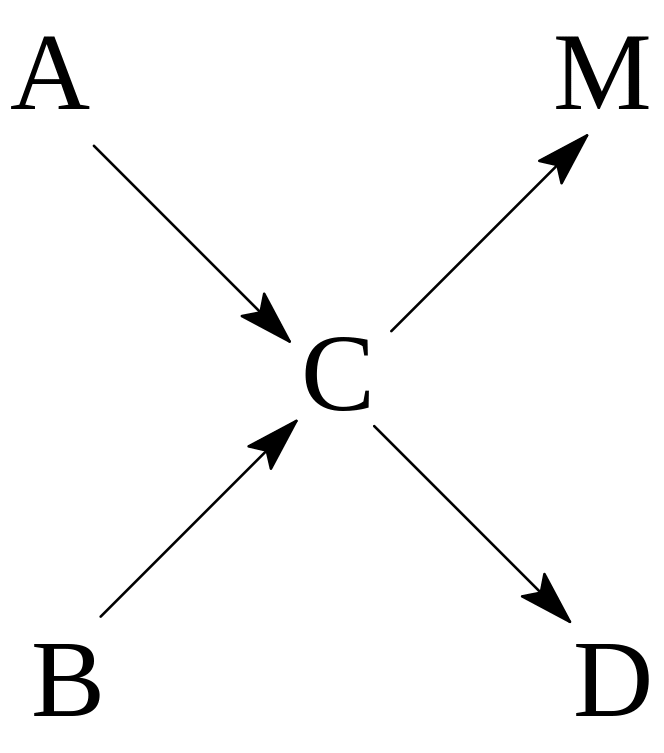
где С – активная промежуточная частица.
Например, бензол в водном растворе не окисляется Н2О2, но при добавлении соли двухвалентного железа происходит его превращение в фенол и дифенил. Чтобы «запустить данный процесс, ионы Fe2+ сперва вступают во взаимодействие с Н2О2, образуя радикалы ·ОН
Fe2+ + H2O2 → Fe3+ + OH– + ˙OH,
которые затем реагируют как с бензолом
С6Н6 + ˙ОН → ˙С6Н5 + Н2О
˙С6Н5 + ˙ОН → С6Н5ОН
так и с Fe2+
Fe2+ + ˙OH → Fe3+ + OH–
Явление химической индукции впервые было исследовано Н.А. Шиловым в 1905 г.
Цепными называют химические реакции, протекающие через ряд регулярно повторяющихся элементарных стадий с участием активных частиц, содержащих в своём составе атомы с неспаренными электронами на внешнем энергетическом уровне (или по другому – свободных радикалов).
К цепным относятся реакции горения, полимеризации и поликонденсации, распада ядер и др.
Механизм цепных реакций состоит в том, что свободные радикалы (часто в их роли выступают одиночные атомы) обладают высокой химической активностью. Они легко вступают во взаимодействие с устойчивыми молекулами и превращают их в активные частицы, которые затем образуют продукты реакции и новые радикалы, и таким образом возникает цепь дальнейших стадий. Цепная реакция продолжается, пока не прореагирует всё вещество, или пока не исчезнут активные частицы-радикалы.
Для цепных реакций характерны три этапа: 1) зарождение цепи; 2) развитие цепи или её рост; 3) обрыв цепи.
Зарождение цепи начинается с элементарного химического акта, в результате которого образуется активная частица. Этот процесс требует затраты энергии и может идти при нагревании вещества, воздействии ионизирующего излучения, действии катализатора.
Например, в реакции синтеза хлороводорода и водорода и хлора, протекающей по цепному механизму (Н2 + Cl2 = 2 HCl), возникновению цепи соответствует процесс
Cl2 2 ∙Сl
Развитие цепи представляет собой периодическое повторение стадий реакции с участием образовавшихся радикалов. Они иначе называются звеньями цепи:
Н2 + ·Cl → HCl + ˙H
˙H + Cl2 → HCl + ˙Cl
H2 + ˙Cl → HCl + ˙H
Cl2 + ˙H → HCl + ˙Cl и т.д.
Длина цепи определяется числом молекул исходного вещества, прореагировавшего в результате одного акта зарождения цепи, до её обрыва.
По особенностям стадии развития цепные реакции делят на неразветвлённые и разветвлённые. В первом случае количество свободных активных частиц-радикалов остаётся неизменным на протяжении всего данного этапа.
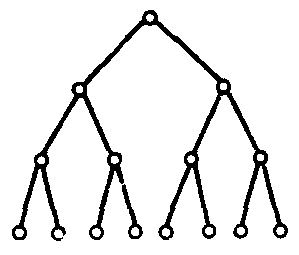
В разветвлённых цепных реакциях расход одной активной частицы приводит к образованию нескольких (двух или более) других активных частиц. Схематически это можно представить следующим образом:
Обрыв цепи соответствует исчезновению активных частиц в результате их взаимодействия друг с другом:
˙ H
+ ˙H = H2
H
+ ˙H = H2
˙Cl + ˙Cl = Cl2 обрыв цепи
˙H + ˙Cl = HCl
Кроме того, он может происходить при адсорбции частиц стенками сосуда, при столкновении двух активных частиц с третьей (называемой ингибитором), которой активные частицы отдают избыточную энергию. Поэтому для цепных реакций характерны зависимость их скорости от размеров, формы и материала реакционного сосуда, от наличия посторонних инертных веществ, выполняющих роль ингибитора.
Скорость неразветвлённых цепных реакций определяется скоростью наиболее медленной стадии, т.е. зарождением цепи. Для каждой стадии в реакциях данного типа используются обычные уравнения химической кинетики (первого или второго порядка).
Разветвлённые химические реакции могут протекать по сложному кинетическому закону и не иметь определённого порядка. «Размножение» радикалов в них часто приводит к лавинообразному течению процесса, которое вызывает взрыв. Однако и в этих реакциях возможен обрыв цепи. Поэтому бурное увеличение скорости процесса (вплоть до взрыва) происходит в том случае, если темп разветвления цепи опрежает темп её обрыва. Теория цепных реакций была разработана в трудах академика Н.Н. Семёнова, С.Н. Хиншельвуда (Англия) и др. учёных.
Существуют цепные реакции, в которых в роли активных частиц выступают не радикалы, а ионы, образующиеся в результате гетеролитического разрыва химической связи:
 А : В → Аˉ:
+ В+
А : В → Аˉ:
+ В+
Подобный механизм на практике часто реализуется в реакциях полимеризации непредельных органических соединений.
