
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Энтропия. Второй закон термодинамики Энтропия
На основании первого начала термодинамики невозможно установить, в каком направлении и до какого предела будет протекать тот или иной процесс, связанный с превращением энергии.
Из наблюдений над естественными явлениями в природе известно, что многие из них осуществляются самопроизвольно (т.е. без внешних воздействий) только в определенном направлении.
Так, теплота передается от более нагретого тела к менее нагретому, газ распространяется из области высокого давления в область низкого, вода стекает по склону только вниз, а не наоборот. В обратном направлении указанные процессы идти не могут, т.к. требуют приложения энергии извне. В связи с этим они являются несамопроизвольными.
Характерной особенностью многих самопроизвольных процессов является то, что их протекание сопровождается уменьшением внутренней энергии или энтальпии системы. Это утверждение справедливо и для большинства химических реакций, которые, как правило, являются экзотермическими, если протекают сами по себе.
Наблюдаемые закономерности можно объяснить, если предположить, что любая система из всех разрешенных ей состояний стремится занять то, в котором будет обладать наименьшим (из возможных для нее) значением внутренней энергии или энтальпии. При этом данное состояние для системы будет наиболее устойчивым.
Однако предсказать направленность самопроизвольного протекания физических и химических процессов только за счет стремления системы к достижению минимального значения своей внутренней энергии удается не всегда, т.к. известны многие физические явления и эндотермические химические реакции, которые идут самопроизвольно, но внутренняя энергия системы при этом возрастает.
Примерами таких процессов являются: растворение в Н2О некоторых твердых солей (NН4NО3, NаСl, KNO3), распад угольной кислоты на газообразный СО2 и жидкую Н2О.
Очевидно, существует еще какая-то причина или мотив, влияющие на возможность осуществления тех или иных явлений. Опытным путем установлено, что таким другим поводом для самопроизвольного протекания процессов в природе является стремление системы к максимальному беспорядку, т.е. к достижению неупорядоченного состояния, которое при данных условиях будет для нее наиболее вероятным (рис. 10).

Рис. 10. Схема, иллюстрирующая самопроизвольный процесс выравнивания концентрации
В связи с этим вводится новая термодинамическая функция энтропия (S), являющаяся мерой упорядоченности системы или мерой вероятности достижения ею того или иного состояния.
Термодинамические системы представляют собой совокупность огромного числа структурных единиц вещества: молекул, ионов, атомов, которые участвуют одновременно в различных видах движения: поступательном, вращательном, колебательном и т.д.
Ранее было показано, что любое состояние системы можно описать как с помощью набора ее макроскопических параметров, так и микроскопических. Причем последние учитывают свойства не всей системы в целом, а каждой ее отдельной структурной единицы, т.е. ее расположение в пространстве, скорость и направление движения, характер этого движения, способ и меру взаимодействия с соседними частицами и т.д. Вследствие теплового движения частиц значения их микроскопических параметров будут постоянно изменяться во времени даже в том случае, если макроскопические параметры системы останутся неизменными, вследствие достижения ею равновесного состояния.
Многочисленные наблюдения позволили сделать вывод, что чем большим числом различных микросостояний структурных единиц вещества может быть описано данное макросостояние системы, тем больше вероятность его осуществления и большее значение при этом примет энтропия самой системы.
Принято, что энтропия чистых веществ, существующих в виде идеальных кристаллов при температуре абсолютного нуля (0оK или –273оС), равна нулю. Это значит, что в данном случае достигается полная упорядоченность системы, в результате чего всякое движение частиц в узлах кристаллической решетки станет невозможным. Таким образом, данное макросостояние системы может быть реализовано только одним определенным расположением структурных единиц друг относительно друга (иначе говоря, лишь одним их микросостоянием).
При повышении температуры число возможных микросостояний частиц возрастает, т.к. появляются и усиливаются колебательные и вращательные движения атомов, ионов или молекул в узлах кристаллической решетки. В связи с этим число возможных вариантов их расположения друг относительно друга тоже увеличивается.
Энтропия системы возрастает не только с повышением температуры, но и при плавлении либо сублимации твердого вещества, кипении жидкости. Сопровождаются увеличением энтропии и процессы расширения газа, растворения кристаллов, химического взаимодействия, протекающего с увеличением числа молекул либо других структурных единиц вещества.
Все процессы, связанные с увеличением упорядоченности системы: охлаждение, кристаллизация из раствора либо расплава, конденсация газа, сжатие газа, химические реакции, протекающие с уменьшением числа структурных единиц вещества (полимеризация, поликонденсация) – наоборот, сопровождаются уменьшением энтропии.
Так как энтропия системы пропорциональна числу ее равновероятных микросостояний (W), то, согласно уравнению Больцмана, она может быть численно определена следующим образом:
S = k · lgW,
где k – коэффициент пропорциональности, называемый иначе константой Больцмана. Он имеет значение 1,38 · 10–23 Дж/K и рассчитывается по формуле:
![]() ,
,
где R – универсальная газовая постоянная;
NA – число Авогадро.
Однако таким образом определить значение энтропии для термодинамической системы нельзя, т.к. не представляется возможным учесть и сосчитать все ее микроскопические состояния.
В 1865 г. Клаузиус предложил другую трактовку понятия энтропии.
Р удольф
Клаузиус (1822 –
1888).
удольф
Клаузиус (1822 –
1888).
Немецкий
физик. Ввел понятие энтропии. Обобщив
работы Карно, Р. Клаузиус определил
функцию S, которая зависит только от
начального и конечного состояния
обратимого процесса и dS =
![]() .
При этом он писал: «Предлагаю величину
S назвать энтропией от греческого
– преобразование.
Я специально так подобрал слово энтропия,
чтобы оно было созвучно со словом
энергия, так как эти две величины
настолько сходны по своему физическому
значению, что созвучие их кажется мне
полезным».
.
При этом он писал: «Предлагаю величину
S назвать энтропией от греческого
– преобразование.
Я специально так подобрал слово энтропия,
чтобы оно было созвучно со словом
энергия, так как эти две величины
настолько сходны по своему физическому
значению, что созвучие их кажется мне
полезным».
Он исходил из того, что движение частиц в любой системе может быть упорядоченным и неупорядоченным. Между этими двумя видами движения существует принципиальная разница.
Упорядоченное движение способно полностью превращаться в неупорядоченное, а переход неупорядоченного движения в упорядоченное никогда не бывает полным. Причина разности между двумя типами движения связана с неодинаковой вероятностью осуществления каждого из них.
Внутренняя энергия идеального газа полностью (а в других системах в значительной степени) определяется неупорядоченным тепловым движением молекул. В то же время совершение работы всегда требует упорядоченного (направленного) движения частиц вещества. Поэтому принципиально невозможно всю внутреннюю энергию системы использовать для совершения работы. Иными словами – любая форма энергии может перейти в теплоту, но теплота преобразуется в другие формы энергии только частично.
Естественность хаотического движения молекул является причиной того, что различные виды энергии стремятся самопроизвольно перейти в теплоту, а теплота передается менее нагретым телам.
Таким образом, запас внутренней энергии системы можно представить в виде двух слагаемых. Ту часть внутренней энергии, которую можно использовать для совершения работы, по предложению Гельмгольца назвали свободной энергией, остальную часть внутренней энергии, которую даже в принципе нельзя превратить в работу, назвали связанной энергией. Она может превращаться только в теплоту и рассеиваться.
Свободная энергия в любой системе заключена в виде потенциальной энергии. По мере совершения системой работы величина ее свободной энергии убывает. Так, более разреженный газ содержит меньше свободной энергии и больше связанной, чем сжатый газ при одной и той же температуре. Следовательно, сжатый газ способен совершить больше полезной работы.
Величина связанной или «обесцененной» части внутренней энергии тем больше, чем меньше разность температур в системе между отдельными ее частями и выше степень неупорядоченности молекул в ней. Таким образом, при самопроизвольных процессах количество свободной энергии в системе должно уменьшаться, а связанной, наоборот, увеличиваться.
Мерой изменения связанной энергии при переходе системы из одного состояния в другое Клаузиус предложил считать изменение ее энтропии. Он показал, что для изотермических обратимых процессов изменение энтропии равняется тепловому эффекту процесса, деленному на температуру системы (в градусах Кельвина):
![]()
Для изобарных процессов, в ходе которых температура системы изменяется от Т1 до Т2 и ее агрегатное состоянии остается одним и тем же, ΔS определяется более сложным образом:
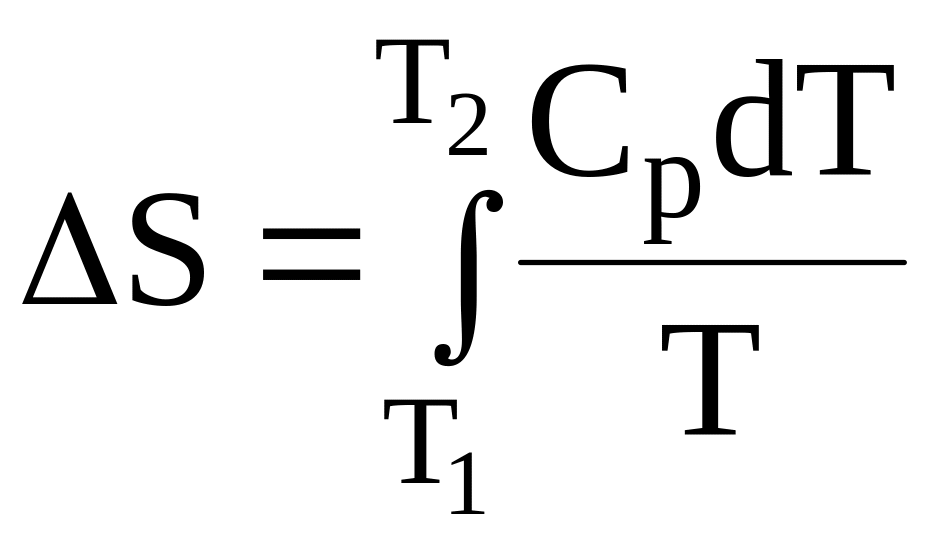
При этом, если Т1 = 0; то ΔS = SТ – S0,
где S0 – энтропия системы при абсолютном нуле; SТ – энтропия системы при температуре Т.
Если S0 = 0, то ΔS = SТ, а значит
![]()
Верхнее выражение позволяет рассчитать энтропию при любой температуре, если известна зависимость изобарной теплоемкости системы (Ср) от температуры в интересующем нас интервале. При температуре плавления и температуре кипения энтропия вещества увеличивается скачкообразно (рис. 11) и ее прирост ΔS можно рассчитать по формуле
![]()
где Qфаз. перехода – теплота, затраченная на плавление или кипение вещества; Тфаз. перехода – температура плавления или кипения вещества.
В общем случае энтропию любого вещества при некоторой температуре Т можно рассчитать по формуле
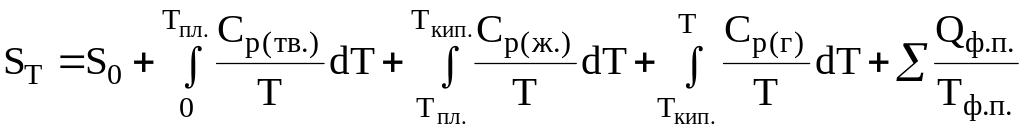

Рис. 11. Зависимость энтропии некоторого вещества от температуры (тв. – твердое вещество; ж. – жидкость; г. – газообразное вещество)
Энтропию вещества, найденную таким образом (т.е. относительно S0 = 0), называют абсолютной энтропией.
Значения
энтропии различных чистых веществ,
определенные в расчете на один их моль
или для растворов веществ с молярной
концентрацией 1 моль/дм3
при Т = 298K
и р = 101,325 кПа называются стандартными
энтропиями
![]() и являются справочными величинами
(табл. 3).
и являются справочными величинами
(табл. 3).
Единица измерения энтропии для вещества (так называемая «энтропийная единица» или сокращенно – э.е.) имеет размерность Дж/моль · K.
Изменение энтропии при протекании какой-либо химической реакции можно вычислить таким же способом, как и изменение энтальпии, т.е. из суммы энтропий продуктов реакции следует вычесть сумму энтропий исходных веществ (с учетом стехиометрических коэффициентов):
![]()
Например, для химической реакции:
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6H2O(ж)
![]() = (
= (![]() (N2(г))
+
(N2(г))
+
![]() (H2O(ж))
– (
(H2O(ж))
– (![]() (O2(г))
+
(O2(г))
+
![]() (NH3(г))
(NH3(г))
Таблица 3. Стандартные энтропии некоторых веществ (Дж/моль • К)
Вещество |
S°298 |
Вещество |
S°298 |
Вещест-во |
S°298 |
Вещество |
S°298 |
Al (г.) Al (тв.) Al3+ (р.) AlCl3(тв.) AlBr3(тв.) Al2O3(тв.) Fe (г.) Fe (тв.) Fe3+(р.) FeO (тв.) Fe2O3 (тв.) NaCl (тв.) |
164,4 28,35 -301 109,3 180,2 50,92 180,4 27,15 -309,3 60,75 87,4 72,12 |
Cl2 (г.) Cl (г.) Cl-(р.) HCl(г.) HCl(р.) ClO2(г.) Cl2O(г.) Br2 (г.) Br2 (ж.) HBr (г.) HI (г.) CaO(тв.) |
229,9 165,1 56,54 186,8 56,5 257,0 266,2 245,5 152,2 198,6 206,5 39,7 |
N2 (г.) NH3 (г.) NH4+(р.) NH4Cl(тв.) NO (г.) NO2 (г.) N2O4 (г.) HNO3 (г.) NO3-(р.) Pбел (тв.) Pкрас (тв.) CO2 (г.) |
199,9 192,6 114,4 95,8 210,6 240,1 304,3 266,9 147,3 41,1 22,8 213,68 |
H2O (г.) H2O(ж.) H2O(тв.) H2 (г.) H+(р.) OH-(р.) O2 (г.) O3 (г.) SO2(г.) SO3 (г.) H2S(г.) CaCO3(тв.) |
188,72 70,08 39,33 130,6 0 -10,87 205,04 238,8 248,1 256,4 205,7 92,9 |
Энтропия является функцией состояния (ее изменение не зависит от пути процесса) и экстенсивным свойством системы (т.е. общая энтропия системы равна сумме энтропий ее составных частей).
В изолированных системах самопроизвольно могут протекать только те процессы, которые сопровождаются увеличением энтропии. Это означает, что состояние устойчивого термодинамического равновесия в такой системе возникает в том случае, если величина ее энтропии достигает своего максимально возможного значения.
Для неизолированных, т.е. закрытых и открытых систем только изменение энтропии, как и изменение одной внутренней энергии, уже не является критерием возможности самопроизвольного протекания процесса.
