
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Принцип энергетического сопряжения
Самопроизвольно протекающие при данных условиях реакции называются экзергоническими; реакции, которые могут протекать только при оказании постоянного воздействия извне называются эндергоническими.
В биологической химии важную роль играет принцип энергетического сопряжения, заключающийся в том, что энергия, необходимая для протекания эндергонической реакции, поступает за счет осуществления экзергонической реакции, причем в этих двух реакциях присутствует общее вещество, называемое интермедиатом.
Наиболее распространенной экзергонической реакцией, вступающей в энергетическое сопряжение в условиях организма, является гидролиз АТФ, сопровождающийся переносом остатка фосфорной кислоты на другой субстрат. Например, при образовании сложного эфира глюкозы и фосфорной кислоты одновременно протекают 2 реакции:
АТФ
+ Н2О → АДФ + Н3РО4; D![]() = -29,2 кДж
= -29,2 кДж
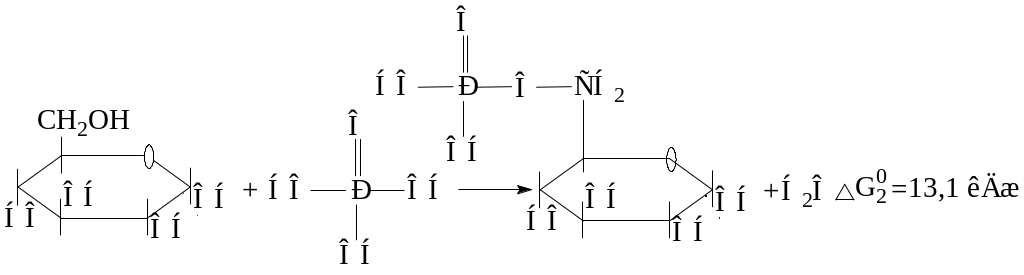
глюкоза глюкозо-6-фосфат
Суммарное уравнение данного процесса можно представить следующим образом:
Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ
Изменение энергии Гиббса будет равно DG0 = –29,2 + 13,1 = –16,1 кДж.
Образование глюкозо-6-фосфата из глюкозы возможно, следовательно, только в результате энергетического сопряжения с экзергонической реакцией, сопровождающейся уменьшением энергии Гиббса. Интермедиатом в этой реакции является фосфорная кислота.
Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
В ходе самопроизвольного процесса энергия Гиббса уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Дальнейшее изменение энергии Гиббса при неизменных условиях становится невозможным, система переходит в состояние химического равновесия. При его наступлении она не может больше совершать полезную работу, поэтому термодинамическим критерием установления равновесия является следующее уравнение:
∆G = 0
Таким образом, любая химическая реакция протекает самопроизвольно только в направлении, приближающем систему к состоянию равновесия. Причем движущей силой данного процесса является изменение изобарно-изотермического потенциала системы ∆G. Чем ∆G меньше, тем дальше система находится от состояния равновесия и тем более она реакционноспособна. Равновесие может существовать только для обратимых реакций.
По признаку обратимости все химические реакции делятся на обратимые и необратимые.
Необратимые химические реакции при данных условиях самопроизвольно протекают только в одном направлении и при этом получившиеся продукты не взаимодействуют друг с другом с образованием исходных веществ. В связи с этим необратимые реакции заканчиваются либо полным расходованием всех исходных веществ (если они взяты в стехиометрическом соотношении), либо – одного из них, находящегося в недостатке (если исходные вещества взяты в нестехиометрическом соотношении). Реакция с высокой долей вероятности будет необратимой, если при ее протекании выделяется или затрачивается большое количество энергии. Исходя из этого, необратимыми являются реакции горения, многие реакции термического разложения сложных веществ, например:
С + О2 = СО2 + Q
СН4 + 2О2 = СО2 + 2Н2О + Q
![]()
![]()
Необратимыми также могут быть реакции, при протекании которых один из продуктов удаляется из сферы реакции в виде осадка либо газа. Это особенно характерно для реакций обмена между электролитами, находящимися в растворенном состоянии, например:
![]()
![]()
Большинство
химических реакций являются обратимыми.
Обратимые реакции протекают
одновременно в двух противоположных
направлениях и не заканчиваются полным
расходованием всех, либо одного из
исходных веществ, поэтому вместо знака
равенства « = » в уравнениях таких реакций
ставится знак обратимости «![]() »
(« ↔ »).
»
(« ↔ »).
В начальный момент времени (когда в системе присутствуют только исходные вещества) протекает лишь прямая реакция, идущая слева направо. Скорость ее при этом будет максимальной, но в дальнейшем (по мере расходования исходных веществ и уменьшения их концентрации) скорость прямой реакции будет падать (рис. 13).
В результате протекания прямой реакции в системе появятся и начнут накапливаться конечные вещества, которые будут взаимодействовать между собой. Это приведет к возникновению обратной реакции, идущей справа налево. Скорость ее в начальный момент времени будет равна нулю, но затем (в связи с увеличением концентрации конечных веществ) начнет плавно возрастать (рис. 13).
С течением времени, любая обратимая реакция заканчивается установлением химического равновесия, т.е. такого состояния системы, при котором скорости прямой и обратной реакции становятся равными (рис. 13). Такое равновесие называется динамическим или подвижным, т.к. обе реакции не прекра-
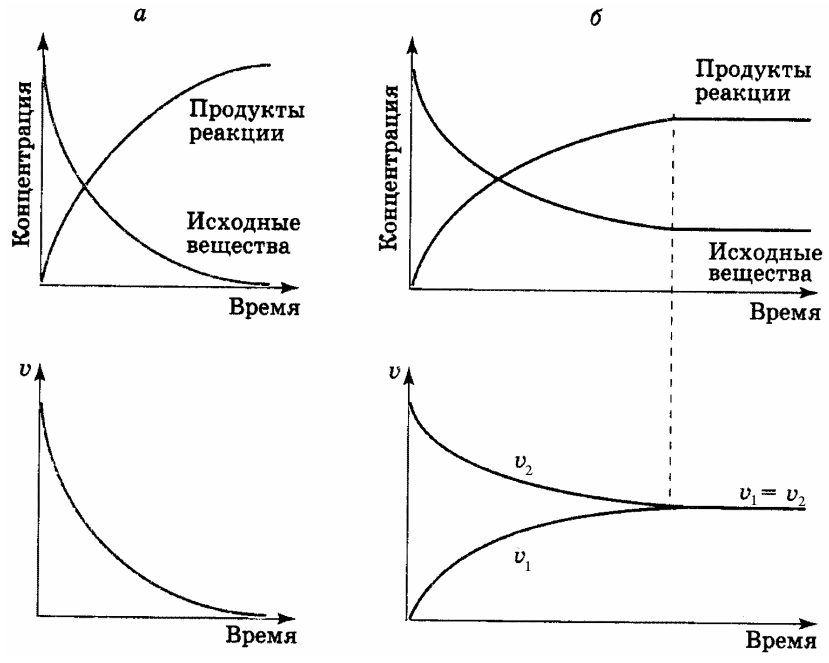
Рис. 13. Изменение концентраций веществ и скоростей необратимой (а) и обратимой (б) реакций.
щаются, но при этом концентрации исходных и конечных веществ остаются неизменными. Они называются иначе равновесными концентрациями.
Это объясняется тем, что в состоянии равновесия число молекул исходных веществ, прореагировавших в единицу времени, равно числу молекул этих же веществ, образовавшихся за то же время из продуктов реакции. До наступления равновесия концентрации исходных веществ непрерывно уменьшаются по сравнению с начальными, а концентрации продуктов реакции, наоборот, возрастают.
Как следует из рисунка 14, состояния химического равновесия в случае обратимой реакции можно достичь двумя путями: из начального состояния системы, в котором находятся только исходные вещества (точка x на графике), либо из начального состояния системы, в котором находятся только продукты реакции (точка y на графике).
Опытным путем было установлено, что для большинства обратимых реакций в условиях их протекания величина |∆G| как прямой, так и обратной реакции обычно не превышает 10 кДж /моль.

Рис. 14. Изменение энергии Гиббса химической системы при протекании в ней обратимой химической реакции
Если же для одной из реакций |∆G| >> 10 кДж /моль, то она становится необратимой по направлению. Следует иметь в виду, что реакции, необратимые в одних условиях, могут стать обратимыми при их изменении.
Многие реакции являются обратимыми в условиях, отличных от стандартных. В этом случае для расчета ∆G химической реакции в состоянии равновесия необходимо использовать ∆G образования исходных и конечных веществ именно для этих, а не стандартных условий.
Установлено, что если реакция осуществляется в газовой фазе, то ∆G образования 1 моля газа при парциальном давлении p (отличном от стандартного значения) равна
∆Gобр = ∆ + RT ln p
Для реакций, протекающих в растворе, ∆G образования вещества рассчитывается аналогично:
∆Gобр = ∆ + RT ln C
где C – равновесная молярная концентрация растворенного вещества, отличная от стандартного значения, т.е. от 1 моль/л.
Рассмотрим обратимую химическую реакцию, протекающую в газовой фазе
aA + bB ↔ cC + dD
Как известно ∆G химической реакции равно сумме ∆G образования продуктов реакции за вычетом суммы ∆G образования исходных веществ (с учетом их стехиометрических коэффициентов)
∆Gх.р. = с ∆Gобр.С + d ∆Gобр.D – a ∆Gобр.A – b ∆Gобр.B =
= с ∆ С + с RT ln pС + d ∆ D + d RT ln pD – a ∆ A – – a RT ln pA – b ∆ B – b RT ln pB;
Данное уравнение можно преобразовать
∆ Gх.р.
= с ∆
С
+ d ∆
D
– a ∆
A
– b ∆
B
+
Gх.р.
= с ∆
С
+ d ∆
D
– a ∆
A
– b ∆
B
+
∆ х.р.
+ с RT ln pС + d RT ln pD – a RT ln pA – b RT ln pB;
В окончательном варианте его можно записать таким образом
∆Gх.р.
= ∆![]() х.р. + RT
ln
х.р. + RT
ln
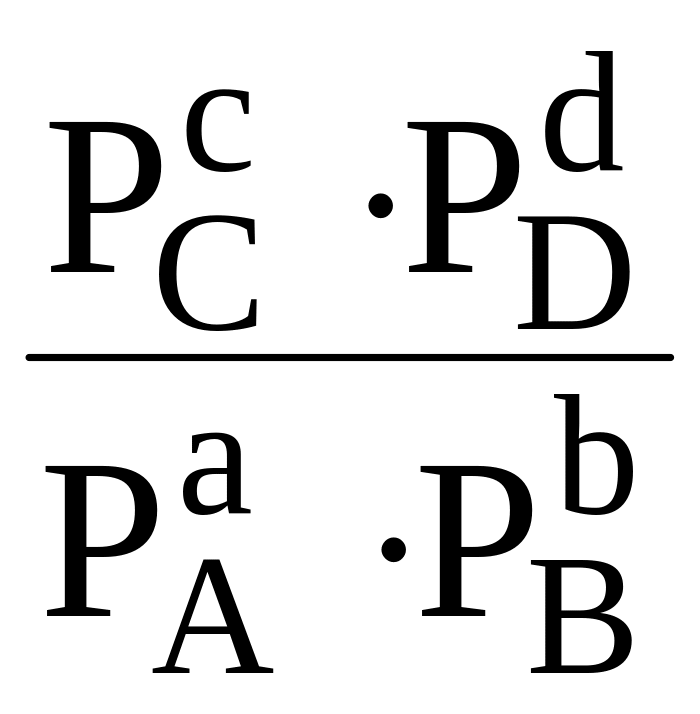
Так как при равновесии ∆Gх.р. = 0, то
∆ х.р. = - RT ln
где PA, PB, PC, и PD являются равновесными парциальными давлениями веществ A, B, C и D.
Как следует из последнего уравнения, выражение под знаком логарифма есть величина постоянная при данной температуре T. Она называется иначе константой химического равновесия Kравн.
Таким образом, для изобарно-изотермических условий
∆G°298 х.р. = - RT ln Kравн.
Рассуждая подобным образом, для этой же реакции
aA + bB ↔ cC + dD,
но уже протекающей в растворе, можем вывести аналогичные уравнения:
1) ∆G
х.р. = ∆
х.р.
+ RT ln
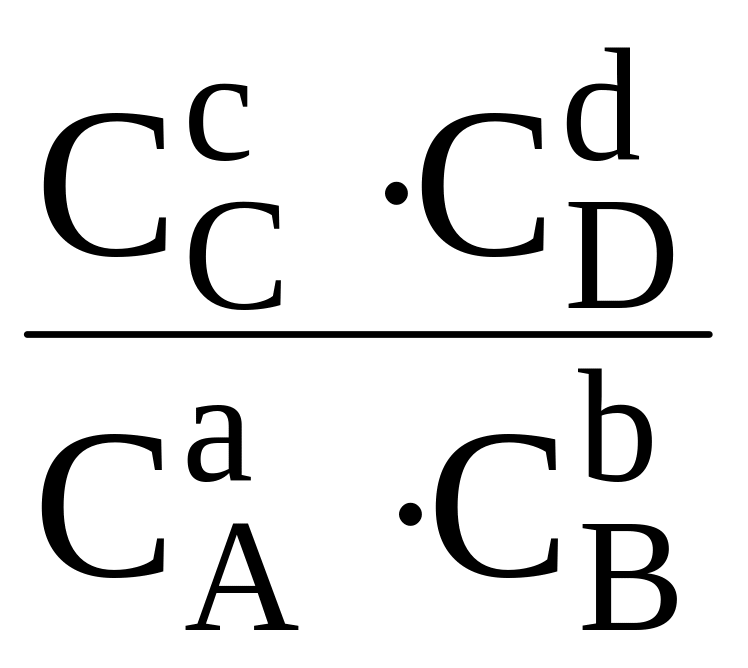
Данное выражение называется иначе уравнением изотермы химической реакции
2) ∆
х.р. = - RT ln
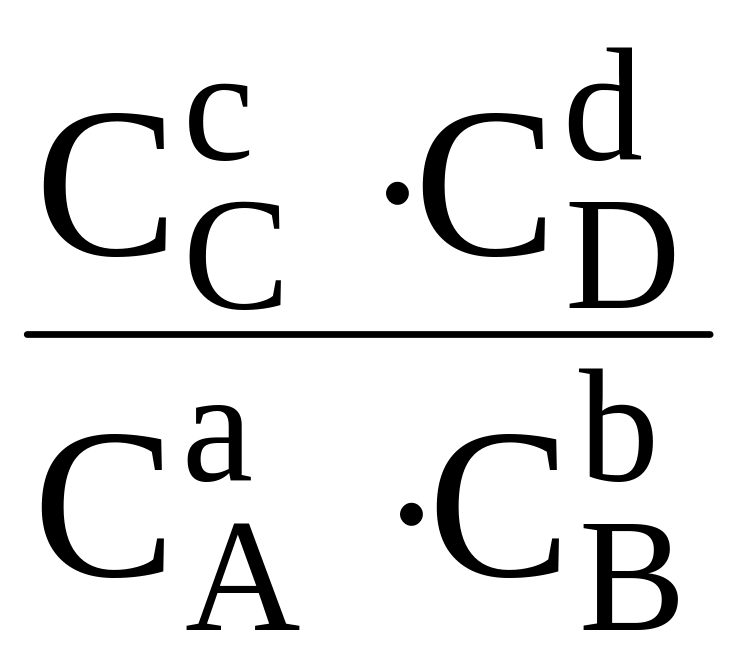
(С учетом того, что в условиях химического равновесия ∆G х.р. = 0).
В этом случае Kравн. =
где СA, СB, СC, и СD – равновесные молярные концентрации исходных и конечных веществ.
Таким образом, Kравн. обратимой реакции, протекающей в растворе при постоянных температуре и давлении равна произведению равновесных молярных концентраций конечных веществ, деленному на произведение равновесных молярных концентраций исходных веществ (с учетом их стехиометрических коэффициентов).
Константа равновесия для данной обратимой реакции есть величина постоянная и при одних и тех же условиях не зависит от равновесных концентраций конечных и исходных веществ, а меняется только от температуры.
Введение в систему катализатора не влияет на величину константы равновесия. Это объясняется тем, что катализатор в равной мере уменьшает энергию активации как прямой, так и обратной реакций, и поэтому на отношение констант их скоростей он не оказывает влияния. Катализатор только изменяет время наступления химического равновесия, т.е. уменьшает при положительном катализе и увеличивает при отрицательном катализе (рис. 15).
Численное значение константы равновесия приблизительно характеризует выход продуктов данной реакции. Например, при К>>1 выход продуктов значителен, т.к. при этом произведение равновесных молярных концентраций конечных веществ много больше произведения аналогичных концентраций исходных веществ, а значит, и сами равновесные молярные концентрации продуктов больше равновесных концентраций исходных веществ.
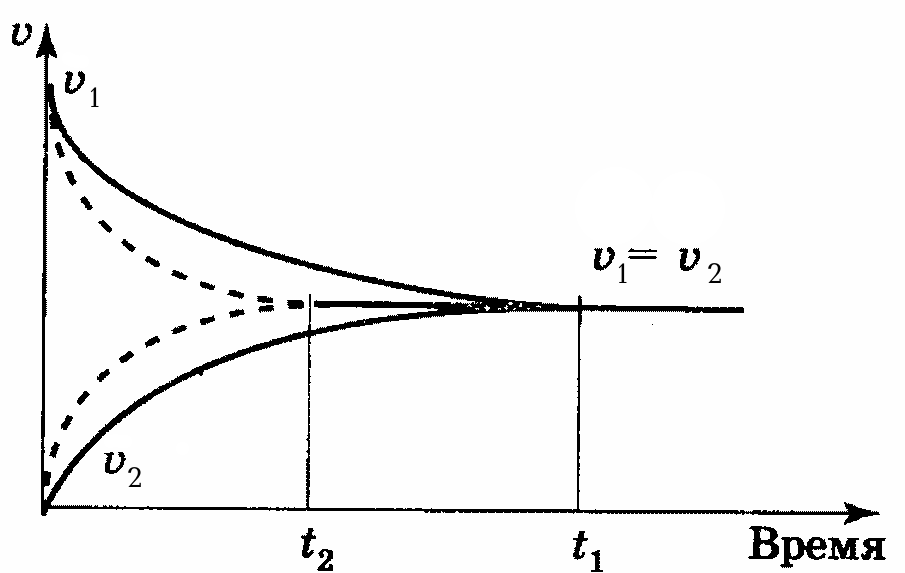
Рис. 15. Влияние катализатора на время установления равновесия в обратимой реакции без катализатора (t1) и в присутствии катализатора (t2).
При К<< 1 (по аналогичной причине) выход продуктов реакции мал.
