
- •170034, Г. Тверь, пр. Чайковского, д. 9, оф. 504,
- •Список сокращений
- •Характеристика системы гемостаза
- •Морфологические компоненты системы гемостаза:
- •Сосудистая стенка
- •Эндотелий
- •Продукты эндотелиоцитов, участвующие в гемостазе
- •Контроль активности тромбоцитов
- •Тромбомодулин
- •Прокоагулянтная роль эндотелия, регуляция сосудистого тонуса
- •Роль эндотелия в регуляции сосудистого тонуса
- •Сосудистая стенка
- •Тканевой фактор
- •Коллаген
- •Тромбоциты
- •Рецепторы мембраны тромбоцитов
- •Рецепторы для высокомолекулярных белков
- •Интегрины
- •Фактор роста тромбоцитов (pdgf)
- •Фактор XIII
- •Адгезия тромбоцитов
- •Тромбоциты
- •Активация тромбоцитов
- •Агрегация тромбоцитов
- •Ретракция сгустка крови
- •Участие моноцитов в свертывании крови
- •Плазменные белки гемостаза
- •1) Многоступенчатый этап, приводящий к акти вации протромбина и превращению его в ак тивный фермент - тромбин;
- •Роль кофакторов и микроокружения в процессе свертывания крови
- •Роль кальция в гемостатических реакциях
- •Ингибиторы ферментов системы гемостаза
- •Антитромбин и гепарин
- •Протеин s
- •Система фибринолиза
- •Активатор плазминогена тканевого типа
- •Внутренний путь активации фибринолиза
- •Внешний путь активации фибринолиза
- •Ингибиторы тканевого активатора плазминогена (pai)
- •Активируемый тромбином ингибитор фибринолиза (tafi)
- •Другие элементы системы фибринолиза
- •Реологические аспекты гемостаза
- •Функция тромбоцитов в различных гемодинамических условиях
- •Современная теория свертывания крови
- •Особенности физиологии и исследования гемостаза у плодов, новорожденных и детей раннего возраста
- •Тромбоциты
- •О собенности физиологии и исследования гемостаза у женщин при менструации и беременности
- •Клинический пример 1
- •Обеспечение диагностики нарушении гемостаза в
- •Подбор антикоагулянтов
- •Динамический анализ функции тромбоцитов
- •2 Агонистов (индукторов агрегации) возможно селективное выделение аспириновых тромбоцитопа-тий. По типу измерения pfa-100 является динамическим агрегометром.
- •Тромбоцитокрит (рст)
- •Агрегация тромбоцитов
- •Клинический пример 2
- •Исследования агрегации тромбоцитов в образцах цельной крови
- •Молекулярно-биологические методы
- •Коагуляционные методы
- •Ручные методы
- •Автоматизированные коагулометры
- •Оптико-механические коагулометры
- •Турбидиметрические коагулометры
- •Нефелометрические коагулометры
- •Преимущества и недостатки различных методов обнаружения сгустка
- •Иммунохимические методы
- •Скрининговые тесты оценки плазменного звена гемостаза
- •Диагностическое значение ачтв
- •Использование ачтв для выявления волчаночного антикоагулянта
- •Контроль лечения гирудином
- •Скрининговый тест на основе ачтв для оценки антикоагулянтной активности протеина с
- •Протромбиновое время
- •3) Протромбиновое отношение (по), которое определяется как
- •Тканевые тромбопластины
- •Протромбиновый тест (пт) по Квику
- •0,5 Г/л (врожденная или приобретенная гипо/
- •Рептилазное время (батроксобиновое время)
- •Турбидиметрический метод
- •Интерпретация результатов
- •Определение фактора Виллебранда (vWf)
- •Определение фактора VII с использованием хромогенного субстрата
- •Определение протромбина (фактора II) с использованием хромогенного субстрата
- •Определение фактора XIII
- •Преаналитические факторы, влияющие на результаты определения гепарина
- •Определение протеина с
- •Определение протеина s
- •Определение антитромбина
- •Тесты аля исслелования фибринолитической системы
- •Определение α2-антиплазмина
- •Опрелеление ингибитора активатора плазминогена типа 1 (pai-1)
- •Паракоагуляционные тесты
- •Стандарты воз
- •Внутрилабораторный контроль качества
- •Патология гемостаза
- •Без правильных современных лабораторных исследований невозможно лечение и профилактика нарушений гемостаза.
- •Гемофилия а
- •Коагулограмма при гемофилии а
- •Исследование восстановления фактора VIII в крови
- •Клинический пример 3
- •500 Me 1 раз в 2 дня. Исследование коагулог-раммы через год показало отсутствие ингибитора к ф.VIII у пациента.
- •Клинический пример 4
- •Патология гемостаза
- •VWf:Ag - антиген фактора Виллебранда, vWf:rCo - коллаген-связывающая активность фактора Виллебранда, ф.VIII - фактор коагуляции VIII, а-д - аутосомно-доминантное, а-р - аутосомно-рецессивное.
- •Клинический пример 5
- •Клинический пример 6
- •Иммунная тромбоцитопеническая пурпура (итп)
- •Клинический пример 7
- •3 Недель.
- •Приобретенный ингибитор к фактору VIII (приобретенная гемофилия а)
- •Клинический пример 8
- •Приобретенный ингибитор к фактору V
- •Приобретенные ингибиторы к протромбину, факторам VII и X
- •Приобретенные ингибиторы к фибриногену, фибрину, ф.Хiii и промежуточным продуктам
- •Приобретенный дефицит витамина к
- •Лечение антикоагулянтами непрямого действия, отравление антагонистами витамина к
- •Клинический пример 9
- •Лабораторные тесты при тромбофилии
- •Клинический пример 10
- •Дефицит протеина с
- •Клинический пример 11
- •Дефицит протеина s
- •Мутация протромбина 20210а
- •Дефицит антитромбина
- •Гипергомоцистеинемия
- •Клинический пример 12
- •Высокая активность фактора VIII и фактора Виллебранда
- •Дисфибриногенемия
- •Антифосфолипидный синдром и волчаночный антикоагулянт
- •Клинический пример 14
- •110%, Ачтв 45,9 с (норма 28-40 с), активность ф.Iх 68%, ф.Хi 80%, ф.Хii 96%, ф.VIII 120%, скринин-говый тест на волчаночный антикоагулянт положительный.
- •Клинический пример 15
- •Клинический пример 16
- •Фибринолитическая терапия
- •Этиология и патогенез двс
- •Виды двс-синдрома
- •Тромбоцитарно-сосудистый гемостаз при двс-синдроме
- •Плазменный гемостаз при двс-синдроме
- •И фазы двс-синдрома
- •Клинический пример 18
- •Наиболее значимые факторы патологического тромбообразования у детей первого полугодия жизни
- •Приложение
- •Новорожденных в первые 6 месяцев жизни
- •В течение первых 6 месяцев жизни
- •У детей первых 6 месяцев жизни
- •По сравнению с взрослыми
- •По сравнению с взрослыми
- •Обеспечение качества лабораторной
- •Вторичные комплексные нарушения
Ингибиторы тканевого активатора плазминогена (pai)
Ингибитор активатора плазминогена 1-го типа (PAI-1). Это специфический ингибитор тканевого активатора плазминогена (t-PA) и урокиназы (u-РА). Помимо этого он подавляет активацию фибринолиза стрептокиназой.
PAI-1 обнаружен в плазме и тромбоцитах. В плазме он связан с витронектином. PAI-1 синтезируется в эндотелиальных клетках. Синтез усиливается при их стимуляции липополисаха-ридами плазматических мембран бактерий (эндотоксином), провоспалительными цитокина-ми, такими, как ИЛ-1 или ФНО-α, а также тромбином. Наиболее значительная стимуляция происходит в условиях сепсиса и при обширных тромбозах.
PAI-1 ингибируется протеином С. Таким образом, протеин С ингибирует не только активированные факторы Va и VIIIa, но и PAI-1, проявляя, следовательно, профибринолитическую активность.
Ингибитор тканевого активатора плазминогена 2-го типа (PAI-2) обнаружен в очень низких концентрациях в плазме, но может существенно повышаться при беременности. Он в большей степени ингибирует активность u-РА, чем t-PA.
Ингибитор тканевого активатора плазминогена 3-го типа (PAI-3). Это, по-видимому, относительно слабый ингибитор. Он подавляет активацию плазминогена протеином С. Диагностического значения определение PAI-2 и PAI-3 пока не имеют.
Активируемый тромбином ингибитор фибринолиза (tafi)
TAFI (карбоксипептидаза Y, или плазменная карбоксипептидаза В) - один из наиболее важных ингибиторов фибринолиза. Его неактивная форма - прокарбоксипептидаза Y - активируется тромбином, связанным с тромбомодулином, и, вероятно, трипсином, калликреином, плазмином до активной карбоксипептидазы Y или TAFI.
Механизм ингибирования фибринолиза кар-боксипептидазой Y отличается от описанных выше. TAFI разрушает каталитическую поверхность фибрина (лизин-связывающий сайт), необходимую для активации плазминогена t-PA. Кроме того, в более высокой концентрации TAFI обладает прямой ингибирующей активностью по отношению к плазминогену.
TAFI играет большую роль в формировании гемостатического тромба, предотвращая его преждевременный лизис. Однако для активизации достаточного количества ингибитора необходим значительный избыток тромбина, превышающий количество, необходимое для образования фиб-ринового сгустка. Видимо, этим объясняется повышение фибринолиза у лиц с гемофилией и дефицитом фактора XI.
Определение TAFI проводится методом ELISA. Повышение TAFI зарегистрировано при тромбозах и при применении тромболитических препаратов. Обнаружена корреляция между концентрацией и активностью TAFI, с одной стороны, и временем, в течение которого лизируется сгусток крови.
Другие элементы системы фибринолиза
Аполипопротеин (а). Аполипопротеин (а) конкурирует с плазминогеном и t-PA за связь с фибрином, что приводит к снижению активности процесса фибринолиза. Кроме того, было показано, что в присутствии аполипопротеина (а) уменьшается активация плазминогена на поверхности фибрина.
Витронектин. Витронектин стабилизирует PAI-1 в его активной конформации, являясь, по сути, его кофактором, и повышает период полураспада последнего. Кроме того, он способствует клиренсу PAI-1 липопротеинами низкой плотности.
Система фибринолиза
Лизис фибринового сгустка. Продукты деградации фибрина/фибриногена и D-димеры
Плазмин является очень активной и в то же время относительно неспецифичной сериновой протеазой, которая разрушает фибрин и фибриноген. Образующиеся вследствие этого молекулы, имеющие разную молекулярную массу, обозначаются как продукты деградации фибрина/ фибриногена (ПДФ).
Продуктами деградации фибрина в основном являются комплексы DDE и D-димеры (рис. 60).
Помимо фибрина, плазмин способен активно деградировать фибриноген, особенно в тех случаях, когда вводятся активаторы фибринолиза (фибринолитики). В результате лизиса фибриногена образуются меньшие фрагменты X, Y, D и Е (рис. 61), а D-димеры не образуются.
Некоторые фрагменты ПДФ обладают выраженной физиологической активностью. Они снижают агрегацию тромбоцитов и нарушают поли-
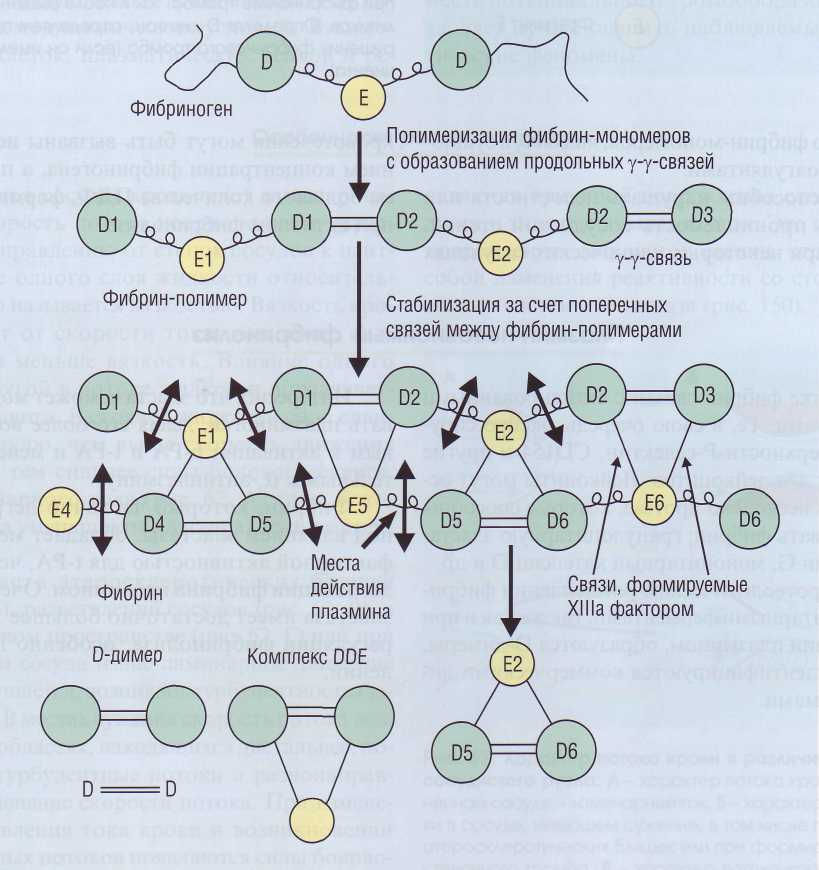
Рис. 60. Образование фибрина из фибриногена и формирование D-димеров при деградации фибрина плазмином
Система фибринолиза
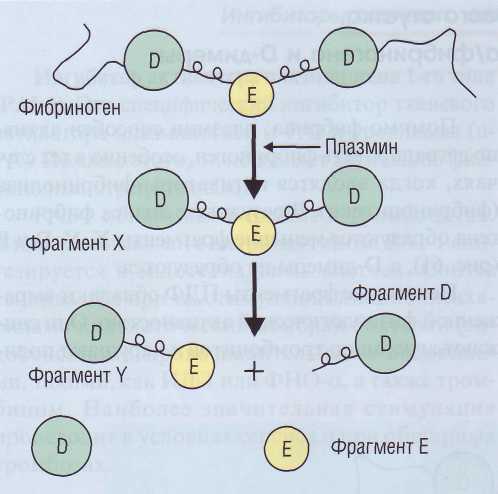
меризацию фибрин-мономеров, являясь, в сущности, антикоагулянтами.
ПДФ способны нарушать целостность или повышать проницаемость сосудистой стенки. Поэтому при некоторых клинических ситуациях
кровотечения могут быть вызваны не уменьшением концентрации фибриногена, а присутствием большого количества ПДФ, формирующихся при активном фибринолизе.
Плазмин-независимый фибринолиз
В сгустке фибрин связан с активированными тромбоцитами. Те, в свою очередь, экспрессиру-ют на поверхности Р-селектин, CD154 и другие рецепторы для лейкоцитов. Лейкоциты могут освобождать несколько протеаз, которые способны деградировать фибрин: гранулоцитарную эласта-зу, катепсин G, моноцитарный катепсин D и др.
При протеолитическом расщеплении фибрина лейкоцитарными ферментами, так же как и при расщеплении плазмином, образуются D-димеры, которые идентифицируются коммерческими ди-агностикумами.
Интересно, что эластаза может модифицировать плазминоген, делая его более восприимчивым к активации u-РА и t-PA и менее чувствительным к α2-антиплазмину.
Фибрин, который частично деградировал под влиянием эластазы, обладает меньшей ко-факторной активностью для t-PA, чем в случае деградации фибрина плазмином. Очевидно, что эластаза имеет достаточно большое значение в регуляции фибринолиза, особенно при воспалении.
Реологические аспекты гемостаза
