
- •170034, Г. Тверь, пр. Чайковского, д. 9, оф. 504,
- •Список сокращений
- •Характеристика системы гемостаза
- •Морфологические компоненты системы гемостаза:
- •Сосудистая стенка
- •Эндотелий
- •Продукты эндотелиоцитов, участвующие в гемостазе
- •Контроль активности тромбоцитов
- •Тромбомодулин
- •Прокоагулянтная роль эндотелия, регуляция сосудистого тонуса
- •Роль эндотелия в регуляции сосудистого тонуса
- •Сосудистая стенка
- •Тканевой фактор
- •Коллаген
- •Тромбоциты
- •Рецепторы мембраны тромбоцитов
- •Рецепторы для высокомолекулярных белков
- •Интегрины
- •Фактор роста тромбоцитов (pdgf)
- •Фактор XIII
- •Адгезия тромбоцитов
- •Тромбоциты
- •Активация тромбоцитов
- •Агрегация тромбоцитов
- •Ретракция сгустка крови
- •Участие моноцитов в свертывании крови
- •Плазменные белки гемостаза
- •1) Многоступенчатый этап, приводящий к акти вации протромбина и превращению его в ак тивный фермент - тромбин;
- •Роль кофакторов и микроокружения в процессе свертывания крови
- •Роль кальция в гемостатических реакциях
- •Ингибиторы ферментов системы гемостаза
- •Антитромбин и гепарин
- •Протеин s
- •Система фибринолиза
- •Активатор плазминогена тканевого типа
- •Внутренний путь активации фибринолиза
- •Внешний путь активации фибринолиза
- •Ингибиторы тканевого активатора плазминогена (pai)
- •Активируемый тромбином ингибитор фибринолиза (tafi)
- •Другие элементы системы фибринолиза
- •Реологические аспекты гемостаза
- •Функция тромбоцитов в различных гемодинамических условиях
- •Современная теория свертывания крови
- •Особенности физиологии и исследования гемостаза у плодов, новорожденных и детей раннего возраста
- •Тромбоциты
- •О собенности физиологии и исследования гемостаза у женщин при менструации и беременности
- •Клинический пример 1
- •Обеспечение диагностики нарушении гемостаза в
- •Подбор антикоагулянтов
- •Динамический анализ функции тромбоцитов
- •2 Агонистов (индукторов агрегации) возможно селективное выделение аспириновых тромбоцитопа-тий. По типу измерения pfa-100 является динамическим агрегометром.
- •Тромбоцитокрит (рст)
- •Агрегация тромбоцитов
- •Клинический пример 2
- •Исследования агрегации тромбоцитов в образцах цельной крови
- •Молекулярно-биологические методы
- •Коагуляционные методы
- •Ручные методы
- •Автоматизированные коагулометры
- •Оптико-механические коагулометры
- •Турбидиметрические коагулометры
- •Нефелометрические коагулометры
- •Преимущества и недостатки различных методов обнаружения сгустка
- •Иммунохимические методы
- •Скрининговые тесты оценки плазменного звена гемостаза
- •Диагностическое значение ачтв
- •Использование ачтв для выявления волчаночного антикоагулянта
- •Контроль лечения гирудином
- •Скрининговый тест на основе ачтв для оценки антикоагулянтной активности протеина с
- •Протромбиновое время
- •3) Протромбиновое отношение (по), которое определяется как
- •Тканевые тромбопластины
- •Протромбиновый тест (пт) по Квику
- •0,5 Г/л (врожденная или приобретенная гипо/
- •Рептилазное время (батроксобиновое время)
- •Турбидиметрический метод
- •Интерпретация результатов
- •Определение фактора Виллебранда (vWf)
- •Определение фактора VII с использованием хромогенного субстрата
- •Определение протромбина (фактора II) с использованием хромогенного субстрата
- •Определение фактора XIII
- •Преаналитические факторы, влияющие на результаты определения гепарина
- •Определение протеина с
- •Определение протеина s
- •Определение антитромбина
- •Тесты аля исслелования фибринолитической системы
- •Определение α2-антиплазмина
- •Опрелеление ингибитора активатора плазминогена типа 1 (pai-1)
- •Паракоагуляционные тесты
- •Стандарты воз
- •Внутрилабораторный контроль качества
- •Патология гемостаза
- •Без правильных современных лабораторных исследований невозможно лечение и профилактика нарушений гемостаза.
- •Гемофилия а
- •Коагулограмма при гемофилии а
- •Исследование восстановления фактора VIII в крови
- •Клинический пример 3
- •500 Me 1 раз в 2 дня. Исследование коагулог-раммы через год показало отсутствие ингибитора к ф.VIII у пациента.
- •Клинический пример 4
- •Патология гемостаза
- •VWf:Ag - антиген фактора Виллебранда, vWf:rCo - коллаген-связывающая активность фактора Виллебранда, ф.VIII - фактор коагуляции VIII, а-д - аутосомно-доминантное, а-р - аутосомно-рецессивное.
- •Клинический пример 5
- •Клинический пример 6
- •Иммунная тромбоцитопеническая пурпура (итп)
- •Клинический пример 7
- •3 Недель.
- •Приобретенный ингибитор к фактору VIII (приобретенная гемофилия а)
- •Клинический пример 8
- •Приобретенный ингибитор к фактору V
- •Приобретенные ингибиторы к протромбину, факторам VII и X
- •Приобретенные ингибиторы к фибриногену, фибрину, ф.Хiii и промежуточным продуктам
- •Приобретенный дефицит витамина к
- •Лечение антикоагулянтами непрямого действия, отравление антагонистами витамина к
- •Клинический пример 9
- •Лабораторные тесты при тромбофилии
- •Клинический пример 10
- •Дефицит протеина с
- •Клинический пример 11
- •Дефицит протеина s
- •Мутация протромбина 20210а
- •Дефицит антитромбина
- •Гипергомоцистеинемия
- •Клинический пример 12
- •Высокая активность фактора VIII и фактора Виллебранда
- •Дисфибриногенемия
- •Антифосфолипидный синдром и волчаночный антикоагулянт
- •Клинический пример 14
- •110%, Ачтв 45,9 с (норма 28-40 с), активность ф.Iх 68%, ф.Хi 80%, ф.Хii 96%, ф.VIII 120%, скринин-говый тест на волчаночный антикоагулянт положительный.
- •Клинический пример 15
- •Клинический пример 16
- •Фибринолитическая терапия
- •Этиология и патогенез двс
- •Виды двс-синдрома
- •Тромбоцитарно-сосудистый гемостаз при двс-синдроме
- •Плазменный гемостаз при двс-синдроме
- •И фазы двс-синдрома
- •Клинический пример 18
- •Наиболее значимые факторы патологического тромбообразования у детей первого полугодия жизни
- •Приложение
- •Новорожденных в первые 6 месяцев жизни
- •В течение первых 6 месяцев жизни
- •У детей первых 6 месяцев жизни
- •По сравнению с взрослыми
- •По сравнению с взрослыми
- •Обеспечение качества лабораторной
- •Вторичные комплексные нарушения
1) Многоступенчатый этап, приводящий к акти вации протромбина и превращению его в ак тивный фермент - тромбин;
Рис.
37. Каскад активации плазменного
гемостаза

Внешний путь образования протромбиназы
Внешний путь образования протромбиназы короткий, что ведет к быстрому образованию тромбина.
При контакте ТФ и ф.VIIа формируется комплекс, который активирует ф.Х. Фактор Ха при участии фактора Va, в присутствии ионов Са2+, на отрицательно заряженной фосфолипидной поверхно-
сти формирует протромбиназу. В настоящее время полагают, что внешний путь - основной физиологический путь запуска процесса свертывания крови. Подробно его значение будет описано в разделе «Современная теория свертывания крови».
Активность внешнего пути поддерживается за счет механизма положительной обратной свя-
Плазменные белки гемостаза

Рис. 38. Внешний каскад свертывания крови. Начинается с контакта крови с тканевым фактором (ТФ), который, взаимодействуя с ф.VIIа, образует комплекс, активирующий ф,Х, Усиление активности внешнего каскада свертывания крови обеспечивается 2 механизмами положительной обратной связи
Внутренний путь образования протромбиназы. Факторы контактной активации
 Внутренний
путь активации свертывания начинается
с активации контактных факторов
коа-гуляционного
каскада: ф.ХII,
прекалликреина и высокомолекулярного
кининогена.
Внутренний
путь активации свертывания начинается
с активации контактных факторов
коа-гуляционного
каскада: ф.ХII,
прекалликреина и высокомолекулярного
кининогена.
Факторы контактной активации - ф.ХII, пре-калликреин, высокомолекулярный кининоген, С1-ингибитор - синтезируются в печени. In vitro эти белки участвуют в активации внутреннего каскада свертывания.
В лабораторных условиях активация происходит на некоторых небиологических отрицательно заряженных поверхностях, например на стекле, каолине, кремнии, сульфате декстрана, а также в присутствии эллаговой кислоты. Имеются данные, что важным механизмом активации контактных факторов является их взаимодействие с поверхностью, характеризующейся свойствами твердой фазы. В патологических условиях контактная активация, вероятно, происходит на мембранах клеток крови и эндотелия, а также при контакте с коллагеном субэндотелия.
Схематично взаимодействие белков при контактной активации показано на рис. 39. Видимо, в «подходящих условиях» происходит аутоактивация и взаимоактивация ф.ХII, ПК до активных ферментов. In vitro активация контактной системы приводит к активации ф.ХI, который в свою очередь активирует ф.IХ, образующий с ф.VIII теназный комплекс. Теназный комплекс (название комплекса происходит от английского слова ten - десять) активирует ф.Х, а далее процесс свертывания идет по уже описан-
ному пути. Поскольку сборка теназного комплекса происходит на фосфолипидной поверхности, для нее необходимо присутствие ионов кальция. Контактная фаза активации поддерживается положительной обратной связью. Тромбин активирует ф.VIII и -XI.
Физиологическое значение контактной активации, роль факторов контактной активации в процессе свертывания крови, физиологические активаторы и условия активации этих факторов в организме требуют дальнейшего изучения.

Рис. 39. Контактная фаза активации плазменных факторов. Контакт с поверхностью твердого тела вызывает активацию фактора XII, который запускает каскад свертывания плазмы, каскад активации фибринолиза, активацию калликреин-кининовой системы (положительная обратная связь) и активацию системы комплемента (отрицательная обратная связь)
Плазменные белки гемостаза
Классическая теория свертывания крови оставляла слишком много вопросов и противоречила клиническим данным. Например, с одной стороны, было неясно, какая поверхность в физиологических условиях является активатором, с другой стороны, почему дефицит факторов внутреннего пути (ф.VIII, -IX, -XI) приводит к выраженной кровоточивости при нормальной активности факторов внешнего пути, а глубокий дефицит факторов контактной активации, как правило, не сопровождается геморрагическим синдромом. В современной каскадно-матричной теории гемостаза эти противоречия разрешены.
С современной точки зрения, контактная активация играет большую роль во взаимодействии системы свертывания крови с другими протеоли-тическими системами крови (фибринолитичес-кой, ангиотензин-рениновой, калликреин-кини-новой, системой комплемента и др.).
В настоящее время изучены следующие функции белков контактной активации:
1. Брадикинин стимулирует повышение внутри клеточной концентрации цАМФ и приводит к:
Вазодилатации и снижению артериально го давления.
Активации системы фибринолиза путем стимуляции секреции тканевого актива тора плазминогена.
Ингибированию активации тромбоцитов.
Стимуляции репарации и росту гладкомы- шечной ткани в поврежденных сосудах.
Прямое ингибирование тромбин-индуциро- ванной активации тромбоцитов.
Активация фибринолиза.
Непосредственная активация плазмино гена калликреином и ф.ХIIа. Однако оба этих белка значительно менее активны, чем тканевой активатор и урокиназа.
Активация калликреином проурокиназы до активной сериновой протеазы - двух- цепочечной урокиназы.
Блокада клеточной адгезии.
Антиангиогенное действие.
По-видимому, контактная активация играет важную роль в активации свертывания кро ви при взаимодействии крови с нефизиоло гическими поверхностями, в частности при установке искусственных протезов или искус ственных клапанов сердца.
Внутренний путь образования протромбиназы (рис. 40) включает активирующее действие ф.ХПа на ф.Х1, который в свою очередь активирует ф.1Х. Поскольку значение контактной активации в процессе свертывания крови переосмыслено, физиологическая роль ф.Х1 изучается. Видимо, в физиологических условиях ф.Х1 в основном активируется тромбином. ф.Х1 довольно устойчив к инактивации ингибиторами и имеет длительный период полувыведения. Образовавшись в достаточном количестве, ф.Х1 увеличивает количество активного ф.1Х, за счет чего соответственно значительно возрастает концентрация тромбина, который в свою очередь активирует по механизму положительной обратной связи ф.1Х, -VIII и -V. В то же время избыток тромбина тормозит начало процесса фибри-
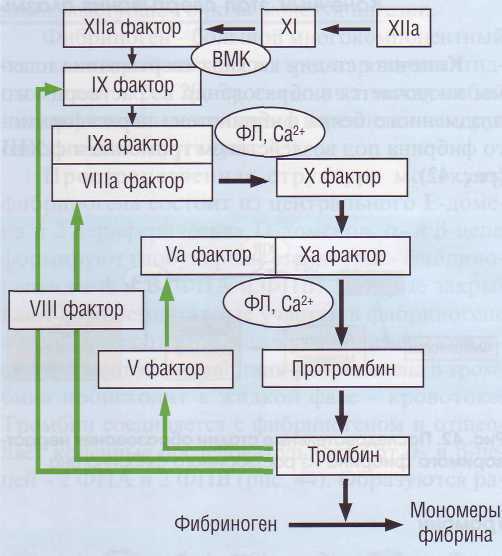
Рис. 40. Внутренний каскад активации плазменного гемостаза. Начинается с взаимной активации контактных факторов системы гемостаза, Фактор XIIа переводит фактор XI в ХIа. Фактор ХIа активирует фактор IX. Все последующие этапы активации свертывания по внутреннему пути требуют ионов Са2+ и зависят от присутствия фосфоли-пидов. Фактор IХа активирует фактор X, но эта реакция не очень эффективная. Однако появившийся тромбин активирует фактор VIII. Активный фактор Villa вместе с фактором IХа, ионами Са2+ и фосфолипидами очень эффективно активирует фактор Ха, Обратная связь поддерживает развитие процесса за счет активации тромбином ф.VIII, -IX и -V
Плазменные белки гемостаза
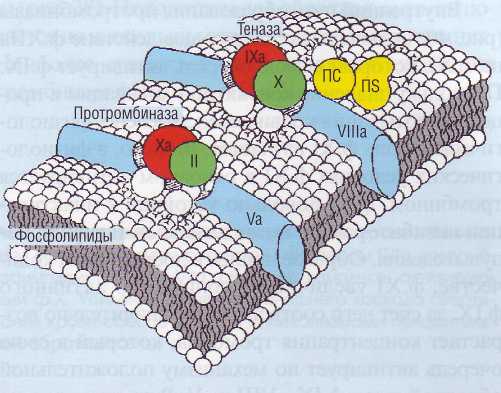
нолиза за счет активируемого тромбином ингибитора фибринолиза (TAFI).
Ингибитор С1-компонента комплемента (С1-ингибитор) является элементом системы контактной активации. Помимо комплемента, он ингибирует ф.ХIIа (см. раздел «Ингибиторы системы свертывания крови»).
Другим ингибитором процесса контактной активации в физиологических условиях является апротинин.
Рис. 41. Теназный и протромбиназный комплексы. Образование этих комплексов сопровождается резким увеличением активации соответственно фактора X и протромбина (фактор II)
Конечный этап свертывания плазмы - образование фибринового сгустка
Конечная стадия каскада свертывания плазмы заключается в образовании из растворимого плазменного белка фибриногена нерастворимого фибрина под воздействием тромбина и ф.ХIII (рис. 42).
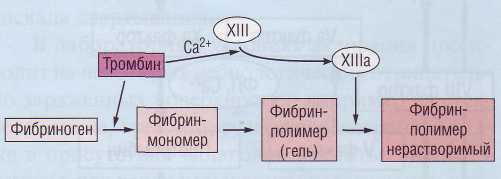
Рис. 42. Последовательные стадии образования нерастворимого фибрина из растворимого фибриногена
Тромбин
Тромбин - ключевой фермент гемостаза. Тромбин - витамин-К-зависимый белок - является сериновой протеазой. В печени происходит синтез неактивного предшественника протромбина, который в дальнейшем циркулирует в плазме. В комплексе ф.Ха-Va-II на фосфолипидной поверхности происходит ограниченный протео-лиз протромбина. Образуется несколько активных структур с уменьшающейся молекулярной массой - мезотромбин, α-тромбин, β-тромбин, γ-тромбин. Наиболее значимым продуктом является сериновая протеаза - α-тромбин. На мо-
лекуле тромбина имеется, по крайней мере, 4 сайта связывания для субстратов, ингибиторов, кофакторов и иона кальция. Это, а также способность тромбина активно функционировать не только на твердой фазе, но и в токе крови позволяет ему выполнять многочисленные функции. Важнейшие функции тромбина в гемостазе:
Ограниченный протеолиз фибриногена до фибрин-мономеров (происходит в жидкой фазе - кровотоке).
Активация ф.V, -VIII, -VII, -XI.
Активация тромбоцитов.
В комплексе с тромбомодулином тромбин активирует протеин С.
Активация ф.ХIII.
Ограниченный протеолиз плазматической карбоксипептидазы В до активной формы - активируемого тромбином ингибитора фиб ринолиза (TAFI).
• Стимуляция выброса из эндотелиоцитов тка невого активатора плазминогена. Однако роль тромбина в организме не огра ничивается вышеперечисленными функциями. Ключевая роль в процессе свертывания крови, активация сосудистого эндотелия, клеточный рост и процессы репарации, активация перифе рических клеток крови, активация фибриноли за - это наиболее изученные функции тромби на. Видимо, со временем этот список значитель но увеличится.
Плазменные белки гемостаза
Косвенным подтверждением важности тромбина для организма может служить тот факт, что известны лишь единичные описания пациентов с гомозиготным дефектом молекулы тромбина, а пациенты с гипопротромбинемией встречаются чрезвычайно редко.
Важнейшим ингибитором тромбина является антитромбин III. Несколько меньшую роль играет кофактор гепарина П.
Фактор XIII
Фактор XIII - трансглютаминаза. В плазме большая часть неактивного ф.ХIII связана с фибриногеном. Активация ф.ХIII происходит путем ограниченного протеолиза неактивного ф.ХIII тромбином одновременно с отщеплением пептида А от фибриногена. Как и большинство других ферментов, он выполняет несколько функций в гемостазе:
Стабилизирует фибриновый сгусток путем образования ковалентных связей между у-це- пями мономеров фибрина.
Участвует в связывании, α-ингибитора плаз- мина с фибрином, что способствует предотв ращению преждевременного лизиса фибрино- вого сгустка.
Значительную роль ф.ХIII играет в процес сах полимеризации актина, миозина и других компонентов цитоскелета тромбоцитов, что чрезвычайно важно для активации тромбо цитов и ретракции образовавшегося фибри- нового сгустка. Это объясняет наличие ф.ХIII в цитоплазме тромбоцитов.
Обнаружены перекрестные реакции ф.ХIII с ф.V, фон Виллебранд протеином. Помимо непосредственно реакций гемостаза,
ф.ХIII участвует в процессах образования соединительной ткани, репаративных реакциях:
Участвует в связывании молекул фибронек- тина между собой и с молекулами фибрина. Вероятно, это важно для направленной миг рации клеток и процессов репарации.
Играет роль в биосинтезе коллагена, катали зируя образование связей между молекулами коллагена типов I, II, III и V.
крови и образовывать прочную объемную структуру, которая эффективно закрывает повреждение сосуда и предотвращает потерю крови. Концентрация фибриногена в крови здорового человека значительно выше, чем концентрация других белков гемостаза, что связано с его уникальной ролью.
Синтез фибриногена происходит в печени и не зависит от витамина К. Некоторое количество фибриногена синтезируется в мегакариоцитах и содержится в тромбоцитах. Этот фибриноген несколько отличается от фибриногена, синтезированного в печени.
Помимо гепатоцитов и мегакариоцитов, активность гена γ-цепей фибриногена обнаружена в некоторых других тканях - головном мозге, легких, костном мозге, где γ-цепи фибриногена, видимо, выступают в роли молекул адгезии.
Фибриноген - большой многокомпонентный белок, который состоит из трех пар полипептидных цепей - 2α, 2β, 2γ, связанных между собой дисульфидными мостиками и переплетенных друг относительно друга (рис. 43).
Пространственная структура молекулы фибриногена состоит из центрального Е-доме-на и 2 периферических D-доменов. α- и β-цепи формируют глобулярные структуры - фибрино-пептиды А и В (ФПА и ФПВ), которые закрывают комплементарные участки в фибриногене и не позволяют этой молекуле полимеризовать-ся. Процесс взаимодействия фибриногена и тромбина происходит в жидкой фазе - кровотоке. Тромбин соединяется с фибриногеном и отщепляет конечные последовательности от α- и β-це-пей - 2 ФПА и 2 ФПВ (рис. 44). Образуются ра-
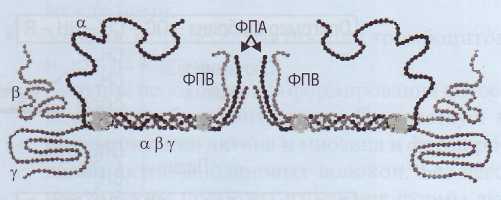
Фибриноген.
Формирование гемостатического тромба
Фибриноген - уникальная молекула, обладающая свойством быстро полимеризоваться в токе
Рис. 43. Фибриноген состоит из 3 парных белковых молекул α, β и γ, Фибринопептиды А и В (ФПА и ФПВ) отщепляются тромбином от фибриногена, инициируя тем самым процесс полимеризации и превращение фибриногена в фибрин
Плазменные белки гемостаза
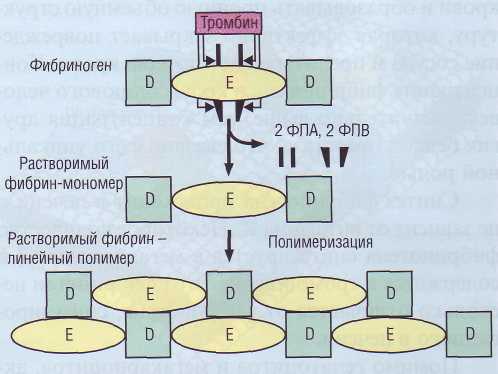
Рис. 44. Формирование фибрин-мономеров из фибриногена. Тромбин отщепляет фибринопептиды ФПА и ФПВ от молекулы фибриногена, тем самым образуются растворимые мономеры фибрина, которые способны полимери-зоваться до линейного полимера, или «растворимого фибрина»
створимые мономеры фибрина. В дальнейшем происходит спонтанное соединение комплиментарных участков фибрин-мономеров. Сначала образуются димеры, далее олигомеры и в конечном итоге собираются мононити полимери-зованного фибрина. Таким образом, фибрино-вая цепь формируется спонтанной, конец в конец полимеризацией фибрин-мономеров, при которой концевая часть одного мономера взаимодействует с центральной частью другого мономера в месте отщепления ФПА. Результатом такой полимеризации является линейный полимер шириной в 2 молекулы (рис. 44). На этом этапе фибрин легко растворим в 5-молярной
мочевине, поэтому он получил название растворимого фибрина.
Соединяясь с фибриногеном, тромбин не только отщепляет фибринопептиды. но и активирует связанный с ним фактор XIII. Фактор ХIIIа образует ковалентные связи между γ-цепями (D-доме-нами) нитей растворимого фибрина (рис. 45), которые соединяются за счет образования пептидных мостиков между боковыми радикалами лизина и глютамина. Сшитые между собой мононити фибрина образуют прочную сеть, менее подверженную фибринолизу и более устойчивую к механическим воздействиям. В такой форме фибрин не растворяется в 5-молярной мочевине и называется нерастворимым фибрином.
Рис. 46. Организованный тромб, в котором в фибрино-вую сеть включены клетки крови
Образовавшийся фибриновый сгусток - трехмерная молекулярная сеть, в которую включены тромбоциты, эритроциты и лейкоциты (рис. 46). Активированные тромбоциты, связанные с нитями фибрина через рецепторы GPIIb-IIIa, сокращают-
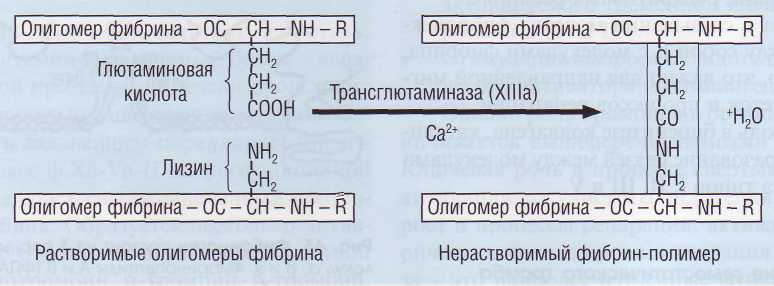
Рис. 45. Образование нерастворимого фибрина под влиянием фактора ХIIIа
Плазменные белки гемостаза
ся под действием тромбостенина (тромбоцитарно-го актомиозина) вследствие присущих им контрак-тильных свойств (см. главу «Тромбоциты»). Происходит ретракция сгустка крови. Сгусток уплотняется, из него выдавливается часть сыворотки. Формирование окончательного тромба наступает на 10-15-й минуте после полимеризации фибрина.
Если тромбоциты отсутствуют или имеют дефект GPIIb-IIIa, то ретракции кровяного сгустка не происходит и он быстро лизируется в процессе фибринолиза. При отсутствии ретракции тромба в сосудистом русле возможен отрыв тром-ботических масс и эмболия удаленных сосудов (тромбоэмболия).
