
- •170034, Г. Тверь, пр. Чайковского, д. 9, оф. 504,
- •Список сокращений
- •Характеристика системы гемостаза
- •Морфологические компоненты системы гемостаза:
- •Сосудистая стенка
- •Эндотелий
- •Продукты эндотелиоцитов, участвующие в гемостазе
- •Контроль активности тромбоцитов
- •Тромбомодулин
- •Прокоагулянтная роль эндотелия, регуляция сосудистого тонуса
- •Роль эндотелия в регуляции сосудистого тонуса
- •Сосудистая стенка
- •Тканевой фактор
- •Коллаген
- •Тромбоциты
- •Рецепторы мембраны тромбоцитов
- •Рецепторы для высокомолекулярных белков
- •Интегрины
- •Фактор роста тромбоцитов (pdgf)
- •Фактор XIII
- •Адгезия тромбоцитов
- •Тромбоциты
- •Активация тромбоцитов
- •Агрегация тромбоцитов
- •Ретракция сгустка крови
- •Участие моноцитов в свертывании крови
- •Плазменные белки гемостаза
- •1) Многоступенчатый этап, приводящий к акти вации протромбина и превращению его в ак тивный фермент - тромбин;
- •Роль кофакторов и микроокружения в процессе свертывания крови
- •Роль кальция в гемостатических реакциях
- •Ингибиторы ферментов системы гемостаза
- •Антитромбин и гепарин
- •Протеин s
- •Система фибринолиза
- •Активатор плазминогена тканевого типа
- •Внутренний путь активации фибринолиза
- •Внешний путь активации фибринолиза
- •Ингибиторы тканевого активатора плазминогена (pai)
- •Активируемый тромбином ингибитор фибринолиза (tafi)
- •Другие элементы системы фибринолиза
- •Реологические аспекты гемостаза
- •Функция тромбоцитов в различных гемодинамических условиях
- •Современная теория свертывания крови
- •Особенности физиологии и исследования гемостаза у плодов, новорожденных и детей раннего возраста
- •Тромбоциты
- •О собенности физиологии и исследования гемостаза у женщин при менструации и беременности
- •Клинический пример 1
- •Обеспечение диагностики нарушении гемостаза в
- •Подбор антикоагулянтов
- •Динамический анализ функции тромбоцитов
- •2 Агонистов (индукторов агрегации) возможно селективное выделение аспириновых тромбоцитопа-тий. По типу измерения pfa-100 является динамическим агрегометром.
- •Тромбоцитокрит (рст)
- •Агрегация тромбоцитов
- •Клинический пример 2
- •Исследования агрегации тромбоцитов в образцах цельной крови
- •Молекулярно-биологические методы
- •Коагуляционные методы
- •Ручные методы
- •Автоматизированные коагулометры
- •Оптико-механические коагулометры
- •Турбидиметрические коагулометры
- •Нефелометрические коагулометры
- •Преимущества и недостатки различных методов обнаружения сгустка
- •Иммунохимические методы
- •Скрининговые тесты оценки плазменного звена гемостаза
- •Диагностическое значение ачтв
- •Использование ачтв для выявления волчаночного антикоагулянта
- •Контроль лечения гирудином
- •Скрининговый тест на основе ачтв для оценки антикоагулянтной активности протеина с
- •Протромбиновое время
- •3) Протромбиновое отношение (по), которое определяется как
- •Тканевые тромбопластины
- •Протромбиновый тест (пт) по Квику
- •0,5 Г/л (врожденная или приобретенная гипо/
- •Рептилазное время (батроксобиновое время)
- •Турбидиметрический метод
- •Интерпретация результатов
- •Определение фактора Виллебранда (vWf)
- •Определение фактора VII с использованием хромогенного субстрата
- •Определение протромбина (фактора II) с использованием хромогенного субстрата
- •Определение фактора XIII
- •Преаналитические факторы, влияющие на результаты определения гепарина
- •Определение протеина с
- •Определение протеина s
- •Определение антитромбина
- •Тесты аля исслелования фибринолитической системы
- •Определение α2-антиплазмина
- •Опрелеление ингибитора активатора плазминогена типа 1 (pai-1)
- •Паракоагуляционные тесты
- •Стандарты воз
- •Внутрилабораторный контроль качества
- •Патология гемостаза
- •Без правильных современных лабораторных исследований невозможно лечение и профилактика нарушений гемостаза.
- •Гемофилия а
- •Коагулограмма при гемофилии а
- •Исследование восстановления фактора VIII в крови
- •Клинический пример 3
- •500 Me 1 раз в 2 дня. Исследование коагулог-раммы через год показало отсутствие ингибитора к ф.VIII у пациента.
- •Клинический пример 4
- •Патология гемостаза
- •VWf:Ag - антиген фактора Виллебранда, vWf:rCo - коллаген-связывающая активность фактора Виллебранда, ф.VIII - фактор коагуляции VIII, а-д - аутосомно-доминантное, а-р - аутосомно-рецессивное.
- •Клинический пример 5
- •Клинический пример 6
- •Иммунная тромбоцитопеническая пурпура (итп)
- •Клинический пример 7
- •3 Недель.
- •Приобретенный ингибитор к фактору VIII (приобретенная гемофилия а)
- •Клинический пример 8
- •Приобретенный ингибитор к фактору V
- •Приобретенные ингибиторы к протромбину, факторам VII и X
- •Приобретенные ингибиторы к фибриногену, фибрину, ф.Хiii и промежуточным продуктам
- •Приобретенный дефицит витамина к
- •Лечение антикоагулянтами непрямого действия, отравление антагонистами витамина к
- •Клинический пример 9
- •Лабораторные тесты при тромбофилии
- •Клинический пример 10
- •Дефицит протеина с
- •Клинический пример 11
- •Дефицит протеина s
- •Мутация протромбина 20210а
- •Дефицит антитромбина
- •Гипергомоцистеинемия
- •Клинический пример 12
- •Высокая активность фактора VIII и фактора Виллебранда
- •Дисфибриногенемия
- •Антифосфолипидный синдром и волчаночный антикоагулянт
- •Клинический пример 14
- •110%, Ачтв 45,9 с (норма 28-40 с), активность ф.Iх 68%, ф.Хi 80%, ф.Хii 96%, ф.VIII 120%, скринин-говый тест на волчаночный антикоагулянт положительный.
- •Клинический пример 15
- •Клинический пример 16
- •Фибринолитическая терапия
- •Этиология и патогенез двс
- •Виды двс-синдрома
- •Тромбоцитарно-сосудистый гемостаз при двс-синдроме
- •Плазменный гемостаз при двс-синдроме
- •И фазы двс-синдрома
- •Клинический пример 18
- •Наиболее значимые факторы патологического тромбообразования у детей первого полугодия жизни
- •Приложение
- •Новорожденных в первые 6 месяцев жизни
- •В течение первых 6 месяцев жизни
- •У детей первых 6 месяцев жизни
- •По сравнению с взрослыми
- •По сравнению с взрослыми
- •Обеспечение качества лабораторной
- •Вторичные комплексные нарушения
Ингибиторы ферментов системы гемостаза
Среди ингибиторов ферментов системы гемостаза, в свою очередь, можно условно выделить 2 группы - ингибиторы сериновых протеаз и неспецифические ингибиторы протеаз, к которым относится α2-макроглобулин.
Ингибиторы сериновых протеаз, или серпи-ны. Большинство ферментов каскада свертывания крови составляют сериновые протеазы. Се-риновыми протеазами также являются ферменты фибринолитической системы, некоторые ферменты системы комплемента, эластаза, трипсин, химотрипсин и многие другие. Все они имеют гомологичную структуру. Существует группа ингибиторов, специфичных для сериновых протеаз, - серпины. Механизм их ингиби-рующего действия изучен довольно хорошо. Серпины имеют строение, похожее на строение субстрата сериновых протеаз. Однако, охотно соединяясь с ферментами, серпины не подвергаются немедленному расщеплению. Это соеди-
нение блокирует ферментативную активность сериновой протеазы (рис. 48). Различные серпины несколько отличаются по строению, могут быть более или менее специфично ингиби-ровать разные ферменты. Кроме того, на актив-
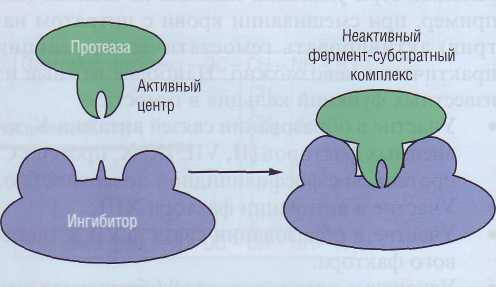
Рис. 48. Ингибирование активных сериновых протеаз серпинами за счет образования стабильного неактивного фермент-субстратного комплекса
Плазменные белки гемостаза
ность и специфичность серпинов может влиять микроокружение.
Антитромбин и гепарин
Антитромбин (синоним - антитромбин III, AT) - гликопротеин, состоит из 432 аминокислот и имеет 4 участка гликолизации с разным количеством сиаловых кислот. Этот ингибитор формирует стабильный 1:1 комплекс с сериновыми протеа-зами плазменного гемостаза. Кроме того, AT связывается со специфическими сульфатными группами на пентасахаридных структурах гепарина.
AT синтезируется в печени и является наиболее значимым ингибитором системы свертывания крови. Активности находящегося в крови здорового человека антитромбина достаточно, чтобы ингиби-ровать в три раза больше тромбина, чем может образоваться из циркулирующего протромбина. Несмотря на это, уже при снижении активности AT в плазме ниже 60% возрастает риск патологических тромбозов. При изолированном дефиците активности AT риск тромботических проявлений возрастает пропорционально степени снижения активности. Помимо тромбина, AT ингибирует фактор Ха, а также факторы IХа, ХIа, ХIIа и калликреин.
Антитромбин по структуре гомологичен α1 -антитрипсину. В его активном центре присутствует специфическая связь Arg-Ser, которая и взаимодействует с сериновыми протеазами.
Рис. 49. Влияние гепарина на активность фактора Ха в плазме. Гепарин существенно усиливает ингибирующий эффект антитромбина на фактор Ха
Активность AT в десятки тысяч раз усиливается в присутствии отрицательно заряженных гли-козаминогликанов, таких, как гепарансульфат, входящих в структуру гликокаликса на поверхности эндотелиальных клеток. Аналогичное потенциру-
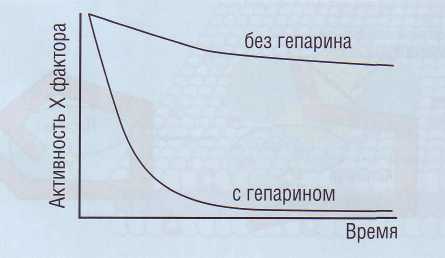
ющее действие на AT оказывает гепарин (рис. 49), вырабатываемый тучными клетками. Антикоагу-лянтное действие гепарина связано с его способностью вызывать конформационные изменения AT. Функция гепарина каталитическая. После образования эквимолярного 1:1 комплекса тромбин-антитромбин (ТАТ) гепарин может освобождаться для организации других комплексов.
Нефракционированный гепарин представляет собой смесь гепаринов различной молекулярной массы. До последнего времени он широко применялся в клинической практике как антикоагулянт. В настоящее время большее распространение получили препараты низкомолекулярного гепарина (НМГ, английская аббревиатура - LMWH), который получается из гепарина химической или энзиматической обработкой. Гепарин не только значительно усиливает активность AT, но и модулирует его ингиби-торную активность. Для стабилизации комплекса ТАТ гепарин должен быть представлен структурой, имеющей, по крайней мере, 18 моносахаридных оснований. Нефракционированный гепарин связывается одновременно как с ферментом, так и с AT, тогда как НМГ связывается только с молекулой AT (рис. 50). Нефракционированный гепарин усиливает активность AT в отношении всех сериновых про-теаз каскада свертывания крови, тогда как низкомолекулярный - в основном в отношении ф.Ха.
Наиболее эффективно AT «работает» в токе крови. В составе протромбиназного комплекса (рис. 41), содержащем также фосфолипиды, Са и ф.Vа, фактор Ха лучше защищен от ингибирова-ния комплексом АТ-гепарин.
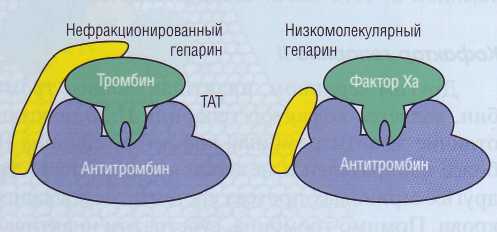
Рис. 50. Эффект нефракционированного гепарина
(молекулярная масса до 30 кДа) по стабилизации комплекса тромбин-антитромбин и низкомолекулярного гепарина (молекулярная масса 3 кДа), предпочтительно влияющего в качестве кофактора на образование комплекса фактор Ха - антитромбин, ТАТ - тромбин-антитромбино-вый комплекс
Плазменные белки гемостаза
Гепарин и НМГ широко используются для профилактики и лечения тромбозов.
Антикоагулянтное действие гепарина можно быстро и обратимо снять внутривенным введением протаминсульфата - основного белка, содержащегося в сперме рыб и ковалентно связывающегося с гепарином. Гепарин, помимо активации AT, обладает дополнительными антикоагулянтны-ми эффектами. Очень важной функцией является нейтрализация гепарином тромбоцитарного фактора 4, который освобождается из а-гранул, а также стимуляция гепарином освобождения из сосудистой стенки ингибитора внешнего пути (TFPI) и кофактора гепарина П.
Серьезным осложнением гепаринотерапии может быть развитие гепариновой тромбоцито-пении и рикошетных тромбозов (см. раздел «Тромбоцитопения, вызванная гепарином»).
Комплекс тромбин-антитромбин
Продукт взаимодействия тромбина и AT (ТАТ) - неактивный комплекс, в нем тромбин и AT быстро теряют свою активность. ТАТ удаляется из системы циркуляции печенью в течение нескольких минут. Увеличение ТАТ в системе циркуляции свидетельствует о развитии гиперкоагуляции с увеличением образования тромбина. В частности, ТАТ повышен у пациентов с гипергомоцис-теинемией, которая вызывает, по-видимому, воспалительную реакцию на уровне эндотелиальных клеток. У таких больных увеличен риск тромбо-эмболической болезни и окклюзии артериальных сосудов. После лечения фолиевой кислотой и витамином В6 ТАТ значительно снижается.
Кофактор гепарина II
Другим серпином, инактивирующим тромбин, является кофактор гепарина П. Однако, в отличие от антитромбина, кофактор гепарина II более избирателен и не ингибирует активность других сериновых протеаз системы свертывания крови. Помимо тромбина, субстратом инактивации для кофактора гепарина II являются химо-трипсин и катепсин Н.
С1-ингибитор
С1-ингибитор (Cl-Ing) - наиболее важный ингибитор факторов контактной активации (см. раз-
дел «Внутренний путь образования протромби-назы. Факторы контактной активации»). С1-ин-гибитор-высокогликозилированный серпин, ин-гибирующий факторы ХПа, ХIа, калликреин, плазмин и субкомпоненты Clr и Cls первого компонента системы комплемента.
Вклад С1-ингибитора в систему гемостаза, вероятно, не очень велик, так как его дефицит не проявляется ни кровоточивостью, ни тромбозами. Основное проявление дефицита С1-ингибитора -рецидивирующие ангионевротические отеки.
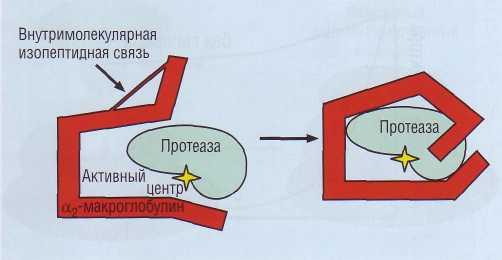
α2-макроглобулин
Рис. 51. Ингибирование активных протеаз за счет погружения фермента внутрь макромолекулы α2-макрогло-булина
α2-макроглобулин - гликопротеид, неспецифический ингибитор протеаз. Это крупный белок с молекулярной массой 725 000 Да. Механизм его действия отличается от такового у серпинов. Он действует по принципу мышеловки, у которой дверца захлопывается после попадания объекта внутрь (рис. 51). Образуя связи с внутренними пептидами α2-макроглобулина, протеазы не могут расщепить такой высокомолекулярный субстрат. α2-макроглобулин имеет большую емкость по связыванию протеиназ, но относительно низкое сродство. Он включается в физиологическую инактивацию протеиназ после истощения других ингибиторов, обладающих высоким сродством, но относительно низкой емкостью. Он инактивирует большинство протеаз, включая ферменты системы свертывания крови и фибринолиза. Потребление α2-макроглобулина обычно обнаруживают в состояниях повышенной протеолитической активности, в частности при панкреатитах. У новорожденных содержание α2-макроглобулина примерно в 2 раза выше, чем у взрослых.
Плазменные белки гемостаза
Ингибиторы коферментов
 Наиболее
значимым ингибитором в этой группе
является система протеина С.
Наиболее
значимым ингибитором в этой группе
является система протеина С.
Система протеина С
Система протеина С включает непосредственно сам протеин С (ПС) и его кофактор протеин S (ITS). Другими компонентами системы являются мембранный белок тромбомодулин (ТМ), рецептор протеина С на эндотелиальных клетках (РПСЭК) и С4-связывающий протеин. Система протеина С вместе с антитромбином и ингибитором внешнего пути - наиболее важные и эффективные компоненты, очищающие плазму от активированных кофакторов плазменного гемостаза и ограничивающие процесс свертывания крови.
Протеин С
Протеин С (ПС) - витамин-К-зависимый белок плазмы, синтезируется в печени. Активированный протеин С (АПС) является специфической сериновой протеазой, сходной по структуре с другими витамин-К-зависимыми сериновыми протеазами. Основная функция его в гемостазе -инактивация факторов Va и VIIIa. Помимо это-
го, он ингибирует PAI, что приводит к усилению фибринолиза.
Активация ПС происходит на поверхности эндотелиальных клеток. ПС связывается с РПСЭК на эндотелиальной мембране и контактирует с комплексом тромбин-тромбомодулин. Происходит ограниченный протеолиз неактивного ПС с образованием активной сериновой про-теазы.
АПС способен инактивировать факторы Va и Villa, расположенные на мембране активированных тромбоцитов или других клеток, в присутствии ионов Са2+. Протеин S является кофактором этой реакции (рис. 52). Механизм инактивации факторов Va и VIII протеином С заключается в их лизисе. Время полувыведения АПС из плазмы примерно 15 мин.
Фактор Виллебранда (vWF) защищает ф.VШ от протеолитического воздействия протеина С. При типе 2N болезни Виллебранда мутация затрагивает сайт vWF, связывающий ф.VIII. Последний лишается защиты и подвергается ускоренному разрушению АПС, что приводит к снижению его активности в крови. ф.VIII в комплексе с ф.IХ и ф.V в комплексе с ф.Х также относительно защищены от инактивации. Основным ин-

Рис. 52. Деградация активных факторов Va и Villa активированным протеином С (АПС), Транспортный С4-связыва-ющий протеин (С4-СП) доставляет протеин S (F1S), участвующий как кофактор в формировании комплексов на фосфоли-пидной мембране
Плазменные белки гемостаза
гибитором АПС является PAI-3, который иногда обозначают как протеин С ингибитор (ПСИ, в английской аббревиатуре PCI), другим ингибитором АПС является α2-макроглобулин.
Значение протеина С в системе гемостаза чрезвычайно велико. Пациенты с дефицитом протеина С страдают венозными и артериальными тромбозами. Выраженность тромбофилии коррелирует с тяжестью дефицита этого белка. Пациенты с гомозиготным дефицитом протеина С не описаны, видимо, это состояние не совместимо с жизнью.
