
- •Введение
- •Тема 1: Строение и свойства аминокислот. Методы исследования аминокислот.
- •7. Этапы занятия и контроль их усвоения
- •Тема 2: Структурная организация белковых молекул. Методы количественного определения белка.
- •7. Этапы занятия и контроль их усвоения
- •Количественные методы определения белков
- •Лабораторная работа №2
- •Основные понятия фотоколориметрии
- •Устройство и принцип работы фотоэлектроколориметра
- •Тестовый контроль по теме « Строение белковой молекулы»
- •Тема 3 Физико-химические свойства растворов белков. Диализ. Осадочные реакции. Разделение смеси белков методом электрофореза.
- •2. Цель занятия:
- •3. Конкретные задачи:
- •5. Задание для самоподготовки:
- •Практическое применение осадочных реакций
- •Лабораторная работа № 3
- •Реактивы и оборудование
- •II.Диализ
- •III. Фракционное высаливание белков. Разделение альбуминов и глобулинов
- •Iy.Электрофорез
- •Осадочные пробы на белок
- •Тема 4: "Изучение свойств и биологической роли витаминов водорастворимой группы. Методы исследования свойств витаминов и количественного определения витамина с.
- •6. Вопросы для самоподготовки:
- •Лабораторная работа № 4 Количественное определение витамина с (аскорбиновой кислоты) в пищевых продуктах и в моче по методу Тильманса
- •Определение содержания витамина «с» в хвое и свежей капусте.
- •Определение содержания витамина «с» в сыром и вареном картофеле и в квашеной капусте.
- •Содержание витамина «с» в различных продуктах и моче
- •Тестовый контроль по теме « Витамины»
- •Установите строгое соответствие
- •3. Конкретные задачи.
- •4. Мотивация.
- •6. Вопросы для самоподготовки:
- •Специфичность действия ферментов
- •Тема 6: "Активация и ингибирование ферментов.
- •3. Конкретные задачи.
- •Лабораторная работа №6 Количественное определение активности сывороточной холинэстеразы. Изучение ингибирующего действия карбофоса и активирующего действия ионов кальция.
- •Клиническое значение определения активности сывороточной хэ.
- •Количественное определение активности тканевых дегидрогеназ и изучение действия их ингибиторов
- •Применение метода в санитарно-гигиенических исследованиях
- •Количественное определение активности дегидрогеназы янтарной кислоты (сукцинатдегидрогеназы, к. Ф. 1.3.99.1) тетразолиевым методом
- •Определение общей активности лактатдегидрогеназы (к.Ф. 1.1.1.27) и ее изоферментов.
- •Клиническое значение определения активности лактатдегидрогеназы.
- •Методы определения активности ферментов
- •Тест 12
- •Тест 13
- •Тест 14
- •Тест 15
- •Тема 7: "Энзимодиагностика и энзимотерапия. Клинико-диагностическое значение определения белкового спекра крови."
- •Тема 8 Программа контрольной работы по теме «Химия белков и ферментов. Витамины».
- •195067, Санкт-Петербург, Пискаревский пр.,д. 47
- •394019, Г. Воронеж, ул. Еремеева, 22ж
7. Этапы занятия и контроль их усвоения
N п\п |
Этапы проведения занятия |
Формы проведения |
Время (мин.) |
7.1 |
Постановка задачи. |
Излагает преподаватель. |
5 |
7.2 |
Разбор теоретического материала. |
Опрос студентов. Студенты пишут на доске формулы ами-окислот и пептидов обсуждают свойства аминокислот.
|
90 |
7.3 |
Приобретение практических навыков Выполнение практической части занятия, оформление про-токолов работы и подписание протоколов преподавателем. |
|
70 |
7.4 |
Подведение итогов занятия. Задание на дом |
Излагает преподаватель. |
5 |
Лабораторная работа № 1
Цветные реакции на белки.
Цель работы: используя цветные реакции на белки, обнаружить белок в растворе. Открыть функциональные группы исследуемых аминокислот. УИРС ¾ на основании полученных данных сделать заключение об амино-кислотном составе и полноценности двух белков - яичного и желатины.
Проведение цветных реакций основано на образовании окрашенных соединений в результате взаимодействия того или иного реактива с опреде-ленными функциональными группами, входящими в состав молекулы белка.
Существует два типа цветных реакций:
1. Универсальные – биуретовая (характерна для всех белков и доказы-вает наличие пептидной связи) и нингидриновая (определяет наличие NH2 – группы в a - положении у аминокислот и белков):
2. Специфические реакции, характерные для отдельных аминокислот, содержащих специфические функциональные группы.
Универсальные реакции на белки.
Биуретовая реакция. В результате взаимодействия ионов двухва-лентной меди с пептидными связями в щелочной среде образуется комп-лексное соединение, окрашенное в красно-фиолетовый цвет. Название реак-ции обословлено тем, что биурет (продукт конденсации двух молекул моче-вины NH2-CO-NH-CO-NH2 в аналогичных условиях дает такой же комплекс.
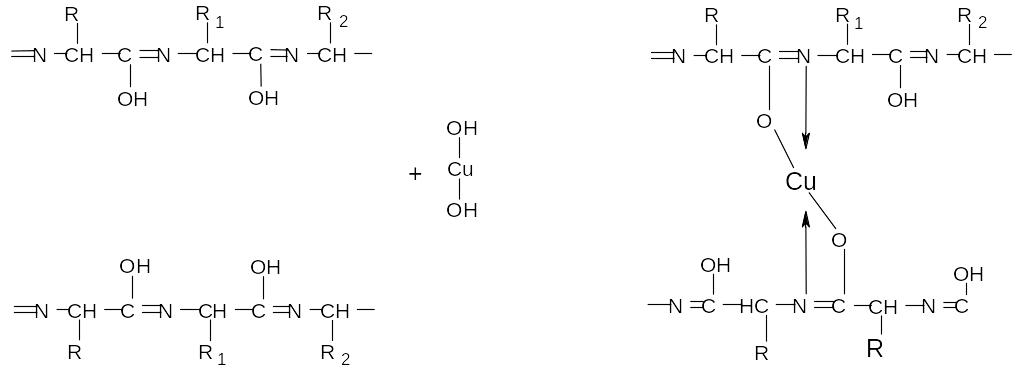
пептидные связи в биуретовый
енольной форме комплекс
Проведение реакции: к 4-5 каплям раствора белка добавляют 5 капель 10% раствора NaOH и 1 каплю (избыток мешает чтению результатов реак-ции!) 1% раствора CuSO4. Так же проводят реакцию с желатиной.
Специфичность реакции: реакцию дают все соединения, содержащие в молекуле две и больше двух близко расположенных пептидных связей. Реакция характерна для всех белков (как полипептидов), но не специфична для них.
Реакция с нингидрином основана на его взаимодействии со свобод-ной аминогруппой.
Механизм реакции: нингидрин, являясь сильным окислителем, вызыва-ет отщепление аминогруппы с образованием свободного аммиака, СО2, аль-дегида и восстановленной формы нингидрина. Восстановленная форма нин-гидрина, реагируя с аммиаком и избытком нингидрина, дает продукт конден-сации фиолетового цвета.
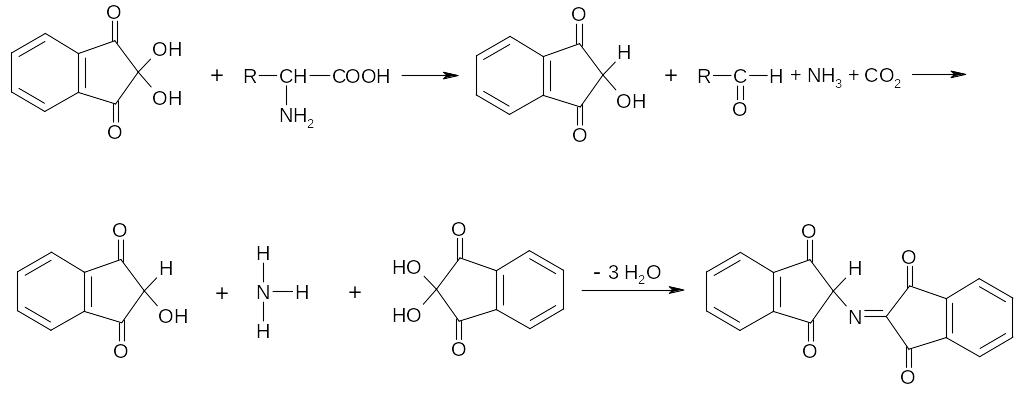
Проведение реакции: к 4-5 каплям раствора белка добавляют 5 капель раствора нингидрина и длительно (5-10 мин) нагревают на кипящей водяной бане. Присутствующий аммиак должен быть удален из системы. Аналогич-ным образом проводят реакцию с желатиной.
Специфичность реакции: в реакцию вступают белки, пептиды, свобод-ные аминокислоты и их производные, имеющие свободную амино группу в -положении.
Специфические реакции на отдельные аминокислоты и аминокислоты, входящие в состав молекулы белка или полипептида
Ксантопротеиновая реакция происходит при условии наличия в молекуле белка радикалов циклических аминокислот.
Механизм реакции: при действии на белок концентрированной азотной кис-лоты (белок при этом выпадает в осадок ¾ см. раздел «Денатурация белков») происходит нитрование циклических (содержащих бензольное кольцо) ради-калов аминокислот и образование нитропроизводных, окрашенных в желтый цвет. При подщелачивании окраска усиливается.
Молекула тирозина динитропроизводное хиноидное
в пептидной цепи тирозина производное тирозина
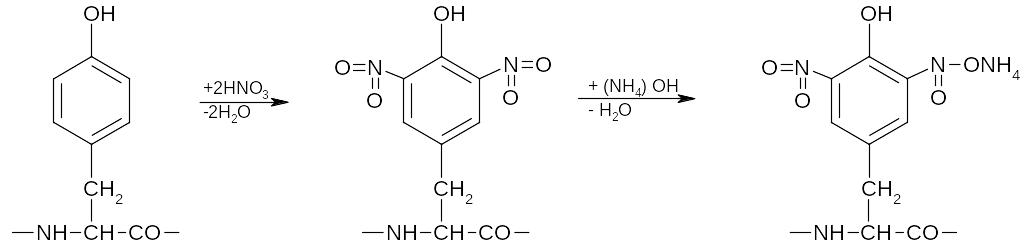
Проведение реакции: к 4-5 каплям раствора белка добавляют 2-3 капли концентрированной азотной кислоты. Образуется осадок белка, который при осторожном нагревании на водяной бане окрашивается в желтый цвет. К ох-лажденной (!) пробе добавляют избыток аммиака – появляется оранжевое ок-рашивание. Аналогичным образом проводят реакцию с желатиной.
Специфичность реакции: реакцию дают соединения, имеющие бен-зольные кольца в молекуле.
Реакция на аргинин (реакция Сакагучи) обусловлена образованием в щелочной среде ярко-красного продукта конденсации гуанидиновой груп-пировки с a - нафтолом.

+
аргинин a - нафтол
+ NH3

хиноидный аммиак
комплекс
Выделяющийcя при реакции аммиак разлагается гипобромитом:
2NH3+ 3NaBrO → N2+3H2O+3NaBr
Проведение реакции: к 4-5 каплям раствора белка добавляют равный объем 10% раствора NaOH и 3 капли спиртового раствора a - нафтола. После перемешивания добавляют 2-3 капли 2% раствора NaBrO. Появляется малиново-красное окрашивание. Так же проводят реакцию с желатиной.
Специфичность: реакция характерна для соединений, содержащих гуанидиновую группировку.
Реакция на слабосвязанную серу (реакция Фоля). При наличии в молекуле белка или пептида сульфгидрильных (тиоловых) групп SH ще-лочной гидролиз приводит к отщеплению серы в виде сульфида и при до-бавлении ионов Pb+2 к образованию черного осадка PbS.
1. + 2NaOH →
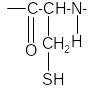
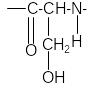

+Na2S + H2O
2. (CH3COO)2Pb + 4 NaOH → Na2PbO2 + 2CH3COONa + 2 H2O
3 .
Na2S
+ Na2PbO2
+ CH3СOOH
PbS¯
+ CH3COONa
.
Na2S
+ Na2PbO2
+ CH3СOOH
PbS¯
+ CH3COONa
сульфид свинца
черного цвета
Если в реакцию включаются дисульфидные группы остатков цистеина, то они должны вначале подвергнуться восстановительному расщеплению.
Проведение реакции: при добавлении к нескольким каплям раствора ацетата свинца избытка 10% раствора гидроксида натрия образуется щелоч-ной раствор плюмбита натрия. К нему приливают несколько капель раствора белка. Смесь нагревают на кипящей водяной бане. Раствор окрашивается в темно бурый цвет. Так же проводят реакцию с желатиной.
Специфичность реакции: реакция характерна для соединений, содер-жащих тиоловые группы.
Результаты лабораторной работы
Наименование Реакций |
Субстрат |
Окра- шива-ние |
Чем обусловлена реакция |
Биуретовая
Нингидриновая
Ксантопротеино-вая
Реакция Фоля
С a -нафтолом (Сакагучи) |
а) яичный белок б) желатина а) б)
а) б)
а) б)
а) б) |
|
|
Вывод:
Клинико – диагностическое значение цветных реакций.
1. Цветные реакции используют для диагностики заболеваний, при которых происходит
- наследственное нарушение метаболизма отдельных аминокислот (фенилкетонурия, гомоцистинурия – методы смотри ниже).
- усиленный распад тканевых белков (злокачественные новообразования, гипертиреоз, ожоги).
- нарушение реабсорбции аминокислот в почках.
2. С помощью цветных реакций можно оценить качественный и коли-чественный состав белков и пептидов в биологических жидкостях, а также полноценность белков в пищевых продуктах.
3. В санитарно-гигиенической практике цветные реакции используют для количественного и качественного определения белковых веществ (загрязне-ний) во внешней среде (атмосферном воздухе, сточных водах и т.д.).
Скрининг – тесты для выявления наследственных и приобретенных нарушений белкового обмена.
Обнаружение цистина и гомоцистеина.
Ход исследования: каплю мочи наносят на фильтровальную бумагу и после высушивания добавляют одну каплю азида натрия. В течение 5 минут наблюдают за исчезновением бурой окраски. Исчезновение бурой окраски через 2-3 минуты после добавления азида натрия указывает на нормальные величины.
Клинические значения: тест положителен при наследственной гомоцис-тинурии (дефицит синтеза фермента цистатионинсинтетаза) или приобретен-ной (дефицит витаминов В6, В12, фолиевой кислоты), в этом случае окраска остается более 5 мин.
Для диагностики заболеваний белкового обмена также используют скрининг - тесты на обнаружение кетокислот, так как нарушения обмена аминокислот сопровождаются образованием и накоплением соответсвующих кетокислот и экскрецией их с мочой в большом количестве.
Обнаружение кетокислот (проба с треххлористым железом). К 0,5 мл мочи добавляют 0,25 мл раствора треххлористого железа. О наличии кето-кислот судят по характеру окраски (проба положительна); сине-зеленое окра-шивание указывает на наличие фенилпировиноградной кислоты, а желтое – на избыток пирувата в моче.
Обнаружение кетокислот по реакции с 2,4 – динитрофенилгидразином. Смешивают 1 мл раствора 2,4 ДНФГ и 0,25 мл мочи. При положительной пробе развивается окраска от желтой до оранжево-коричневой. В норме про-ба отрицательная, окраска не развивается.
Разделение смеси аминокислот методом распределительной хроматографии на бумаге.
Хроматография – это метод разделения компонентов смеси между двумя несмешивающимися фазами. Одной из них является неподвижная фаза, ко-торая бывает твердой, жидкой или представляет собой смесь твердой и жид-кой фаз. Вторая, подвижная фаза, может быть жидкой или газообразной; она обычно течет по неподвижной фазе или пропускается через нее. Поэтому в зависимости от агрегатного состояния фаз хроматографию разделяют на жидкостную, газовую и газожидкостную.
В зависимости от природы адсорбента и механизма разделения веществ, хроматография бывает нескольких видов:
- адсорбционная – основана на различной способности отдельных компо-
нентов смеси адсорбироваться на поверхности твердой фазы сорбента; этот метод предложен М.С.Цветом в 1903 г.
- распределительная – основана на различной растворимости разделяемых веществ в двух мало смешивающихся жидкостях
- ионообменная – основана на различной способности разделяемых
веществ к обмену их ионов на ионы неподвижной фазы
- осадочная – основана на образовании трудно растворимых осадков в
определенной последовательности
- диффузионная – основана на разделении веществ по скорости диффузии внутрь сорбента в зависимости от размера молекул неподвижной фазы ( к данному типу относится гель-фильтрация)
- аффинная – основана на сродстве компонентов смеси к лигандам неподвижной фазы.
Хроматографические методы анализа различают и по технике выпол-нения: колоночная (используется для разделения высокомолекулярных соединений), капиллярная, плоскостная (на бумаге или в тонком слое силика-геля). По направлению движения растворителя (подвижной фазы) различают восходящую, нисходящую, двухмерную и радиальную.
Для разделения аминокислот используют бумажную, нисходящую,
распределительную хроматографию.
Принцип метода: отдельные аминокислоты обладают различной растворимостью в двух частично смешивающихся жидкостях, одной из которых является вода, другой – водонасыщенный органический раство-ритель. Более гидрофобная аминокислота лучше растворяющаяся в непо-лярном растворителе, движется с большей скоростью от линии старта, чем гидрофильная аминокислота. В результате этого смесь аминокислот по окончании хроматографического разделения оказывается на разном расстоянии от линии старта.
Этапы работы.
На полоске хроматографической бумаги проводят линию старта, отступив от края на 3-5 см. Используя капилляр на линию старта наносят небольшое количество (1-2 капли) исследуемых растворов аминокислот и растворы «свидетели» (известных аминокислот). После нанесения раство-ров, бумагу просушивают на воздухе в течении 10 мин.Для проведения нисходящей хроматографии используется камера, состоящая из двух отсеков. В один отсек наливают растворитель (смесь бутанол _ уксусная кислота – вода, 15:10:10), в другой отсек помещают хроматограмму, таким образом чтобы конец бумаги на котором нанесены растворы аминокислот был погру-жен в растворитель.
Хроматографию проводят при комнатной температуре. Растворитель поднимается по бумаге, увлекая за собой аминокислоты, с большей ско-ростью в гидрофобной фазе двигаются аминокислоты с более гидрофобным радикалом. Когда растворитель дойдет до почти до края бумаги ее выни-мают и для фиксации пятен аминокислот высушивают в сушильном шкафу при температуре 105 градусов в течение 5 минут с целью устранения раство-рителя и фиксации аминокислот. Для выявления пятен аминокислот хрома-тограмму окрашивают 0,2% раствором нингидрина и вновь высушивают при температуре 90-1000в течении 5 минут. Для каждой аминокислоты рассчи-тывают коэффициент распределения Rf по формуле: Rf = a / b, где
а – расстояние в миллиметрах от линии старта до середины пятна (расстояние пройденное аминокислотой), b –расстояние в миллиметрах от линии старта до фронта растворителя. Сравнивают коэффициенты распре-деления «свидетелей» и аминокислот исследуемой смеси для качественного анализа исследуемой жидкости.
Для количественного анализа аминокислот каждое пятно вырезают и элюируют (вымывают) подходящим растворителем; затем проводят коли-чественный колориметрический анализ, либо хроматограмму помещают в фотометр для определения интенсивности окрашивания пятна в проходящем или отраженном свете.
