
- •Введение
- •Тема 1: Строение и свойства аминокислот. Методы исследования аминокислот.
- •7. Этапы занятия и контроль их усвоения
- •Тема 2: Структурная организация белковых молекул. Методы количественного определения белка.
- •7. Этапы занятия и контроль их усвоения
- •Количественные методы определения белков
- •Лабораторная работа №2
- •Основные понятия фотоколориметрии
- •Устройство и принцип работы фотоэлектроколориметра
- •Тестовый контроль по теме « Строение белковой молекулы»
- •Тема 3 Физико-химические свойства растворов белков. Диализ. Осадочные реакции. Разделение смеси белков методом электрофореза.
- •2. Цель занятия:
- •3. Конкретные задачи:
- •5. Задание для самоподготовки:
- •Практическое применение осадочных реакций
- •Лабораторная работа № 3
- •Реактивы и оборудование
- •II.Диализ
- •III. Фракционное высаливание белков. Разделение альбуминов и глобулинов
- •Iy.Электрофорез
- •Осадочные пробы на белок
- •Тема 4: "Изучение свойств и биологической роли витаминов водорастворимой группы. Методы исследования свойств витаминов и количественного определения витамина с.
- •6. Вопросы для самоподготовки:
- •Лабораторная работа № 4 Количественное определение витамина с (аскорбиновой кислоты) в пищевых продуктах и в моче по методу Тильманса
- •Определение содержания витамина «с» в хвое и свежей капусте.
- •Определение содержания витамина «с» в сыром и вареном картофеле и в квашеной капусте.
- •Содержание витамина «с» в различных продуктах и моче
- •Тестовый контроль по теме « Витамины»
- •Установите строгое соответствие
- •3. Конкретные задачи.
- •4. Мотивация.
- •6. Вопросы для самоподготовки:
- •Специфичность действия ферментов
- •Тема 6: "Активация и ингибирование ферментов.
- •3. Конкретные задачи.
- •Лабораторная работа №6 Количественное определение активности сывороточной холинэстеразы. Изучение ингибирующего действия карбофоса и активирующего действия ионов кальция.
- •Клиническое значение определения активности сывороточной хэ.
- •Количественное определение активности тканевых дегидрогеназ и изучение действия их ингибиторов
- •Применение метода в санитарно-гигиенических исследованиях
- •Количественное определение активности дегидрогеназы янтарной кислоты (сукцинатдегидрогеназы, к. Ф. 1.3.99.1) тетразолиевым методом
- •Определение общей активности лактатдегидрогеназы (к.Ф. 1.1.1.27) и ее изоферментов.
- •Клиническое значение определения активности лактатдегидрогеназы.
- •Методы определения активности ферментов
- •Тест 12
- •Тест 13
- •Тест 14
- •Тест 15
- •Тема 7: "Энзимодиагностика и энзимотерапия. Клинико-диагностическое значение определения белкового спекра крови."
- •Тема 8 Программа контрольной работы по теме «Химия белков и ферментов. Витамины».
- •195067, Санкт-Петербург, Пискаревский пр.,д. 47
- •394019, Г. Воронеж, ул. Еремеева, 22ж
3. Конкретные задачи.
3.1. Студент должен знать:
3.1.1. Взаимосвязь структурной организации белковой молекулы с проявлением биологической активности.
3.1.2.Механизмы действия на белок-фермент различных физических и химических факторов (температура, изменения рН среды, тяжелых металлов, кислот и щелочей).
3.1.3. Условия протекания ферментативной реакции.
3.2.Студент должен уметь:
3.2.1. С помощью пипеток, бюреток и мерной посуды отбирать необходимое количество биологического материала и реактивов.
3.2.2.Проводить ферментативную реакцию в термостатированных условиях.
3.2.3 Оценивать результаты ферментативной реакции
4. Мотивация.
Знания и навыки, полученные на данном занятии необходимо использовать в лечебной и санитарно-гигиенической практике.
4.1. Хранение биологического материала при низких температурах приводит к замедлению ферментативных процессов и обеспечивает более длительные сроки хранения.
4.2. Повышение температуры тела больного при развитии патологического процесса, приводит на начальных этапах к повышению защитных сил организма и не требует применения жаропонижающих средств. Стойкое и значительное повышение температуры может вызвать существенное конформационное изменение термолабильных белков-ферментов, сопровождающееся снижением биологической активности.
4.3. Изменение рН среды, попадание в организм тяжелых металлов, изменяет активность ферментов и приводит к развитию патологического процесса.
5. 3адание для самоподготовки.
Студент должен изучить рекомендуемую литературу, используя контрольные вопросы для самоподготовки.
Основная литература
Повторить лекционный материал по темам "Строение белковой молекулы", "Физико-химические свойства белков", "Ферменты. Общие свойства".
Использовать при подготовке учебник:
. Биохимия: Учебник / Под редакцией Е.С. Северина./ М. ГЭОТАР – Мед., 2003, с.-75-102.
Березов Т.Т. и Коровкин Б.Ф. Биологическая химия, М. :Медицина -1998-С. 114-126, 129-145, 157-163.
5.2.3. Учебно-методическое пособие к практическим занятиям по биологической химии СПб. 2005.
Дополнительная литература
5.2.4. Ленинджер А. Основы биохимии. М.: Мир.- 1985. т. 1 - c. 226-301
5.2.5. Диксон М., Уэбб Э. Ферменты. -М. : Мир - 1982.-т. 1- с. 2-281.
5.2.6. Реннеберг Р. Эликсиры жизни. М. : Мир - 1987. –С.152.
Марри Р. и др. Биохимия человека. М.: Мир - 1993. т.1. с. 63-68, 76-88, 91-97
5.2.9. Подготовиться к проверочному контролю.
6. Вопросы для самоподготовки:
1. Что такое ферменты?
2. В чем заключается сходство и отличие ферментов и неорганических катализаторов?
3. Какие виды специфичности ферментов Вы знаете? Приведите примеры.
4. На какие группы делят ферменты по строению белковой молекулы?
5. Каковы особенности строения сложных ферментов? Что такое холофермент, апофермент, небелковая часть?
б. Что такое кофактор? Приведите примеры.
7. Что такое кофермент? Назовите известные Вам коферменты и витамины, входящие в их состав.
8. Когда используется термин "простетическая группа"? Приведите примеры.
9. Какие центры выделяют в молекуле фермента? Какова их роль?
10. Каковы особенности строения активного центра? Какие участки в нем выделяют и какова их роль?
11. 3а счет каких сил образуется фермент субстратный комплекс? Что такое многоцентровое связывание? В чем суть теории индуцированного соответствия Кошланда?
12. Механизм действия ферментов. Объясните понятия "энергетический барьер" и "энергия активации". Начертите соответствующий график без фермента и в присутствии фермента.
13. Основные обозначения применяемые в энзимологии. Что означает запись схемы ферментативной реакции? E+S ¬® ES ® Е+Р
14. . Перечислите основные положения теории фермент-субстратного комплекса Михаэлиса-Ментен. Нарисуйте график зависимости скорости ферментативной реакции от концентрации субстрата.
15. Напишите уравнение Михаэлиса-Ментен. Что такое максимальная скорость реакции и константа Михаэлиса?
16. Перечислите факторы, от которых зависит скорость реакции? Какие условия необходимы для оптимального проведения ферментативной реакции?
17. Как зависит активность фермента от температуры? Начертите график, объясните характер кривой?
18. Как влияет рН среды на скорость ферментативной реакции? Начертите график и объясните характер кривой?
19. Какой принцип лежит в основе классификации ферментов?
20. Назовите классы ферментов. Приведите примеры ферментов.
21. Что такое шифр или код фермента? Приведите пример.
7. Этапы занятия и контроль их усвоения.
№ |
Этапы проведения занятия |
Форма проведения |
Время (мин) |
7.1 7.2
7.3.
7.4.
7.5
7.6. |
Постановка задачи. Контроль исходного уровня знаний. Разбор теоретического материала Разбор практических работ. Приобретение практических навыков. Обсуждение работы студентов. Подведение итогов занятия. |
Излагает преподаватель Тестовый контроль.
Опрос студентов по контрольным вопросам. Излагает преподаватель. Проведение практических работ и оформление протоколов. Ответы на вопросы студентов.
|
5 10
55
10 90
10 |
Пример билета проверочного контроля
Как влияет температура на скорость ферментативной реакции, приведите соответствующий график
Какой тип реакции катализируют ферменты класса трансфераз, приведите пример
Лабораторная работа №5
Влияние неспецифических факторов на активность ферментов. Специфичность действия ферментов.
Ферменты это биологически активные вещества белковой природы, выполняющие в организме роль катализаторов, которые:
а) не сдвигают равновесия реакции, а только ускоряют ее;
б) активны в малых количествах;
в) не входят в состав конечных продуктов реакции;
г) не вызывают новых реакций, а ускоряют реакции, возможные по термодинамическим условиям.
Но в отличие от неорганических катализаторов, ферменты:
а) работают в мягких условиях;
б) высоко специфичны;
в) обладают очень высокой каталитической активностью;
г) характеризуются высокой кооперативностью и запрограмированностью этапов действия;
д) термолабильны;
е) подвержены влиянию рН среды;
ж) изменяют свою активность под действием ингибиторов и активаторов .
Клинические и санитарно-гигиенические аспекты занятия
Ингибирование ферментов является ведущим звеном биохимического механизма патологических состояний, вызванных действием на организм токсических веществ и различных физических факторов (ионизирующая и ультрафиолетовая радиация, шум, вибрация и др.) внешней среды или как результат развития патологии при многих соматических и инфекционных заболеваниях. Поскольку все ферменты имеют белковую природу, их ингибирование может быть следствием конформационных и денатурационных изменений фермента, вызванных химическими или физическими фактором, и в этом смысле рассматривается как неспецифическое. Вместе с тем многие химические вещества обладают высоким сродством к активным центрам ферментов, блокируют их и вызывают специфическое ингибирование ферментов. Поэтому определение ферментативной активности крови, других тканей и жидкостей широко используется в лечебной и гигиенической практике с целью выявления признаков действия на организм вредных факторов среды, для изучения патогенеза заболеваний, оценки эффективности способов их профилактики и лечения. Например, в клинике определяют активность двух трансаминаз — аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ). Повышение активности АлАТ наблюдается при заболеваниях печени, а повышение активности АсАТ — при патологии сердечной мыщцы. Поэтому метод может быть широко использован при диагностике гепатитов, изучении действия гепатотропных ядов, для диагностики инфаркта миокарда.
Реактивы: 1. Сыворотка крови - источник фермента аланинаминотрансферазы 2. Субстратная смесь, содержащая аланин и a-кетоглутарат 3. Раствор гидроксида калия –10% (вещество, меняющее рН среды); 4. Раствор хлорида кадмия 1% (ионы тяжелого металла); 5. 2,4-динитрофенилгидразин - 0,5% раствор; 6. 0,4 Н раствор гидроксида натрия.
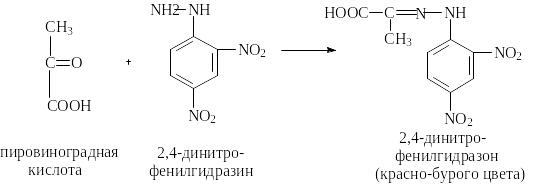
Принцип метода Аминотрансферазы или трансаминазы катализируют межмолекулярный перенос аминогруппы с аминокислот на кетокислоты. Коферментом трансаминаз является фосфопиридоксаль, который служит непосредственным переносчиком аминогрупп. Определение концентрации кетокислот, образующихся в процессе трансаминирования из аминокислот, составляет основу методов количественного определения трансаминазной активности и проводится путем спектрофотометрических или фотоколориметрических измерений. Количество образующейся в данной реакции пировиноградной кислоты определяют по цветной реакции с 2,4-динитрофенилгидразином, в ходе которой развивается красно-бурое окрашивание в щелочной среде.
Аланинаминотрансфераза (К. .Ф. 2.6.1.2) катализирует реакцию переаминирования между L-аланином и а-кетоглутаровой кислотой:

Влияние неспецифических факторов на активность ферментов
Ход работы: в 4 пробирки наливают по 0,05 мл сыворотки крови, содержащей фермент аланинаминотрансферазу. В первую пробирку добавляют 0,5 мл воды и нагревают на кипящей водяной бане в течение 5 мин, во вторую добавляют 0,5 мл 10% раствора КОН, в третью – 0,5 мл 1 % СdСI2, в четвертую - 0,5 мл физиологического раствора эту пробирку используют для определения активности нативного фермента, в пятую - 0,5 мл воды, в эту пробирку сыворотку крови не добавляют, она служит контролем на реактивы. Через 5 мин во все пробирки добавляют по 0,5 мл раствора субстратной смеси и выдерживают их в термостате при 38°С 20 мин. После этого во все пробирки добавляют по 0,20 мл 2,4-динитрофенилгидразина, встряхивают и оставляют стоять 5 мин при комнатной температуре, затем во все пробирки добавляют по 2,5 мл 0,4 Н гидроксида натрия, встряхивают и колориметрируют против пробы 5 в кюветах с рабочим расстоянием 10 мм с зеленым светофильтром (l=560 нм) после 10 минут инкубации при комнатной температуре. Активность фермента определяют по калибровочному графику.
№
|
Сыво ротка крови 0,05мл |
Воздействие неспецифиче ких факторов |
Суб- стр. смесь 0,5мл |
Во да 0,5мл |
Физ р-р 0,5 мл |
Резуль - таты |
||
|
|
100С 10% 1% КОН СdCl2 0,5мл 0,5мл |
|
|
|
D
|
Активность |
|
1 |
+ |
+ |
+ |
+ |
- |
|
|
|
2 |
+ |
+ |
+ |
- |
- |
|
|
|
3 |
+ |
+ |
+ |
- |
- |
|
|
|
4 |
+ |
|
+ |
- |
+ |
|
|
|
5 |
- |
|
+ |
+ |
- |
|
|
|
Вывод
