
- •Под редакцией проф. В. С. Силецкого Допущено Министерством высшего и среднего специального образования ссср в качестве учебного пособия для неэнергетических специальностей вузов
- •74 Бечгородск.;я ' областная ' библиотека
- •Предисловие к первому изданию
- •Часть первая техническая термодинамика
- •Глава I введение
- •Контрольные вопросы и примеры к I главе
- •Глава II
- •Контрольные вопросы и примеры к II главе
- •Контрольные вопросы и примеры к III главе
- •Глава IV реальные газы
- •Глава V первый закон термодинамики
- •Г л а в а VI теплоемкость газов. Энтропия
- •3 В. В. Нащокин .65
- •§ 6Т11. Тепловая Тя-диаграмма
- •Глава VII
- •CpdT vdp , dv dp
- •Контрольные вопросы и примеры к VII главе
- •Глава VIII . Второй закон термодинамики
- •Глава IX характеристические функции и термодинамические потенциалы. Равновесие систем
- •Контрольные вопросы и примеры к IX главе
- •Водяной пар,
- •_ Масса сухого насыщенного пара во влажном
- •Масса влажного пара
- •Глава XII
- •Глава XIII истечение газов и паров
- •Контрольные вопросы Ли примеры к XIII главе
- •Глава XIV
- •Глава XV влажный воздух
- •Глава XVI [ компрессоры
- •Глава XVII циклы двигателей внутреннего сгорания
- •Глава XVIII
- •V Лг изоб изох'
- •Глава XIX циклы паротурбинных установок
- •Контрольные вопросы и примеры к XIX главе
- •Глава XX циклы атомных электростанций, парогазовых и магнитогидродинамических установок
- •Контрольные вопросы к XX главе
- •Глава XXI циклы холодильных установок
- •* С. Я. Г е р ш. Глубокое охлаждение. Госэнергоиздат, 1957, стр. 85.
- •Глава XXII
- •Контрольные вопросы к XXII главе
- •Глава XXIII
- •Глава XXIV теплопроводность при стационарном режиме и граничных условиях третьего рода, коэффициент теплопередачи
- •Глава XXV
- •2 В. В. Нащокин
- •Контрольные вопросы к XXV главе
- •Глава XXVI конвективный теплообмен
- •Физические свойства жидкостей
- •Режимы течения и пограничный слой
- •Числа подобия
- •Теореме! подобия
- •Контрольные вопросы к"XXVI главе
- •Глава XXVII
- •Контрольные вопросы и примеры к XXVII главе
- •Глава XXVIII
- •Контрольные вопросы и примерь! к XXVIII главе
- •Глав а XXIX теплообмен излучением
- •Степень черноты полного нормального излучения для различных материалов
- •Средняя длина лучей для газов, заполняющих объем различной формы
- •Контрольные вопросы и примеры к XXIX главе
- •Глава XXX теплообменные аппараты
- •1 1 ТуСру 4190
- •Глава XXXI
- •Воздух (абсолютно сухой)
- •Кдж/(моль- град)
- •Кдж/(кг-град)
- •"50. Н о з д р е в в. Ф. Курс термодинамики. «Высшая школа», 1961.
- •Глава I. Введение 5
- •Глава VII. Термодинамические процессы идеальных газов ...... 79
- •Глава VIII. Второй закон термодинамики , 95
- •Глава IX. Характеристические функции и термодинамические потен- циалы. Равновесие систем 124
- •Глава XII. Основные термодинамические процессы водяного пара . . 173 § 12-1. Общий метод исследования - термодинамических процессов
- •Глава XV. Влажный воздух . . 214
- •Глава XVII. Циклы двигателей внутреннего сгорания 235
- •Глава XVIII. Циклы газотурбинных установок и реактивных двига- телей 253
- •Глава XX. Циклы атомных электростанций, парогазовых и магнито-
- •Глава XXI. Циклы холодильных установок 299
- •Часть вторая. Теплопередача
- •Глава XXII. Основные положения теплопроводности 315
- •Глава XXIV. Теплопроводность при стационарном режиме и граничных условиях третьего рода. Коэффициент теплопередачи . . 337 § 24-1. Передача теплоты через плоскую однослойную и многослойную
- •Глава XXV. Теплопроводность при нестационарном режиме . . . 352
- •Глава XXVI. Конвективный теплообмен . . 363
- •Глава XXVII. Конвективный теплообмен в вынужденном и свобод- ном потоке жидкости 386
- •Глава XXX. Теплообменные аппараты зд7
- •Глава XXXI. Тепло- и массоперенос во влажных телах , 460
- •Владимир Васильевич Нащокин техническая термодинамика и теплопередача
3 В. В. Нащокин .65
определить и cv, которую из опыта определить очень трудно. Следует отметить, что для реальных газов
Ср — cv^> R.
Это неравенство объясняется тем, что при расширении реальных газов (при р = const) совершается ле только внешняя, но и внутренняя работа, связанная с изменением внутренней потенциальной энергии тела, что и вызывает больший расход теплоты.
§ 6-4. Элементы молекулярно-кинетической и квантовой теории теплоемкости
Классическая молекулярно-кинетическая теория газов рассматривает идеальный газ как совокупность абсолютно жестких молекул, между которыми отсутствуют силы взаимодействия и каждая молекула обладает лишь энергией поступательного и вращательного движения, а сами молекулы рассматриваются как материальные точки.
Поступательное движение такой молекулы можно разложить по направлениям трех, координатных осей, в соответствии' с этим говорят, что молекула имеет три степени свободы поступательного движения. Количество вращательных степеней евободы будет зависеть от атомности газа.
В соответствии с кинетической теорией внутренняя энергия газов равномерно распределяется по степеням свободы поступательного и вращательного движения молекул.
Одноатомный газ имеет только три степени свободы поступательного движения (/ = 3). Молекула двухатомного газа кроме поступательного движения может совершать и вращательное движение вокруг общего центра тяжести, который находится' на линии, соединяющей оба атома. Такая молекула двухатомного газа имеет пять степеней свободы (i = 5), из них три степени свободы поступательного движения и две степени свободы вращательного движения...
Молекулы трех- и многоатомных газов имеют три степени свободы поступательного движения и три степени свободы вращательного движения, а всего I =6.
Для того Чтобы вычислить долю внутренней энергии, приходящуюся на одну степень свободы, рассмотрим одноатомный идеальный газ, у которого имеется только три степени свободы поступательного движения.
Из кинетической теории известно, что давление, оказываемое идеальным газом на стенки, равно 2/3 средней кинетической энергии поступательного движения атомов, т. е.
р = (2/3) шЛ, - (6-17)
где р — давление газа, н/м2; п — число атомов в 1 мг; т — масса одного атома; w — средняя квадратичная скорость атомов, определяемая
из уравнения
до2 = (до? -f w\ 4- Доз 4- •" + Wn)/n,
где wlt до2, доп — скорости отдельных атомов.
Умножая обе части уравнения (6-17) на объем киломоля Уц, получим уравнение для 1 кмоль:
pV» = (2/3) пУ^пш2/2.
В этом уравнении произведение nVy. = N есть число атомов в 1 кмоль газа (число Авогадро):
pV» = (2/3) NmwV2.
Величина mwV2 представляет собой среднюю кинетическую энергию поступательного движения одного атома газа, а так как общее число атомов равно N, то вся внутренняя энергия 1 кмоль одноатомного газа, равная кинетической энергии всех атомов, равна
ци = Nm до2/2.
Тогда f.
pVy, - (2/3) ци, или ци = (3/2) pVa. (6-18) Заменяя pVß его значением из уравнения состояния, находим
. ци = (3/2) iiRT, (6-19) а так как \iR = 8,3142 кдж/(кмоль-град), то для одноатомного газа ци = (3/2).8,3142 Т = 12,5 Т. / (6-20
Взяв из уравнения (6-19) производную от внутренней энергии по температуре, -имеем
аци/dT = [icv = (3/2). pi?. (6-21)
Из уравнения видно, что цси не зависит от температуры. Следовательно, уравнение (6-19) выражает внутреннюю энергию одноатомного идеального газа, который подчиняется уравнению pVß = цЯТ и у.которого цси = const.
Численное значение мольной теплоемкости для одноатомного газа равно
цс„ = (3/2)р#, = 12,5 кдж/(кмоль * град).
Отсюда на каждую степень свободы движения в одноатомном газе расходуется энергия — 12,5 : 3 = 4,16 кдж/(кмоль-град). Подставляя значение теплоемкости цсь из (6-21) в уравнение Майера, находим
цсР = [(/ 4- 2)/2]р#, ' ' (6-22)
или для одноатомного газа
цср = [(3 4- 2)/2]8,3142 я* 20,8 кдж/(кмоль-град).
Экспериментальные исследования для одноатомных газов подтверждают полученные данные.
3* • 67
Для двухатомного газа, считая, что на каждую степень свободы движения расходуется количество энергии, как и для одной степени свободы поступательного движения одноатомного газа, находим:
рс0 = 4,16-5 20,8 кдж/(кмоль-град), рср = [(5 + 2)/2]8,3142 » 29,1 кдж/(кмоль.-град).
Однако для сравнительно высоких температур получается значительное несоответствие'приведенных значений теплоємкостей двухатомных газов с экспериментальными данными. Еще большее расхождение получается для трех- и многоатомных газов.
Это расхождение объясняется тем, что в сложных молекулах необходимо учитывать не только поступательное и вращательное движение, но и колебательное движение атомов в самой молекуле, энергия которых в кинетическойтеории газов не учитывается.
Энергию колебательного движения атомов в молекуле учитывают в квантовой теории теплоємкостей. Эта теория доказывает, что теплоемкость двух- и многоатомных газов является функцией температуры, так как энергия колебательного движения • атомов в молекуле изменяется не прямо пропорционально температуре.
ч Эйнштейн, пользуясь квантовой теорией Планка, получил следующее выражение для мольной теплоемкости, достаточно точное для температур, применяемых в теплотехнике:
^-i^RV+^R^JeWlieW-l)*, . (6-23)
где ~ix -— число степеней свободы поступательного и вращательного движений молекулы; і2 — число степеней свободы внутримолекулярных колебаний; Ö — характеристическая температура колебательного движения, равная ö = ha/k (h — постоянная Планка, k — постоянная Больцмана, со — число колебаний в секунду): е—основание натуральных логарифмов; Т — абсолютная температура газа.
Первый член правой части формулы (6-23) учитывает количество .энергии, идущей на изменение-поступательного и вращательного движения молекул; он определяется числом степеней свободы этих" движений. Второй член формулы учитывает энергию, идущую на изменение внутримолекулярных колебаний; он определяется числом колебательных степеней свободы.
Формула (6-23) не является абсолютно точной, так как .при ее выводе были сделаны некоторые допущения.
Для приближенных расчетов при не очень высоких температурах можно рекомендовать использование постоянных мольных теплоємкостей цс0 и рСр, полученных с некоторой корректировкой для трех-и многоатомных газов на основании молекулярно-кинетической тео
 рий
теплоемкости. Эти данные
Тіри-ведены
в табл. 6-1.
рий
теплоемкости. Эти данные
Тіри-ведены
в табл. 6-1.
Точные значения теплоємкостей идеальных газов в зависимости от температуры приводятся в специальных таблицах. Эти значения вычисляются на основании спек-' троскопических данных с использованием математического аппарата квантовой статистики.
§ 6-5. Истинная и средняя теплоемкости
Так как теплоемкость идеального газа зависит от температуры, а реального и от давления, то в технической термодинамике различают истинную и среднюю теплоемкости.
Теплоемкость, определяемая уравнениями (6-1), (6-3), (6-4) при данных значениях параметров состояния v и Т или р и Т (т. е. в данном состоянии тела), называют истинной теплоемкостью. Следовательно, истинной теплоемкостью называется отношение элементарного количества теплоты, сообщаемой термодинамической системе в каком-либо процессе, к бесконечно малой разности температур.
Истинные теплоемкости реальных газов можно выразить в виде суммы двух слагаемых:
Сх eXQ "f" Асх.
"Первое слагаемое представляет собой теплоемкость данного газа в разреженном (идеально газовом) состоянии (при р -*■ 0 или v со ) и зависит только от температуры.
Температурная зависимость теплоємкостей ср и cv приближенно может.быть представлена в виде полинома третьей степени от f С:
сх0 = й0 + aj + a2t* + a3t'A. ■
Однако в настоящее время в расчетах используют более точные табличные значения. '
Второе слагаемое Асх определяет зависимость теплоемкости от давления или удельного объема и связано с изменением потенциальной составляющей внутренней энергии реального газа.
В практических расчетах при определении колйчества.теплоты обычно применяют та-к называемые средние теплоемкости.
Средней теплоемкостью схт данного процесса в интервале температур от tt до t2 называют отношение количества теплоты q\.->. к конечной разности, температур t2 — 1г:
с , " (6-24)
Так как количество теплоты 171.2, х, полученное системой в процессе х = const, определяется уравнением (6-2), где сх — истинная теплоемкость в данном процессе, то
с«»й=-^Ьг1с**- (6"25)
Уравнение (6-25) устанавливает связь межДу средней и истинной теплоємкостями тела в данном процессе.
Если средние теплоемкости даны в таблице для интервала температур от 0- до Ґ С, то средняя теплоемкость схт$1 может быть вычислена по формуле
Г =
(6-26)
Действительно, интеграл в уравнении (6-25) на основании известного из математики правила может быть разбит на следующие интегралы:
ti Р о
но
схdt = cxm |„2t2, a cxdt — cxm |0' ty о о
Подставляя найденные значения интегралов в уравнение (6-25), получаем уравнение (6-26).
Таким образом, если в каком-либо процессе идеальный газ был нагрет от температуры tx до t2, то количество теплоты, затраченное на нагревание, равно
Q* = m \cxm 1о2 к~схт \ї h) = Va [с'хт \t* t2-c'xm \il /J. (6-27)
Средние мольные, массовые и объемные теплоемкости газов при р = const и v = const приведены в табл. Ill, IV, V, VI, VII, VIII. приложения.
§ 6-6. Отношение теплоємкостей Ср и си 1
В термодинамике часдо используется отношение теплоемкости при постоянном давлении'к теплоемкости при постоянном объеме, обозначаемое обычно буквой k: *
k = CpiCv = C'p/c'v — рСр/рСц.
Согласно классической кинетической-теории газов величина к определяется числом степеней свободы молекулы. Из уравнений (6-21) и (6-22) следует
fe = i±2-./?: -L/г=1 + 2/і. ' (6-28)
Если считать cÄ=const, то из табл. 6.1 получаем: для одноатомного газа k = 1,66; для двухатомного газа £=1,4, для трех- и многоатомных газов k = 1,33.
При сх ф const k для идеальных газов зависит от температуры, что и видно из формулы
И'= cp/cv = (cv + R)lcv — 1 4- R/cD.
Из уравнения Майера можно получить следующие соотношения для теплоємкостей & и ср:
cv = Rl(k — 1); ср = kRl(k - 1). (6-29)
§ 6-7. Определение <7„ и qp для идеальных газов по таблицам теплоємкостей
Как уже указывалось, количество теплоты в изобарном н изохор-ном процессах идеального газа может быть подсчитано по следующим уравнениям:
Яр. і-» = Срт ti'h-cvm Iі; и = h-h; (6-30)
Qv, ]-г = Сг,т|о^2 — Cpmlo' /і = «2 — "і- (б'31)
Следовательно, для определения теплота <7р'и ^."необходимо знать либо теплоемкости в интервале температур от 0 до f С, ли.бо значения энтальпий и внутренних энергий.
В настоящее время имеется большое количество пособий и специальных таблиц, в которых эти величины с высокой степенью точности даются для широкого интервала температур. Все новейшие данные по теплоємкостям, энтальпии и внутренней энергии рассчитаны с использованием уточненных спектроскопических констант методом квантовой статистики. Приведенная выше формула Эйнштейна для подсчета теплоемкости может, рассматриваться как первый шаг в создании современной квантовой теории теплоемкости.
В отечественной литературе подробные данные по теплоємкостям Ср и Со, а также энтальпии и внутренней энергии приведены в 18, 48, 58).
§ 6-8. Теплоемкость смесей идеальных газов
При расчетах тепловых установок приходится встречаться со смесями газов, а в таблицах приводятся теплоемкости только для отдельных идеальных газов; поэтому нужно уметь определить теплоемкость газовой смеси. Если смесь газов задана массовыми долями, то массовая теплоемкость смеси определяется как сумма произведений массовых
долей на массовую теплоемкость каждого газа:
с*, см = 81 с*1 + & ^2 + •' • + £п ст = 2 & с„, (6-32)
и
и
1
где £1( ... —массовые доли каждого газа, входящего в смесь.
Если смесь газов задана объемными долями, то объемная теплоемкость смеси равна сумме произведений объемных долей на объемную теплоемкость каждого газа:
п
< см - »1 са1 + г2 с'а2 -\ Ь гп с1п = 3 Г, Со, . , (6-34)
1
и -
п ,
с'р. см - ^ с'р1 + г, си + • • • + гп с;п = 3 г, с^,, (6-35)
1
где гь г2,..., гп—объемные доли отдельных газов, входящих" в смесь.
Мольная теплоемкость смеси газов равна произведению объемных долей на мольные теплоемкости составляющих смесь газов:
п
№У1 см =? /1 со1 + г2 р2 с^ + •' • + г„ рп с„„ = 2 Г,- Р/ сы,
п
№Р, см - Г\ Ні Срі + г2 р2 Срг + " • + г„ р„ ср„ = ^ г, р; ср„
і
где р — средняя молекулярная масса смеси газов; р2, рп — молекулярные массы отдельных газов.
Массовая теплоемкость смеси газов может быть определена, если известны плотность и удельный объем смеси газов при нормальных физических условиях:
см = £»,»ем ^см, о° = Сг>, см/Рем, о"
и
Ор, см ~Ар< см '■'см, о0 = с», см/Рем, о0-§ 6-9. Приближенные значения теплоємкостей*
Для приближенных расчетов иногда пользуются эмпирическими |юрмулами, учитывающими зависимость теплоемкости от температуры по линейному закону. Для истинной теплоемкости эта,зависимость может быть представлена уравнением вида
*
§ 6:9_приведен в'этом учебнике вынужденно,
в связи с тем, что вся техни-іеская
литература по расчету пищевых машин
применяет'ураенение (6-37).
где а — истинная теплоемкость при 0° С; Ь — тангенс угла наклона прямой, ха_рактеризующий изменение теплоемкости от температуры.
1 ''
$
^2 -' ^2
/2-
1
/2-/1
«0*2
/2 /2
'2 «I
= * + -§-(/а +/і)- (6-37)
 §
6-10. Энтропия. Вычисление энтропии
идеального газа для обратимых и
необратимых процессов
§
6-10. Энтропия. Вычисление энтропии
идеального газа для обратимых и
необратимых процессов
Как уже указывалось, теплота д не является функцией состояния и &д — йи + р&и не будет полным дифференциалом; (к/ представляет собой только некоторую бесконечно малую величину. Для того чтобы проинтегрировать правую часть уравнения первого закона термодинамики ^7 = йи + рйю, должна быть известна зависимость р от V (или р от Г). В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем деления (или умножения) на интегрирующий делитель. Таким интегрирующим делителем для элементарного количества теплоты ад является абсолютная температура Т° К.
Покажем это на примере идеального газа. Имеем йд = СуйТ 4-+ рйь, или, заменив р на ЯТЬ, получим йд — Сцй.Т + ЯТймЫ.
Разделив обе части последнего уравнения на Т, находим
йх}/Т = сис1Т/Т + Яйи/и. (6-38)
Отсюда выражение йд/Т при обратимом изменений состояния газа есть полный дифференциал некоторой функции переменных Т и р (са зависит только от температуры, а Я— величина постоянная). Клаузиус назвал эту функцию энтропией и обозначил буквой 5. Измеряется полная энтропия 5 в джоулях на градус (дж/град), а удельная энтро-ші.і я — в джоулях на килограмм на градус [дж/(кг-град)].
Таким образом, дифференциал энтропии для обратимого изменения состояния определяется как
(6-39)
Энтропия есть однозначная функция состояния газа, принимающая для каждого его состояния вполне определенное значение. Энтропия
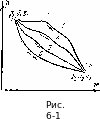 является
экстенсивным (зависит от массы вещества)
параметром состояния и изменение
ее в любом термодинамическом процессе
полностью определяется крайними
состояниями тела и не зависит от
пути процесса. В связи с этим энтропия
газа, являясь параметром состояния,
в процессах 1-3-2,
1-4-2,
1-5-2,
1-6-2
(рис.
6:1)
будет изменяться одинаково. Это
свойство относится как к обратимым,
так и необратимым процессам. Поэтому
является
экстенсивным (зависит от массы вещества)
параметром состояния и изменение
ее в любом термодинамическом процессе
полностью определяется крайними
состояниями тела и не зависит от
пути процесса. В связи с этим энтропия
газа, являясь параметром состояния,
в процессах 1-3-2,
1-4-2,
1-5-2,
1-6-2
(рис.
6:1)
будет изменяться одинаково. Это
свойство относится как к обратимым,
так и необратимым процессам. Поэтому
ДЯЬЗ-г = А«|-4-2 = Л$1-5-2 = = Д81.6.8 = 5, — 5! = /(р202) — /(/>, О,).
Так как энтропия обладает свойством аддитивности, то алгебраическая сумма изменений энтропии отдельных тел, составляющих термодинамическую систему, будет равна изменению энтропии всей термодинамической системы в целом. Причем изменения энтропии отдельных тел в зависимости от процесса могут быть как положительными, так и отрицательными величинами.
Энтропия может быть определена как функция основных параметров состояния:
8 = /, (р, V); з - !г (р, Т); 8 = /8 (о, Т).
Полные дифференциалы энтропии имеют вид:
(6-40)
Частные производные энтропии, входящие в эти уравнения, вычисляются по уравнениям, которые выведены в гл. X.
Для получения изменения энтропии как функции Г и о соотношение (6-38) представим в следующем виде:
<к = СгДТ/Т + ЯеЫо.
(6-41)
Интегрируя,
при Со
=
const
найдем для идеального газа
s2
—
Si
== Сь
In
7У7\ +
R
In
i^i-
(6-42)
Для
получения изменения энтропии как
функции Т
и
р следует из уравнения (6-41) исключить
v.
Из
уравнения Клапейрона после
дифференцирования получим:
ри
=
pdv
+
vdp
=
/W7;
dü/o
=
dT/T
—
dp/p.
Подставляя
значение
dv/v
в
уравнение (6-41), имеем
'
ds
=
с^ТУГ +
RdT/T
—
Rr
dp/p
=
CpdT/T
—
R
dp/p.'
Интегрируя
при
cv
=
const,
находим
s2
—
Sj
=
cp
In T2/7\
—
ft
In
р2/рР
(6-43)
Для
получения изменения энтропии как
функции р
и
V
следует
из уравнения (6-41) исключить Т.
Пользуясь
тем же методом, получим
ds
=
Cvdvlv
+
Cbdplp
-f
R
dv/v,
откуда
ds
=
(cv
+
R)
dv/v
+
cvdplp
=
Cpdu/u
+
cvdp/p.
•
Интегрируя, определяем
s2—s1
=
Cp\n-?2-
+
c~v]np2/pi;
(6-44)
vi
Учитывая,
что изменение энтропии тела не зависит
от характера процесса, полученные
уравнения (6-42), (6-43) и (6-44) применимы как
для обратимых, так и для необратимых
процессов.
Из
уравнения (6-39) можно получить общую
формулу для определения теплоемкости.
Теплоемкость
сх
любого
процесса равна произведению абсолютной
температуры Т
на
частную производную энтропии^ по
температуре Т
при
х
=
const:
(6-45)
Подставив
в уравнения (5-9) и (5-13) значение йа
из
уравнения
(6-39), получим
Т<к
=
йи
+
pdv,
(6-46)
Тек
=
Л ~
vdp.
(6-47)
Равенства
(6-46) и (6-47) содержат только параметры
состояния и их дифференциалы и
носят/название термодинамических
тождеств;
они
относятся к обратимым процессам.
Если
в термодинамической системе кроме
работы изменения объема совершается
работа dlv,
не
связанная с изменением объема тела, то
термодинамические тождества имеют вид
Тйа
-
du
+
pdv
+
й1в;
'
(6-48)
Tds
=
di
—
ьйр
+
йК.
. •
(6-49)![]()
В термодинамике- внутренняя энергия, энтальпия, энтропия, теплоемкости называются калорическими свойствами вещества, а удельный объем, абсолютное давление, температура — термическими свойствами.
