
- •Под редакцией проф. В. С. Силецкого Допущено Министерством высшего и среднего специального образования ссср в качестве учебного пособия для неэнергетических специальностей вузов
- •74 Бечгородск.;я ' областная ' библиотека
- •Предисловие к первому изданию
- •Часть первая техническая термодинамика
- •Глава I введение
- •Контрольные вопросы и примеры к I главе
- •Глава II
- •Контрольные вопросы и примеры к II главе
- •Контрольные вопросы и примеры к III главе
- •Глава IV реальные газы
- •Глава V первый закон термодинамики
- •Г л а в а VI теплоемкость газов. Энтропия
- •3 В. В. Нащокин .65
- •§ 6Т11. Тепловая Тя-диаграмма
- •Глава VII
- •CpdT vdp , dv dp
- •Контрольные вопросы и примеры к VII главе
- •Глава VIII . Второй закон термодинамики
- •Глава IX характеристические функции и термодинамические потенциалы. Равновесие систем
- •Контрольные вопросы и примеры к IX главе
- •Водяной пар,
- •_ Масса сухого насыщенного пара во влажном
- •Масса влажного пара
- •Глава XII
- •Глава XIII истечение газов и паров
- •Контрольные вопросы Ли примеры к XIII главе
- •Глава XIV
- •Глава XV влажный воздух
- •Глава XVI [ компрессоры
- •Глава XVII циклы двигателей внутреннего сгорания
- •Глава XVIII
- •V Лг изоб изох'
- •Глава XIX циклы паротурбинных установок
- •Контрольные вопросы и примеры к XIX главе
- •Глава XX циклы атомных электростанций, парогазовых и магнитогидродинамических установок
- •Контрольные вопросы к XX главе
- •Глава XXI циклы холодильных установок
- •* С. Я. Г е р ш. Глубокое охлаждение. Госэнергоиздат, 1957, стр. 85.
- •Глава XXII
- •Контрольные вопросы к XXII главе
- •Глава XXIII
- •Глава XXIV теплопроводность при стационарном режиме и граничных условиях третьего рода, коэффициент теплопередачи
- •Глава XXV
- •2 В. В. Нащокин
- •Контрольные вопросы к XXV главе
- •Глава XXVI конвективный теплообмен
- •Физические свойства жидкостей
- •Режимы течения и пограничный слой
- •Числа подобия
- •Теореме! подобия
- •Контрольные вопросы к"XXVI главе
- •Глава XXVII
- •Контрольные вопросы и примеры к XXVII главе
- •Глава XXVIII
- •Контрольные вопросы и примерь! к XXVIII главе
- •Глав а XXIX теплообмен излучением
- •Степень черноты полного нормального излучения для различных материалов
- •Средняя длина лучей для газов, заполняющих объем различной формы
- •Контрольные вопросы и примеры к XXIX главе
- •Глава XXX теплообменные аппараты
- •1 1 ТуСру 4190
- •Глава XXXI
- •Воздух (абсолютно сухой)
- •Кдж/(моль- град)
- •Кдж/(кг-град)
- •"50. Н о з д р е в в. Ф. Курс термодинамики. «Высшая школа», 1961.
- •Глава I. Введение 5
- •Глава VII. Термодинамические процессы идеальных газов ...... 79
- •Глава VIII. Второй закон термодинамики , 95
- •Глава IX. Характеристические функции и термодинамические потен- циалы. Равновесие систем 124
- •Глава XII. Основные термодинамические процессы водяного пара . . 173 § 12-1. Общий метод исследования - термодинамических процессов
- •Глава XV. Влажный воздух . . 214
- •Глава XVII. Циклы двигателей внутреннего сгорания 235
- •Глава XVIII. Циклы газотурбинных установок и реактивных двига- телей 253
- •Глава XX. Циклы атомных электростанций, парогазовых и магнито-
- •Глава XXI. Циклы холодильных установок 299
- •Часть вторая. Теплопередача
- •Глава XXII. Основные положения теплопроводности 315
- •Глава XXIV. Теплопроводность при стационарном режиме и граничных условиях третьего рода. Коэффициент теплопередачи . . 337 § 24-1. Передача теплоты через плоскую однослойную и многослойную
- •Глава XXV. Теплопроводность при нестационарном режиме . . . 352
- •Глава XXVI. Конвективный теплообмен . . 363
- •Глава XXVII. Конвективный теплообмен в вынужденном и свобод- ном потоке жидкости 386
- •Глава XXX. Теплообменные аппараты зд7
- •Глава XXXI. Тепло- и массоперенос во влажных телах , 460
- •Владимир Васильевич Нащокин техническая термодинамика и теплопередача
CpdT vdp , dv dp
■-L = tL или k-— — .
cv dT * pay ' v . p
Интегрируя последнее уравнение при условии, что k — const (ср = const и Со = const), находим
V2 Pi
dv[v= — ^ dplp и kInvjvx.— Inpx/p2. vt pi После потенцирования имеем ■
(u2/yI)fc = Pl/p2, или pxv\ =.p2v1,-откуда уравнение адиабаты
pvk = const. (7-15)
При адиабатном процессе произведение давления на объем газа в степени k есть величина постоянная. Величину k называют показателем адиабаты. Рассмотрим зависимость между основными параметрами в адиабатном процессе.
Из уравнения адиабаты следует, что
I
Px'pt = и vJvl = {pJPiY.
Если эти соотношения параметров тела подставить в уравнение состояния для крайних точек процесса {pJPii'lpdvi) = (7V7\)> то после соответствующих преобразований найдем
k— 1
' TjT^ipJvtf-^ipJPi) k .
Удельная работа изменения объема / = J pdv, совершаемая те-
лом над окружающей средой при равновесном адиабатном процессе, может быть вычислена по сравнению адиабаты
Р = PiVkJvk
или,
I = J pl v* (dvI vk) = [рг v\ I (1 — k)) (v\ - х — v} ~ k) =-■=
= Pi v\ /_1 1_Y 1 / Pi 4 Рг v'l )
k-\ \vi-1 л-ч k~i Ui_l I'
откуда
/ = (l//e - 1) (plVl - p2v2). (7-16) Из выражения (7-16) могут быть получены следующие формулы:
/ = (plVllk - 1) (1 - TJTy); I = (Rfk - 1) (7\ - T2). Отношение температур заменяем отношением объемов и -давлений
/= (Pl vjk-1) [l - (рМ~] = (RTjk-* 1) [l-ivjvj*-*].
Все зависимости между р, v, Т и уравнения работы получены при условии, что k = const. При переменной k обычно при расчетах берут среднее значение k, соответствующее изменению температуры в процессе по уравнению
k = cpj I cv j =At/A«.
Уравнения первого закона термодинамики (6-46) и (6-47) для адиабатного процесса (dq = 0) имеют следующий вид: ■
du = —pdv udi = vdp,
откуда
(du/dv)s = — р и (di/dp)s = v.
Из этих соотношений можно получить
(di/du)s =-—(v/p) (dp/dv)s.
Полученное выражение и есть дифференциальное уравнение изо-энтропного процесса.
В этом уравнении (di/du)s = к.
 Согласно
первому закону термодинамики работа
изменения объема в адиабатном процессе
получается за счет убыли внутренней
энергии тела; при с„
—
const
Согласно
первому закону термодинамики работа
изменения объема в адиабатном процессе
получается за счет убыли внутренней
энергии тела; при с„
—
const
Если газ расширяется, то его внутренняя энергия и температура убывают; если газ сжимается, то его внутренняя энергия и температура возрастают.
Теплоемкость в адиабатном процессе из выражения с=йц1йТ при с/<7 = 0 также равна нулю.
Вычислим располагаемую (полезную) внешнюю работу в адиабат-, ном процессе, равную
р« » /' = —^ иФ« *
Р1
При обратимом адиабатном процессе идеального газа располагаема^ внешняя работа будет в к раз больше величины работы изменения объема и обратна ей по знаку.
Действительно, из уравнения адиабаты (7-15) следует, что к&иЬ — .*= — йр!р или'—ьйр — крйь, т. е. &1' = Ы1
Следовательно,
/' = _ 1) (рЛ _ р2и2) . (7-17)
и
V - Ы.
* Графически располагаемая внешняя работа изображается на pv-диаграмме пл. ABCD (рис. 7-5), или площадью, ограниченной линией процесса, крайними абсциссами и осью ординат.
Из рис. 7-6 видно, что поскольку в уравнении адиабаты k > 1, она на /?у-диаграмме идет круче, чем изотерма.
Для обратимого адиабатного процесса dq =- 0, поэтому
ds ' dqlT = 0hs2 = s± = const, (7-18)
т. е. обратимый адиабатный процесс является одновременно изоэнт-ропным (или при постоянной энтропии) и изображается в Гя-диаграмме вертикальной прямой о — Ь, параллельной оси ординат (см. рис. 7-2).
§ 7-6. Политропные процессы
До сих пор рассматривались процессы, у которых имелись вполне определенные признаки: изохорный процесс осуществлялся при попето ян ном объеме; изобарный—при • постоянном давлении; изотерм-ный — при постоянной температуре; адиабатный — при отсутствии теплообмена между рабочим телом и внешней средой. Наряду с этими процессами можно представить еще бесконечное множество процессов, у которых имеются другие постоянные признаки.
Условились всякий процесс идеального газа, в котором теплоемкость является постоянной величиной, называть политропным процессом, а линию процесса — политропой.
Из определения политропного процесса следует, что основные термодинамические процессы — изохорный, изобарный, изотермический и адиабатный, если они протекают при постоянной теплоемкости, являются частными случаями политропного процесса.
Теплоемкость политропного процесса Сп может принимать самые разнообразные положительные и отрицательные значения от + оо до
— оо.
Количество теплоты, участвующее в политропном процессе, может быть выражено произведением теплоемкости процесса сп на разность температур t2 — tx в конечном и начальном состояниях:
Я" = сп (t2 — к) ndq = сп dt. (7-19)
Уравнение политропного процесса выводится на основании уравнения первого закона, термодинамики:
dq = cndT = CpdT — vdp и dq = c^dT — cvdT + pdv.
. Из этих уравнений найдем
(сп — ср)/(сп — cv) =■— vdplpdv.
Обозначив выражение левой части* уравнения через п, получим
(сп — Ср)/{сп — cv) = п и п dvlv = —dpiр.
Интегрируя полученное соотношение в пределах от начала до конца процесса, находим
п lg v2lvx = lg pxlp2
или
pVn = const. (7-20)
Полученное уравнение является уравнением политропнсго процесса.
Показатель политропы п принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных п — ± со, изобарных п = 0, изотермных п = 1 и адиабатных п = k.
Поскольку уравнение политропы отличается от уравнения адиабаты только величиной показателя п, то, очевидно, все соотношения между основными параметрами могут быть.представлены формулами, аналогичными адиабатному процессу:
п- 1
p2/p1 = (V^)n; T2/T1^(v1/v2r-\ т2/тх= (p2/Pl) п .
Теплоемкость политропного процесса определяем из формулы
п = (сп —ср)1 (cn — cv), откуда cn = cu l(n — k) 1(п — 1)1. (7-21)
Уравнение (7-21) позволяет определить теплоемкость политроп-■ ного процесса для каждого значения п.
Если в уравнение (7-21) подставить значения п для частных случаев, то получаем теплоемкости рассмотренных процессов: изохорного процесса п = ± со, сп = си; изобарного процесса п — 0, cn = kcv = cv\ изотермного процесса п ~ 1, cn = ± со; адиабатного процесса п = k, сп = 0.
Уравнение работы изменения объема, совершаемой телом при поли-тропном процессе, имеет аналогичный вид с уравнением работы в адиабатном процессе, т. е.
/ = tl/(n - 1)1 (рЛ - p2v2), (7-22)
или
п— 1
/ = \RTJn — 11 (1 — т2/тх) = lPaV(" — 1)1 П —.(pJPt) " ) = = - 1)1 1(1 - (vMT-1). (7-23)
Изменение внутренней энер'гии газа и теплота в политропном процессе определяются по формулам:
Дм = cv (t2 — txy,
■ Q = cn (t2 - tx) = cv l(n - k)l(n - 1)1 (t2 - h). (7-24)
Располагаемая внешняя работа в политропном процессе по аналогии с адиабатным процессом равна
J Г = vdp = lnl{n-l)){p1v1-p2v2) = [n/(n-l))R(T1-T2). (7-25) pi
Изменение энтальпии в политропном процессе
' І2 — И = ср (*2 —
(7-26)
"Значение п в любом политропном процессе может быть определено по координатам двух любых точек графика:
(7-27)
1 =
lgl>l/t>2
■ IgOz/Oi
Изображая политропный процесс в логарифмических координатах, можно предложить простой способ для определения показателя п. Логарифмируя уравнение политропы, получим
lg р + п lg v = const. .
![]()

![]()
Off=f
Рис. 7-8
Это уравнение представляет собой уравнение прямой линии в координатах ^р и ^у, а показатель политропы я — тангенс угла наклона прямой к оси абсцисс (рис. 7-7).
Изменение энтропии газа в политропном процессе определяется по формуле
Ж = дц1Т = спйТ1Т, или для конечного изменения состояния
88-81 = с„1п7'4/7'1 = с|,[^=^]1пГя/7'1. (7-28)
Политропный процесс на Т^-диаграмме изображается (рис. 7-8) некоторой кривой, расположение которой зависит от показателя п.
На рис. 7-9 показано расположение политропных процессов на ри-диаграмме, выходящих из одной и той же точки, в зависимости от величины показателя п.
Рассмотрим, как изменяется внутренняя энергия газа в политропных процессах. В изотермическом процессе при п. — 1 внутренняя энергия газа не изменяется (иг = их). В изобарном процессе расширения при п = О внутренняя энергия увеличивается. В изохорном процессе с подводом теплбт*Б1 при п — — со внутренняя энергия возрастает. Отсюда можно сделать вывод, что все политропные процессы, т. е. процессы расширения, расположенные над изотермой, при п<С 1, а процессы сжатия при п > 1 протекают с увеличением внутренней энергии газа. Политропные процессы, т. е. процессы расширения, расположенные под изотермой, при п > 1, а процессы сжатия при /г < 1 протекают с уменьшением внутренней энергии газа.
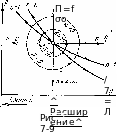 Рассмотрим,
как изменяется знак теплоты в политропных
процессах (рис. 7-9). В адиабатном
процессе теплота не подводится и не
отводится. В изотермическом (п
=
1), изобарном (п
=
0)
процессах расширения и в изохорном
процессе (п
=
— со) теплота подводится. Следовательно,
все политропные процессы, т. е. процессы
расширения, расположенные над
адиабатой в пределах к
>
п
>
— со, а процессы сжатия при со > п
>
&
протекают
с подводом теплоты к, рабочему телу.
Рассмотрим,
как изменяется знак теплоты в политропных
процессах (рис. 7-9). В адиабатном
процессе теплота не подводится и не
отводится. В изотермическом (п
=
1), изобарном (п
=
0)
процессах расширения и в изохорном
процессе (п
=
— со) теплота подводится. Следовательно,
все политропные процессы, т. е. процессы
расширения, расположенные над
адиабатой в пределах к
>
п
>
— со, а процессы сжатия при со > п
>
&
протекают
с подводом теплоты к, рабочему телу.
Политропные же процессы расширения при со > п > к, а процес: сы сжатия при — со <с п <С & про-, текают с отводом теплоты.
Процессы, расположенные меж-* ду адиабатой и изотермой, имеют отрицательную теплоемкость, так как знак йцъ йи в этих процессах различный. Поскольку йи = сьйТ, следовательно, знак у йи соответствует знаку у йТ (йи > 0, йТ > 0 и йи < 0, йТ < 0). Тогда из выражения для теплоемкости с = йа/йТ видно, что она действительно отрицательна. Практически это означает, что при подводе теплоты в этих процессах/Температура уменьшается, а при отводе теплоты— увеличивается.
