
- •Под редакцией проф. В. С. Силецкого Допущено Министерством высшего и среднего специального образования ссср в качестве учебного пособия для неэнергетических специальностей вузов
- •74 Бечгородск.;я ' областная ' библиотека
- •Предисловие к первому изданию
- •Часть первая техническая термодинамика
- •Глава I введение
- •Контрольные вопросы и примеры к I главе
- •Глава II
- •Контрольные вопросы и примеры к II главе
- •Контрольные вопросы и примеры к III главе
- •Глава IV реальные газы
- •Глава V первый закон термодинамики
- •Г л а в а VI теплоемкость газов. Энтропия
- •3 В. В. Нащокин .65
- •§ 6Т11. Тепловая Тя-диаграмма
- •Глава VII
- •CpdT vdp , dv dp
- •Контрольные вопросы и примеры к VII главе
- •Глава VIII . Второй закон термодинамики
- •Глава IX характеристические функции и термодинамические потенциалы. Равновесие систем
- •Контрольные вопросы и примеры к IX главе
- •Водяной пар,
- •_ Масса сухого насыщенного пара во влажном
- •Масса влажного пара
- •Глава XII
- •Глава XIII истечение газов и паров
- •Контрольные вопросы Ли примеры к XIII главе
- •Глава XIV
- •Глава XV влажный воздух
- •Глава XVI [ компрессоры
- •Глава XVII циклы двигателей внутреннего сгорания
- •Глава XVIII
- •V Лг изоб изох'
- •Глава XIX циклы паротурбинных установок
- •Контрольные вопросы и примеры к XIX главе
- •Глава XX циклы атомных электростанций, парогазовых и магнитогидродинамических установок
- •Контрольные вопросы к XX главе
- •Глава XXI циклы холодильных установок
- •* С. Я. Г е р ш. Глубокое охлаждение. Госэнергоиздат, 1957, стр. 85.
- •Глава XXII
- •Контрольные вопросы к XXII главе
- •Глава XXIII
- •Глава XXIV теплопроводность при стационарном режиме и граничных условиях третьего рода, коэффициент теплопередачи
- •Глава XXV
- •2 В. В. Нащокин
- •Контрольные вопросы к XXV главе
- •Глава XXVI конвективный теплообмен
- •Физические свойства жидкостей
- •Режимы течения и пограничный слой
- •Числа подобия
- •Теореме! подобия
- •Контрольные вопросы к"XXVI главе
- •Глава XXVII
- •Контрольные вопросы и примеры к XXVII главе
- •Глава XXVIII
- •Контрольные вопросы и примерь! к XXVIII главе
- •Глав а XXIX теплообмен излучением
- •Степень черноты полного нормального излучения для различных материалов
- •Средняя длина лучей для газов, заполняющих объем различной формы
- •Контрольные вопросы и примеры к XXIX главе
- •Глава XXX теплообменные аппараты
- •1 1 ТуСру 4190
- •Глава XXXI
- •Воздух (абсолютно сухой)
- •Кдж/(моль- град)
- •Кдж/(кг-град)
- •"50. Н о з д р е в в. Ф. Курс термодинамики. «Высшая школа», 1961.
- •Глава I. Введение 5
- •Глава VII. Термодинамические процессы идеальных газов ...... 79
- •Глава VIII. Второй закон термодинамики , 95
- •Глава IX. Характеристические функции и термодинамические потен- циалы. Равновесие систем 124
- •Глава XII. Основные термодинамические процессы водяного пара . . 173 § 12-1. Общий метод исследования - термодинамических процессов
- •Глава XV. Влажный воздух . . 214
- •Глава XVII. Циклы двигателей внутреннего сгорания 235
- •Глава XVIII. Циклы газотурбинных установок и реактивных двига- телей 253
- •Глава XX. Циклы атомных электростанций, парогазовых и магнито-
- •Глава XXI. Циклы холодильных установок 299
- •Часть вторая. Теплопередача
- •Глава XXII. Основные положения теплопроводности 315
- •Глава XXIV. Теплопроводность при стационарном режиме и граничных условиях третьего рода. Коэффициент теплопередачи . . 337 § 24-1. Передача теплоты через плоскую однослойную и многослойную
- •Глава XXV. Теплопроводность при нестационарном режиме . . . 352
- •Глава XXVI. Конвективный теплообмен . . 363
- •Глава XXVII. Конвективный теплообмен в вынужденном и свобод- ном потоке жидкости 386
- •Глава XXX. Теплообменные аппараты зд7
- •Глава XXXI. Тепло- и массоперенос во влажных телах , 460
- •Владимир Васильевич Нащокин техническая термодинамика и теплопередача
Глава V первый закон термодинамики
§ 5-1. Закон сохранения и превращения энергии
Первый закон термодинамики является частным случаем всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям, протекающим в термодинамических системах.
Закон сохранения и превращения энергии гласит, что в изолированной системе сумма всех видов энергии является величиной постоянной. Из этого закона следует, что уменьшение какого-либо вида энергии в одной системе, состоящей из одного или множества тел, должно сопровождаться увеличением энергии в другой системе тел.
Превращение механического движения в теплоту известно человеку с древнейших времен, но обратное превращение теплоты в механическую работу в тепловых двигателях практически было осуществлено лишь во второй половине XVIII столетия. И хотя первые попытки превращения теплоты в механическую работу были предприняты еще до нашей эры, они не оказали какого-либо влияния на создание теплового двигателя. Так, например, Герон Александрийский в первом столетии до нашей эры изобрел шар, вращающийся под действием реактивных сил, созданных-водяным паром, который вырывался из шара при нагревании его. В начале XVII в. итальянский ученый Бран-ка создал установку, в которой использовалась кинетическая энергия пара для вращения колеса, укрепленного на вертикальной оси.
В начале XVIII столетия Папин пытался создать паровую поршневую машину. Однако только в 1766 г. такая машина была создана И. И. Полз у новым.
Таким образом, в концу XVШ в. процесс превращения теплоты в работу был осуществлен, но без всяких теоретических расчетов и обоснований. Общую формулировку закона сохранения и превращения энергии дал великий русский ученый М. В. Ломоносов. Однако Ломоносов не мог установить эквивалентность различных форм движения материи и дать количественную связь между ними, так как не имел необходимых для этого фактических данных.
Лишь через сто лет после Ломоносова, в первой половине XIX в., наука вплотную подошла к открытию закона сохранения и превращения энергии и эквивалентности теплоты и работы.
В 1842 г. Роберт Майер на основании опытов установил прямую пропорциональность между затраченной теплотой 0_ и полученной работой Ь и определил количественное соотношение между ними:
<2 = АЬ,
где А — постоянная величина, называемая тепловым эквивалентом работы. Тепловой эквивалент единицы работы — величина размерная и зависит от системы единиц, выбранных для измерения теплоты и ра
боты. Если теплота и. работа измеряются в одних единицах (Джоулях), то эквивалент равен единице и тогда
(} = Ь. (5-1)
В установленном соотношении Майера говорится не только об эквивалентности теплоты и работы, т. е. о количественном постоянстве , энергии, но и об изменении качества самой энергии.
Об этом Энгельс в «Диалектике природы» говорит следующее: «Количественное постоянство движения было высказано уже Декартом и почти в тех же-выражениях, что и теперь, Клаузиусом и Р. Майером, зато превращение формы движения открыто только в 1842 г., и это, а не закон количественного постоянства, есть как раз новое». .
И дальше Энгельс писал: «Любая форма движения оказалась способной и вынужденной превращаться в любую другую форму движения, Дойдя до этой формы, закон достиг своего последнего выражения... Он абсолютный закон природы».
В 1843 г. англичанин Джоуль, а в 1844 г. русский академик Ленц 'установили соотношение между электрической энергией и теплотой. Доказали эквивалентность электрической работы и теплоты. Этот закон вошел в физику под названием закона Ленца — Джоуля.
В 1847 г. была опубликована работа Гельмгольца «О сохранении силы». В ней научно излагался закон сохранения энергии.
В 1850 г. была опубликована работа Клаузиуса «О движущей силе теплоты», в которой давалось математическое обоснование закона сохранения энергии, разбирались особенности теплоты при идеальных и реальных процессах, объяснялось не только количественное, но качественное содержание открытого закона.
Таким образом, закон сохранения и превращения энергии, открытый М. В. Ломоносовым, но не получивший широкого развития при его жизни, во второй половине XIX в. получил полное -признание.
§ 5-2. Внутренняя энергия
Под внутренней энергией газа понимается вся энергия, заключенная в теле или системе тел. Эту энергию можно представить в виде суммы отдельных видов энергий: кинетической энергии молекул, включающей энергию поступательного н вращательного движения молекул, а также колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии или энергии положения молекул в каком-либо внешнем поле сил; энергии электромагнитного излучения. Внутренняя энергия тела равна
и* = икт + иПОТ + и0,
*
Полную внутреннюю энергию тела принято
обозначать и
(дж),
а
удельную внутреннюю энергию,
отнесенную к 1 кг,
— и (дж/кг).
Внутреннюю кинетическую энергию можно разделить на следующие составляющие:
^КШ1 = ^КНП. ПОСТ ~Ь ^КИН. вр ~Ь ^кол>
где ^кин.пост — кинетическая энергия поступательного движения молекул; £/,.„„.вр — кинетическая энергия вращательного движения молекул; £/„ол — энергия колебательного движения ядер атомов молекулы относительно друг друга.
Величина ио представляет собой нулевую энергию или внутреннюю энергию при температуре абсолютного нуля. Как известно, при Г = О тепловое движение молекул и атомов, входящих в молекулы, прекращается, но движение частиц внутри атомов продолжается. Например, движение электронов в атомах не является тепловым движением и имеет место при любых температурах, в том числе и при Т = = 0. Так как абсолютное значение внутренней энергии методами термодинамики определить невозможно, то при термодинамическом анализе системы приходится иметь дело не с абсолютными значениями внутренней энергии, ас ее изменением в результате происходящих процессов, поэтому для решения большинства термодинамических задач значение и0 не требуется и ее обычно полагают равной нулю.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. Поэтому в понятие внутренней энергии будем в дальнейшем включать для идеальных газов кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов еще дополнительно и потенциальную составляющую энергии, связанную с наличием сил взаимодействия между молекулами и зависящую от расстояния между ними.
Отсчет внутренней энергии при этом может производиться от любого условного нуля. Так, например, для идеальных газов принято считать внутреннюю энергию при (0 — 0° С равной нулю.
Поскольку кинетическая составляющая внутренней энергии целиком определяется температурой тела, а потенциальная ее составляющая при заданной температуре зависит еще и от удельного объема (расстояния между молекулами), то полная внутренняя энергия будет являться функцией двух параметров и в данном состоянии тела будет ' иметь' вполне определенную величину.
Такие величины, как было установлено ранее, называются пара- ■ метрами, или функциями, состояния. Следовательно, внутренняя энергия, являясь параметром состояния, представляет собой одновременно однозначную непрерывную и конечную функцию состояния системы.
Внутренняя энергия является аддитивным или экстенсивным параметром, так как ее величина зависит от массы тела. Внутренняя энергия сложной системы, отнесенная к 1 кг, равна сумме внутренних энергий ее отдельных составляющих, т. е. ..
п
и=и1~{-и2-\ +«„ = 2«;.
1
Из закона сохранения энергии следует, что термодинамическая система в каждом своем состоянии-может иметь только одно значение внутренней энергии. Если предположить, что система в данном состоянии может иметь разные значения внутренней энергии, то мы могли бы использовать эту разность без изменения состояния системы. Такое положение противоречит закону сохранения энергии. Поэтому изменение внутренней энергии газа не будет зависеть от характера или пути процесса, полностью определяясь заданными начальным и конечным его состояниями:
"2 — "1 = / (Ра. ^2. Т2) — / (рх, их, 7\). ' (5-2)
Это наглядно иллюстрируется рис. 5-1. Во всех процессах
2 2 2 1 2
(3)^Аи = (4)ЛАи = (5)$йи = —(6) ^Аи = (6)^Аи
I I I О * 1 *
 изменение
внутренней энергии будет одно •и то
же.
изменение
внутренней энергии будет одно •и то
же.
В круговых процессах изменение внут--ренней энергии равно нулю:
и, — и, = <{></« = 0.
Приращение Аи, как и любого параметра, является полным дифференциалом. Поскольку состояние газа вполне определяется основными параметрами состояния,
внутреннюю энергию можно представить как функцию любых двух параметров состояния:
(5-3)
Аи=. (ды/др)с Ар + (ди/ди)р Аи.
Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема или давления .(ди/дЬ) т — 0 и (ди/др) т = 0, а зависит только от температуры ы = / (Г).
Следовательно, производная от внутренней энергии идеального газа по температуре есть полная производная:
. _ (ди/дТ)р = (ди/дТ)и = Аи1АТ>
С. ■ Это положение было доказано Джоулем, который проделал в 1845 г, ^следующий опыт. В калориметр с водой помещались два сосуда, соединенные между собой трубкой с краном (рис. 5-2). В первом сосуде находился воздух под давлением. Из второго сосуда воздух был удален, Температура всей установки определялась несколькими термометрами.
После того как температура в калориметре длительное время оставалась постоянной и равной температуре воздуха в помещении, кран между сосудами открывался и часть воздуха из первого сосуда попадала во второй.
При проверке температуры в калориметре оказалось, что она осталась неизменной, следовательно, в опыте теплота не поглощалась и не выделялась (О. = 0). Внешняя работа Ь воздуха при перетекании в сосуд с жесткими стенками при условии, что там был вакуум, также не совершалась (Ь — 0).
При таких условиях внутренняя энергия воздуха также должна была остаться неизменной. Так как в опыте неизменными остава-
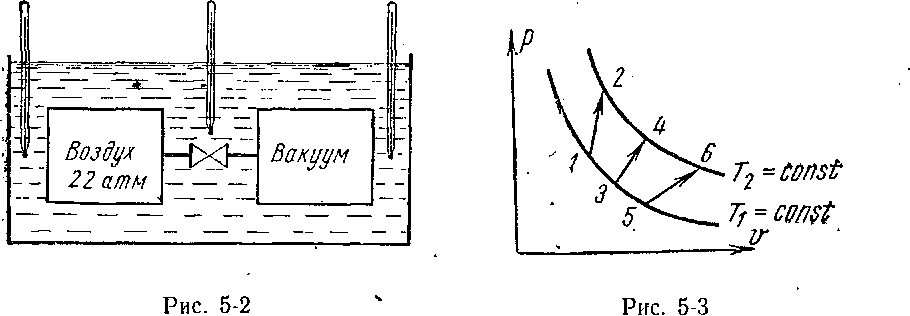
лись только температура и внутренняя энергия, Джоуль сделал вывод, что внутренняя энергия газа зависит только от температуры: и = / (Т).
Это положение в точности справедливо только для идеальных газов.
Выводы Джоуля могут быть отнесены с-допустимой для практики погрешностью и к реальным газам, если они находятся при высоких температурах и малых давлениях. Поэтому для приближенных расчетов можно считать, что внутренняя энергия реальных газов при указанных условиях является функцией только одной температуры.
Если на ру-диаграмме (рис. 5-3) между изотермами 7\ и Т2 изобразить ряд произвольных процессов 1-2, 3-4, 5-6, которые имеют различные начальные и конечные объемы и давления, то изменение внутренней энергии идеального газа у всех этих процессов будет одинаковым, т. е.
Ли = и2 —щ, = и4 — «з = и, — иъ = / (Т2) — - / (7\).
§ 5-3. Аналитическое выражение работы процесса
Передачу энергии от одного тела к другому, связанную с изменением объема рабочего тела, с перемещением его во внешнем пространстве или с изменением его положения, называют работой. В производстве работы всегда участвует два или больше тел. Первое тело, производящее работу, отдает энергию, второе тело получает энергию. Как уже указы
валось ранее, работа является макрофизической формой передачи энергии от одного тела к другому.
Совершаемая газом работа при его расширении зависит от изменения параметров состояния р, V и Т.
Для вывода уравнения работы гада при его расширении рассмотрим частный случай — получение работы в равновесном процессе при постоянном давлении.
Пусть в цилиндре под поршнем находится 1 кг газа при давлении р, равном в равновесном процессе давлению среды, и удельном объеме
2
 \Р
1
\Р
1
V?-
VI (рис. 5-4); площадь поршня Если сообщить газу некоторое количество теплоты, то он будет расширяться при постоянном давлении и перемещать поршень до нового положения в точке 2.
Сила, действующая на поршень, равна р/7; путь перемещения поршня равен 5. Из физики известно, что произведение силы на путь есть работа. Тогда работа, совершаемая газом, равна
1 = рР8,
но произведение FS есть разность удельных объемов VI — уъ поэтому
/ = р (у2 — V}) = рДу. (5-4)
Элементарная работа а7, совершаемая системой в равновесном процессе изменения состояния тела при бесконечно малом изменении ее объема, определится по формуле
Ш = реГи. (5-5)
Работа /, совершаемая системой при конечном изменении ее объема в произвольном равновесном процессе, изображается кривой АВ (рис. 5-5) и равна
о.
/ = 5 рЛо. (5-6)
Зная функциональную зависимость параметров р и V в процессе или уравнение вида р = / (и), можно аналитически определить работу для любого равновесного процесса в указанных пределах.
Если система совершает работу во внешней среде, где давление р\ то работа расширения системы при увеличении объема на' д.ь равна й1 = р'йь, а при конечном изменении объема от их до у2
= $ р'йу.
(5-7)
При
равновесном процессе давление р'
= р.
Следует
напомнить, что если расширение системы
происходит в пустоту, когда давление
р'
на
границах системы и внешней среды равно
нулю и никаких перемещений внешних
тел не наблюдается, работа / равна нулю,
что и вытекает из формулы (5-7).
.Кроме
работы /, -связанной с изменением объема
и определяемой выражением (5-7), иногда
встречаются случаи, когда в рабочем
теле изменяется внешняя кинетическая
энергия без изменения объема (например,
вращение жидкости с помощью мешалки,
работа .против . электрических,
магнитных и некоторых других сил).
В
таком процессе интеграл | р'йи
=
0, так как
йь
— 0.
Эту работу, производимую •
источником, обозначают 1Ь.
Следовательно,
работа системы в общем случае складывается
из работы расширения и работы, совершаемой
без изменения объема, т. е.
внешним
»1
При
расширении газа не вся работа расширения
может быть полезно использована..Часть
ее вследствие увеличения объема газа
должна быть затрачена на вытеснение
среды, давление которой изменяется от
р'х
до
р2- Эта работа (рис. 5-6), отнесенная к'1
кг
расширяющегося
газа, равна
Р2/Л2
—
р\!К
(где
/ — площадь поршня)
или
:р2У2
р(01»
Каждая
величина р\ь%
или
р'^
представляет
собой работу, которую нужно затратить,
чтобы ввести газ объемом V
в
среду с давлением р'.
Следовательно,
полезная,
или,
как ее обычно называют, располагаемая,
работа V равна
разности между работой расширения и
работой вытеснения, т. е;
"(Р2
Ьг—р\у^.
Так как
р'йо = (р'йу + ийр') — юйр' й (р'у) — Ыр',
то
у2 • а
^ р' йю = (р2 у2 —Р1 "1)— ^ юйР'-
Тогда располагаемая работа
5 ы!р' + 1„.

Уравнения (5-4) и (5-5) показывают, что / и д.1 имеют те же знаки, что и Ду и йу, так как абсолютное давление р — величина положительная.
Если иг> V! — газ расширяется, тогда Ду > 0 и аЪ > 0 — работа газа есть величина положительная.
Если у2 •< у! — газ сжимается, тогда Ду <С 0 и аЪ •< 0, при этих условиях работа газа величина отрицательная.
Если процесс расширения протекает не с 1 кг газа, ас т кг, то уравнение .работы изменения объема запишется так:
Ь = т
" 2
^ Р<2у.
;: -.. Работа изменения объема газа (расширения) при равновесном про-?цессе, определяемая уравнением (5-6), на ру-диаграмме изображается ;.пл. АВу2У1 (см. рис. 5-5), ограниченной линией процесса, крайними .ординатами и осью объемов:
■;}■ ." / = /' + р2у2
Располагаемая внешняя работа
газа (полезная), равная \ Ыр,
изображается лл. АВр2ри заключенной между линией процесса, крайними абсциссами и осью давлений (см. рис. 5-5):
/' = / + Р
1^1
РиЩ
у,. Из изложенного следует, что располагаемая (полезная) работа Сможет быть как больше, так.и меньше работы расширения; она зависит |от наклона кривой процесса в ру-диаграмме.
!&
Из рис. 5-7 видно, что величина работы
расширения (или сжатия) Зависит не
только от начального и конечного
состояний тела, но и от Характера
процесса, в котором рабочее тело
переходит из
одного
состояния
в
другое. Все процессы 1-а-2,
1-Ь-2,
1-с-2,
1-й-2
имеют
-начальные
и конечные параметры одинаковые, но разные площади, изображающие работу. Так, .например, при переходе в процессе 1-а-2 работа газа изображается пл. 41а234, а при переходе в процессе 1-й-2 — пл. 41(1234.
Если рабочее тело совершает круговой процесс, изображаемый на ри-диаграмме замкнутой кривой 1-а-2-Ь-1 (рис. 5-8), то при расширении его по линии 1-а-2 тело совершает положительную работу, численно равную пл. 1а2431, а при сжатии, по кривой процесса 2-6-7 над телом должна быть совершена работа, численно равная пл. 1Ь2431, — эта работа будет отрицательной. Разность указанных площадей изображает суммарную работу, совершенную рабочим телом в результате одного кругового процесса или одного цикла; она будет численно равна площади внутри замкнутой линии процессов. 1-а-2-Ь-1.
§ 5-4. Обратимые и необратимые процессы
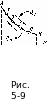 Рассмотрим
равновесный процесс расширения газа
А-В
(рис.
5-9),
который
прошел через равновесные состояния Л,
1,2,
3, п, В. В
этом процессе была получена работа
расширения, изображаемая в некотором
масштабе пл. АВОС.
Для
того чтобы рабочее тело возвратить в
первоначальное состояние (в точку.Л),
необходимо от точки В'провести обратный
процесс — процесс сжатия.- Если увеличить
на величину, о1р
внешнее
давление на поршень, то поршень
передвинется на бесконечно малую
величину и сожмет газ в цилиндре до
давления внешней среды, равного р + о1р.
При
дальнейшем увеличении давления на
&р
поршень
опять передвинется на бесконечно
малую величину и газ будет сжат до
нового давления внешней среды. Во всех
последующих увеличениях внешнего
давления на йр
газ,
сжимаясь при обратном течении процесса,
будет проходить через все равновесные
состояния прямого процесса В,
п, 3. 2, 1, А и
возвратится к состоянию, характеризуемому
точкой Л. Затраченная работа в обратном
процессе сжатия (пл. ВАСО)
будет
равна работе расширения в прямом
процессе (пл. АВОС).
При
этих условиях все точки прямого процесса
сольются со всеми точками обратного
процесса. Такие процессы, протекающие
в прямом и обратном направлениях без
остаточных изменений как в самом рабочем
теле, так и в окружающей среде, называют
обратимыми.
Следовательно,
любой
равновесный термодинамический процесс
изменения
состояния рабочего тела всегда будет
обратимым
термодинамическим процессом.
Рассмотрим
равновесный процесс расширения газа
А-В
(рис.
5-9),
который
прошел через равновесные состояния Л,
1,2,
3, п, В. В
этом процессе была получена работа
расширения, изображаемая в некотором
масштабе пл. АВОС.
Для
того чтобы рабочее тело возвратить в
первоначальное состояние (в точку.Л),
необходимо от точки В'провести обратный
процесс — процесс сжатия.- Если увеличить
на величину, о1р
внешнее
давление на поршень, то поршень
передвинется на бесконечно малую
величину и сожмет газ в цилиндре до
давления внешней среды, равного р + о1р.
При
дальнейшем увеличении давления на
&р
поршень
опять передвинется на бесконечно
малую величину и газ будет сжат до
нового давления внешней среды. Во всех
последующих увеличениях внешнего
давления на йр
газ,
сжимаясь при обратном течении процесса,
будет проходить через все равновесные
состояния прямого процесса В,
п, 3. 2, 1, А и
возвратится к состоянию, характеризуемому
точкой Л. Затраченная работа в обратном
процессе сжатия (пл. ВАСО)
будет
равна работе расширения в прямом
процессе (пл. АВОС).
При
этих условиях все точки прямого процесса
сольются со всеми точками обратного
процесса. Такие процессы, протекающие
в прямом и обратном направлениях без
остаточных изменений как в самом рабочем
теле, так и в окружающей среде, называют
обратимыми.
Следовательно,
любой
равновесный термодинамический процесс
изменения
состояния рабочего тела всегда будет
обратимым
термодинамическим процессом.
Всякий термодинамический процесс, который проходит через неравновесные состояния, называют необратимым термодинамическим процессом. В результате протекания необратимых процессов в прямом и обратном направлениях термодинамическая система не возвращается в первоначальное состояние без затраты извне энергии.
В качестве примера рассмотрим газ, заключенный в вертикальном цилиндре с поршнем. Чтобы создать обратимый процесс сжатия, протекающего бесконечно медленно, необходимо увеличивать груз на поршень на бесконечно малые количества. Если же рабочее тело будет совершать процесс с конечными скоростями, то такой процесс будет необратимым. При конечной скорости поршня газ, расположенный непосредственно у поршня, будет иметь давление, большее, чем газ в остальном объеме,'и потребуется некоторое время, чтобы давление его выравнялось по всему объему.
При расширении газа будем наблюдать явления в обратном порядке. Непосредственно у поршня давление газа будет меньше, чем в остальном объеме, и потребуется некоторое время Для того, чтобы газ равномерно расширился и занял весь объем цилиндра. Таким образом, процессы расширения и сжатия с конечными скоростями являйся необратимыми термодинамическими процессами.
Конечная скорость протекания необратимого процесса всегда связана с дополнительной затратой энергии на преодоление сил трения. Так как обратное некомпенсированное превращение теплоты в работу невозможно, то всякий процесс, сопровождающийся трением, необратим. Необратимыми процессами являются также процессы, протекающие при конечной разности температур между рабочим телом и источниками теплоты, процессы диффузии, процесс расширения в пустоту и ряд других.
Обратимые термодинамические процессы являются идеальными процессами. В них при расширении газ производит максимальную работу, определяемую уравнением
4 /= ^ рйи,
V,
где р — давление рабочего тела, равное давлению внешней среды.
А при сжатии, когда рабочее тело возвращается в первоначальное состояние, в обратимом процессе затрачивается минимальная работа.
При необратимых процессах работа газа определяется уравнением
»«
/ = ^ р' йю,
где р' -— давление внешней среды.
При расширении газа всегда /обр > /пеобр! ПРИ сжатии газа, наоборот, /обр < /необр-
Только обратимые процессы могут быть изображены графически на диаграммах состояния, так как на этих, диаграммах каждая точка представляет равновесное состояние тела. Графическое же изображение необратимых процессов с помощью диаграмм или совершенно невозможно, или их можно изображать лишь приближенно, заменяя, например, все параметры их осредненными по объему значениями.
ч
В термодинамике рассматриваются обратимые процессы, протекающие в идеализированных системах с бесконечно медленными скоростями течения процессов. При этих условиях любой процесс поддается полному термодинамическому и математическому анализу, если известны свойства рабочего тела.
Все действительные процессы, протекающие в природе и в технике, сопровождаются явлениями трения или теплопроводности при конечной разности температур и являются необратимыми. Однако многие необратимые процессы, с которыми приходится иметь дело на практике, сравнительно мало отличаются от-обратимых.. В практических расчетах переход от обратимых процессов к действительным осуществляется с помощью эмпирических коэффициентов, которые учитывают отклонения действительных процессов от идеальных — обратимых.
Таким образом, обратимый процесс представляет собой некоторый, предельный случай действительного процесса.
§ 5-5. Аналитическое выражение первого закона термодинамики
С повышением температуры тела на йТ увеличивается скорость молекул или увеличивается его внутренняя кинетическая энергия. С увеличением объема тела на &о увеличивается расстояние между молекулами, что связано с увеличением его внутренней потенциальной энергии. '
р1)С 5 ,0 ч Сумма изменений внутренней кинетической и
внутренней потенциальной энергии представляет полное изменение внутренней энергии йи. С увеличением объема на &о тело совершает внешнюю работу -по преодолению внешних сил, которую обозначают 6.1.
Если, в рабочем теле не происходит- каких-либо других явлений и отсутствует кинетическая энергия видимого движения, то, согласно закону сохранения энергии, можно написать для элементарного процесса с учетом выбранного правила законов следующее уравнение:
2 2
&и = а'ч—&1\ - иг — и1 = ^6д — ^ё1 = д1г—11.2 (5-8) или для обратимых процессов
2
6д = йи-\-рйь\ д^^иъ — и^ + ^рйь. , (5-9)
Полученное уравнение является математическим выражением первого закона термодинамики. Оно формулируется так: изменение внутренней энергии термодинамической системы равно алгебраической сумме полученной системой энергии в форме теплоты йц и совершенной ею внешней работой Ш, или подведенная к рабочему телу энергия в форме теплоты расходуется на изменение внутренней энергии тела и на. совершение телом внешней работы.
Основное уравнение первого закона термодинамики (5-9) как закона сохранения энергии было получено для процессов, в которых не происходит перемещения рабочего тела в пространстве. В последнем случае в основное уравнение необходимо ввести добавочное слагаемое й"г£р/2, учитывающее приращение кинетической энергии 1 кг газа при его перемещении в пространстве на участке рассматриваемого процесса. Тогда уравнение первого закона термодинамики принимает вид
й<7 = йи + йГ + (1тЧ2, .(5-10)
где дХ' — работа газа^против внешних сил при его движении, или работа проталкивания (она не равна работе расширения й1); йхю%12 — приращение внешней кинетической энергии газа при его перемещении, называемое располагаемой работой.
Полученное уравнение первого закона термодинамики (5-8) справедливо для любых рабочих тел и, в частности для идеальных газов. Это уравнение описывает как обратимые, так и необратимые процессы. Действительно, для необратимых процессов
й?<7 + й?<7Тр = с1и + й1 + Штр, (5-11)
где й<7тр — теплота трения; й/тр — работа против сил трения-. Но поскольку работа, затраченная на преодоление сил трения, переходит полностью в теплоту трения, то й<7Тр = с11Тр. Следовательно, уравнение (5-8) описывает и необратимые процессы.
Все величины, входящие в уравнение (5-8), могут быть как положительными, так и отрицательными и в некоторых случаях могут принимать нулевые значения.
§ 5-6. Энтальпия
В прошлом столетии известный физик Гиббс в.вел в практику тепловых расчетов новую функцию, которая по предложению Камер-линга — Оннеса названа энтальпией. Удельная энталъпия, т. е. энтальпия, отнесенная к 1 кг, обозначается буквой г и измеряется в джоулях на килограмм (дж/кг); она представляет собой, по определению, сложную функцию вида
I = и + ри. (5-12)
Поскольку входящие в энтальпию величины и, р и V являются параметрами (функциями) состояния, следовательно, и сама энтальпия будет также параметром (функцией) состояния.
Энтальпия относится к аддитивным или экстенсивным параметрам, так как ее величина пропорциональна массе,
Если в качестве независимых параметров выбрать давление р и температуру Т, то можно получить для обратимых процессов другой вид аналитического выражения первого закона термодинамики:
dq = du + pdv = du -f- d (pv) — vdp = d (u + pv) — vdp.
Отсюда '
dq = di — vdp, (5-13)
или
Pa
Qi-2 = h — h—jj Ф- (5-14) pi
Абсолютное значение энтальпии термодинамической системы можно получить, проинтегрировав уравнение (5-13). В результате интегрирования в выражение для i войдет постоянная интегрирования i0:
i =J (dq+vdp) + i0, (5-15)
т. е. энтальпия системы определяется с точностью до некоторой аддитивной постоянной i0. Эту постоянную выбирают произвольно, и в большинстве случаев энтальпию идеального газа (при р-н»-0) считают равной нулю при 0° С, а константу интегрирования не учитывают.
Если в термодинамической системе протекают обратимые процессы и наряду с работой изменения объема pdv производится работа, не связанная.с изменением объема системы и отдаваемая внешнему объекту, то в правые части уравнений (5-9) и (5-13) войдет дополнительный член lv:
dq = du + pdv + dlv; . (5-16)
dq = di — vdp + dla. (5-17)
Уравнения (5-16) и (5-17) являются наиболее общим аналитическим выражением первого закона термодинамики для обратимых процессов изменения состояния термодинамической системы.
При р = const уравнение (5-13)-превращается в^
dqp = di. (5-18)
Дифференциал энтальпии di есть элементарное количество теплоты, участвующее в процессе при постоянном давлении. Вся теплота в процессе при постоянном давлении расходуется на изменение энтальпии:
2
qp = ^di = ti — i1.[ (5-19) 1
Щ уравнения (5-13) следует, что
Pt
di = dq + vdp, или i2—i1~q-{-^ vdp. (5-20)
p« \
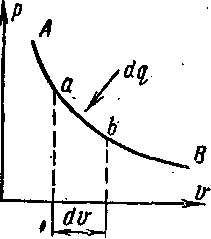
Энтальпия больше внешней теплоты на величину работы vdp, которая на /w-диаграмме изображается элементарной площадкой abed (рис, 5-11), -~
58
-1
Изменение энтальпии полностью определяется начальным и конечным состояниями рабочего тела и не зависит от промежуточных состояний. Изменение энтальпии газа в циклах равно нулю, т, е,
$ Л" = 0.
 Поскольку
энтальпия является функцией основных
параметров состояния, то сИ
есть
полный дифференциал этой функции при
любых независимых переменных,
характеризующих состояние газа:
Поскольку
энтальпия является функцией основных
параметров состояния, то сИ
есть
полный дифференциал этой функции при
любых независимых переменных,
характеризующих состояние газа:
откуда .
сИ = (дЦдр)ь йр + (дг/ду)р йь, \
Л" = (дЦдТ)г,(1Т + {дЦдю)т йю, I (5-21)
сИ = (д1/дТ)р(1Т + (д1/др)тс1р.\
Изменение энтальпии во всех процессах, протекающих между двумя точками А и В, одинаково (рис. 5-12). Физический смысл энтальпии будет понятен из рассмотрения следующего примера. На перемещающийся поршень в цилиндре с 1 кг газа помещена гиря массой пг кг (рис. 5-13). Площадь поршня /, внутренняя энергия рабочего тела и. Потенциальная энергия гири равна произведению массы гири пг на высоту 5. Так как давление газа р уравновешивается массой Гири, то потенциальную энергию ее можно выразить так:
шБ = р/5.
Произведение /5 есть удельный объем газа. Отсюда
тБ = ру.
Произведение давления на объем есть работа, которую надо затратить, чтобы ввести газ объемом V во внешнюю среду с давлением р. Таким образом, работа pv есть потенциальная энергия газа, зависящая от сил, действующих на поршень. Чем больше эти внешние силы, тем больше давление р и тем больше потенциальная энергия давления рь.
Если рассматривать газ, находящийся в цилиндре, и поршень с грузом как одну систему, которую будем называть расширенной системой, то полная энергия £ этой системы складывается из внутренней энергии газа и и потенциальной энергии поршня с грузом, равной pv:
E=u + pv = i. (5-22)
Отсюда видно, что энтальпия i равна энергии расширенной системы — тела и окружающей среды. В этом и заключается физический смысл энтальпии.
Значения энтальпии для паров, газов, газовых смесей приводятся в технической и справочной литературе. Пользуясь этими данными, можно определять количество теплоты, участвующее в процессе при постоянном давлении. Энтальпия, имеет большое значение и применение при расчетах тепловых и холодильных установок и как параметр состояния рабочего тела значительно упрощает тепловые расчеты. Она позволяет применять графические методы при исследовании всевозможных термодинамических процессов и циклов.
Энтальпией особенно целесообразно пользоваться тогда, когда в качестве основных параметров принимают р и Т. Это наглядно можно видеть, если энтальпию i сравнить с внутренней энергией и. При v = = const уравнение первого закона термодинамики dq — du pdv превращается в dqv — du, или qv — иг — ult а при р = const qp=
Энтальпия идеального газа, так же, как. и внутренняя энергия, является функцией температуры и не зависит от других параметров. Действительно, для идеального газа
i = и (Т) + pv = и (Т) + RT,
следовательно (поскольку оба слагаемых зависят только от температуры), i — / (Г).
Тогда по аналогии с внутренней энергией имеем
{dildT)p = {dildT)v = di/dT, ' (5-23)
т. е. в любом процессе изменения состояния идеального газа производная от изменения энтальпии по температуре будет полной производной.
Численные значения энтальпий идеальных газов приведены в табл. XIII приложения.
Контрольные вопросы ^ и примеры к V главе
Что понимается под внутренней энергией идеального и реаль- ного газов? ' -
От каких параметров состояния зависит внутренняя энергия реального и идеального газов?
Является ли внутренняя энергия функцией состояния,йли процесса?
" 4. Чему-равно изменение внутренней энергии в круговом>процессе?
Вывод уравнения работы в произвольном процессе.
Что изображает площадь, под кривой процесса на /?о-диаграмме?'
Показать, что работа является функцией процесса.
Определение обратимого и необратимого процессов.
Признаки обратимых процессов.
10. Какая работа газа больше: в обратимом или необратимом процессе и почему?
Можно ли изобразить графически обратимый и необратимый процессы? ,
Можно ли^на практике осуществить обратимый процесс?
Формулировка первого закона термодинамики.
Аналитическое выражение первого закона термодинамики.
Что такое, энтальпия?
1Б. Другая форма аналитического выражения первого закона термодинамики (с использованием энтальпии).
17. В чем заключается физический смысл энтальпии?
Пример 5-1. Определить часовой расход топлива, необходимого для работы паровой турбины мощностью 500 кет, если теплотворность топлива 30000 кдж/кг, к. п.. д. установки 20%.
500-60-60 олл
т — =300 кг.
30 000-0,2
Пример 5-2. 10 кг воздуха при начальной температуре 30° С изменяют свое состояние до конечной температуры 300° С. Определить изменение внутренней энергии воздуха, считая его идеальным газом.
Изменение внутренней энергии по табл. XIII приложения
т («2 — «1) = 10 (219,5—21,5) = 1980 кдж.
,Пример 5-3. В котельной электростанции за 10 ч работы сожжено 100 т каменного угля с теплотворностью 28 000 кдж/кг. Определить количество.выработанной электроэнергии и мощность электростанции, если к. п. д. станции 20%.
Мощность электростанции
10-3600
Количество выработанной электроэнергии
•к, 100-1000-28 000-0,2 1СССС1- гз XV--= ■— = 155 555 квт-ч — ЪШ Гдж.
