
- •Эссенциальная артериальная гипертензия
- •Степень тяжести эаг
- •Эпидемиология
- •Классификация
- •Вторичная артериальная гипертензия
- •Факторы риска
- •Дополнительные:Нарушение толерантности к глюкозе,Низкая физическая активность,Повышение фибриногена. Поражение органов-мишеней
- •Сопутствующие клинические состояния
- •Клиническая картина
- •Диагностика
- •Регенерация
- •I стадия продолжается 2—3 дня, II и III (их нельзя четко разделить, так как процессы красного и серого опеченения идут почти параллельно) — 3—5 дней. Разрешение наступает к 7— 11-му дню болезни.
- •Признаки внематочной беременности
- •1. Определение заболевания
- •Организация работы клинико-диагностической лаборатории основывается на следующих принципах:
- •Рабочая классификация ибс
- •Патоморфологическая классификация опухолей
- •Симптомы почечнокаменной болезни
- •Диагностика мочекаменной болезни
- •Хронические неспецифические заболевания легких (хнзл)
- •Общая патология (патологическая анатомия и патологическая физиология)
- •Патогенез и патологическая анатомия
- •Первичное инфицирование микобактериями туберкулёза и скрытое течение туберкулёзной инфекции
- •Основные клинические проявления
- •Трёхкомпонентная схема лечения
- •Четырёхкомпонентная схема лечения
- •Пятикомпонентная схема лечения
- •Лабораторная диагностика анемий
- •Причины шока
- •Виды шока
- •Стадия адаптации шока
- •Нейроэндокринное звено стадии адаптации шока
- •Гемодинамическое звено стадии адаптации шока
- •Причины коллапса
- •Факторы риска коллапса
- •Виды коллапса
- •Дифференциация наследственных заболеваний
- •Моногенные наследственные заболевания
- •Митохондриальные заболевания
- •Полигенные наследственные болезни
- •Хромосомные аберрации
- •Диагностика
- •Холелитиаз, холецистит и холангит
- •Хронический холецистит
- •Холедохолитиаз, холангит
- •Гиперфункциональные состояния
- •Гипофункциональные состояния
- •Гиперальдостеронизм
- •Симптомы аддисонического криза
- •Этиология и патогенез
- •Классификация
- •Стадии опн
- •Клинические проявления опн
- •Современная классификация
- •Устаревшее определение хронической почечной недостаточности
- •Лабораторная диагностика
- •Основные клинические синдромы
- •Миелопоэз
- •Лимфопоэз
- •Патология клетки
- •Причины и общие механизмы клеточной патологии
- •Патология клеточных мембран
- •Избирательная проницаемость
- •Патология клеточного ядра
- •Патология митохондрий
- •Патология лизосом
- •Этапы развития патанатомии
- •Автоматизм и проводимость миокарда
- •Классификация
- •Нарушения автоматизма
- •Нарушения проводимости
- •Характеристика отдельных нарушений сердечного ритма
- •Паренхиматозные углеводные дистрофии
- •Классификация
- •Период разгара км олб
- •Критерии постановки диагноза
- •Первичная церебральная кома
- •Кома, вызванная недостатком гормонов
- •Кома, вызванная передозировкой гормональных препаратов
- •Кома, связанная с потерей электролитов, воды и энергетических веществ
- •Осложнения ранние:
- •Классификация/этиология/
- •Диагностика
- •Гиалиново-капельная дистрофия
- •Кожные пробы
- •Кожные пробы с накалыванием
- •Внутрикожные пробы
- •Накожные пробы
- •Анализ крови
- •Pact (радиоаллергосорбентный тест)
- •Маст (множественный аллергосорбентный тест)
- •Методы стимуляции или провокации
- •Носовая провокация
- •Бронхиальная провокация
- •Пищевая провокация
- •Методы проверки легочной функции
- •Биопсия кишечника
- •Этиология
- •Патогенез
- •Осложнения
- •Приобретенные пороки сердца
- •Врожденные пороки сердца
- •Исходы инфарктов а) аутолиз и последующая полная регенерация небольших очагов некроза б) организация и образование рубца
- •Течение, исходы и значение продуктивного воспаления
- •Патоморфология 2-й и 3-й стадии
- •Симптомы острого энтерита
- •Степени обезвоживания
- •Билет№24(1)
- •Основные сведения
- •Функции
- • Искусственная лимфедема вызывается пациентом в результате самоувечья.
- •Пирогены
- •Стадии лихорадки
- •Классификация По этиологии
- •По скорости развития
- •Патогенез
- •Необходимые условия
- •Понятия
- •Рекомендации в отношении диагностики Анамнез
- •Исследование мочи
- •Лейкоциты
- •Причины физиологического лейкоцитоза:
- •Причины патологического лейкоцитоза:
- •Причины лейкопении:
- •Пирогены
- •Стадии лихорадки
- •Гипотермия и гипертермия
- •Патогенез
- •Стадии лихорадки
- •Гипотермия и гипертермия
- •Метастазирование злокачественных нейроэктодермальных опухолей
- •Патология паращитовидных желез
- •Гормон паращитовидной железы
- •Расстройства, связанные с паращитовидными железами
- •Гистологическая картина
Симптомы почечнокаменной болезни
Как правило, почечнокаменная болезнь не остается незамеченной больным. Однако в некоторых случаях протекание болезни может оказаться скрытым и обнаруживается во время исследования организма при подозрение на другие болезни.
-
Боли в пояснице. Тупая, изматывающая боль с одной стороны (или двусторонняя) усиливается во время физической нагрузки или просто при изменении положения тела. Это один из самых типичных симптомов наличия камней в мочевыводящих органах. Когда из почки камень попадает в мочеточник, боль чувствуется внизу живота, паху, половых органах, может даже отдавать в ногу. После сильного приступа боли камни могут отходить вместе с мочой.
-
Почечная колика. Сильнейшая боль в поясничной области. Стихая и возобновляясь, колика может продолжаться нескольких дней. Обычно прекращается в случае, если камень перемещается или выходит из мочеточника в мочевой пузырь.
-
Боль при мочеиспускании, учащенное мочеиспускание. Подобная боль – свидетельство того, что камни присутствуют в мочевом пузыре или мочеточнике. Во время мочеиспускания струя мочи может прерываться, хотя больной чувствует, что мочевой пузырь не опорожнился. Это так называемый синдром "закладывания"; мочеиспускание продолжится, если поменять положение тела.
-
Кровь в моче. Кровь в моче может появиться после сильной боли или после физической нагрузки.
-
Помутнение мочи.
-
Высокое артериальное давление
-
Повышение температуры тела до 38-40 градусов, что характерно для присоединения пиелонефрита.
Диагностика мочекаменной болезни
-
общий анализ мочи выявляет незначительную примесь крови в моче, микробное инфицирование, характер солевых примесей;
-
общий анализ крови выявляет воспалительные процессы;
-
биохимический анализ крови;
-
УЗИ почек – один из основных методов выявления камней – позволяет оценить степень анатомических изменений, вызванных наличием или движением камня. Единственный недостаток: камни мочеточника при УЗИ диагностировать намного сложнее, а иногда и невозможно в силу его глубокого залегания в забрюшинном пространстве;
-
экскреторная урография: в вену вводится контрастное вещество, и проводится серия рентгеновских снимков. Обзорный снимок мочевой системы позволяет определить нахождение камней, их размеры и форму. Однако существуют так называемые рентгенонегативные камни, которые пропускают сквозь себя рентгеновские лучи, и поэтому они не видны на обзорных рентгеновских снимках;
-
радиоизотопная нефросцинтиграфия: в вену вводится специальный радиофармпрепарат, который накапливается и выводится через почки. На этом фоне производится сканирование почек на специальных аппаратах. Очень информативное исследование, позволяющее выявить нарушение функции почек.
Билет№5(3)
Сепсис, виды, причины и механизмы развития, патоморфология, клинико- лабораторные проявления, особенности течения и последствия. Сепсис - общее инфекционное заболевание, возникающее в связи с существованием в организме очага инфекции и имеющее ряд отличий от других инфекционных болезней (Серов), с точки зрения диагностики и лечения - это недостаточная или извращенная общебиологическая реакция макроорганизма в ответ на внедрение неспецифического микробного возбудителя, сопровождающаяся его генерализацией и протекающая в виде стадийного процесса различной протяженности, при которой самостоятельная способность организма бороться с инфекцией. Клинико- морфологически патанатомы выделяют 4 формы сепсиса:септицемию, септикопиемию, бакэндокардит и хрониосепсис, хирурги исключают из классификации эндокардит, но добавляют гнойно-резорбтивную лихорадку. В зависимости от входных ворот сепсис может быть терапевтическим (параифекционным), тонзилогенным, хирургическим, маточным,ото- и одонтогенным, пупочным, криптогенным. По течению выделяют хронический, подострый (7-14сут.),острый (5-7сут.) и молниеносный (1-2 сут.) сепсис. По развитию клинической картины выделяют ранний, возникший в сроки до 3-х недель до повреждения, и поздний (через месяц и более) сепсис; при позднем первичный очаг утрачивает свою значимость. Этиология разнообразна, сепсис полиэтиологичен. Стафилококки все еще занимают первое место среди микробов, вызывающих сепсис (до 50%), реже сепсис вызывают стрептококки, синегнойная палочка и протей. Удельный вес грамотрицательных бактерий в настоящее время продолжает расти (E.coli.Samonella), возросла роль анаэробов (клостридии), бактероидов. Широкое применение антибиотиков расчистило дорогу грибам Candida. Несмотря на неспецифичность проявлений сепсиса, этиология возбудителя часто сказывается на особенностях течения - для стафилококков характерны отдаленные метастазы и септические пневмонии, для стрептококков - распространение по лимфатическим путям (лимфангиты, лимфадениты) и комбинации с другими возбудителями, для синегнойной палочки - молниеность, шоковая реакция, для кишпалки - перитониты и перитонеальный сепсис, для клостридий - некрозы, отеки и газообразование, для бактероидов - ДВС- синдром. Эти особенности обусловлены вырабатываемыми бактериями токсинами, ферментами ( например, бактероиды способны разрушать гепарин).
Иммунитет при сепсисе не вырабатывается. Цикличность, свойственная многим инфекционным заболеваниям, отсутствует. Имеет место неадекватная гиперергическая реакция организма на генерализованную инфекцию, при невозможности ее локализовать. Выделяют три фазы течения сепсиса:напряжения,катаболических расстройств и анаболическую. Фаза напряжения отражает реакцию макроорганизма на внедрение возбудителя, при недостаточной местной воспалительной реакции включаются защитные функциональные системы, с участием гипоталано-гипофизарной и симпатоадреналовой. Энергетические резервы постепенно уменьшаются, нагрузка же нарастает, что приводит к истощению организма и напряжению энергетических процессов. Клинически доминируют гемодинамические нарушения, токсические проявления типа энцефалопатии или очаговых нарушений ЦНС.
Расстройства гемодинамики протекают по типу септического шока; общим для них является несоответствие объема сосудистого русла и ОЦК, коагулопатические катастрофы. Гемодинамические нарушения и интоксикация сопровождаются ухудшением функционирования детоксикационных систем (печень, почки,легкие), изменением показателей периферической крови и костно- мозгового кроветворения. Катаболическая фаза характелизуется прогрессирующим расходом структурных и ферментных запасов, с последующим наступлением декомпенсации функциональных систем. Повышение катаболизма белков, углеводов и жиров, декомпенсация водно-электролитного и кислотно-основного баланса сопровождаются вовлечением окружающих тканей,увеличением зоны деструкции. Это приводит к ряду системных нарушений (ССН, синдром поражения легочной ткани, печеночно- почечная недостаточность, и т.д. Анаболическая фаза характеризуется восстановлением утраченных резервов. Переход к ней засисит от особенностей организма больного, может быть плавным, или, реже, быстрым, с общим возбуждением, падением АД, вегетативными нарушениями. Морфологически при сепсисе находят местные и общие изменения. Местные - во входных воротах образуется септический очаг, фокус гнойного воспаления (может и не быть), при распространении инфекта по лимфатическо системе развивается лимфангит, лимфотромбоз и лимфаденит, по венам - флебит , тромбофлебит, иногда гнойный тромбофлебит и тромбобактериальная эмболия. Общие изменения: дистрофические, в паренхиматозных органах, могут завершаться некрозами; воспалительные - печень, почки, мио- и эндокард, васкулиты; гиперпластические - костный мозг, селезенка.
Септицемия. Характерны выраженный токсикоз ( высокая температура, затемненное сознание), гиперергия, отсутствие гнойных метастазов и быстрое течение. Связывают во втрептококком. Септический очаг не выражен ( ворота не находят). Желтушность склер и кожи (гемолиз). Геморрагии (васкулит). Гиперплазия лимфоидной и кроветворной тканей (септическая селезенка с обильным соскобом пульпы, множество юных форм в костном мозге, очаги внекостномозгового кроветворения. Межуточное воспаление и отек стромы в паренхиматозных органах ( сердце, печень, почки). Проницаемость сосудов повышена, фибриноидные изменения стенок, аллергический васкулит). Морфология бактериального шока. Септикопиемия. При этой форме преобладают гнойные процессы в воротах и бактельная эмболия, с образованием гнойников в органах и тканях. Гиперергия не выражена, бурного течения нет. Характерна для стафилококка и синегнойной палочки. Находят септический очаг, обычно расположенный в воротах, с гнойным воспалением, гнойным тромбофлебитом, лимфангитом и лимфаденитом. Первые метастатические гнойники появляются в легких, оттуда по легочным венам в большой круг, в печень (абцессы), почки (гнойничковый нефрит), подкожную клетчатку, могут распространяться на соседние ткани. Гиперплазия лимфатической и кроветворной тканях слабо выражена. Межуточное воспаление слабо или отсутствует. Септический эндокардит. Это септицемия с очагом на клапанах сердца (здесь ворота и очаг не совпадают). Гиперергия выражена, воспалительные процессы носят характер иммунных, а не гнойных. В основе гиперергии - гиперчувствительность из-за циркуляции токсических иммунных комплексов, содержащих антиген возбудителя. С ними связывают генерализованные васкулиты, резкое повышение сосудистой проницаемости, тромбоэмболии, клеточные реакции стромы. Выделяют острый, подострый и затяжной септический эндокардит; первичный ( на интактных клапанах, болезнь Черногубова), и вторичный ( на порочных, чаще ревматических, клапанах). При полипозно-язвенном эндокардите на створках появляются тромботические наложения в виде полипов, возникают очаги некроза ткани клапана, инфильтрация лимфогистиоцитами, макрофагами. Тромботические наложения организуются. В миокарде находят нипертрофию волокон, лимфогимтицитарные инфильтраты типа ошофф-балалаевских гранулем. Проницаемость сосудов повышена (васкулиты), геморрагический синдром проявляется пятнами Либмана, Дженуэя, в то же время имеет место тромбоэмболический синдром (т.е. ДВС ), гломерулонефрит, селезенка гипертрофирована, с инфарктами. Прочие внешние проявления - узелки Ослера, барабанные пальцы, некрозы в подкожной клетчатке, желтуха. Этиология: чаще всего стафилококк и громотрицательные бактерии. Хрониосепсис. Имеется длительно не заживающий септический очаг (карпозные зубы, миндалины), обширные нагноения. Всасывание продуктов тканевого распада, гноя ведет к интоксикации, нарастающему истощению, развитию илмлоидоза. Изменения в органах и тканях носят преимущественно атрофический характер. Атрофия обнаруживается в печени, миокарде, поперечнополосатых мышцах. Согласно Давыдовскому, хрониосепсис и есть длительная гнойнорезорбтивная лихорадка, ведущая к травматическому истощению.
Гемодинамика при сепсисе. В целом проявляется синдромом малого выбора: снижение сердечного выброса и объемного кровотока, бледность, малый частый пульс, низкое АД (септический шок). Причина - снижение сократительной способности миокарда, уменьшение ОЦК и сосудистого тонуса. Повреждающими механизмами считают ДВС синдром и стимуляцию альфа-рецепторов токсинами. Изменения протекают в 2 фазы - 1) небольшая гипотония, возбуждение, гипертермия, тахикардия, 2) выраженная гипотония, тяжелые СС и Днедостаточность, потеря сознания, изменения почек ( олиго, анурия) и печени. Интоксикация ведет к снижению сократимости миокарда, угнетению регуляции тонуса сосудов из ЦНС. Изменения дыхания - для всех форм характерна прогрессирующая ДН. Ведущий фактор - гипоксия легочной ткани, из-за ее токсического повреждения и расстройств гемодинамики, с нарушением свойств альвеоло-капиллярной мембраны, нарушением синтеза сурфактанта и спадением альвеол. В начале преобладают обструктивные нарушения (проба Тиффно снижается), от токсического повреждения реснитчатого эпителия, увеличением продукции и вязкости слизи. Проявляется тахипноэ, стенотическим дыханием, цианозом, тахикардией, профузным потом. В катаболической фазе преобладают рестриктивные нарушения ( повреждение паренхимы по типу метастатического пио- и пневмоторакса). Нарушение легочного кровотека усугубляет гипоксию. Физико-химические нарушения. Гипопротеинемия от потерь белка с гноем и экссудатом, через паретичный кишечник. Глобулиновая фракция повышена. Сдвиги pH разнонаправленны. Ацидоз из-за гипоксии. Гипербилирубинемия из-за недостаточности функции печени и гемолиза. АСТ, АЛТ повышены. Периферическая кровь. Анемия, угнетение эритропоэза от интоксикации, потерь белка и сдвигов КОС, нарушение обмена железа, гемолиза. Гипорегенараторный и гипопластический типы. Лейкоцитоз в левым сдвигом, токсическая зернистость лейкоцитов. Повышена СОЭ. Коагулопатии: ДВС - синдром.
Билет№6(1)
некроз (от греческ. nekros — мертвый,\ омертвение, термин, употребляющийся для обозначения так наз. местной или частичной смерти, т. е. смерти какой-либо части организма (клетки, группы клеток, участка ткани или органа) при продолжающейся жизни целого.
Иногда смерть данного участка наступает быстро, среди так сказать полного здоровья или во всяком случае без* значительных предварительных повреждений, но гораздо чаще ей предшествуют постепенно развивающиеся и усиливающиеся дегенеративные процессы, связанные с той или иной формой прогрессирующей деструкции тканевых элементов, которая в конце-концов и приводит их к смерти (например белковое, жировое, вакуольное перерождения. заканчиваюшиеся белковым, жировым распадом или полным расплавлением соответствующего участка). Такой процесс постепенного умирания ткани обозначается как некробиоз . При Н., наступающем без резко выраженных предшествующих дегенеративных процессов, как например при механических воздействиях (сотрясение мозга), задушении ткани вследствие закрытия приводящей артерии, при резком действии лучистой энергии, некоторых ядов и т. п., в первое время после прекращения жизненных процессов в ткани - может не обнаруживаться никаких видимых нарушений структур.Или же они могут касаться лишь каких-нибудь специальных клеточных органоидов (например хондриосомного аппарата), т. ч. при обычной гист. обработке ткань будет казаться нормальной. То же самое наблюдается в ткани, убитой и зафиксированной каким-нибудь хим. реактивом (алкоголь, сулема, формалин и др.). Однако через известный, обычно короткий промежуток времени в мертвой ткани, остающейся среди живых тканей, развиваются б. или м. резкие морфол. изменения, причем наиболее доказательными для наступившего омертвения являются изменения ядер, выражающиеся в виде пикноза, кариолиза и кариорексиоа.Что касается протоплазмы и межклеточных субстанций, то в большинстве случаев первым морфол. выражением Н. в4 них является коагуляция белковых составных частей. Такой Н. обозначается коагуляционный или сухой. При этом общие контуры тканевых элементов в зависимости от причины Н., характера ткани, предшествующего ее состояния и т. д.' могут то сохраняться в течение известного времени довольно хорошо, как это бывает например при ишемических инфарктах почки, миокарда или при т. н. мумификации (см.), то, наоборот, тканевые элементы быстро подвергаются полной деструкции, вызывая превращение омертвевшего участка в бесформенную массу мелкозернистого распада, как напр. при токсических фокусных Н. селезенки, печени, слизистых оболочек, лимф. желез и других органов, наблюдающихся при многих острых инфекционных болезнях (скарлатина, брюшной тиф, дифтерия, дизентерия, оспа и т. п.)..К только-что описанной категории Н. относится и т. н. творожистый, казеозный, или сыровидный Н., чаще всего развивающийся в ткани и различных пат. продуктах при tbc и сифилисе, реже при некоторых др. инфекциях (лимфогранулематоз, корь) и иногда в опухолях (саркомах). Отличительной особенностью его является присутствие в мертвой массе значительных количеств жирового распада,. благодаря чему она по виду и консистенции получает большое сходство с творогом или мягким сыром. Помимо коагуляции некроз может протекать также при явлениях к о л л и к в а-ции {colliquatio), т. е. расплавления ткани (влажный, колликвационный некроз). Этого рода процесс возникает иногда с самого начала Н., чаще же после предварительной коагуляции. В первом случае причинами его служат или предшествующие условия существования данного участка (как напр. резко выраженный отек или вакуольное перерождение ткани, кончающееся полным ее расплавлением) или же особые физ.-хим. свойства соответствующих элементов, что-выявляется напр. очень ярко в центральной нервной системе, где некротические фокусы тотчас размягчаются (т.н. очаги размягчения) и в дальнейшем превращаются в кисты. Что касается разжижения после предварительной коагуляции, то оно наблюдается в самых разнообразных некротических продуктах и объясняется частью как проявление ауто-лиза (см.) частью же как результат действия протеолитических ферментов, поступающих в мертвый очаг с лейкоцитами или с лимфой. Сюда относятся разжижение туб. творожистых масс с образованием т. н. туб. гноя, расплавление инфарктов, образование кист с жидким содержимым на месте фокусов Н. поджелудочной железы и т. п.— Морфол. картина смерти ткани, наступающей в исходе некробиоза, определяется в значительной степени теми дегенеративными изменениями, которые ее вызвали (см. Мутное набухание, Восковидное, Вакуольное Жировое перерождение и т. п.), о моменте же смерти, как показывают многочисленные наблюдения, можно при этом судить. только по состоянию ядра (рисунок 2). Наличность последнего свидетельствует о продолжении жизненных пргцессов, а следовательно о возможности обратного развития болезненных изменений и восстановления нормальной структуры, тогда как гибель ядра, морфологически проявляющаяся в виде кариолиза или кариорексиса с несомненностью указывает на прекращение жизни клетки.—Особый вид Н. представляет т. н. гангрена (см.), которая в свою очередь может быть сухой или влажной. О микробах, играющих. роль при развитии влажной гангрены,—см. Гангрена. О Н. жировой ткани—см. Жировые некрозы. Причины Н. чрезвычайно разнообразны. Соответственно им различают 1) м е-ханические, или травматические некрозы (вследствие удара, разрыва, разможжения, сотрясения, раздавливания и т. п.); 2) Н. вследствие действия физич. агентов (высокая и низкая t°, электричество, различные виды лучистой энергии); 3) Н. вследствие действия химич. и инфек-ционно - токсических агентов: крепкие кислоты, щелочи, мышьяк, фосфор, соли тяжелых металлов, алкалоиды, яды, выделяемые различными животными и растительными паразитами , а также образуемые самим организмом (при желтухе, уремии, эклямпсии и т. д.); 4) Н. вследствие расстройств к ров о- и лимфообра щ е н и я (местная анемия, венозный застой, "резкий отек); 5) Н. вследствие нервных влияний вазомоторного ж трофического характера (как например при прободающей язве стопы, симметрической гангрене конечностей, множественной гангрене кожи, сиингомиелии, спинной сухотке и т. п.). В происхождении всех перечисленных видов Н. большое значение имеет наличность предрасполагающих моментов в виде (предшествующего основной причине) действия других вредностей, характера ткани (в смысле ее чувствительности к вредным влияниям), индивидуальных особенностей организма, общего его состояния и т. п. Так например в развитии декубитальных некрозов и язв (см. Пролежни) играет роль не только давление на ткань и ее сосуды, но и имеющаяся обычно у таких больных слабость кровообращения, а нередко и расстройства трофоневротического порядка. При закрытии приводящего сосуда нервная ткань благодаря своей чувствительности погибает раньше всех других, во внутренних органах паренхима гибнет значительно раньше стромы и т. д. У лиц, страдающих какой-либо идиосинкразией (см.), соответствующее вещество может вызвать Н., будучи применено в такой дозе, к-рая у других не дает никаких заметных повреждений (например Н. кожи при применении слабых растворов карболовой к-ты). У глубоких стариков и больных длительными истощающими б-нями (напр. при хрон. тяжелых поражениях кишечника, длительных расстройствах сердечной деятельности, диабете, нек-рых злокачественных опухолях) некрозы могут возникать под влиянием очень незначительных и не всегда определимых моментов (небольшие расстройства кровообращения, легкие воспалительные процессы и т. п.)—т. н. маранти-ческие некрозы. Обычным следствием некроза является развитие вокруг некротического фокуса реактивного отграничивающего (демар- кационного) воспаления, в результате к-рого происходит или организация мертвого участка или отграничение его от окружающих тканей путем развития того или иного рода капсулы [секвестрация кости, образование кист с соединительнотканной или глиозной (в центральной нервной системе) стенкой и т. п]. Иногда реактивная зона подвергается в свою очередь омертвению, что ведет к увеличению объема первичного некротического очага. Последнее нередко наблюдается напр. в случаях влажной гангрены при номе или в случаях прогрессирующей гангрены конечностей на почве восходящего поражения соответствующей артерии (тромбоартериит). Если Н. не прогрессирует, а, с другой стороны, не происходит ни полной организации ни растворения мертвых частей (как это нередко случается напр. в инкапсулированных туб. творожистых очагах), то обычно эти части пропитываются солями извести (см. Известковые отложения)..
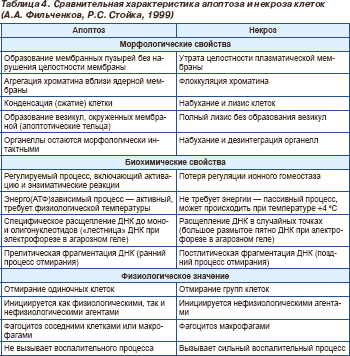
НЕКРОЗ, АПОПТОЗ, АТРОФИЯ
Смерть как биологическое понятие является выражением необратимого прекращения жизнедеятельности организма. С наступлением смерти человек превращается в мертвое тело, труп (cadaver). С юридической точки зрения в большинстве стран организм считается мертвым, когда наступает полное и необратимое прекращение деятельности мозга. Но при этом большое количество клеток и тканей в юридически мертвом организме остаются жизнеспособными в течение некоторого времени после смерти. Эти органы и ткани составляют главный источник для трансплантации.
Необходимо знать, что смерть клетки — постоянное проявление жизнедеятельности организма и в здоровом состоянии оно сбалансировано физиологической регенерацией клеток. Как структурные компоненты клеток, так и целые клетки изнашиваются, стареют, гибнут и требуют замены. Поддержание различных органов и тканей в здоровом состоянии невозможно без “естественного” физиологического обновления, а, следовательно, без смерти отдельных клеток. Такая смерть клеток получила в 1972 году название “апоптоз”. Апоптоз — это запрограммированная смерть клетки. Прямая связь апоптоза и многих патологических состояний сегодня уже не вызывает сомнения. Исследования нарушения функции многих генов, регулирующих апоптоз, позволят разрабатывать совершенно новые направления в терапии этих заболеваний. Разработка лекарственных средств, которые смогут регулировать апоптоз, откроет новые возможности в лечении злокачественных опухолей, вирусных инфекций, некоторых заболеваний нервной системы, иммунодефицитов и аутоиммунных заболеваний. Например, при злокачественных опухолях и лимфопролиферативных заболеваниях требуется усилить апоптоз, а при заболеваниях, характеризующихся поражением клеток, необходимо ослабить его.
Но смерть клетки может происходить в живом организме в результате «насильственных» действий внешних повреждающих (патогенных) факторов. Эта смерть клетки носит название «некроз». Мертвые клетки полностью прекращают свое функционирование. Гибель клетки сопровождается необратимыми биохимическими и структурными изменениями.
Таким образом, смерть клетки может происходить двумя путями: некроза и апоптоза. Поскольку биологические признаки, а также значение некроза и апоптоза различны, в этой главе эти процессы рассматриваются отдельно.
Традиционно сложилось так, что изучение смерти клеток начинают с некроза, хотя апоптоз, безусловно, встречается значительно чаще, поскольку сопровождает, а иногда и регулирует некоторые как общепатологические, так и физиологические процессы организма
НЕКРОЗ
Некроз (от греч. nekros — мертвый) — омертвение, гибель клеток и тканей в живом организме под воздействием болезнетворных факторов. Этот вид гибели клеток генетически не контролируется.Причины некроза. Факторы, вызывающие некроз:—физические (огнестрельное ранение, радиация, электричество, низкие и высокие температуры — отморожение и ожог);—токсические (кислоты, щелочи, соли тяжелых металлов, ферменты, лекарственные препараты, этиловый спирт и др.);—биологические (бактерии, вирусы, простейшие и др.);—аллергические (эндо- и экзоантигены, например, фибриноидный некроз при инфекционно-аллергических и аутоиммунных заболеваниях, феномен Артюса);—сосудистый (инфаркт — сосудистый некроз);—трофоневротический (пролежни, незаживающие язвы).
В зависимости от механизма действия патогенного фактора различают:
—прямой некроз, обусловленный непосредственным действием фактора (травматические, токсические и биологические некрозы),
—непрямой некроз, возникающий опосредованно через сосудистую и нервно-эндокринную системы (аллергические, сосудистые и трофоневротические некрозы).
Морфологические признаки некроза
Некрозу предшествует период некробиоза, морфологическим субстратом которого являются дистрофические изменения.
A. Ранние изменения: В начальном периоде некробиоза клетка морфологически не изменена. Должно пройти 1-3 часа, прежде чем появятся изменения, распознаваемые при электронной микроскопии или гистохимически, и, по крайней мере, 6-8 часов, прежде чем появятся изменения, выявляемые при световой микроскопии; еще позже развиваются макроскопические изменения. Например, если больной с инфарктом миокарда умирает спустя несколько минут от момента начала приступа стенокардии (боль при недостаточном притоке крови к миокарду), то на аутопсии не будет выявлено никакого структурного свидетельства некроза; если же смерть наступает на 2-й день после острого приступа, то изменения будут очевидны.
Б. Гистохимические изменения: приток ионов кальция в клетку тесно связан с необратимым повреждением и появлением морфологических признаков некроза. В нормальной клетке внутриклеточная концентрация кальция составляет приблизительно 0.001 от концентрации его во внеклеточной жидкости. Этот градиент поддерживается мембраной клетки, которая активно транспортирует ионы кальция из клетки. Экспериментально доказано, что при повреждении клеток в результате ишемии или под воздействием различных токсических агентов, накопление кальция внутри клеток наблюдается только тогда, когда изменения необратимы. Кальций активирует эндонуклеазы (гидролиз, расщепление ДНК), фосфолипазы (разрушение мембран) и протеазы (деструкция, переваривание цитоскелета). Повышение их активности выявляется гистохимическими методами. Активность окислительно-восстановительных ферментов (например, сукцинатдегидрогеназы) резко падает или исчезает.
B. Изменения в ядрах: одним из важных и наглядных морфологических признаков некроза клетки является изменение структуры ядра. Хроматин мертвой клетки конденсируется в крупные глыбки. Ядро уменьшается в объеме, становится сморщенным, плотным, интенсивно базофильным, то есть, окрашивается в темно-синий цвет гематоксилином. Этот процесс назван кариопикнозом (сморщиванием). Пикнотическое ядро может затем разрываться на многочисленные маленькие базофильные частицы (кариорексис) или подвергнуться лизису (растворению) в результате действия лизосомной дезоксирибонуклеазы (кариолизис). Тогда оно увеличивается в объеме, слабо окрашивается гематоксилином, постепенно теряются контуры ядра. При быстро развивающемся некрозе ядро подвергается лизису без пикнотической стадии.
Г. Цитоплазматические изменения: приблизительно через 6 часов после того, как клетка подверглась некрозу, цитоплазма ее становится гомогенной и выражено ацидофильной, то есть окрашивается интенсивно кислыми красителями, например, в розовый цвет при окраске эозином. Это- первое изменение, выявляемое световой микроскопией, которое возникает в результате коагуляции цитоплазматических белков и разрушения (исчезновения) рибосом. РНК рибосом придает базофильный оттенок нормальной цитоплазме. Специализированные органеллы клетки, например, миофибриллы в миокардиальных клетках, исчезают в первую очередь. Набухание митохондрий и деструкция (разрушение) мембран органелл вызывают вакуолизацию цитоплазмы. Наконец, переваривание клетки ферментами, которые высвобождаются из собственных лизосом, вызывает лизис клетки (аутолиз). Таким образом, в цитоплазме происходит коагуляция белков, сменяемая обычно их колликвацией.
Д. Изменения межклеточного вещества охватывают как межуточное вещество, так и волокнистые структуры. Чаще всего развиваются изменения, характерные для фибриноидного некроза: коллагеновые, эластические и ретикулиновые волокна превращаются в плотные, гомогенные розовые, иногда базофильные массы, которые могут подвергаться фрагментации, глыбчатому распаду либо лизироваться. Реже может наблюдаться отек, лизис и ослизнение волокнистых структур, что свойственно колликвационному некрозу.
Клинико-морфологические формы некроза
Некроз проявляется различными клиническими и морфологическими изменениями. Различия зависят от структурно-функциональных особенностей органов и тканей, скорости и типа некроза, а также причины его возникновения и условий развития. Среди клинико-морфологических форм некроза различают коагуляционный (сухой) некроз и колликвационный (влажный) некроз.
Коагуляционный (сухой) некроз
При этом типе некроза погибшие клетки сохраняют свои очертания в течение нескольких дней. Клетки, лишенные ядра, выглядят как масса коагулированной, гомогенной, розовой цитоплазмы.
Механизм коагуляционного некроза недостаточно ясен. Коагуляция цитоплазматических белков делает их резистентными к действию лизосомных ферментов и в связи с этим замедляется их разжижение.
Коагуляционный некроз обычно происходит в органах, богатых белками и бедных жидкостями, например, в почках, миокарде, надпочечниках, селезенке, обычно в результате недостаточного кровообращения и аноксии, действия физических, химических и других повреждающих факторов, например, коагуляционный некроз клеток печени (рис. 6.1) при вирусном поражении или при действии токсических агентов бактериального и небактериального генеза. Коагуляционный некроз еще называют сухим, поскольку он характеризуется тем, что возникающие при нем мертвые участки сухие, плотные, крошащиеся, белого или желтого цвета.
К коагуляционному некрозу относят:
А. Инфаркт — разновидность сосудистого (ишемического) некроза внутренних органов (кроме мозга). Это самый частый вид некроза.
Б. Казеозный (творожистый) некроз развивается и при туберкулезе, сифилисе, лепре, а также при лимфогрануломатозе. Его еще называют специфическим, поскольку чаще всего встречается при специфических инфекционных гранулемах. Во внутренних органах выявляется сухой, крошащийся ограниченный участок ткани беловато-желтого цвета. В сифилитических гранулемах очень часто такие участки не крошащиеся, а пастообразные, напоминают аравийский клей. Это смешанный (то есть экстра- и интрацеллюлярный) тип некроза, при котором одновременно гибнет и паренхима, и строма (и клетки, и волокна). Микроскопически такой участок ткани выглядит как бесструктурный, гомогенный, окрашен гематоксилином и эозином в розовый цвет, хорошо видны глыбки хроматина ядер (кариорексис).
В. Восковидный, или ценкеровский некроз (некроз мышц, чаще передней брюшной стенки и приводящих мышц бедра, при тяжелых инфекциях – брюшном и сыпном тифах, холере);
Г. Фибриноидный некроз — тип некроза соединительной ткани как исход фибриноидного набухания. Фибриноидный некроз наблюдается при аллергических и аутоиммунных болезнях (например, ревматизме, ревматоидном артрите и системной красной волчанке). Наиболее сильно повреждаются коллагеновые волокна и гладкая мускулатура средней оболочки кровеносных сосудов. Фибриноидный некроз артериол наблюдается при злокачественной гипертензии. Этот некроз характеризуется потерей нормальной структуры коллагеновых волокон и накоплением гомогенного, ярко-розового некротического материала, который похож микроскопически на фибрин. Обратите внимание, что понятие «фибриноидный» отличается от понятия «фибринозный», так как последнее обозначает накопление фибрина, например, при свертывании крови или при воспалении. Участки фибриноидного некроза содержат различное количество иммуноглобулинов и комплемента, альбуминов, продуктов распада коллагена и фибрина.
Д. Жировой некроз:
1.Ферментный жировой некроз: жировой некроз наиболее часто происходит при остром панкреатите и повреждениях поджелудочной железы, когда панкреатические ферменты выходят из протоков в окружающие ткани. Панкреатическая липаза действует на триглицериды в жировых клетках, расщепляя их на глицерин и жирные кислоты, которые, взаимодействуя с плазменными ионами кальция, образуют мыла кальция. При этом в жировой ткани, окружающей поджелудочную железу, появляются непрозрачные, белые (как мел) бляшки и узелки (стеатонекроз).
При панкреатитах возможно попадание липазы в кровоток с последующим широким распространением, что является причиной жирового некроза во многих участках организма. Наиболее часто повреждаются подкожная жировая клетчатка и костный мозг.
2.Неферментный жировой некроз: неферментный жировой некроз наблюдается в молочной железе, подкожной жировой ткани и в брюшной полости. Большинство пациентов имеют в анамнезе травмы. Неферментный жировой некроз называют также травматическим жировым некрозом, даже если травма не определена как основная причина. Неферментный жировой некроз вызывает воспалительный ответ, характеризуемый наличием многочисленных макрофагов с пенистой цитоплазмой, нейтрофилов и лимфоцитов. Затем следует фиброзирование, при этом данный процесс бывает трудно отличить от опухоли.
Е. Гангрена (от греч. gangraina — пожар): это некроз тканей, сообщающихся с внешней средой и изменяющихся под ее воздействием. Термин «гангрена» широко используется для обозначения клинико-морфологического состояния, при котором некроз ткани зачастую осложняется вторичной бактериальной инфекцией различной степени выраженности либо, находясь в соприкосновении с внешней средой, претерпевает вторичные изменения. Различают сухую, влажную, газовую гангрены и пролежни.
1. Сухая гангрена — это некроз тканей, соприкасающихся с внешней средой, протекающий без участия микроорганизмов. Сухая гангрена наиболее часто возникает на конечностях в результате ишемического коагуляционного некроза тканей. Некротизированные ткани кажутся черными, сухими, они четко отграничены от смежной жизнеспособной ткани. На границе со здоровыми тканями возникает демаркационное воспаление. Изменение цвета обусловлено превращением гемоглобиногенных пигментов в присутствии сероводорода в сульфид железа.
2.Влажная гангрена: развивается в результате наслоения на некротические изменения ткани тяжелой бактериальной инфекции. Под действием ферментов микроорганизмов возникает вторичная колликвация. Лизис клетки ферментами, которые образуются не в самой клетке, а проникают извне, называется гетеролизисом. Тип микроорганизмов зависит от локализации гангрены. Влажная гангрена развивается обычно в тканях, богатых влагой. Она может встречаться на конечностях, но чаще — во внутренних органах, например, в кишечнике при непроходимости брыжеечных артерий (тромбоз, эмболия), в легких как осложнение пневмонии (грипп, корь). У ослабленных инфекционным заболеванием (чаще корью) детей может развиться влажная гангрена мягких тканей щек, промежности, которую называют номой (от греч. nome – водяной рак). Острое воспаление и рост бактерий являются причиной того, что некротическая область становится отечной и красно-черной, с обширным разжижением мертвой ткани. При влажной гангрене может возникнуть распространяющееся некротизирующее воспаление, которое не четко ограничено от смежной здоровой ткани и, таким образом, трудно поддается хирургическому лечению. В результате жизнедеятельности бактерий возникает специфический запах. Очень высок процент летальности.
3.Газовая гангрена: газовая гангрена возникает при инфицировании раны анаэробной флорой, например, Clostridium perfringens и другими микроорганизмами этой группы. Она характеризуется обширным некрозом ткани и образованием газов в результате ферментативной активности бактерий. Основные проявления сходны с влажной гангреной, но с дополнительным присутствием газа в тканях. Крепитация (феномен потрескивания при пальпации) – частый клинический симптом при газовой гангрене. Процент летальности также очень высок.
4.Пролежень (decubitus): как разновидность гангрены выделяют пролежни – омертвение поверхностных участков тела (кожа, мягкие ткани), подвергающихся сдавлению между постелью и костью. Поэтому пролежни чаще появляются в области крестца, остистых отростков позвонков, большого вертела бедренной кости. По своему генезу это трофоневротический некроз, так как сдавливаются сосуды и нервы, что усугубляет нарушения трофики тканей у тяжелобольных, страдающих сердечно-сосудистыми, онкологическими, инфекционными или нервными болезнями.
Колликвационный (влажный) некроз
Колликвационный (влажный) некроз характеризуется расплавлением мертвой ткани. Он развивается в тканях, относительно бедных белками и богатых жидкостью, где имеются благоприятные условия для гидролитических процессов. Лизис клеток происходит в результате действия собственных ферментов (аутолиз). Типичным примером влажного колликвационного некроза является очаг серого размягчения (ишемический инфаркт) головного мозга.
Инфаркт мозга часто называют размягчением, так как основным макроскопическим признаком является понижение упругости ткани мозга в очаге поражения во все сроки. В течение первых суток он представлен нечетко ограниченным участком синюшного оттенка, мягковатым на ощупь. К концу первых суток очаг становится более четким и бледнеет. В последующие дни вещество мозга в этой зоне становится еще более дряблым, желтоватого цвета, иногда даже с зеленоватым оттенком. В первые недели объем мозга несколько увеличивается из-за его отека. Через 1-1.5 мес. на месте инфаркта образуется довольно четко ограниченная полость, содержащая мутную жидкость и детрит. Определение точных сроков инфаркта весьма затруднительно не только по внешнему виду его, но и по гистологической картине.
Микроскопически ткань мозга гомогенная, бесструктурная, слабо розового цвета при окраске гематоксилином и эозином. Рассасывание мертвых тканей осуществляется макрофагами, которые имеют вид жиро-зернистых шаров.
Исход некроза. Некроз — процесс необратимый.
При относительно благоприятном исходе вокруг омертвевших тканей возникает реактивное воспаление, которое отграничивает мертвую ткань. Такое воспаление называется демаркационным, а зона отграничения — демаркационной зоной. В этой зоне кровеносные сосуды расширяются, возникают полнокровие, отек, появляется большое число лейкоцитов, которые высвобождают гидролитические ферменты и расплавляют некротические массы. Некротические массы рассасываются макрофагами. Вслед за этим размножаются клетки соединительной ткани, которая замещает или обрастает участок некроза. При замещении мертвых масс соединительной тканью говорят об их организации. На месте некроза в таких случаях образуется рубец (рубец на месте инфаркта). Обрастание участка некроза соединительной тканью ведет к его инкапсуляции. В мертвые массы при сухом некрозе и в очаг омертвения, подвергшийся организации, могут откладываться соли кальция. В этом случае развивается обызвествление (петрификация) очага некроза. В некоторых случаях в участке омертвения отмечается образование кости – оссификация. При рассасывании тканевого детрита и формировании капсулы, что встречается обычно при влажном некрозе и чаще всего в головном мозге, на месте омертвения появляется полость— киста.
Неблагоприятный исход некроза – гнойное (септическое) расплавление очага омертвения. Секвестрация – это формирование участка мертвой ткани, который не подвергается аутолизу, не замещается соединительной тканью и свободно располагается среди живых тканей. Секвестры обычно возникают в костях при воспалении костного мозга – остеомиелите. Вокруг такого секвестра образуется секвестральная капсула и полость, заполненная гноем. Нередко секвестр выходит из полости через свищи, которые закрываются лишь после полного его выделения. Разновидность секвестрации – мутиляция – отторжение концов пальцев.
Значение некроза. Оно определяется его сущностью – “местной смертью” и выключением из функции таких зон, поэтому некроз жизненно важных органов, особенно крупных участков их, нередко ведет к смерти. Таковы инфаркты миокарда, ишемические некрозы головного мозга, некрозы коркового вещества почек, прогрессирующий некроз печени, острый панкреатит, осложнившийся панкреонекрозом. Нередко омертвение ткани является причиной тяжелых осложнений многих заболеваний (разрыв сердца при миомаляции, параличи при геморрагическом и ишемическом инсультах, инфекции при массивных пролежнях, интоксикации в связи с воздействием на организм продуктов тканевого распада, например, при гангрене конечности и т.д.). Клинические проявления некроза могут быть самыми разнообразными. Патологическая электрическая активность, возникающая в областях некроза в мозге или миокарде, может приводить к эпилептическим припадкам или сердечной аритмии. Нарушение перистальтики в некротизированной кишке может вызвать функциональную (динамическую) кишечную непроходимость. Часто наблюдаются кровоизлияния в некротизированную ткань, например, кровохаркание (hаemoptysis) при некрозе легкого.
АПОПТОЗ
Смерть клеток в организме может происходит 2 путями: некроза и апоптоза. Апоптоз – это такой тип гибели клеток, при котором сама клетка активно участвует в процессе своей гибели, т.е. происходит самоуничтожение клетки. Апоптоз, в отличие от некроза, является процессом активным, после воздействия этиологических факторов запускается генетически запрограммированный каскад реакций, сопровождающийся активацией определенных генов, синтезом белков, ферментов, приводящих к эффективному и быстрому удалению клетки из ткани.
Причины апоптоза:
1. Во время эмбриогенеза апоптоз играет важную роль в разрушении различных тканевых зачатков и формировании органов.
2. Апоптозу подвергаются стареющие клетки, закончившие цикл своего развития, например, исчерпавшие запас цитокинов лимфоциты.
3. В растущих тканях определенная часть дочерних клеток подвергается апоптозу. Процент погибающих клеток может регулироваться системными и местными гормонами.
4. Причиной апоптоза может быть слабое воздействие повреждающих факторов, которые при большей интенсивности могут привести к некрозу (гипоксия, ионизирующее излучение, токсины и др.)
Патогенез апоптоза:
Клетка подвергается апоптозу, если в ядре происходит повреждение ДНК, которое не может быть исправлено системой репарации. За данным процессом следит белок, кодируемый геном р53. При невозможности устранения дефекта ДНК под действием р53-протеина активируется программа апоптоза.
На многих клетках имеются рецепторы, воздействие на которые вызывает активацию апоптоза. Наиболее изученными являются Fas-рецептор, обнаруженный на лимфоцитах, и рецептор к фактору некроза опухолей-альфа (TNF-α), обнаруженный на многих клетках. Данные рецепторы играют большую роль в удалении аутореактивных лимфоцитов и регуляции постоянства размера клеточной популяции по типу обратной связи.
Активировать апоптоз могут различные метаболиты и гормоны: противовоспалительные цитокины, стероидные гормоны, окись азота (NO) и свободные радикалы.
Апоптоз клеток активируется при недостатке кислорода в тканях. Причиной его активации может быть действие свободных радикалов, нарушение энергетически зависимых процессов репарации ДНК и др.
Апоптозу подвергаются клетки, утратившие связь с межклеточным матриксом, базальной мембраной или соседними клетками. Утрата данного механизма апоптоза в опухолевых клетках приводит к появлению способности метастазировать.
Некоторые вирусные белки могут активировать апоптоз клеток после самосборки вируса в зараженной клетке. Поглощение апоптотических телец соседними клетками ведет к их заражению вирусом. Вирус СПИДа также может активировать апоптоз незараженных клеток, имеющих на своей поверхности CD4-рецептор.
Также существуют факторы, препятствующие апоптозу. Замедлять апоптоз могут многие метаболиты и гормоны, например, половые гормоны, провоспалительные цитокины. Апоптоз может резко замедляться при дефектах в механизме гибели клетки, например, при мутации в гене р53 или активации генов, тормозящих апоптоз (bcl-2). Многие вирусы обладают способностью ингибировать апоптоз после встраивания собственной ДНК в геном клетки на период синтеза собственных структурных белков.
Морфологические проявления апоптоза
Апоптоз имеет свои отличительные морфологические признаки, как на светооптическом, так и на ультраструктурном уровне. Наиболее четко морфологические признаки выявляются при электронной микроскопии. Для клетки, подвергающейся апоптозу характерно:
Сжатие клетки. Клетка уменьшается в размерах; цитоплазма уплотняется; органеллы, которые выглядят относительно нормальными, располагаются более компактно. Предполагается, что нарушение формы и объема клетки происходит в результате активации в апоптотических клетках трансглютаминазы и цистеиновых протеаз (каспаз). Первая группа ферментов вызывает образование перекрестных связей в цитоплазматических белках, что приводит к формированию своеобразной оболочки под клеточной мембраной, подобно ороговевающим клеткам эпителия, а вторая группа ферментов разрушает белки в цитозоле.
Конденсация хроматина. Это наиболее характерное проявление апоптоза. ДНК расщепляется эндонуклеазами в местах, связывающих отдельные нуклеосомы, что приводит к образованию большого количества фрагментов, в которых число пар оснований делится на 180-200, которые затем конденсируются под ядерной мембраной. Ядро может разрываться на два или несколько фрагментов.
Формирование апоптотических телец. В апоптотической клетке формируются глубокие впячивания клеточной мембраны, что приводит к отшнуровке фрагментов клетки, т.е. формированию окруженных мембраной апоптотических телец, состоящих из цитоплазмы и плотно расположенных органелл, с или без фрагментов ядра.
Фагоцитоз апоптотических клеток или телец осуществляется окружающими здоровыми клетками, как макрофагами, так и паренхиматозными. Апоптотические тельца быстро разрушаются в лизосомах, а окружающие клетки либо мигрируют, либо делятся, чтобы заполнить освободившееся после гибели клетки пространство.
При окраске гематоксилином и эозином апоптоз определяется в единичных клетках или небольших группах клеток. Апоптотические клетки имеют округлую или овальную форму, интенсивно эозинофильную цитоплазму с плотными фрагментами ядерного хроматина. Поскольку сжатие клетки и формирование апоптотических телец происходит быстро и также быстро они фагоцитируются, распадаются или выбрасываются в просвет органа, то на гистологических препаратах апоптоз обнаруживается в случаях его значительной выраженности. К тому же апоптоз – в отличие от некроза – никогда не сопровождается воспалительной реакцией, что также затрудняет его гистологическое выявление.
Для выявления клеток, находящихся на ранних этапах апоптоза, используют специальные иммуногистохимические исследования, например, определение активированных каспаз или TUNEL-метод, визуализирующий разорванную эндонуклеазами ДНК.
Значение апоптоза.
1. Апоптоз имеет огромное значение в эмбриогенезе (включая имплантацию и органогенез). Нарушение гибели клеток в межпальцевых промежутках может привести в синдактилии, а отсутствие апоптоза избыточного эпителия при слиянии небных отростков или тканей, окружающих нервную трубку, приводит к нарушению слияния тканей с двух сторон, что проявляется расщеплением твердого неба и дефектом в тканях, ограничивающих спинномозговой канал, (spina bifida), соответственно.
2. Апоптоз играет важную роль в поддержании постоянства клеточного состава, особенно в гормон-чувствительных тканях. Замедление апоптоза приводит к гиперплазии тканей, ускорение – к атрофии. Он принимает участие в отторжении эндометрия во время менструального цикла, атрезии фолликулов в яичниках в менопаузе и регрессии ткани молочной железы после прекращения лактации.
3. В данный момент исследуется огромное количество лекарственных препаратов, направленных на регуляцию апоптоза в определенных тканях. Так, ускорение апоптоза иммунокомпетентных клеток можно использовать для лечения аутоиммунных заболеваний и предотвращения отторжения трансплантата, замедление апоптоза может использоваться для предотвращения апоптоза в тканях, испытывающих ишемию, повышенное внешнее давление или временно бездействующих тканях. Замедление апоптоза при вирусных инфекциях предотвращает распространение инфекции на соседние клетки.
4. Во всех опухолях наблюдается нарушение апоптоза в опухолевых клетках. Эта поломка может происходить на разных этапах апоптоза, например, может происходить мутация гена р53, что приведен к тому, что мутантный протеин-р53 будет накапливаться в клетке в избыточном количестве, но не будет вызывать апоптоз несмотря на дефекты в геноме клетки, что приведет к пролиферации клеток с нарушенным геномом, причем с каждым последующим делением нарушения в ДНК будут накапливаться. Иногда в опухолевых клетках может накапливаться и нормальный, или «дикий», протеин р53, если поломка в механизме апоптоза происходит на других уровнях. При хронических лимфоидных лейкемиях наблюдается накопление продуктов гена bcl-2, что приводит к патологическому удлинению срока жизни опухолевых клеток и резистентности клеток к различным проапоптотическим факторам. Иногда нарушается передача сигналов от рецепторов гибели клеток, например, с рецептора к TNF-α. TNF-α принимает участие в регуляции клеточной популяции по типу обратной связи. Все клетки в популяции выделяют TNF-α в небольших количествах; чем больше клеток в ткани, тем выше концентрация TNF-α, а значит и уровень апоптоза. Таким образом достигается баланс между пролиферацией и гибелью клеток. Опухолевые клетки теряют способность подвергаться апоптозу под действием этого цитокина, при этом он накапливается в большом количестве в опухолевой ткани. В результате этого TNF-α начинает в большом количестве попадать в кровоток и вызывать апоптоз паренхиматозных клеток во многих органах, приводя к кахексии.
Атрофия — прижизненное уменьшение объема ткани или органа за счет уменьшения размеров каждой клетки, а в дальнейшем — числа клеток, составляющих ткань, сопровождающееся снижением или прекращением их функции. Обратите внимание, что атрофия, которая характеризуется уменьшением размера нормально сформированного органа, отличается от агенезии, аплазии и гипоплазии, которые являются патологией развития органа.
Агенезия - полное отсутствие органа и его закладки в связи с нарушением хода онтогенеза.
Аплазия - недоразвитие органа, который имеет вид раннего зачатка.
Гипоплазия - не полное развитие органа (орган частично уменьшен в размере).
Атрофию делят на физиологическую и патологическую.
Физиологическая атрофия наблюдается на протяжении всей жизни человека. Так, после рождения атрофируются и облитерируются пупочные артерии, артериальный (боталлов) проток. У пожилых людей атрофируются вилочковая и половые железы.
Сенильная (старческая) атрофия: уменьшение количества клеток — одно из морфологических проявлений процесса старения. Этот процесс имеет наибольшее значение в тканях, образованных постоянными, неделящимися клетками, например, в мозге и сердце. Атрофия при старении часто отягощается атрофией в результате влияния сопутствующих факторов, например, ишемии.
Патологическая атрофия может иметь местный и общий характер.
Местная атрофия. Различают следующие виды местной патологической атрофии в зависимости от причины и механизма развития:
Атрофия от бездействия (дисфункциональная атрофия): развивается в результате снижения функции органа. Она наблюдается, например, в иммобилизированных скелетных мышцах и костях (при лечении переломов). При длительном постельном режиме, гиподинамии скелетная мускулатура атрофируется достаточно быстро вследствие бездействия. Первоначально наблюдается быстрое уменьшение размеров клеток, которые также быстро восстанавливают объем при возобновлении активности. При более длительной иммобилизации мышечные волокна уменьшаются и в размерах, и в количестве. Так как скелетная мускулатура может регенерировать в ограниченном объеме, восстановление размеров мышц после потери мышечных волокон происходит в основном путем компенсаторной гипертрофии оставшихся в живых волокон, на что требуется длительный период восстановления. Атрофия кости заключается в том, что резорбция кости происходит быстрее, чем ее формирование; это проявляется уменьшением размеров трабекул (уменьшение массы), что приводит к остеопорозу от бездействия. Кроме того, примерами дисфункциональной атрофии могут служить атрофия зрительного нерва после удаления глаза; краев зубной ячейки, лишенной зуба.
Атрофия, вызванная недостаточностью кровоснабжения, развивается вследствие сужения артерий, питающих данный орган. Уменьшение кровотока (ишемия) в тканях в результате заболеваний артерий приводит к гипоксии, вследствие чего возникает уменьшение объема клеток, их количества – деятельность паренхиматозных органов снижается, размер клеток уменьшается. Гипоксия стимулирует пролиферацию фибробластов, развивается склероз. Такой процесс наблюдается в миокарде, когда на почве прогрессирующего атеросклероза венечных артерий развивается атрофия кардиомиоцитов и диффузный кардиосклероз; при склерозе сосудов почек развивается атрофия и сморщивание почек; болезни сосудов мозга, например, проявляются мозговой атрофией, включающей в себя и гибель нейронов.
Атрофия от давления: длительное сдавливание ткани вызывает атрофию. Большое, инкапсулированное доброкачественное новообразование в спинномозговом канале может вызвать атрофию спинного мозга. Вероятно, этот вид атрофии возникает из-за сдавления мелких кровеносных сосудов, что приводит к ишемии, а не от прямого влияния давления на клетки. При давлении аневризмы в телах позвонков и в грудине могут появляться узуры. Атрофия от давления возникает в почках при затруднении оттока мочи. Моча растягивает просвет лоханки, сдавливает ткань почки, которая превращается в мешок с тонкими стенками, что обозначают как гидронефроз. При затруднении оттока спинномозговой жидкости происходят расширение желудочков и атрофия ткани мозга — гидроцефалия.
Атрофия при денервации (нейротическая атрофия): состояние скелетной мускулатуры зависит от функционирования иннервирующего нерва, что необходимо для сохранения нормальной функции и структуры. Повреждение соответствующего мотонейрона в любой точке между телом клетки в спинном мозге и моторной концевой пластинкой ведет к быстрой атрофии мышечных волокон, которые иннервируются этим нервом (при полиомиелите, при воспалении нервов). При временной денервации с помощью физиотерапии и электрической стимуляции мышц можно предотвратить гибель мышечных волокон и гарантировать восстановление нормальной функции при возобновлении функционирования нерва.
Атрофия в результате недостатка трофических гормонов: эндометрий, молочная железа и большое количество эндокринных желез зависят от трофических гормонов, необходимых для нормального клеточного роста и уменьшение количества этих гормонов ведет к атрофии. При уменьшении секреции эстрогена в яичниках (опухоли, воспалительные процессы) наблюдается атрофия эндометрия, влагалищного эпителия и молочной железы. Болезни гипофиза, сопровождающиеся уменьшенной секрецией гипофизарных трофических гормонов, приводят к атрофии щитовидной железы, надпочечников и половых желез. Лечение кортикостероидами надпочечников в высоких дозах, которое иногда используется для иммуносупрессии, вызывает атрофию надпочечниковых желез из-за подавления секреции гипофизарного кортикотропина (АКТГ). Такие пациенты быстро теряют способность к секреции кортизола и становятся зависимыми от экзогенных стероидов. Отмена стероидной терапии у таких пациентов должна быть достаточно постепенной, чтобы успела произойти регенерация атрофированных надпочечников.
Атрофия под воздействием физических и химических факторов. Под действием лучевой энергии атрофия особенно выражена в костном мозге, половых органах. Йод и тиоурацил подавляют функцию щитовидной железы, что ведет к ее атрофии.
Внешний вид органа при местной атрофии различен. В большинстве случаев размеры органа уменьшаются, поверхность его гладкая (гладкая атрофия). При гладкой атрофии уменьшается складчатость слизистой оболочки ЖКТ. Реже органы, например, почки, печень, принимают зернистый или бугристый вид (зернистая атрофия). При гидронефрозе, гидроцефалии, ложной гипертрофии (увеличение органа в объеме за счет стромального компонента) органы увеличены в размерах, но не за счет увеличения объема паренхимы, а вследствие скопления жидкости или разрастания жировой клетчатки. В полых органах различают концентрическую и эксцентрическую атрофию.
Бурая атрофия характеризуется уменьшением размеров клеток, которое происходит за счет уменьшения количества цитоплазмы и числа цитоплазматических органелл и обычно связано со снижением интенсивности метаболизма. Органеллы, которые подвергаются дистрофическим изменениям, обнаруживаются в лизосомных вакуолях, где они подвергаются ферментативному разрушению (аутофагия). Остаточные мембраны органелл часто накапливаются в цитоплазме как коричневый пигмент — липофусцин (пигмент изнашивания). Уменьшение количества клеток возникает из-за нарушения баланса между уровнями пролиферации клеток и их гибели в течение длительного периода.
Общая атрофия, или истощение (кахексия) имеет следующие причины:
—атрофия из-за недостатка питательных веществ: тяжелое белковое и калорийное голодание приводит к использованию тканей организма, в первую очередь скелетной мускулатуры, в качестве источника энергии и белков после того, как другие источники (гликоген и жиры в жировых депо) истощаются. Такая атрофия возникает также при болезнях пищеварительного тракта вследствие снижения его способности переваривать пищу.
—раковая кахексия (при любой локализации злокачественной опухоли);
—эндокринная (гипофизарная) кахексия (болезнь Симмондса при поражении гипофиза, при повышении функции щитовидной железы – тиреотоксическом зобе);
—церебральная кахексия (поражение гипоталамуса);
—истощение при хронических инфекционных заболеваниях (туберкулез, бруцеллез, хроническая дизентерия).
Внешний вид больных при истощении характерен. При общей атрофии в первую очередь исчезает жир из жировых депо, затем атрофируются скелетные мышцы, затем – внутренние органы, в последнюю очередь – сердце и мозг. Отмечается резкое исхудание, подкожная клетчатка отсутствует, там, где она сохранилась, имеет оранжевую окраску (накопление пигмента липохрома). Мышцы атрофичны, кожа сухая, дряблая. Внутренние органы уменьшены в размерах. В печени и миокарде отмечаются явления бурой атрофии (накопление в клетках липофусцина).
Значение атрофии для организма определяется степенью уменьшения органа и понижения его функции. Если атрофия и склероз не достигли большой степени, то после устранения причины, вызвавшей атрофию, возможно восстановление структуры и функции. Далеко зашедшие атрофические изменения необратимы.
Билет №6(2)
Хроническая обструктивная болезнь легких
За последние 15-20 лет отмечен значительный рост заболеваемости хронической обструктивной болезнью легких (ХОБЛ) в различных странах мира. При этом сложилась ситуация, когда практические врачи и специалисты, занимающиеся проблемой ХОБЛ, больше знают о том, как лечить это заболевание, чем о том, какой же смысл вкладывать в само понятие ХОБЛ. Данное заболевание характеризуется не полностью обратимым ограничением воздушного потока. Это ограничение обычно прогрессирует и связано с патологической реакцией легких на патогенные частицы и газы.
До недавнего времени аббревиатура ХОБЛ расшифровывалась как «хронические обструктивные болезни легких» и трактовалась как собирательное понятие, включающее хронические экологически опосредованные заболевания дыхательной системы с преимущественным вовлечением дистальных отделов дыхательных путей с частично обратимой бронхиальной обструкцией, характеризующиеся прогрессированием и нарастающей хронической дыхательной недостаточностью. Согласно первой редакции федеральной программы, ХОБЛ - это гетерогенная по своей природе группа легочных заболеваний, которые объединяет расстройство функции внешнего дыхания по обструктивному типу.
В сентябре 2000 г. Конгресс Европейского респираторного общества ( проект документа под названием GOLD (Global Initiatie for chronic) - ХОБЛ определяется в нем как «...заболевание, характеризующееся частично необратимым ограничением воздушного потока. Ограничение воздушного потока, как правило, носит неуклонно прогрессирующий характер и вызвано аномальной воспалительной реакцией легочной ткани на раздражение различными патогенными частицами и газами» (GOLD-2006). В соответствии с GOLD-2007 основными диагностическими критериями ХОБЛ являются клинические (кашель, выделение мокроты, одышка), анамнестические (наличие факторов риска) и функциональные (постбронходилатационный ОФВ1 менее 80% от должного в сочетании с отношением ОФВ1/ЖЕЛ менее 70%).
Одно из важнейших мест среди факторов риска развития ХОБЛ занимает курение (см. табл.). Индекс курящего человека (ИКЧ) - основной показатель, используемый для расчета частоты табакокурения. Вычисляется он следующим образом: количество выкуренных в день сигарет х число месяцев в году, которые человек курил (как правило, 12).
Имеются данные, в том числе отечественной медицины, позволяющие использовать данный показатель для оценки вероятности развития ХОБЛ.
* ИКч > 120 - курение приводит к хроническому обструктивному бронхиту.
* ИКЧ > 160 - курение представляет риск в отношении ХОБЛ.
* ИКЧ > 240 - курение неизбежно ведет к развитию ХОБЛ.
ИКЧ также опосредованно зависит от стажа курения, при этом зоной, наносящей гарантированный вред организму, считается ИКЧ в диапазоне от 60 до 720.
У курящих лиц с этим генетическим дефектом значительно быстрее происходит развитие и прогрессирование эмфиземы, формирование бронхоэктазов.
Патогенез. В патогенезе ХОБЛ важнейшую роль играют угнетение клеточного и гуморального иммунитета - локальное разрушение иммуноглобулинов, снижение уровня интерферона, лизоцима, лактоферрина, угнетение фагоцитарной активности нейтрофилов и альвеолярных макрофагов, активная продукция гистамина и других провос-палительных медиаторов, окислительный стресс, нарушение мукоцилиарного клиренса. В норме мукоцилиарный клиренс обеспечивается работой реснитчатого эпителия. Сигаретный дым, дефицит ААТ, токсины микроорганизмов вызывают разрушение и уменьшение количества реснитчатых клеток, снижение активности ресничек. В ответ на это происходит гиперпродукция слизи бокаловидными клетками и железами подслизи-стого слоя, что оказывает негативное влияние. Меняется реология бронхиальной слизи: увеличиваются ее вязкость и адгезив-ность, снижается эластичность, что также способствует ухудшению мукоцилиарного клиренса, мукостазу, а значит, развитию микробной колонизации, нарушению бронхиальной проходимости, нарастанию дыхательной недостаточности.
Застой бронхиального содержимого приводит к нарушению вентиляционно-респираторной функции легких, а неизбежное инфицирование - к развитию эндобронхиального или бронхолегочного воспаления. Кроме того, вязкий секрет, помимо угнетения ци-лиарной активности, может вызвать бронхиальную обструкцию вследствие скопления слизи в дыхательных путях. В тяжелых случаях вентиляционные нарушения сопровождаются развитием ателектазов. Трахеобронхиальная слизь в нормальных условиях обладает бактерицидным эффектом, так как содержит иммуноглобулины и неспецифические факторы защиты (лизоцим, трансферрин, опсонины и др.). Воспаление органов дыхания, как правило, сопровождается компенсаторным увеличением слизеобразования. Изменяется и состав трахеобронхиального секрета: уменьшается содержание воды и повышается концентрация муцинов (нейтральных и кислых гликопротеинов), что приводит к увеличению вязкости мокроты. Отмечено, что чем выше вязкость слизи, тем ниже скорость ее продвижения по респираторному тракту. Увеличение вязкости бронхиального секрета способствует повышенной адгезии (прилипанию) патогенных микроорганизмов на слизистых респираторного тракта, что создает благоприятные условия для их размножения. Изменение состава слизи сопровождается и снижением бактерицидных свойств бронхиального секрета за счет уменьшения в нем концентрации секреторного иммуноглобулина А. В свою очередь, инфекционные агенты и их токсины оказывают неблагоприятное воздействие на слизистые дыхательных путей. Следовательно, нарушение дренажной функции бронхиального дерева может привести не только к вентиляционым нарушениям, но и к снижению местной иммунологической защиты дыхательных путей с высоким риском развития затяжного течения воспалительного процесса и способствовать его хронизации.
–Диагноз обострения ХОБЛ обычно устанавливается клинически при наличии одного из следующих симптомов или более – усиление одышки; – усиление кашля; – изменения характера мокроты (увеличении ее объема, степени гнойности или вязкости). Эта симптоматика обычно предшествует обострению инфекционно-зависимой бронхиальной астмы и является основанием для назначения антибиотиков. Клиническая практика показывает, что при обострении бронхиальной астмы всегда следует уточнить наличие недавнего эпизода бронхолегочной инфекции и решить вопрос о показанности антибактериальных препаратов.
Диагностика. Основными симптомами ХОБЛ являются кашель с мокротой и одышка. Степень их варьирует от одышки при интенсивной физической нагрузке и эпизодического кашля до одышки в покое с признаками правожелудочковой недостаточности и постоянного кашля. При расспросе пациента следует обратить внимание на влияние симптоматики на его качество жизни, частоту, время и длительность обострений ХОБЛ, характеристику мокроты (цвет, консистенция, количество, легкость отхожде-ния). Согласно международным рекомендациям (GOLD-2006), определяющим и объединяющим признаком всех стадий ХОБЛ является снижение соотношения ОФВ1/ФЖЕЛ
< 70%, характеризующее ограничение экспираторного воздушного потока. Разделяющим признаком, позволяющим оценить степень тяжести (стадию) ХОБЛ как легкое (I стадия), среднетяжелое (II стадия), тяжелое (IiI стадия) и крайне тяжелое (IV стадия) течение, служит значение показателя ОФВ1 (определяемого после назначения бронхолитических препаратов).
Стадия I: легкое течение. ОФВ1/ФЖЕЛ
< 70 %. На этой стадии больной может не замечать, что функция легких у него нарушена. Обструктивные нарушения выражены незначительно - значение ОФВ1 > 80% от должных величин. Обычно, но не всегда, ХОБЛ проявляется хроническим кашлем и продукцией мокроты. Поэтому только в 25% случаев заболевание диагностируется своевременно (данные Европейского респираторного общества), то есть на этой стадии развития ХОБЛ.
Стадия II: среднетяжелое течение.
ОФВ1/ФЖЕЛ < 70%. Эта стадия, при которой пациенты обращаются за медицинской помощью в связи с одышкой или обострением заболевания, характеризуется увеличением обструктивных нарушений (ОФВ1 составляет 50-80% от должных величин). Отмечается усиление симптомов заболевания и одышки, появляющейся при физической нагрузке.
Стадия III: тяжелое течение. ОФВ1/ ФЖЕЛ < 70%. Характеризуется дальнейшим увеличением ограничения воздушного потока (ОФВ1 составляет 30-50% от должных величин), нарастанием одышки, частыми обострениями.
Стадия IV: крайне тяжелое течение. ОФВ1/ФЖЕЛ < 70%. На этой стадии качество жизни заметно ухудшается, а обострения могут быть угрожающими для жизни. Болезнь приобретает инвалидизирующее течение. Характеризуется крайне тяжелой бронхиальной обструкцией (ОФВ1 < 30% от должных величин или < 50% при наличии дыхательной недостаточности).
