
конспекты / ------------------
.pdf1
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДОНБАСЬКА НАЦІОНАЛЬНА АКАДЕМІЯ БУДІВНИЦТВА І АРХІТЕКТУРИ
Кафедра «Прикладна екологія і хімія» Секція прикладної хімії
ОРГАНІЧНА ХІМІЯ
Конспект лекцій
Укладач::
к.х.н, доцент Сохіна С.І.
Затверджено:
на засіданні секції прикладної хімії протокол №1 від _28.08.09. р
Макіївка 2009
|
|
2 |
|
|
|
ЗМІСТ |
|
1.ЛЕКЦІЯ 1. Сучасні електронні уявлення в органічній хіміі |
3 |
||
2. |
ЛЕКЦІЯ 2. Алкани (вуглеводні аліфатичного ряду) |
22 |
|
3. ЛЕКЦІЯ 3. Алкени (ненасичені вуглеводні ряду етілену) |
38 |
||
4. |
ЛЕКЦІЯ 4. |
Алкадієни (дієнові вуглеводні, або діолефіни) |
49 |
5. ЛЕКЦІЯ 5. Алкіни (ненасичені вуглеводні ряду ацетілену) |
59 |
||
6. |
ЛЕКЦІЯ 6. |
Монота полігалогенопохідні вуглеводнів |
69 |
7. |
ЛЕКЦІЯ 7. |
Однота багатоатомні спирти. |
82 |
8. |
ЛЕКЦІЯ 8. |
Альдегіди (алканалі) і кетони (алканони) |
100 |
9. ЛЕКЦІЯ 9. Карбонові (алканові) кислоти і їх похідні. |
116 |
||
10. |
ЛЕКЦІЯ 10. Органічні сполуки азоту. |
142 |
|
11. |
ЛЕКЦІЯ 11-12 Бензол та його гомологи. Природа ароматичного стану. |
152 |
|
12. |
ЛЕКЦІЯ 13.Сполуки ароматичного ряду, що містять кисень. |
169 |
|
13. |
ЛЕКЦІЯ 14. |
Галогено-, нитрота сульфопохідні ароматичного ряду |
175 |
14. |
ЛЕКЦІЯ 15. |
Ароматичні аміни, діазота азосполуки. Барвники. |
183 |
15. |
ЛЕКЦІЯ 16. |
Загальні уявлення про високомолекулярні сполуки |
198 |
16. |
ЛЕКЦІЯ 17. |
Хімічні перетворення полімерів |
228 |
ЛІТЕРАТУРА ТА МЕТОДИЧНІ ПОСІБНИКИ |
244 |
||

3
ЛЕКЦІЯ № 1
СУЧАСНІ ЕЛЕКТРОННІ УЯВЛЕННЯ В ОРГАНІЧНІЙ ХІМІЇ
Перші теоретичні уявлення в органічній хімії. Основні положення теорії хімічної будови органічних сполук О. М. Бутлерова.
Накопичення великого експериментального матеріалу в органічній хімії привело до створення єдиної теорії, спроможної не тільки пояснити, але, головне, науково передбачати нові наукові факти.
Першою такою теорією була «теорія радикалів» (Берцеліус, Лібих, Велер, ГейЛюссак). У її основу було призначено те, що при багатьох хімічних реакціях група з декількох атомів - органічний радикал, що входити до складу органічної сполуки, може переходити без зміни з однієї молекули (вихідна речовина) в іншу (продукт реакції). Оскільки Берцеліус розглядав органічні речовини як системи, що складаються з двох частин протилежно заряджених радикалів, пов'язаних за допомогою електростатичної взаємодії, теорія радикалів відома ще й як дуалістична теорія (від лат. dиоs - два). Прихильники цієї теорії розглядали і радикал як абсолютно стійку і незмінну частину молекули. У цьому і була їхня помилка. Подальші дослідження показали неспроможність цієї теорії.
У 40-х роках минулого сторіччя виникнула нова теорія - «теорія типів» (Жерар, Лоран, Дюма). На противагу «теорії радикалів» вона розглядала частину молекули, що змінюється в процесі хімічної реакції. Згідно з цією теорією всі відомі в той час органічні речовини були віднесені за характером їхніх хімічних перетворень до п'яти типів:
Теорія типів зіграла у свій час добру роль. Вона дозволила створити більш чітку систему класифікації органічних сполук, вказавши при цьому на можливість перетворень одних сполук в інші. Проте теорія типів стояла на ідеалістичних позиціях, тому що вважали, що будову органічних речовин у ході хімічних перетворень пізнати не можна, а тому, і неможливо передбачити їхні властивості. У теорії типів розглядалися лише перетворення органічних сполук в основному в реакціях обмінного розкладу. Таким чином, творці і прихильники цієї теорії стояли на позиціях агностицизму - ідеалістичного навчання, що пропонували непізнаність людиною об'єктивного світу. Надалі ця теорія прийшла в безвихідь. Великий фактичний матеріал, що накопичено на той час, вже не укладався у відомі типи. Введення ж нових типів не рятувало положення, і згодом для хіміків
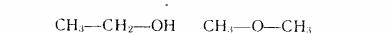
4
органічна хімія, за образним виразом Велера, стала здаватися то «незайманим тропічним лісом, повним самих чудових речовин», то «страшними джунглями, у які ніхто не вирішується проникнути, тому що здається, що з них немає виходу».
Отже, до середини XIX сторіччя склалося критичне положення, вихід із якого міг бути тільки в створенні теорії, за допомогою якої можна було б не тільки пояснити будову органічних сполук, але і пророчити шляху їхнього синтезу.
Для народження нової теорії вже були створені деякі істотні передумови. Було встановлено, що вуглець виявляє валентність, рівну чотирьом (Кекуле і Кольбе), і що його атоми спроможні з'єднуватися один з одним у довгі вуглець-вуглецеві ланцюги. Була також запропонована (Купер) і з успіхом застосовувалася нова система зображення окремих зв'язків за допомогою рисочок-символів.
У 60-х роках XIX в. великий російський хімік-органік О.М.Бутлеров (18281886), виходячи з матеріалістичних уявлень про реальне існування атомів і молекул і можливості встановлення їхньої будівлі, уперше створив теорію хімічної будови органічних сполук. Основна ідея цієї теорії була сформульована О.М.Бутлеровим у 1861 р. у статті «Про хімічну будову речовини».
Сутність цієї теорії можна коротко сформулювати у вигляді таких положень:
1.Атоми, що входять до складу молекули органічної речовини, не знаходяться
вбезладді, а сполучені у визначеному порядку, причому на з'єднання їх один з одним затрачується визначна частка хімічної спорідненості. Послідовність з'єднання атомів у молекулі О.М.Бутлеров назвав хімічною будовою.
2.Від будови молекул, тобто від того, у якому порядку сполучені між собою атоми в молекулі, залежать властивості речовини.
3.Якщо відомі властивості речовини, можна встановити її будову, і навпаки: хімічна будова органічної сполуки може багато чого сказати про його властивості.
4.Хімічні властивості атомів і атомних угрупувань не є постійними, а залежать від інших атомів (атомних груп), що знаходяться в молекулі. При цьому найбільш сильний вплив атомів спостерігається у випадку, якщо вони пов'язані один з одним безпосередньо.
Теорія хімічної будови дала можливість пояснити явище ізомерії. Наприклад,
одній і тієї же молекулярній формулі С2Н6О можуть відповідати дві різноманітних за будовою речовини - етиловий спирт і діметиловий ефір:
етиловий спирт |
діметиловий ефір |
Таким чином, етиловий спирт і діметиловий ефір - ізомери. Вони мають різноманітну хімічну будову при тому ж самому складі і молекулярній масі. Різноманітна хімічна будова визначає і різноманітні властивості цих сполук. Так, етиловий спирт при звичайних умовах реагує з металевим натрієм і кислотами, а діметиловий ефір таких реакцій не дає.
Значення теорії хімічної будови О.М.Бутлерова винятково велике. Завдяки цієї теорії стало можливо передбачити основні властивості органічних сполук, передбачати шляхи їхнього цілеспрямованого синтезу. Теорія хімічної будови вперше дозволила хімікам розглядати молекулу як систему, у якій існує суворий порядок хімічного зв'язку між атомами.
Теорія О.М.Бутлерова й у сучасні дні не загубила свого значення. Вона лягла в
5
основу сучасних теоретичних уявлень органічної хімії.
Зображення органічних сполук за допомогою структурних формул
Зображення органічних сполук за допомогою символів для елементів і рисочок для позначення хімічних зв'язків називаються структурними формулами. Наприклад:
Простий зв'язок (σ -зв'язок) позначається одною рисочкою, подвійний - двома, потрійний - трьома.
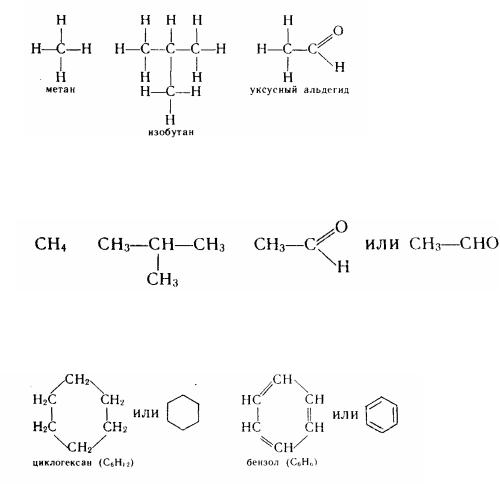
Звичайно структурні формули записують у більш скороченому виді:
метан |
ізобутан |
оцтовий альдегід |
При зображенні циклічних сполук зображення символів вуглецю і водню часто взагалі опускають, а їхня присутність при цьому припускається:
Не можна забувати, що будь-яка, навіть дуже вдала структурна формула - усього лише абстрактна уява молекули. Вона не є точним відображенням реальної структури і вираженням властивостей органічної молекули. Тому не можна ототожнювати схему молекули - формулу - із реально існуючою молекулою.
Будівля електронних підрівней атома вуглецю і його особливості
При вивченні органічної хімії особливий інтерес подає електронна будова атома вуглецю, тому що з цим пов'язані його особливі властивості, що визначає багато в чому розходжень між органічними і неорганічними сполуками.
Вуглець - перший елемент IV групи періодичної системи елементів. Два його електрони знаходяться на внутрішньому К-рівні, а на зовнішньому, L-рівні, - чотири електрони . В основному стані К- і L-рівні атома вуглецю мають будівля
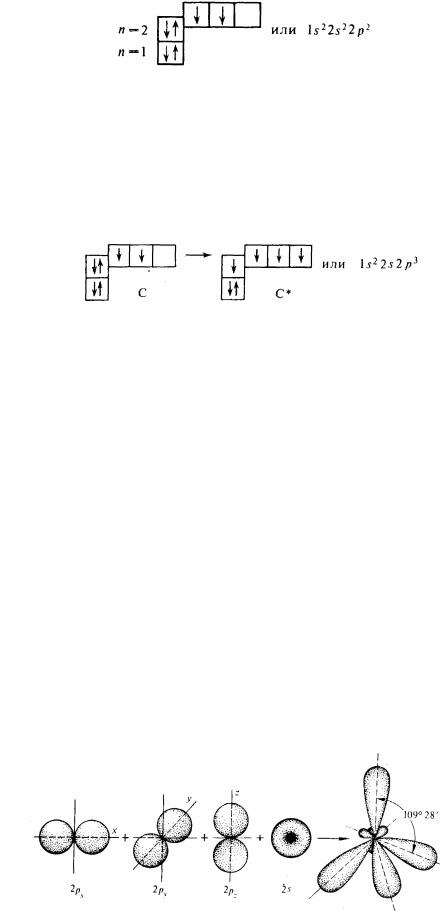
6
Такий розподіл електронів може призвести до зрадливого висновку про те, що вуглець є двохвалентним елементом. Дійсно, в іншому (зовнішньому) електронному прошарку спарені тільки два 2s-електрони, у той час як два інших 2р-електрони залишаються неспареними і спроможні утворювати хімічний зв'язок. Проте необхідно враховувати, що атом вуглецю в момент хімічної реакції збуджується, тобто переходить з основного стану (1s22s22р2) у збуджений (умовно позначається С*). При цьому відбувається розпарювання 2s-електронів і перехід одного з них на 2p-орбіталь:
У результаті такого переходу утворюється чотири неспарених електрони (один s- і три р-): 2sр3. Це можливо тому, що стани 2s і 2р дуже близькі в енергетичному відношенні. Витрачена при цьому енергія (676,2 кДж/моль) потім із надлишком компенсується при утворенні чотирьох зв'язків. Але, з огляду на будову електронної оболонки атома вуглецю в збудженому стані, можна помилково припустити, що, наприклад, у молекулі метану є чотири нерівноцінних зв'язки: один s-зв’язок і три p-зв'язки. Це суперечить експериментальним даним, відповідно до яких у симетрично побудованих сполуках вуглецю (метан, чотирьохлористий вуглець та ін.) усі зв'язки (С—Н або С—С1) цілком однакові. Теоретичне пояснення цього факту грунтується на можливій гібридізації (змішанні) атомних орбіталей (Л. Полинг, Ж. Слейтер, 1931). Було показано, що орбітали не можуть існувати в ізольованому, «чистому» виді; вони обов'язково впливають один на одного. Мінімумом енергії володіють тільки змішані, гібридні орбіталі.
Для атома вуглецю можливі три валентних стани з різноманітними типами гібридизації.
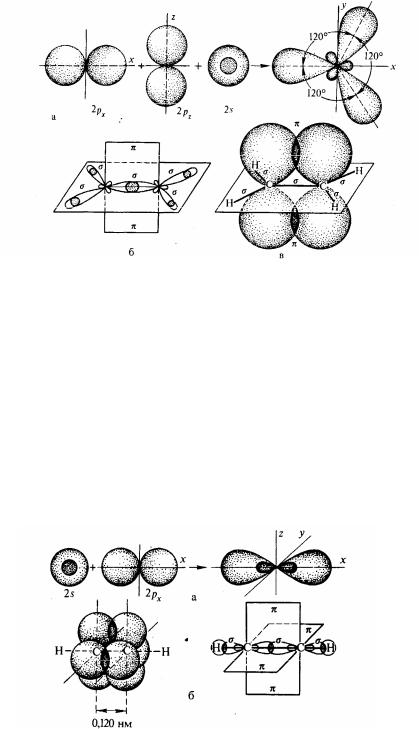
Sp3- Гібридізация. При цій гібридизації відбувається змішання однієї 2s- і трьох 2p-орбіталей. У результаті утворюється чотири однакові гібридні орбіталі, що мають велику електронну щільність за однієї сторони ядра. Тому кожна з гібридних орбіталей схильна в більшому ступені перекриватися з іншими орбіталями, чим окремі «чисті» 2s- і 2p-орбіталі.
Всі чотири гібридні орбіталі строго орієнтовані в просторі, створюючи своїми стовщеними «пелюстками» (мал.1) геометричну фігуру – тетраедр, тому що вони
.
\
Мал. 1. Схема утворення чотирьох sp-гібридних атомних орбіталей
7
розташовані щодо один одного під кутом 109,028/ (мал. 1).
Стан вуглецевого атома з sp3-гібридними орбіталями називають першим валентним станом. Воно характерно для насичених вуглеводнів. Sp2-Гибридизация. Ця гібридизація - результат змішання однієї 2s- і двох 2pорбіталей. При цьому утворяться три гібридні орбіталі, розташовані в одній площині під кутом 120о друг до друга (площина рівностороннего трикутника). Третя 2p-орбиталь, що не приймає участі в гібридизації, зберігає свою стару форму і розташовується на площині, перпендикулярної площині гібридних орбіталей (мал. 2). Такий стан атома вуглецю називається другим валентним станом. Ця гібридизація характерна для вуглецю, пов'язаного подвійним зв'язком (ненасичені вуглеводні ряду этілена).
Мал. 2. Схема утворення трьох sр-гібридних атомних орбіталей (а); схема будови зв'язків этілену (б); утворення л-звязку за рахунок перекривання двох негібридізованих 2р-электронів (в).
Sр-Гібридізация. При змішанні однієї 2s- і однієї 2p-орбіталі утворюється дві гібридні орбіталі, що розташовані на однієй прямої лінії. Інші дві 2p-орбіталі, що не беруть участі в гібридизації, розташовані у взаємно перпендикулярних площинах (мал. 3). При такому типі гібридизації вуглець знаходиться в третьому валентному стані. Ця гібридізація характерна для атомів вуглецю, пов'язаних потрійним зв'язком (ненасичені вуглеводні ряду ацетілену).

8
Мал. 3. Схема утворення двох sр-гібридних атомних орбіталей (а) і схематичне зображення зв'язків в ацетилені (б).
Ковалентний (неелектровалентний або гомеополярний) зв'язок.
При утворенні зв'язку між атомами, електронегативності яких рівні або відрізняються незначно, передача електронів від одного атома до іншого не відбувається. У цьому випадку зв'язок утвориться за рахунок усуспільнення неспарених електронів (двох, чотирьох або шести), що належать обом атомам для утворення хімічного зв'язку (Коссель, Льюис, 1916). Кожна з цих електронних пар утворить тільки один ковалентний зв'язок, що позначається рисочкою:
Ковалентний зв'язок - найбільш поширений тип хімічного зв'язку в органічній хімії. Він утворюється при перекриванні орбіталі одного атома з орбіталью іншого. Таким чином, при утворенні ковалентного зв'язку утворюються стійкі електронні оболонки (октети) шляхом усуспільнення електронів, а не шляхом їх віддачі-приєднання. Такий механізм утворення хімічного зв'язку іноді називають «обмінним механізмом».
Молекула з ковалентним зв'язком може бути неполярною, якщо пов'язані цим зв'язком атоми мають однакові электронегативності (наприклад, у випадку молекули водню). Якщо ж один з атомів має велику спорідненість до електрону й у результаті цього електронна щільність усунута в його сторону, то така молекула або зв'язок буде полярною. Наприклад, у формулі карбонильної групи ›δ+с=оδ- знакі + δ і δ - (дельта) означають, що на атомі кисню є надлишок електронної щільністі (частковий негативний заряд), а на атомі вуглецю - їхній дефіцит (частковий позитивний заряд). Таким чином, чим більше різниця в электронегативності атомів, пов'язаних ковалентним зв'язком, тим більш полярна молекула (або зв'язок). Проте полярність зв'язку в органічних сполуках – величина нестала. Вона часто змінюється під впливом багатьох чинників: природи реагенту, що атакує, характеру розчинника і т.д. Полярність є дуже важливою характеристикою хімічних зв'язків, визначаючи багато в чому фізичні і хімічні властивості і поводження органічних сполук. Від наявності того або іншого заряду на атомі залежить його реакційна спроможність.
Полярність зв'язку, тобто ступінь зсуву електронної щільності, може бути охарактеризована за допомогою електричних моментів діполей. Електричний момент диполя μ зв'язку є векторною величиною, що дорівнюєдобутку заряду (е) на відстань (r) між центрами ваги зарядів μ = er, і вимірюється в кулон-метрах (Кл-м)*. Електричний момент диполя молекули, що має декілька зв'язків, можна уявити як векторну суму електричних моментів діполей цих зв'язків, отриманий шляхом додавання їх за правилами векторної алгебри:
μ = Σiμ i
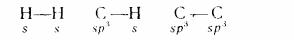
9
Крім полярності, що характеризує хімічні зв'язки в статичному стані, кожний зв'язок може володіти ще і поляризуемостю - спроможністю змінювати свою полярність під дією зовнішнього електромагнітного поля.
Зв'язок між атомами, здійснюваний одною парою електронів, називають простий (одинарний) або σ(сигма)-зв'язок. Такий зв'язок утворюється перекриттям двох орбіталей s-електронів (σ -електронів) або перекриттям орбіталей s-електрона (наприклад, атома водню) з sp3-гібридними орбіталями атома вуглецю (при утворенні, наприклад, молекули метану), або за рахунок перекриттям двох sp3-гібридних орбіталей атомів вуглецю (у насичених вуглеводнів):
σ-Звязок характерно для насичених вуглеводнів, вуглецеві атоми в який знаходяться в першому валентному стані (sp3-гибридизация) .
Якщо при утворенні ковалентного зв'язку беруть участь дві або більш електронні пари, то такий хімічний зв'язок називають кратним. Він може бути подвійний (у випадку двох пар електронів) або потрійний (за участю трьох пар електронів). Кратні зв'язки складаються з одного σ -зв'язку та одного або двох л-звязків. л-Звязок здійснюється негібридизованими 2р-электронами (л-электронами).
У випадку подвійного зв'язку (С=С) простий σ-зв'язок здійснюється за рахунок перекривання sp2-гібридних орбіталей атомів вуглецю і розташований у площині, у якій знаходяться всі ядра атомів вуглецю і водню. Інший зв'язок (л-зв'язок) між вуглецевими атомами утворюється двома 2p-електронами (негібридизованими) і лежить у площині, перпендикулярної площини σ-зв'язків (див. малий. 2). Подвійний вуглець-вуглецевий зв'язок характерно для етіленових вуглеводнів; вуглець, пов'язаний подвійним зв'язком, знаходиться в другому валентному стані (sp2-гибридизация).
Потрійний вуглець-вуглецевий зв'язок (С≡С) утворено одним σ-зв'язком (перекриття двох гібридних 2р-атомних орбіталей) і двома л-звязками (перекриття двох негібридизованних орбіталей від кожного сусіднього вуглецевого атома). σ- Зв'язок у потрійному зв'язку розташовано на однієї прямої лінії, що являє собою вісь трьох σ-зв'язків. Два л-звязки розташовано в двох взаємно перпендикулярних площинах (див. малий. 3.) Потрійний вуглець - вуглецевий зв'язок характерно для ацетиленових вуглеводнів, у яких атом вуглецю, пов'язаний потрійним зв'язком, знаходиться в третьому валентному стані (sp-гібридизація).
Як вже казали, ковалентний зв'язок характеризується яскраво вираженою спрямованістю в просторі. У цьому і складається відмінність ковалентного зв'язку від інших видів зв'язку. Спрямованість хімічного зв'язку позначає, що утворення ковалентних зв'язків атомом вуглецю відбувається не в будь-яких напрямках простору, а тільки у визначених, що складають один з одним кути, розмір яких залежить від валентного стану вуглецю. Так, при sp3-гібридизаціїї кут між гібридними орбіталями складає 109,28о; при sр2-гібридизації він дорівнює 120о , а при sp-гібридизації – 180о .
Крім спрямованості для ковалентного зв'язку характерна довжина зв'язку, що дорівнює відстані між ядрами атомів та виражена в нанометрах (1 нм==10-9 м).
10
Довжина хімічного зв'язку залежить від його характеру: чим більше кратність
зв'язку, тим він коротше (L(C-C) = 0,154 нм; L(C═C) = 0,134 нм; L(C≡C) = 0,120 нм).
Ковалентний зв'язок визначається також енергетичною характеристикою: чим вище енергія зв'язку - дужчий зв'язок.
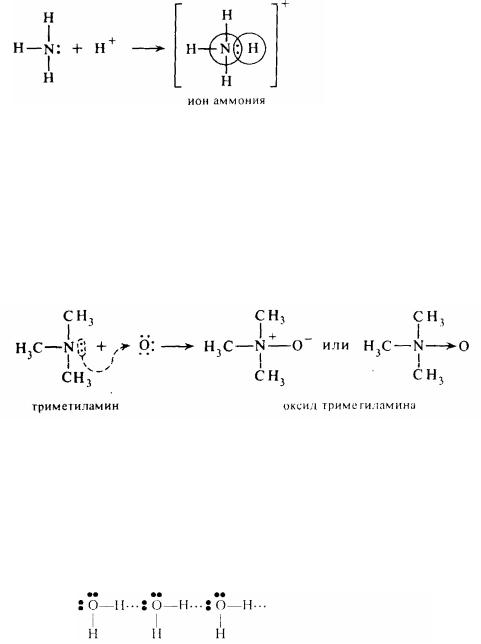
Координаційний зв'язок - окремий випадок ковалентного зв'язку. Такий зв'язок виникає, коли один з атомів має неподілену електронну пару, а інший, навпаки, готовий її прийняти (має вільну орбіталь). Як прийнято говорити, інший атом має «електронну вакансію». У нього до октету не вистачає двох або більше електронів. У цьому випадку відбувається також усуспільнення електронів, але не на рівних «паях», а шляхом передача пар електронів одним з атомів у загальне користування. Інший атом надає тільки свою вільну орбіталь, спроможну прийняти ці електрони:
Атом, що має неподілену пару електронів і надає їх для утворення нового хімічного зв'язку, називається донором, а атом, що приймає їх, - акцептором. Тому, такий зв'язок часто називають донорно-акцепторним зв'язком.
Різновидом координаційного зв'язку є семіполярний зв'язок. Цей зв'язок здійснюється також за рахунок неподіленої пари електронів одного з атомів. Але віддавая цю пару для утворення зв'язку, атом набуває позитивний заряд. У той ж час у іншого атома з'являється негативний заряд. У результаті новий зв'язок можна розглядати як одночасний прояв двох видів зв'язку - ковалентного (за рахунок усуспільненої електронної пари) та іонної (за рахунок взаємодії протилежних зарядів). Наприклад:
Водневий зв'язок (Н- зв'язок). Такий зв'язок виникає між атомами, що мають вільну електронну пару (наприклад,. кисень, азот, фтор та ін.), та воднем, що пов'язаний з іншим атомом високополярним ковалентним зв'язком (наприклад, О-Н)
У цьому випадку водень має досить високу протонну рухливість, у результаті чого виникає зв'язок особливого типу (Н- зв’язок), енергія якого складає усього 12,5-21 кДж/моль. Виникнення такого зв'язку, наприклад, між молекулами води, можна зобразити у вигляді схеми
Особливе поводження деяких гидроксилзмістових сполук (спиртів, кислот і т.д.) пояснюється утворенням водневого зв'язку. Для таких речовин характерні більш високі температур кипіння і плавлення, спостерігається зміна розчинності й електричної провідності і т.д. Наприклад, водневий зв'язок обумовлює
