
конспекты / ------------------
.pdf
141
Ці реакції йдуть по механізмі нуклеофільного заміщення (SN).
Фізичні властивості. Нижчі гомологи (метиламін, діметиламін і триметиламін) - гази, добрі розчинні у воді. Більш складні аміні - рідини з неприємним запахом зіпсованої риби. Вищі аміні - тверді, нерозчинні у воді речовини без запаху. Хімічні властивості. Властивості амінов визначаються аміногрупою, азот якої містить неподелену пару електронів. Тому аміні, подібно аміаку, виявляють основні властивості. Так, у водяних розчинах аміні, приєднуючи протон, утворять амонійні з'єднання:
Ці розчини мають лужну реакцію, тому що містять у надлишку іони ВІН - .
1. Аміни, володіючи основними властивостями, реагують із кислотами з утворенням солей:
Варто підкреслити, що основность амінов (Кb = 10-3-10-4) вище основності аміаку
(Кb = 1,8 ∙10-5).
Солі амінов можна розглядати як комплексні з'єднання. При цьому атом азоту в них є центральним і має координаційне число, рівне чотирьом.
2.Аміни вступають у реакції алкілірованія й ациліровання:
3.Азотиста кислота реагує з первинними і повторними амінами з виділенням у першому випадку азоту й утворенням спиртів, а в другому - нітрозамінів:
З третинними амінами в звичайних умовах азотиста кислота не взаємодіє.
Окремі представники. Метиламін {амінометан) СНзNН2 - газ. Використовується при синтезі лікарських препаратів і барвників антрахінонового ряду.
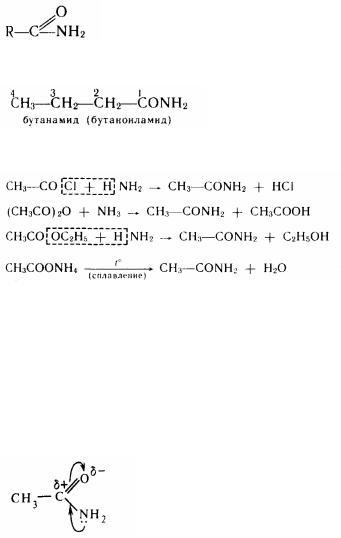
142
Діметиламін {N-метиламінометан) (СНз)2NН—газ. Застосовується в якості пришвидшувача вулканізації каучуку і як вихідний продукт при одержанні високоефективних лікарських препаратів (аміназин і ін.).
Вищі аміні (С12—С20) можна вводити в склади , що ущільнюють, замазки, дорожні покриття і т.д. Смердоти покращують адгезію матеріалів до вологих поверхонь. Ці аміні виявилися гарними інгібіторами корозії стали, алюмінію й інших металів. Вищі масні аміні застосовуються в лакофарбовій і гумовій промисловості. Четвертинної солі таких амінов можуть використовуватися в якості катіоноактивних ПАВ.
Етилендіамін {1,2-діаміноетан} Н2N—СH2—СН2—NН2 - рідина з запахом аміаку, tкип= 116,5°С. Використовується у виробництві ПАВ.
Гексаметилендіамін (1,6-діаміногексан) Н2N(СН2)6NН2-кристаллическое речовина з tпл=42°С. Вступаючи в реакцію поліконденсації з адипиновой кислотою, утворить синтетичне поліамідне волокно - анід (у США, Франції й Італії воно називається нейлоном 6,6, у ЧССР—новадюром).
Аміди кислот
Аміди кислот - продукти заміщення гідроксильної групи карбонових кислот аміногрупою (або водню в аміаку ацильною групою):
Номенклатура. Назви амідів роблять від систематичної назви відповідної кислоти заміщенням закінчення -овая на -амід:
Одержання. Аміди кислот одержують дією аміаку на хлорангідриді, ангідриді, складні ефіри або при сплавці амонійних солей карбонових кислот:
Фізичні властивості. Аміди кислот - кристалічні речовини (виняток - рідкий амід муравьїної кислоти - формамід}. У ІК-спектрах аміди кислот визначаються двома смугами. Смуга 1690-1630см-1 відповідає валентному коливанню карбонільної групи, а смуги 1620-1590 і 1550-1510 см-1— деформаційному коливанню NН. Хімічні властивості. На відміну від аміаку в амідів основні властивості виражені слабко. Це пояснюється впливом кислотного залишку - ацила, карбонільна група якого відтягає вільну пару електронів від атома азоту:
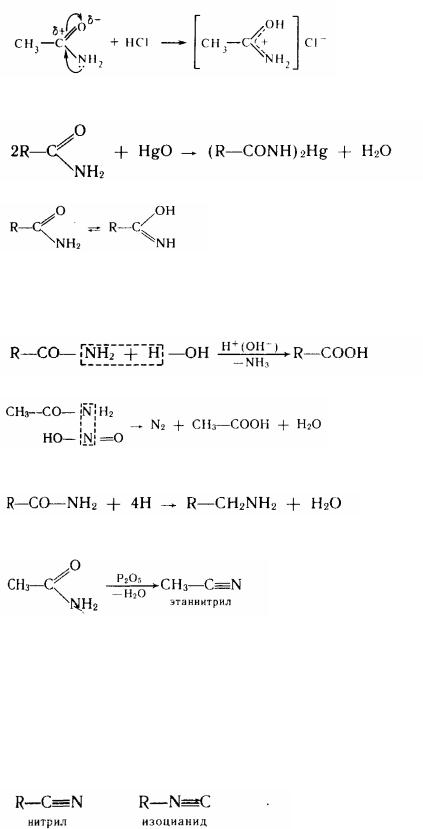
143
Проте, незважаючи на слабкі основні властивості, аміди утворять солі із сильними кислотами. Протонізація при цьому йде переважно по атому кисню, що більш основний:
У тієї ж час водень аміногрупи спроможний заміщатися на метан, проявляючи слабко виражені кислі властивості (рКа=25):
При цьому можлива внутримолекулярна амідо-імідна таутомерія:
Проте амідна форма стійкіше імідної на 94,2 кДж/моль.
Таким чином, аміди виявляють досить слабкі кислі властивості і ще більш слабкі основні.
При кип'ятінні з водою при кислот або лугів аміди піддаються гідролізу:
Дія азотистої кислоти на аміди призводить до виділення вільного азоту:
Аміди, восстанавливаясь, перетворюються в аміни:
Сильні засоби , що водоотнімають, наприклад Р205 спроможні перетворювати аміди в нітрилі:
Окремі представники. Ацетамід (этанамід) - кристалічна речовина з tпл=83°С. Легко розчиняється у воді, спирті, гліцерінє. Використовується в якості розчинника для багатьох органічних сполук. Застосовується також у виробництві папери, шкіри й інших виробів.
Вищі аміди (С9—С21) можуть служити в якості добавок при формованії водостійких гіпсових плит.
Нітрили і ізоцианіди
Нітрили (ціаніди) і ізоцианіди є ізомерними з'єднаннями:
У молекулі нітрилу алкільна група пов'язана з вуглецем, а в ізоцианіді - з азотом.
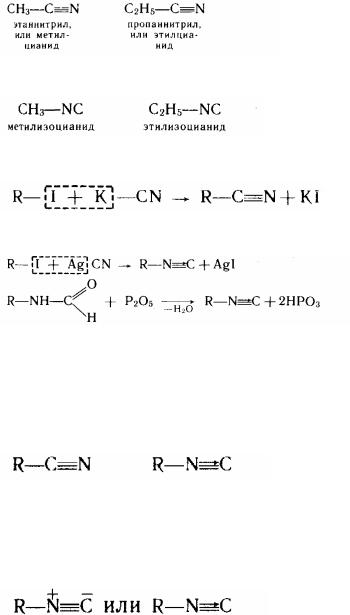
144
Номенклатура. Назви нітрилів по систематичній номенклатурі утворяться з найменувань вуглеводнів із додаванням слова нітрил у якості закінчення або ціанід і назви радикала:
Ізоцианіди звичайно називають виходячи з назви радикалів. По систематичній номенклатурі до назви радикала добавляють слово ізоцианід:
Одержання. Нітрили можна одержувати дегідратацією амідів карбонових кислот дією Р^ПРО^ або взаємодією галогеналкилов із ціанистим калієм:
Ізоцианіди одержують нагріванням галогеналкилов із ціанідом срібла або при дії Р2О5 на алкілформаміди:
Різноманітні результати при дії КСN і AgCN можна пояснити палимо, що ціаніди лужних металів містять іони ціану СN - , а ціанід срібла - ковалентносвязанні атоми срібла.
Будівля. Нітрили і ізоцианіди мають потрійний вуглець-азотний зв'язок, що складається з однієї ? -зв'язку і двох ? -зв'язків:
Проте в нітрилах атоми вуглецю й азоту віддають у загальне користування для утворення цих зв'язків по трьох електрона; у ізоціанидах атом азоту віддає чотири електрони, а вуглець тільки два, надаючи в тієї ж час вільну p-орбіталь для електронів азоту. Таким чином, в угрупованні NС одна зі зв'язків є донорноакцепторної:
Зв'язок С≡ N характеризується великою тривкістю і високою полярністю. Фізичні властивості. Нижчі нітрилі, що містять у молекулі до 11 атомів вуглецю, - рідини, нерозчинні у воді (за винятком етан- і пропаннітрилов). Вищі нітрили - тверді кристалічні речовини.
ізоцианіди - отрутні рідини. Їхньої температур кипіння нижче, чим у ізомерних їм нітрилів.
Наявність потрійного зв'язку в нітрильному і ізоцианідному угрупованнях підтверджується характеристичною частотою в ІК-спектрах: у нітрилах в області 22602240 см -1, у ізоціанидах в області 2180-2120см-1 (для порівняння: потрійний зв'язок — С ≡ С − має смугу поглинання в області 2300 2100 см-1. Хімічні властивості. По хімічному поводженню нітрилі і ізоцианіди сильно відрізняються.

145
Нітрили (при мінеральних кислот або лугів) і ізоцианіди (при тільки мінеральних кислот) піддаються гідролізу, створюючи різноманітні продукти: нітрилі дають спочатку аміди, а потім карбонові кислоти, а ізоцианіди - первинні аміни і муравьїну кислоту:
Нітрили і ізоцианіди при відновленні утворять відповідно первинні і повторні аміни:
При нагріванні до 250°С ізоцианіди перегруповуються в нітрили:
Ізоцианіди можуть брати доля в реакціях приєднання:
Ефіри ізоцианової кислоти, що утворилися при окислюванні ізоцианідов R-N=С=0 ізомерні ефірам ціанової кислоти R—О—С≡ N. Ці з'єднання відповідають двом ізомернім кислотам-цианової і ізоцианової (рKа==3,66):
Окремі представники. Ацетонітрил (этаннітрил) СНзСN - рідина з характерним ефірним запахом, tкип=81,6°С. Застосовується в якості розчинника і як вихідний продукт для синтезу багатьох органічних сполук.
Акрилонітрил (пропеннітрил) СН2==СН—СN - рідина, tкип = 78°С. Застосовується для одержання синтетичного волокна, що заміняє шерсть, нітрону (у США-орлон, акрилан}, що володіє гарної термо- і світлостійкістю і високими фізико-механічними показниками. Акрилонітрил використовується при виробництві бутадієннітрильного синтетичного каучуку (СКН), що має скроні масло- і бензостойкость:
Цей каучук може застосовуватися й у якості клеючи при виготовленні двошарової полівінілхлоридної плівки для захисту від морської води. Ця плівка має гідроізоляційними властивості і перешкоджає обростанню підводними організмами, тому смердота застосовується при будівництві гідротехнічних споруджень.
Ефіри ізоцианової кислоти - ізоцианати застосовуються в якості мономерів для одержання поліізоцианатів:

146
Аліфатичні діазосполучення
Діазосполучення - речовини, що містять у молекулі угруповання з двох атомів азоту.
Найпростішим представником діазосполучень аліфатичного ряду є діазометан СН2N2. Його будівлю можна уявити у виді двох структур:
Одержання. Діазометан зручно одержувати дією азотистої кислоти на метилкарбамид:
Хімічні властивості. Діазометан і інші аліфатичні діазосполучення хитливі і вкрай реакційноспроможні. При нагріванні смердоти разлагаються з вибухом, реагують із водою, галогенами, галогеноводородами, виділяючи при цьому азот:
При піролізє або фотохімічному впливі діазометан розпадається на азот і вільний радикал-метилен (карбен):
Розкладанням діазометану в ефірному розчині при каталізатора (мідний порошок або трифторид бора) можна одержати поліетілен лінійної будівлі:
Окремі представники. Діазометан СН2N2 - токсичній і вибухонебезпечний газ жовтого цвіту, із неприємним запахом, tкип = —23°С. Вживається частіше усього у виді ефірного розчину. Використовується в багатьох органічних синтезах. .
Наприклад, часто застосовується в якості агента , що метилірує:
Етиловий ефір діазоуксусної кислоти N2СН—СООС2Н5 і 2,2-азо-бис- ізобутіронітрил
широко використовуються в якості органічних порофоров (парообразователів) для виробництва газонаполненных пластмас. Такі полімерні матеріали застосовуються в багатьох областях промисловості, у тому числі й у будівництві, у якості тепло- і звукоізоляційних матеріалів.
Порофор 2,2-азо-бис-ізобутіронітрил ставитися до газообразователям, що виділяє газ (азот) унаслідок необоротного термічного розкладання:

147
Ця реакція протікає через проміжну стадію утворення вільних радикалів. У зв'язку з цим порофор можна застосовувати в якості ініціатора реакції полімеризації, причому на відміну від пероксиду бензоілу він не має що окисляє дію.
К серу- і з'єднанням, що азотсодержат, ставляться також відповідні похідні вугільної кислоти.
ЛЕКЦІЯ 11 - 12
Будова бензолу. Природа ароматного стану.
Будова бензолу. Бензол С6Н6 - найпростіший представник ароматних вуглеводнів був відкритий Фарадеєм у 1825 р. у світильному газі.
У 1845 р. Гофман виділив його з кам'яновугільної смоли.
Мабуть, жодне з сполук не викликало такого інтересу дослідників, як бензол - це нескладна по своєму складу речовина.
З численних формул будов, що пропонувалися для бензолу в 60-х роках минулого сторіччя, найбільше удалої виявилася формула Кекуле (1865 р.), відповідно до якої бензол являють собою циклогексатриєн-1,3,5 - шестичленний циклічний вуглеводень із трьома сполученими подвійними зв'язками
Така структура правильно відбила рівноцінність усіх шести атомів водню бензолу і деякі інші особливості цієї речовини. Проте формула Кекуле не могла пояснити, чому бензол не має властивостей ненасиченого вуглеводню.
Бензол не дає реакцій, характерних для ненасичених сполук, не знебарвлює бромну воду і лужний розчин перманганату калію. Замість цього при дії брому протікає реакція заміщення водню, характерна для насичених сполук, і утвориться бромбензол C6H6Br ; при дії азотної кислоти водень зміщується на нітрогрупу й утвориться нітробензол C6H5NO2.
Усе ж у визначених умовах можливі і реакції приєднання. При каталітичному гідруванні молекула бензолу приєднує шість атомів водню, створюючи циклогексан:
С6Н6 + 3Н2 → C6H12
При сильному освітленні бензол приєднує шість атомів хлору, створюючи гексахлорциклогексан C6H6Cl6. Вступає бензол також у реакцію з озоном, даючи
148
хитливий триозонід.
З приведених прикладів очевидно, що бензол може виявляти, але в звичайних умова ненасичености ця властивість ослаблена. Характерна термічна усталеність бензолу (до 900°С) і його похідних, легкість їхніх утворень, специфічний вплив ароматного ядра на властивості пов'язаних із ним заступників.
Лише розвиток ел ектронних і квантово-механічних уявлень про хімічні зв'язки дозволило пояснити особливості ароматних з'єднань.
Енергію молекули бензолу можна визначити різноманітними засобами. Всі вони показують, що реальна молекула бензолу має меншу енергію, чим якби вона являла собою циклогексатриєн (формула Кекуле), де електрони жорстко закріплені в подвійних і простих зв'язках. Теплість сгоряння, обчислена для формули циклогексатриєну, дорівнює 3453 кДж/моль, а знайдена експериментально для бензолу 3303 кДж / моль, тобто менше на 150 кДж/моль.
Гідрування ізольованого подвійного зв'язку в циклогексені або подвійному зв'язку алкену протікає з виділенням енергії. Гідрування ж бензолу потребує витрати енергії. Вуглець - вуглецеві зв'язки в молекулі бензолу відрізняються тривкістю, на їх розривши необхідно затратити значну енергію. Молекула бензолу стабілізована, мірою її усталеності є енергія сполучення. Визначена різними методами, вона складає біля 150 кДж/міль. Утворення ароматних сполук із неароматичними супроводжується виділенням енергії.
Природа ароматного стану.
Бензол— найбільше яскравий приклад речовини, у якому здійснена делокалізація електронів.
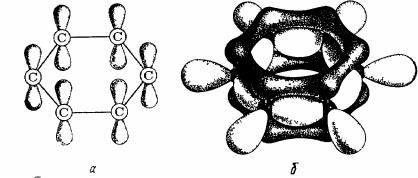
У молекулі бензолу усі вуглець - вуглецеві зв'язки вирівняні, довжина всіх зв'язків однакова (0,139 нм). Це плоска молекула, де шість атомів вуглецю об'єднані в правильний шестикутний цикл Всі атоми вуглецю в бензольному циклі знаходяться в стані sp2 гибридізації. Кожний із них утворить три звичайні про - сполуки (дві С—С і одну С—Н) із кутом між ними 120о , затрачуючи на це трьох валентних електрона, четвертий електрон кожного атома вуглецю не закріплений, орбіталі всіх шести p-електронів перпендикулярні площини каблучки і взаємно рівнобіжні (рис 25, а) Кожний p-електрон даного вуглецевого атома взаємодіє з р - електронами суміжних вуглецевих

149
Мал. 25 |
|
Модель а - і я зв'язків у бензолі |
|
А)—с - зв'язку й окремі л електронні хмари, б—о зв'язку |
(світлі) і |
делокализованные л електрони Цінні) |
|
атомів Всі вони розподілені симетрично навколо каблучки і переміщаються по каблучці Таким чином, шість л-электронов не локалізовані в пари, як при утворенні звичайних подвійних зв'язків, а утворять загальну л- систему - здійснюється кругове сполучення.
Розподіл електронної щільності в бензольному циклі, установлений рентгенографічними методами, свідчить про те, що ця щільність дійсно розподілена рівномірно, тобто ні простих, ні подвійних зв'язків у бензольному ядрі немає, усі зв'язки однакові. На рис приведена модель а- і π зв'язків бензолу Більш темним цвітом зображена π - електронна система, образующая як би зовнішню оболонку шестичленного циклу, більш світлим цвітом передані sр2 - гібридні орбіталі, за допомогою яких здійснюються С - С – сполука з атомами вуглецю і водню.
Обов'язковою умовою повної делокалізації π - електронів, умовою повноти сполучення, є плоска будівля циклічної молекули і визначене число л-электронов у бензольному циклі воно дорівнює шести (ароматний секстет, ароматна
шістка)
Таким чином, молекула бензола—устойчивий симетричний шестичленний цикл з однакових СН - груп, що лежать в одній площині, що пов'язані ароматною системою зв'язків
Щира будівля бензольного циклу є мезомерним, проміжних між що зображується двома граничними формулами.
Для позначення бензолу можна користуватися однієї з формул, що вказують на проміжний характер зв'язків:
Проте частіше усього для умовного зображення молекули бензолу користуються формулою Кекуле, пам'ятаючи про всі її хиби
Існує правило (Хюккель, 1931 г), по якому ароматною усталеністю
150
володіють симетричні циклічні по – лиенові системи з числом л-электронов
4п + 2, де п = О, 1, 2, 3 і т.д. Отже, ароматичностью володіють система з 2, 6, 10, 14 і т.д. π- електронами
Прикладом ароматних систем із 10 і 14 л-электронами є нафталін і антрацен
нафталін антрацен
Ці сполуки ставляться до аналізованих далі багатоядерніх ароматних вуглеводням .
Ізомерія проізводних бензолу. Номенклатура ароматних вуглеводнів.
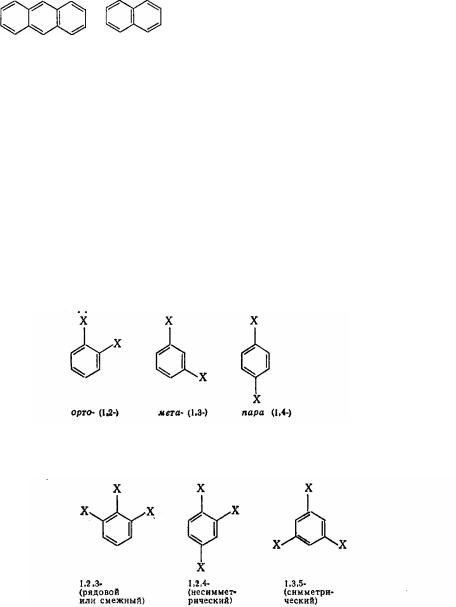
Ізомерія производних бензолу. Однозміщені бензоли ізомерів не мають, тому що всі атоми вуглецю в бензолі рівноважні. Двузміщені бензоли існують у виді трьох ізомерів, що відрізняються розташуванням заступників щодо один одного Положення заступників указують за допомогою приставок орто-, мета-, пара- або позначають цифрами
Три ізомера мають тризміщені бензоли з однаковими заступниками
а також четирїхзміщені з однаковими заступниками. І нарешті, пьяти- і шестизміщені сполуки з однаковими заступниками ізомерів не мають (по тієї ж причині, що однозміщені).
Дослідження останнього років (60-є роки) призвели до одержання валентних ізомерів бензолу. Така ізомерізація може відбуватися внаслідок перерозподілу зв'язків у молекулі, тобто за рахунок перерозподілу електронів. Тому що молекула бензолу стабільна, то його ізомерізація може відбутися під впливом великої кількості енергії.
При опроміненні ультрафіолетовим світлом три - тре - бутілбензолу (I)
