
конспекты / ------------------
.pdf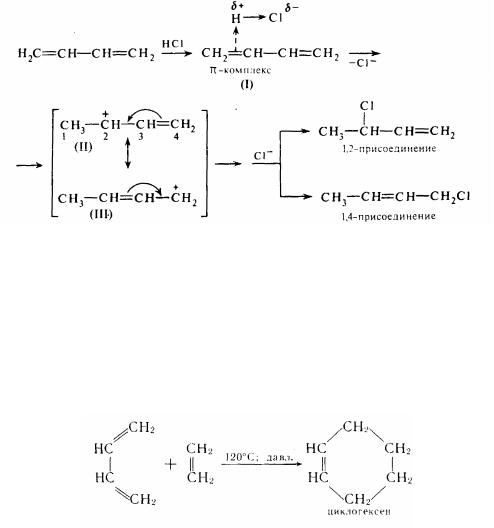
51
подвійними зв'язками - досить стійкі системи.
Стан сполучених подвійних зв'язків у молекулі , що не реагує , називається статичним ефектом сполучення. Якщо ж дієн із такими зв'язками вступає у взаємодію з реагентом, під впливом якого відбувається перерозподіл електронної щільності в молекулі, то виникає стан динамічного ефекту сполучення.
Роздивимося механізм приєднання до бутадієну-1,3 хлороводороду. Реакція починається з електрофільной атаки протоном -електронної хмари однієї з подвійних зв'язків. У результаті утвориться хитливий π -комплекс (1), що переходить потім у сполучений карбонієвий іон (II). π-Электрони сусіднього подвійного зв'язку в результаті взаємодії з позитивним зарядом переміщаються в центр молекули. Одночасно з цим позитивний заряд переходить на крайній вуглецевий атом (III). Ця структура може перебудовуватися в оберненому напрямку - у структуру (II). Структури (II) і (III) називаються граничними і застосовуються як засіб зображення мезомерного карбкатиону. Атоми вуглецю С2 і С4, що несуть позитивний заряд, піддаються потім нуклеофильной атаці з боку аніона Сl- з утворенням продуктів 1,2- і 1,4-приєднання:
Приєднання до сполучених дієнів може відбуватися і по радикальному механізмі. При цьому більш кращим буде утворення 1,4-продуктів.
Дієнові синтези. Однією з найбільше важливих реакцій, які застосовують для одержання багатьох циклічних органічних сполук, є дієновий синтез. Цей вид реакцій складається в 1,4-приєднанні алкена або алкіна до дієну зі сполученими подвійними зв'язками. Такі реакції відомі як синтез ДильсаАльдера (1929).
Найпростішим прикладом дієнового синтезу служить реакція приєднання етилену до бутадієну-1,3:
Особливо легко протікають реакції з непредельними сполуками, що містять электроноакцепторні групи (—NO2—С≡ N, —СНО, —СООН):

52
акролеин |
тетрагидробензойний альдегід |
|
Ненасичені сполуки, що вступають у реакцію з дієнами, |
називаються |
|
дієнофілами.
Реакції полімеризації. Винятково важливою в практичному відношенні є спроможність дієнових вуглеводнів вступати в реакцію полімеризації, у результаті якої утворяться каучукоподібні продукти . Реакції полімеризації протікають із приєднанням у 1,4- і 1,2-положення:
Реакція полімеризації носить ланцюговий характер і йде в присутності каталізаторів або ініціаторів.
Окремі представники. Каучуки
Бутадієн-1,3 (дівинил) СН2=СН—СН=СН2 - безбарвний газ із характерним неприємним запахом, що скраплюється при —5°С. Є одним із найважливіших мономерів для виробництва синтетичних каучуків і латексів, пластмас і інших органічних сполук.
2-Метилбутадієен-1,3 (ізопрен) має формулу СН2=С—СН=СН2 .
СНз
Це безбарвна рідина з tкип=34,1°С. Ізопрен є основною структурною одиницею природного (натурального) каучуку й інших сполук. Він служить мономером для добування синтетичного каучуку.
СНз
2,3-Діметилбутадієн-1,3 СН2=С—С=СН2 – рідина, яка кипить
СНз при температурі 69,6°С. Віп легко полімерізується з утворенням так званого
метилкаучука. При ланцюговій полімерізації цих дієнов утворюються різноманітні каучуки.
Каучук - високомолекулярна сполука, що має величезне технічне значення; є основою для виробництва різноманітних гумових виробів. Каучуки поділяються на два великих класи: натуральні каучуки і синтетичні.
Натуральний каучук (НК) - природний ненасичений полімер (С5Н8)n із молекулярною масою від 15000 до 500000, що утримується в млечном соку деяких тропічних дерев (гевеи бразильської й ін.) і рослинах (кок-сагыз, таусагыз, гваюла). Млечний сік (латекс), отриманий підсіканням каучуконосних дерев, коагулюють різноманітними засобами (наприклад, дією кислот,

53
обкурюванням і т.д.).
Було встановлено (Г. Штаудингер, 1931), що структурна одиниця натурального каучуку - изопренова група:
СН3
СН2 С СН СН2 З'єднуючись між собою в 1,4-положення, такі групи утворять макромолекулу
каучуку, що має цис-строєніє:
Натуральний каучук має високу еластичність. Він розчиняється в аліфатичних і духмяних вуглеводнях, створюючи грузлі розчини. Подібно дієновим вуглеводням, каучук схильний до реакції приєднання (наприклад, із бромом, бромоводородом і ін.).
Різновидом каучуку є гуттаперча (менше еластична), що має транс-1,4- будову.
Синтетичні каучуки (СК) - аналоги натурального каучуку, одержувані синтетичним шляхом із мономерів (каучукогенов) - бутадієна-1,3, ізопрену, хлоропрену й ін. Основний метод їх одержання - ланцюгова полімеризація (по радикальному або іонному механізмі. Виробництво синтетичних каучуків викликано бурхливим розвитком деяких областей промисловості (автомобілебудування, авіація, космос), відсутністю в ряді країн, у тому числі й у СРСР, природних джерел натурального каучуку, а також зрослими вимогами до каучуку (масло та бензостійкість, морозо- і теплостійкість, газонепроникність, тривкість до стирання і т.д.).
Вперше значне промислове виробництво синтетичного каучуку було організовано в СРСР. У 1931 р. була отримана перша партія синтетичного каучуку на основі бутадієна-1,3, синтезованого з етилового спирту за методом С. В. Лебедєва.
Для поліпшання властивостей каучуку полімеризацію каучукогенов проводять разом з іншими ненасиченими мономерами (стиролом, акрилонитрилом, ізобутиленом, метиловим ефіром бутадієнкарбоновой кислоти).
Роздивимося коротко основні типи синтетичних каучуків.
Бутадієнові каучуки (ВКВ) - найбільше поширений тип синтетичних каучуків. Їх одержують полімеризацією бутадієна-1,3 (дівинила) із застосуванням пероксидних каталізаторів:
або каталізаторів аніонної полімеризації. У залежності від природи каталізатора й умов полімеризації одержують каучуки з 14-цис-, 1,4-транс- і 1,2-

54
будовою.
Бутадієновий каучук ставиться до каучуків загального призначення.
Його застосовують у сполученні з ізопреновими, бутадієн-стирольними й іншими каучуками в основному в шинному виробництві (особливо для виробництва шин великого розміру), а також у виробництві взуття й інших гумових виробів. Вони знаходять застосування для виготовлення уплотнительних виробів і складів , що герметизують , при будівництві будинків.
Ізопреновий каучук (С К И) має будову, подібну природному каучуку (цис14), але переважаючий його по багатьох показниках. Одержують цей каучук полімеризацією ізопрену в присутності пероксидів або діазосполучень.
Бутадієн-стирольні каучуки (С К С) також ставляться до каучуків загального призначення. Вони містять біля 2030% пов'язаного стиролу. Ці каучуки відрізняються високою тривкістю і виготовляються у великих кількостях. Вони застосовуються для виготовлення протекторів автомобільних шин, у взуттєвій промисловості. Їх одержують спільною полімеризацією бутадієна-1,3 і стиролу СН2=СН—С6Н5. Складаються на 80% із продуктів приєднання 1,4 і на 20% - 1,2.
Суміш бутадиен-стирольных каучуків з оліями застосовується для стабілізації песчаних грунтів, а також для зміцнення гребель, каналів, автомобільних доріг, набережних і териконів.
Бутадієн-нітрильні каучуки (СКН) утворюються спільною полімеризацією бутадієну-1,3 і акрилонитрилу СН2==СН—СN. Складаються в основному з продуктів 1,4-приєднання.
СКН - каучуки спеціального призначення. Їх відрізняє висока масло- і бензостійкість. Стійкі до нагрівання. У виді латексу застосовуються у виробництві паперу і нетканих текстильних виробів.
Хлоропреновий каучук, або поліхлоропрен (наирит), одержують полімеризацією хлоропрену:
Цей каучук має високу світлостійкість і маслостійкість. Інертний до багатьох органічних розчинників. Використовується в якості ізоляції, а також для виробництва бензостійких гумових виробів.
У зв'язку з високою пластичністю, термічною нестійкістю натуральні і синтетичні каучуки не можна використовувати безпосередньо. Для надання каучукам прочностних властивостей, еластичності і термостійкості їх піддають опрацюванню сіркою або її з'єднаннями (наприклад, хлоридом сірки S2Cl2) - вулканізують. Процес вулканизації був відкритий у 1839 р.
Ч. Гудьиром. Це досить складаний хімічний і фізико-хімічний процес, сутність якого полягає в утворенні нових поперечних (мостикових) зв'язків між полімерними ланцюгами. У результаті такого опрацювання каучук перетворюється в технічний продукт - гуму, що містить до 5% сірки. Крім сірки в

55
гуму входять різноманітні наповнювачи, пластифікаторі, барвники, антиоксіданти й ін. Вулканізований каучук, що містить по масі понад 30% сірки, називається ебонітом.
Особливий інтерес подають фтор каучуки, що мають високу масло- і термостійкість, а також стійкість до хімічних реагентів. Їх одержують із фторированих алкенов або їх похідних (наприклад, трифторхлорэтилену, винилденфторида й ін.). Фторкаучук на основі хлортрифторетилена і вініліденфториду, будову якого можна представити формулою [—СF2—СFСl— СН2—СF2—]п, може бути сполучений із натуральним каучуком, бутадиенстірольним, хлоропреновим, силіконовім і ін. , створюючи при цьому суміш, що володіє високою хімічною стійкістю.
Останнім часом широке поширення в будівництві одержав гумовий лінолеум - релин, що виготовляється на основі гуми. Рєпін застосовується й у виді плиток - гумовий паркет. Каучки часто вводять в асфальт для підвищення його зносостійкості і безпеки прямування на дорогах.
Особливо високою термічною стійкістю і іншими особливостями відрізняються кремнійорганичні (сіліконові) каучуки.
Дієнові вуглеводні.
Дієнові вуглеводні по систематичній номенклатурі називаються так саме, як і етиленові вуглеводні, тільки замість суфіксу -ен ставитися суфікс -адиен (тому що подвійних зв'язків дві). Положення подвійних зв'язків, як звичайно, показують цифрами. Для деяких дієнов збереглися емпіричні або старі раціональні назви:
Дієнові вуглеводні перших двох типів виявляють своєрідні властивості. Для вуглеводнів третього типу характерні звичайні реакції етиленових вуглеводнів, тільки в них беруть участь не один, а обидва зв'язки з більшою або меншою селективнистю.
А л л е н и
У молекулі аллена й інших з'єднань із кумулированими зв'язками, як це очевидно з приведеної схеми, -зв'язку розташовуються в двох взаємно перпен

56
дикулярных площинах. Площини, у яких розташовуються дві пари водневих атомів, також взаємно перпендикулярні. Два крайні вуглецевих атоми алленової системи знаходяться в стані-sp2-гібридизації, середній - sр-гібридизації
Ці особливості квантовомеханічної будови виявляються у фізичних і хімічних властивостях алленів. Зокрема, у ряду алленов при двох різноманітних заступниках у кінцевих вуглецевих атомах можлива оптична діяльність завдяки молекулярній асиметрії. Два просторових ізомера, що ставляться друг до друга як предмет до свого дзеркального зображення, при накладенні не збігаються і, отже, являють собою дві різні ізомерні молекули.
Для алленів характерна легкість гідратації розведеною сірчаною кислотою з утворенням кетонів (порівн. з ацетыленами), спроможність полімерызоватися або конденсуватися з іншими ненасиченими сполуками з утворенням чотирьохчленних циклів (С. В. Лебедєв):

57
ЛЕКЦІЯ № 5
АЦЕТІЛЕНОВІ ВУГЛЕВОДНІ (АЛКІНИ)
Ацетіленовими вуглеводнями називають такі сполуки вуглецю з воднем, у молекулах яких є атоми вуглецю, що затрачають на з'єднання із сусіднім атомом вуглецю три валентності, тобто утворюється потрійний зв'язок (sp-гібридізація) орбіталей атомів вуглецю. Ацетіленові вуглеводні утворять гомологичний ряд із загальною формулою СnН2n-2 . Родоначальником цього ряду є ацетілен НС≡ СН.
Потрійний зв'язок у молекулі ацетілену являє собою сполучення однієї - і двох -зв'язків. Атоми вуглецю, пов'язані потрійним зв'язком, знаходяться в третьому валентному стані (sp-гибридізація), тобто з чотирьох орбиталей (одна 2s- і три 2р-) гібридізовані тільки дві (2s- і 2p-). Всі чотири атоми в молекулі ацетілену розташовані на однієї прямої лінії, що являють собою вісь трьох σ- зв'язків, утворених гібридними орбіталями атомів вуглецю :
структурна |
електронна формула |
Довжина потрійного зв'язку дорівнює 0,120нм, а енергія її утворення складає
838,3 кДж/моль. Моделі просторової будови ацетілену показано на малюнку:
Ізомерія. Номенклатура
Ізомерія ацетіленових вуглеводнів визначається двома чинниками: будовою основного вуглецевого ланцюга і положенням у ній потрійного зв'язку. Структурна ізомерія, обумовлена будовою вуглецевого скелету, починається з п'ятого члена ряду.
Ця особливість у будові пов'язана з тим, що ацетіленове угрупування тільки двовалентне, обумовлює менше число ізомерів у гомологичному ряду ацетіленових вуглеводнів у порівнянні з етіленовими.
Ацетіленові вуглеводні за систематичною номенклатурою називають,

58
користуючись тими ж правилами, що й у випадку насичених вуглеводнів, але суфікс -ан- заміняється суфіксом -ін-. Головний ланцюг вибирається так, щоб у її потрапив потрійний зв'язок. і нумерується з того кінця, до котрого ближче потрійний зв'язок. Найпростіші ацетіленові вуглеводні часто називають як алкілзаміщені ацетілену, тобто за раціональною номенклатурою:
бутін-1, або етилацетілен |
бутін-2. або диметилацетілен |
3-метилбутін-1, або 4-метилпентін-2, або метилізопропилацетілен ізопропилацетілен Якщо молекула містить одночасно подвійний і потрійний зв'язки, то превага в
нумерації віддається подвійного зв'язку:
2-метилпентен-1 -ін-4
Засоби добування
Ацетіленові вуглеводні можна добути такими засобами:
1.При розкладанні водою карбіду кальцію, що, у свою чергу, одержують прожарюванням суміші вугілля і негашеного вапна в електропічах:
2.Ацетіленові вуглеводні добувають або алкиллуванням ацетілену. Алкілування ацетілену здійснюють, перетворюючи ацетілен у металорганичні
сполуки, частіше в натрійацетілен або магнійгалоген-ацетілен (Ж. И. Иоцич). У першому випадку реакцію ведуть у рідкому аміаку і діють амідом натрію, у другому - у ефірі або тетрагідрофурані. При цьому утворюються моно- і діалкилацетілени:
Реакцію з амідом натрію можна проводити тільки з первинними галогеналкилами. Вторинні і третинні галогеналкили при цьому отщеплюють галогеноводень.
3. Відщепленням галогеноводнів (або галогенів) від полігалогенопохідних.

59
Ацетіленові вуглеводні утворюються при дії спиртового розчину лугу на гемінальні і вицінальні дігалогенопохідні насичених вуглеводнів і на галогенопохідні олефінов, що містять галоген у атома вуглецю з подвійним зв'язком:
Гемінальні дігалогенопохідні звичайно утворюються при дії РСl5 на альдегіди, кетони, вицінальні - в результаті приєднання галогенів до олефінів. Крім спиртового розчину лугу, у якості реагентів, що дегідрогалогенують, використовують також порошкоподібні КОН і амід натрію.
4. З природного газу або вуглеводнів нафти при їх термічному або електрокрекінгу:
або при піролізі суміші метану з його гомологами:
5. Алкилуванням металевих похідних ацетілену:
Фізичні властивості
Основні закономірності в зміні температур кипіння і плавлення в гомологічному ряду ацетіленових вуглеводнів (табл. 7) подібні з закономірностями в ряду етіленових вуглеводнів.
Ацетіленові вуглеводні, що містять у молекулі від двох до чотирьох вуглецевих атомів (при звичайних умовах), - гази; починаючи із С5Н8 - рідини, а вищі алкіни (із С16Н30 і вище) - тверді тіла. Ацетілен у звичайних умовах - газ. Горить полум'ям, що сильно коптити, (надлишок вуглецю). Чистий ацетілен не має запаху. Технічний ацетілен має неприємний специфічний запах, що пояснюється присутністю різноманітних домішок. Ацетілен утворює із повітрям вибухівнонебеспечні суміші. У стиснутому й особливо в рідкому стані він може вибухати від найменшого удару.
Положення потрійного зв'язку в ланцюзі ще більше впливає на температуру кипіння. Так, наприклад, 1-бутін кипить при 8,5 °С, а 2-бутін - при 27 °С, тоді як обидва бутани й усі бутілені при звичайних умовах— речовини газоподібні.
Щільність і показник преломлення ацетіленів значно вище, чим олефінов і тим більше парафінів. Ацетіленові вуглеводні мають в інфрачервоному спектрі характерні смуги поглинання валентних коливань потрійного зв'язку при 4,75-4,2 мкм (2100-2300 см-1). УФ-випромінювання алкіни, як і алкени, поглинають в області нижче 200 нм. У спектрах ЯМР протони угруповання -С≡СН дають сигнал у більш сильному полі, чим протони в подвійного зв'язку.

60
Згоряя в кисні, ацетілен утворює полум'я з температурою до 3000°С:
Цим користуються для зварювання («ацетіленове зварювання») і різання металів.
Хімічні властивості
При розгляді хімічних властивостей ацетіленових вуглеводнів варто враховувати особливості потрійного зв'язку: у порівнянні з алкенами алкіни декілька менш активні в реакціях электрофільного приєднання і більш активні в реакціях із нуклеофілами (аміни, алкоголяти, меркаптиди). Ці особливості ацетіленового угруповання пояснюється її будовою. Обидва вуглецеві атоми в ацетілені знаходяться в sp-гібридному стані. Між тим чим більша доля s-орбіталі в гібридному стані, тим ближче електрони знаходяться до кулі (пригадаємо, що радіуси s- і p-орбіталей ставляться друг до друга, як 1: 3) і, отже, тим трудніше ці електрони вступають в хімічні перетворення за участю электрофілов. З іншого боку, ядра вуглецю в ацетілені набагато більш доступні для нуклеофільних реагентів завдяки його лінійній будові:
Цією ж особливістю ацетіленового угруповання пояснюється і значна кислотність кінцевої ацетіленової групи. Ацетілен на 18 порядків більш сильна кислота, чим етілен, і тільки на 6 порядків більш слабка, чим вода. Нижче
приводяться наближені значення їхніх констант дисоціації: |
|
||||
Кислота ... . . СНзСООН Н2О |
С2H5ОН |
С2H2 С2H4 |
С2Н6 |
||
Кдис с ,... .. |
2*10-5 |
10-16 |
10-18 |
10-22 10-40 |
10-40 |
Причиною |
кислотних |
властивостей |
ацетілену є |
сильна поляризація |
|
зв'язку С—Н завдяки тому, що в sp-гібридній формі вуглецевий атом значно сильніше утримує електрони, чим у sp2- і sp3-гібридних формах. Отже, електронна пару С—Н - звязку в молекулі ацетілену ближче до ядра вуглецю, чим у випадку етілену, і атом водню більш позитивно поляризований.
1. Гідрування. Водень приєднується до потрійного зв'язку у присутності тих же каталізаторів, що і за місцем подвійного зв'язку:
Реакція ця йде повільніше, чим в аналогічно побудованих олефінах. Проте в суміші олефіну й ацетілену в першу чергу гідрується ацетілен, тому що ацетілени легше адсорбуються на поверхні каталізатора і не допускають на нього молекули этілену. Ця обставина дозволяє проводити селективне гідрування ацетіленів в олефіни на палладію, а вже потім при необхідності олефіни гидруються до парафінів.
При гідруванні ацетиленів можна добути цис- і трансалкени в залежності від
