
конспекты / ------------------
.pdf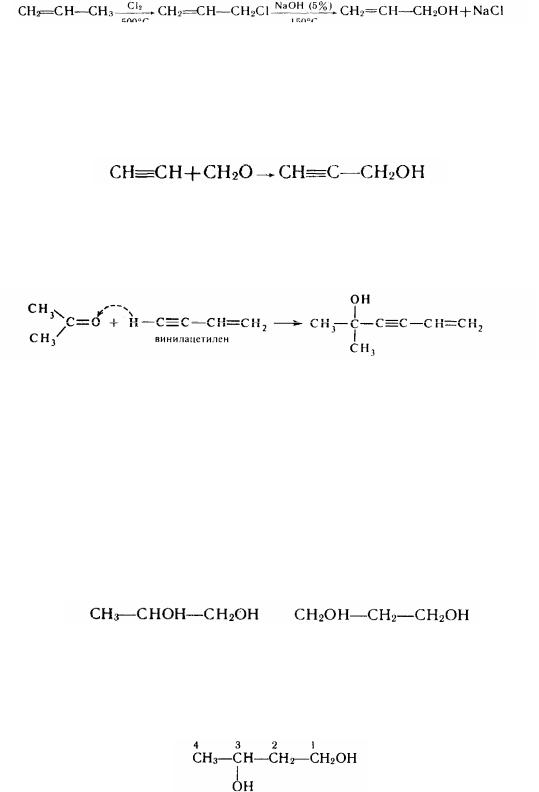
91
Ненасичений спирт із гідроксильної групою при вуглеці зі звичайним зв'язком - алліловий спирт СН2===СН—СН2ОН (радикал СН2=СН—СН2—— алліл) - продукт стійкий. Його хімічні властивості визначаються наявністю гідроксильної групи і подвійного зв'язку. Алліловий спирт звичайно одержують із пропілена через хлористий алліл:
хлористий алліл |
аліловий спирт |
Його використовують для синтезу гліцерину, акролеіну й акрилової кислоти; можна застосовувати як домішку для уповільнення тужавлення бетонної суміші. Існують ненасичені спирти з потрійним зв'язком - похідні ацетилену. Наприклад, пропаргіловий спирт, або пропінол СН С—СН20Н, одержують при конденсації ацетилену з формальдегідом:
Він виявляє властивості як ацетилену, так і первинного спирту.
Ще більш ненасичений спирт, що містить одночасно потрійний і подвійний зв'язки, - диметилвинилацетиленилметанол. Цей третинний спирт утворюється з винилу ацетілену й ацетону у присутності порошкоподібного гідроксиду калію:
Полімеризацією цього спирту И.Н.Назаров одержав універсальний клей, спроможний міцно склеювати дерево, цеглина, метали, скло, кераміку .
БАГАТОАТОМНІ СПИРТИ
Двохатомні спирти (гліколі, або алкандіоли)
Гліколі - спирти з двома гидроксильними групами при різних вуглецевих атомах. Загальна формула таких спиртів СnН2n(ОН)2.
Ізомерія двохатомних спиртів залежить від будови вуглецевого ланцюга і розташування в ній двох гідроксильних груп:
пропандіол-1,2 иропандиил-1,3
Назви цих спиртів за раціональною номенклатурою виходять від назв відповідних етіленових вуглеводнів із додаванням слова «гліколь». За систематичною номенклатурою до назви насиченого вуглеводня додають суфікс - діол, а цифрами вказують місце гідроксилу в головному ланцюзі:
бутандіол-1,3
Для одержання гліколей можна застосовувати ті ж засоби, що і для одноатомних
92
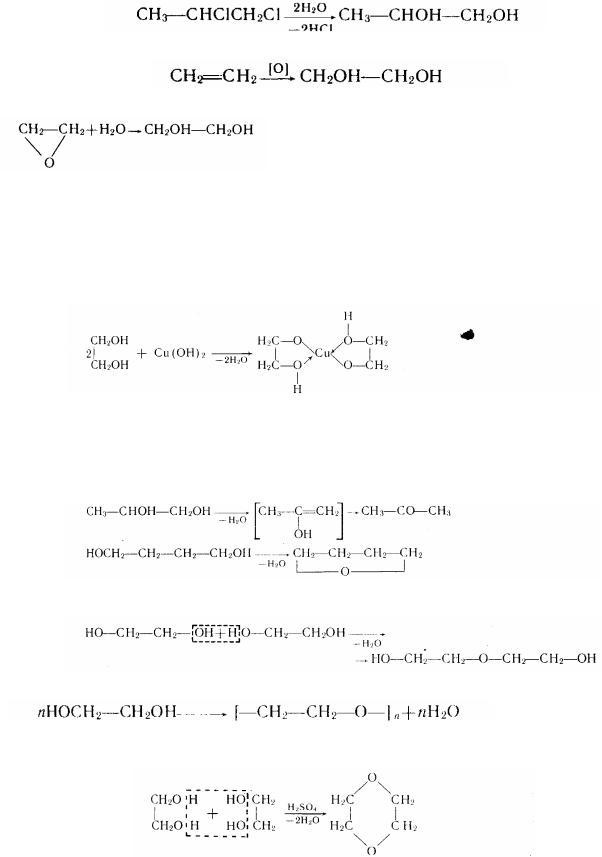
спиртів. Наприклад, вони утворюються при гідролізі дігалогенопохідних:
а також при окисленні етіленових вуглеводнів:
Этіленгліколь можна одержати гідратацією оксиду етілену:
Найпростішим представником двохатомних спиртів є этіленгліколь.
Хімічні реакції гліколей торкаються одну або дві гідроксильні групи. Утворення гліколятов. На відміну від одноатомних спиртів двохатомні легко
вступають у взаємодію не тільки з лужними металами, але і з гідроксидами важких металів:
гліколят міді (комплексне з'єднання)
Утворення продуктів дегідратації. Відщеплення води від гліколей може мати внутрімолекулярний і міжмолекулярній характер. Це залежить від умов реакції. Наприклад, при внутримолекулярної дегідратації можуть утворитися такі продукти:
Міжмолекулярна дегідратація перебігає в такий спосіб:
Цей процес може йти і далі - з утворенням полімеру:
При меж молекулярної дегідратації утворюється |
циклічний |
продукт |
- |
діоксан: |
|
|
|
Утворення простих і складаних ефірів:

93
Этіленгліколь із двухосновними кислотами утворить високомолекулярні сполуки. Наприклад, із этіленгліколю і терефталевої кислоти одержують полімер, використовуваний для виробництва цінного волокна - лавсану.
Заміна гідроксильних груп на галоген:
Діючи на этіленгліколь РС15 або SОСl2, можна замінити на галогени два гідроксила й одержати вицинальне дігалогенопохідне.
Окислення. При окисленні етіленгликоля утворюється ряд продуктів:
Пінаколинове перегрупування. Двохатомний третинний спирт - пінакон (2,3-
діметилбутандіол-2,3) у присутності сірчаної кислоти спроможний перегруповуватися в кетон - пінаколин:
Трьохатомні спирти (алкантріоли)
Ці спирти містять три гідроксильні групи при різних вуглецевих атомах. Їхня загальна формула СnH2n-1(ОН)з. Найпростішим представником трьохатомних спиртів є гліцерин (пропан-триол-1,2,3) НОСН2—СНОН—СН2OН.
Ізомерія трьохатомних спиртів, як і гліколей, залежить від будови ланцюга і положення в ній трьох гідроксильних груп.
Нази цих спирти за систематичною номенклатурою, складаються до назв насичених вуглеводнів добавляти суфікс -тріол.
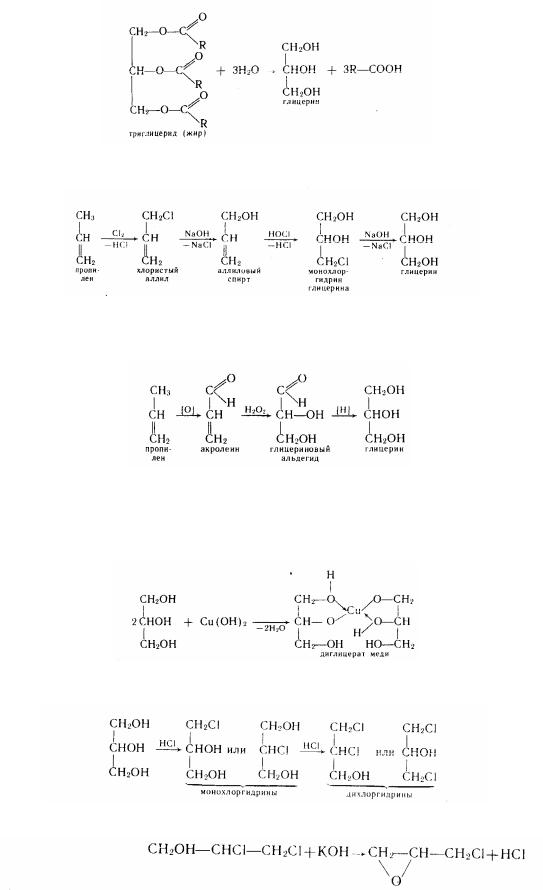
Одержують гліцерин омилєнієм рослинних або тваринних жирів при лужних або кислих каталізаторів:
94
або з пропілену:
Процес добування гліцерину можна зводити до окислення пропіленуа у присутності каталізатору (Сu2О) при високій температурі:
У хімічному відношенні гліцерин багато в чому нагадує етіленгликоль. Утворення гліцератів. Гліцерин, як і гліколі, утворює металеві похідні з
лужними металами і з гідроксидами важких металів:
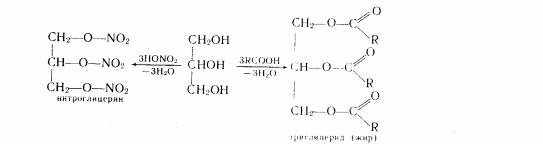
Заміна гідроксильних груп на галогени. При взаємодії гліцерину з хлороводнем можуть утворюватися моно- і діхлоргидрини:
Діючи на діхлоргідрини гідроксидом калію, одержують епіхлоргідрин:
Епіхлоргідрин є вихідним продуктом для одержання епоксидних полімерів. Продукт конденсації епіхлоргідрину з алкіленполіаміном або поліалкиленполіаміном може вводитися в будівельний матеріал для запобігання
95
або зниження вицвітів на бетоні, будівельному розчині, цегельній кладці, асбестоцементу й ін.
Утворення складних ефірів. Органічні і мінеральні кислоти з гліцерином дають складні ефіри:
Нітрогліцерин - оліїста рідина, що володіє величезною вибуховою силою. Вибух може відбутися навіть від найменшого поштовху або нагрівання. Для практичного застосування нітрогліцерину (із метою підвищення безпеки при роботі з ним) його перекладають у динаміту, просочуючи нітрогліцерином інфузорну землю або деревну муку. У виді 1 %-ного спиртового розчину нітрогліцерин застосовується в медицині в якості судинорозширювальної дії.
Окислення. При окисленні гліцерину утворюються різноманітні продукти: гліцериновий альдегід СН2ОН—СНОН—СНО, дігідроксиацетон НОСН2—СО— СН2ОН, щавлева кислота НООС—СООН і ін.
Окремі представники багатоатомних спиртів
Этіленгліколь (этандіол) СН2ОН—СН2ОН - безбарвна грузла рідина, розчинна у воді і багатьох органічних розчинниках (спирті, ацетоні й ін.). Этіленгліколь має більш кислі властивості, чим етиловий спирт. Широко використовується в хімічній промисловості. Водяні розчини этіленгліколя застосовуються як антифризи (незамерзаючих при низькій температурі рідин) для охолодження автомобільних двигунів у зимовий період. Наприклад, 50%-ний водяний розчин этіленгліколю замерзає тільки при —34°С.
Гліцерин (пропантриол-1,2,3) СН2ОН—СНОН—СН2ОН - грузла гігроскопічна нетоксична рідина (кипить при 290Со з розкладанням), солодкувата на смак. Мішається з водою в усіх відношеннях. Використовується для виробництва вибухових речовин, для виготовлення антифризів і поліефірних полімерів. Застосовується також у парфумерії, шкіряної, текстильної і харчової промисловості.
На основі багатоатомних спиртів і їхній похідних -(етіленгликоль, гліцерин, этіленхлоргидрин, монохлоргидрин і ін.) і оксидів деяких металів (свинцю, кальцію й ін.) можна одержувати безобжигові цементи. Тривкість деяких із них досить значна.
ЛЕКЦІЯ № 8
АЛЬДЕГІДИ (АЛКАНАЛІ) І КЕТОНЫ (АЛКАНОНИ)
Альдегіди і кетони - похідні вуглеводнів, у яких утримується одна або більш
96
карбонильних груп С=0. Карбонильна група іноді називається оксогрупой, тому ці сполуки часто називають оксосполуками.
Якщо карбонильна група пов'язана з одним радикалом і водянем, то такі сполуки називаються альдегідами. Виняток складає мурашиний альдегід (формальдегід)

97
,
у який карбонільна група пов'язана з двома атрмами водню. Загальна формула альдегідов,
Сполуки, у яких карбонільна група зв’язана з двома однаковими або різними радикалами, називаються кетонами.Загальна формула їх R—СО—R`. Тому групу С=О називають ще і кетогрупою.  У залежності від характеру радикалів, пов'язаних із карбонільною групою,
У залежності від характеру радикалів, пов'язаних із карбонільною групою,
альдегіді і кетони можуть бути насиченими і ненасиченими. За природою альдегіди і кетони мають багато загального, що виявляється в їхніх хімічних властивостях. Тому розглядати ці сполуки зручно разом, співставляючи і підкреслюючи подібність і розходження між ними.
Номенклатура і ізомерія насичених альдегідів і кетонів
Назви складаються з кислот, у які вони переходять при окисленні. Наприклад:
пропіоновий альдегід
Відповідно до систематичної номенклатури назви альдегідів будують так: до назв відповідних алканів добавляють суфікс -аль, а нумерацію починають від альдегідної групи. Іноді для зручності утворення назв альдегідів із радикалами складної будови їх розглядають як похідні оцтового альдегіду, наприклад:
діметилоцтовий альдегід, 2-етилпропаналь
При назві кетонів використовують як раціональну, так і систематичну номенклатуру. За раціональною номенклатурою спочатку називають радикали, пов'язані з карбонільною групою, а потім добавляють слово «кетон». За систематичною - до назви насиченого вуглеводню додають суфікс -он із указівкою місця карбонільною групи. При цьому нумерацію починають від найближчого до карбонілу кінця ланцюга:
метил ізопропилкетон, |
етил -трет- бутилкетон, |
З-метилбутанон-2 |
2,2-диметилпентанон-З |
Деякі кетони мають тривіальні назви; наприклад, діметилкетон (пропанон) СНз— СО—СНз називають ацетоном.
Ізомерія альдегідів і кетонів обумовлена будовою вуглецевоводневих радикалів, пов'язаних із карбонільною групою, а у випадку кетонів - ще і положенням цієї групи у вуглецевому ланцюзі. Ізомерія альдегідів починається з

98
четвертого члена гомологічного ряду:
н- масляний альдегід, |
ізомасляний альдегід, |
бутаналь |
2-метилпропаналь |
З цих двох ізомерів один - нормальної будови, інший - ізобудови. У валеріанового альдегіду (із п'ятьма вуглецевими атомами) чотири ізомера: один із нормальним, три інші з розгалуженою будовою ланцюга:
|
валеріановій альдегід, |
метилетилоцтовий альдегід, пентаналь |
. |
2-метилбутаналь |
|
ізовалеріановий альдегід, |
триметилоцтовий альдегід, |
3-метилбутаналь |
2,2-диметилпропаналь |
Ізомерія кетонів починається зі сполук, що містять п'ять вуглецевих атомів:
метилпропилкетон, |
диэтилкетон, пентанон-3 |
пентанон-2 |
|
|
метилізопропілкетон, З-метилбутанон-2 |
Засоби добування альдегідів і кетонів
1. Окислення спиртів.
Окислення можна проводити в рідкій і газовій фазах. У першому випадку як окислювачи використовують хромову суміш або розчини перманганату калію. У другому - кисень повітря і каталізатор, а процес проводять при підвищеній температурі:
Цей засіб одержання пояснює самому суть назви «альдегід». Альдегід - це продукт дегідрування спирту, від якого «відняли» водень).
2. Оксо-синтез—пряме приєднання СО і Н2 до олефінам:
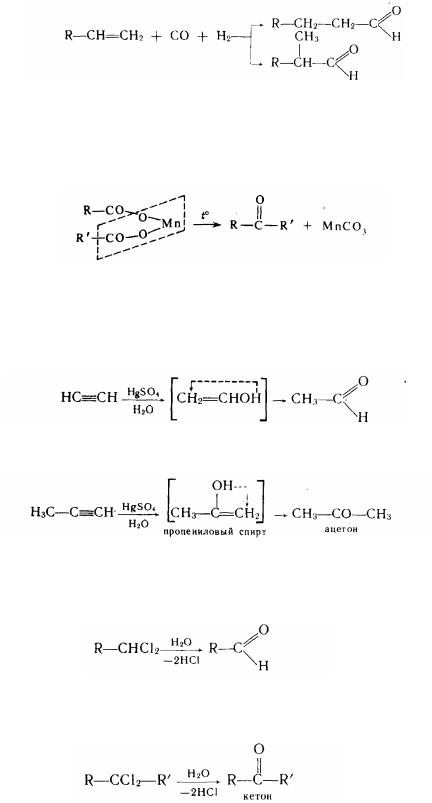
99
Так одержують альдегіди в промисловості. Реакцію проводять при нагріванні (100~200°С) і тиску (до 19,6 МПа) з каталізатором (СО +Тh02+Мg).
3. Одержання з кислот. При пропусканні суміші карбонових кислот над каталізатором (МпО2 или Тh02) при високій температурі утворюються їхні солі, що потім піддаються піролізу:
Характер продуктів, що утворилися, залежить від будови радикалів кислот. При однакових радикалах утворюються симетричні кетони, при різних - несиметричні. Якщо одна з узятих кислот мурашина (R=Н), ті утворюються альдегіди.
4. Гідратація ацетілену і його гомологів (реакція М.Г.Кучерова). При гідратації ацетілену утвориться оцтовий альдегід:
оцтовий альдегід
При гідратації гомологів ацетилену утворюються кетони:
Реакції перебігають через утворення проміжних хитливих ненасичених спиртів. 5. Гідроліз дігалогенпохідних. При гідролізі дігалогенпохідних в останнього
вуглецевого атома можна одержати альдегіди:
альдегід
Якщо два галогени знаходяться в одного із середніх атомів вуглецю, то гідроліз таких дігалогенпохідних призводить до утворення кетонів:
Існують і інші засоби одержання альдегідів і кетонів, що будуть розглянуті у відповідних розділах.
Фізичні властивості
Мурашиний альдегід - газ, гомологи альдегідів - рідини, а вищі альдегіди - тверді тіла. Ацетон і такі представники гомологічного ряду кетонів - рідини, а вищі кетони -тверді сполуки. Температура кипіння альдегідів і кетонів нижче температур кипіння відповідних первинних і вторинних спиртів.

100
Мурашиний і оцтовий альдегіди, а також кетони з невеликою молекулярною масою розчинні у воді. Зі збільшенням молекулярної маси розчинність цих сполук зменшується. Всі альдегіди і кетони добре розчинені в органічних розчинниках (спирті, ефірі й ін.).
В ІК-спектрах валентне коливання карбонильною групи характеризується інтенсивною смугою в області 1740-1720 см-1 (для альдегідів) і 1725-1705 см-1 (для кетонів). В УФ-спектрі альдегідів і кетонів смуга поглинання в області 280 нм.
Фізичні характеристики деяких альдегідів і кетонів подані в табл. 9.
Таблиця 9. Фізичні властивості деяких альдегідів і кетонів
Хімічні властивості
Альдегіди і кетони – реакційноздатні сполуки, що вступають у численні реакції. Хімічна активність альдегідів і кетонів визначається карбонільною групою - однієї з найбільш активних функційних груп. Подвійний зв'язок цієї групи, як і в етіленових вуглеводнях, складається з одного - і одного -зв'язку (малий. 16). Проте на відміну від звичайного подвійний вуглець-вуглецевого зв'язку подвійний зв'язок у карбонільною групі сильно поляризований. Причина цього - у різниці электронегативностей атомів кисню і вуглецю. У результаті відбувається зсув л-електронної щільності убік атома кисню:
Така поляризація подвійного зв'язку визначає значний електричний момент диполя карбонільною групи, що дорівнює ≈ 9*10-30 Кл*м (2,7D). Усе це є причиною високої реакційної спроможності альдегідів і кетонів, що виявляється насамперед у реакціях нуклеофільного приєднання. При цьому вуглець карбонільною групи виявляє электрофільний, а кисень - нуклеофільний характер.
Основними типами хімічних реакцій альдегідів і кетонів є реакції приєднання до карбонільної групи, заміщення, окислювання, полімерізації і конденсації.
Реакції приєднання за подвійним зв'язком карбонильної групи.
