
конспекты / ------------------
.pdf
41
кислоти, А120з, ZпС12 і ін. (жидкофазний засіб):
Мал. 13. Моделі просторових (геометричних) ізомерів бутену-2:
а - цис-ізомер; б - транс-ізомер
Можна також отримати етілен, пропускаючи пару спирту понад А20з при 380— 400°С (парофазная дегидратація):
При дегидратації спиртів атом водню найбільше легко отщіплюється від найменш гидрогенізованого атому вуглеця, тобто вторинного або третинного (правило А. М. Зайцева):
4. Алкени одержують відібранням галогеноводнів від галогеналканів при дії на них спиртового або твердого (здрібненого) гидроксиду калію (дегидрогалогенування):
(спирт, р-р) |
2-метилпропен-1 |
Відповідно до правила А. М. Зайцева водень відщеплюється від найменш гидрогенізованого атому вуглеця.
Чим стійкіше алкен , що утвориться, тим легше він утворюється в реакції дегидрогалогенування. За стійкістю алкени можна розташувати в такий ряд:
5.Дегалогенування (дією Zn або Мg) дигалогенпохідних з атомами галогену при сусідніх вуглецевих атомах:
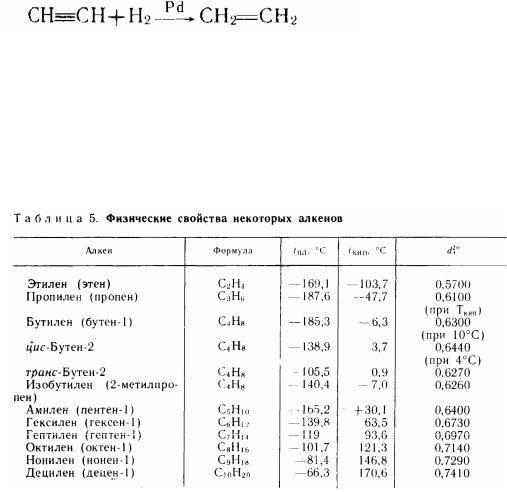
6.Селективним гідруванням на каталізаторі:
42
Фізичні властивості
Перші три представники гомологичного ряду етилену - гази; починаючи із С5Н10 (амілен, або пентен-1) - рідини, а із С18Н36— тверді речовини. Зі збільшенням молекулярної маси підвищуються температура плавлення і кипіння. Алкени з вуглецевим ланцюгом нормальної будівлі киплять при більш високій температурі, чим їхні ізомери. Температура кипіння цис-ізомеров вище, чим транс-ізомеров, а температура плавлення - навпаки.(табл.5)
Алкени погано розчинені у воді (проте краще, чим відповідні алкани). Вони добре розчиняються в органічних розчинниках. Етілен і пропіілен горять полум'ям, що коптить.
У ІК-спектрах подвійний зв'язок у моноалкенах виявляється в області 16801640 см-1. Смуга деформаційного коливання С—Н для трансізомерів знаходиться в області 965 см-1 а для цис-ізомеров - в області 700 см-1 . В УФспектрі алкени поглинають при 165-200 нм.
Хімічні властивості
Хімічні властивості олефінів визначає подвійний вуглець-вуглецевий зв'язок. При дії на подвійний зв'язок різноманітних реагентів розривається π -зв'язок, як найменш тривкий і більш реакціонздатний. Це пояснюється тим, що π -електрони більш доступні для электрофильного реагенту, чим електрони простого σ -зв'язку. У результаті такого валентності вуглецевих атомів , що звільнилися, потім витрачаються на приєднання атомів або груп атомів молекули реагенту. Приєднання до подвійного вуглець вуглецевого зв'язку в більшості випадків носить електрофільный характер (АE); при цьому подвійний зв'язок, як донором електронів, виявляє нуклеофільні властивості.
Реакції приєднання.
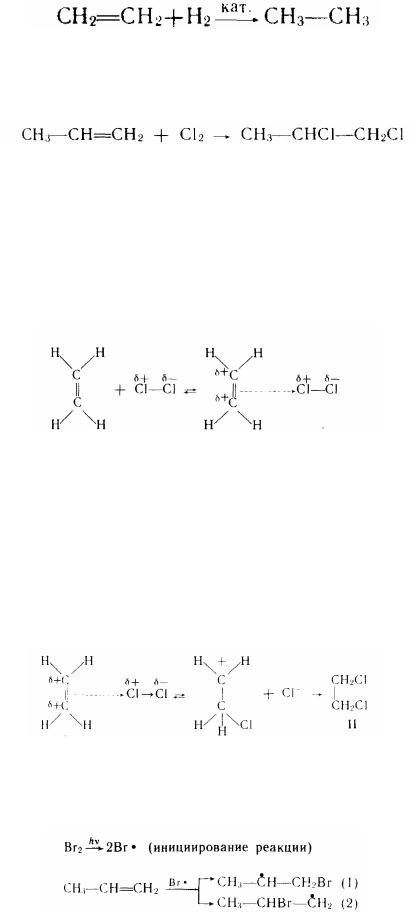
1. Гідрування (приєднання водню). Алкени, приєднуючи водень на
43
каталізаторі (Рt або Рd) при нормальній температурі, переходять у насичені, або алканові, вуглеводні:
Якщо в якості каталізатора використовують мілкоподріблений нікель, то реакція йде при температурі 150—300°С (реакція Сабатье).
2. Галогенування (приєднання галогенів). До олефінам легко приєднуються галогени. При цьому утворюються генопроизводні:
пропилен |
1,2-дихлорпропан |
Легше йде приєднання хлору, сутужніше - йоду. Реакції звичайно проходять у газовій фазі або в розчинах алкенів у чьотиреххлористом вуглеці або хлороформі.
Механізм електрофільного приєднання:
Приєднання галогенів у залежності від умов реакції може перебігати як по іонному, так і радикальному механізмі. У першому випадку під впливом л- электронвв алкена спочатку відбувається поляризація молекули галогену:
л-комплекс (I)
При цьому электрофільна частка галогену (СГ) утворює із л-електронною хмарою подвійного зв'язку хитливу систему—л-комплекс (I) —за рахунок «перекачування» л-электронной щільності на галоген, що несе частковий позитивний заряд.
л-комплекс , що утворився , (I) перегруповується потім у карбоніевий іон, що містить галоген. Відбувається остаточне зв'язування атому галогену з одночасним звільненням іншого атома у вигляді аніону, що, приєднуючись до карбкатиону, утворить кінцевий продукт реакції (II):
л-комплекс |
карбоніевий іон |
дихлоретан |
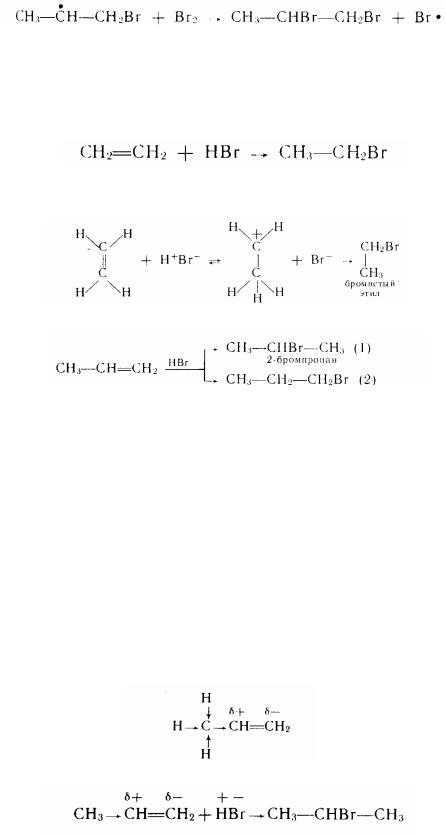
Під дією світла і підвищеної температури або при дії пероксидів реакція приєднання галогенів може носити радикальний характер:
44
Приєднання за радикальним механізмом перебігає через утворення найбільш стійкого вільного радикалу. Радикал (1) у результаті сполучення вільного електрона з електронами п'ятьох С-Н-связей буде більш стійким» чим (2). При його взаємодії з галогеном утворюється дигалогенпохідне:
Реакції галогенування алкенів широко використовуються в промисловості. Реакція з бромом (бромною водою) застосовується для виявлення ненасичених вуглеводнів (якісна реакція).
3. Гидрогалогенуванняє |
(приєднання |
галогеноводнів). До олефінам легко |
приєднуються галогеноводні: |
|
|
Ця реакція перебігає також у дві стадії. Спочатку утворюється карбкатіон, до якого приєднується аніон галогену:
У випадку несиметричних алкенів приєднання може йти по-різному:
1-бромпропан
В. В. Марковников, вивчаючи реакції приєднання галогеноводнів до алкенів,
установив таку закономірність: при іонному приєднанні галогеноводнів до несиметричних олефінів (при звичайних умовах) водень приєднується за місцем подвійного зв'язку до найбільше гидрогенизованого (пов'язаного з найбільшим числом водневих атомів) атому вуглецю, а галоген - до менше гидрогенизиваного
(правило Марковникова). Таким чином, приєднання у вищенаведеному рівнянні реакції йде за схемою (1). З позиції електронної теорії правило Марковникова можна пояснити в такий спосіб. Пропілен, наприклад, у результаті перерозподіли електронної щільності усередині молекули являє собою електричний диполь, момент якого дорівнює 1,16*10-30Кл-м. Такий перерозподіл відбувається під впливом метильної групи, що виявляє +1-ефект, викликаний розходженням у электронегативних атомів вуглецю в sp3 - і sp2 -станах. У результаті відбувається зсув електронної хмари л-связи убік крайнього ненасиченого вуглецевого атома:
При взаємодії такої молекули з галогеноводородом приєднання йде за схемою
Правило Марковникова можна пояснити інакше. У результаті двохстадійного

45
електрофільного приєднання утворююються проміжні продукти різноманітні за стійкістю карбкатіони:
З них найбільше стійкі перші. Таким чином, реакції электрофільного приєднання по подвійному зв'язку йдуть у напрямку утворення найбільш стійкого проміжного карбоніевого іона.
Проте спостерігається і відхилення від правила Марковникова. Так якщо реакція йде за радикальним механізмом (у присутності пероксидних сполук або кисню), то, як показав М. Хараш, порядок приєднання бромоводню буде оберненим правилу Марковникова («пероксидний ефект» Хараша):
Пероксидний ефект має місце тільки у випадку приєднання бромоводню. При приєднанні до алкенів НF, Н2, Н2S04, Н20 і частково НС1 пероксиди не впливають на напрямок приєднання
4. Гідратація (приєднання води). У присутності каталізаторів (конц. Н2SO4, ZnС12 і ін.) до алкенів приєднується вода з утворенням спиртів. Реакція йде відповідно до правила Марковникова:
Сірчанокислий метод гидратації алкенів має ряд хиб (корозія апаратури, витрата сірчаної кислоти і труднощі її регенерації і т.д.). Тому частіше застосовується пряма гідратація з використанням каталізатору НзР04 (на носії) або Аl2Оз:
5. Алкілування алканов алкенами. Алкілування - реакція, за допомогою якої можна вводити різноманітні вуглеводні радикали (алкили) у молекули багатьох органічних сполук.
Для алкілування використовують галогеналкіли, ненасичені вуглеводні, спирти й інші органічні речовини. Наприклад, з концентрованою сірчаною кислотою активно перебігає реакція алкілування ізобутана ізобутіленом:
ізобутан ізобутилен ізооктан (2,2,4-триметилпентан)
Реакція алкілування алканів алкенами може служити для одержання високооктанових компонентів моторного палива.
Реакції полімерізації. Реакція полімерізації алкенів уперше була відкрита

46
О.М.Бутлеровим. Ця реакція дозволяє одержувати різноманітні високомолекулярні сполукі. Наприклад:
СН2=СН2 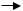 [ —СН2—СН2—]n поліетілен
[ —СН2—СН2—]n поліетілен
Докладно ця реакція полімеризації буде розглянуто у відповідному розділі.
Реакції окислення. Алкени досить легко окисляються. Продукти, утворені при цьому, і їхня будова залежать в основному від природи вихідних алкенів і від умов проведення реакції. Горіння (процес енергійного і повного окислення на повітрі), наприклад, етілену можна висловити таким рівнянням:
СН2=СН2 + ЗО2 2С02 + 2Н20
При дії на етілен водяного розчину КМn04 при нагріванні подвійний зв'язок також розривається:
СН2=СН2 + КМn04 2СО2 + Мn02 + 4КОН
2СО2 + Мn02 + 4КОН
Розщіплення молекули алкену по місцю подвійного зв'язку викликають і більш енергійні окислювачі (наприклад, кислий розчин КМn04, хромова суміш, НNОз):
R—СН=СН—R 2OH 2R─СООН
карбонова кислота
Якщо розведеним водяним розчином КМn04 діяти на етілен при звичайній температурі, то він перетворюється в двохатомний спирт - етіленгликоль - реакція Е. Е. Вагнера:
ЗСН2=СН2 + 2КМn04 + 4Н20 = ЗСН20Н—СН20Н + 2Мn02 + 2КОН
етиленгліколь
При окисленні етілену киснем повітря (кат. металеве срібло) утвориться оксид етілену:
оксид етілену 6. Особливий інтерес подає реакція озонування алкенов. Ця реакція відноситься до
реакцій розщеплення алкенів. У результаті відбувається розрив подвійного зв'язку з утворенням озонідов, що при гидролізі утворять альдегіди або кетони (реакція Гарриеса):
Озоніди - вибухові речовини, тому їх звичайно не виділяють у вільному стані, а розлагають водою у присутності цинку, щоб альдегіди не окислялися пероксидом водню.
47
ЛЕКЦІЯ № 4
ДІЄНОВІ ВУГЛЕВОДНІ (АЛКАДІЄНИ, АБО ДІОЛЕФІНИ)
Ненасичені сполуки, що містять у молекулі два подвійні зв'язки, називаються дієновими вуглеводнями. Їх називають також алкадієнами або діолефінами.
Загальна формула таких з'єднань
Номенклатура і ізомерія. Класифікація
За систематичною номенклатурою дієнові вуглеводні називають так саме, як і етіленові, замінюючи суфікс -єн на -дієн (два подвійні зв'язки). Положення кожного подвійного зв'язку позначають цифрою. Нумерацію роблять так, щоб ці цифри мали менший порядковий номер:
|
2-метилбутадиен-1,3 |
3-метилбутадиен-1,2 |
. |
(ізопрен) |
(несим. диметилаллен) |
|
|
Досить часто застосовуються раціональні і тривіальні назви (наприклад, дівинил, ізопрен і т.д.).
Властивості дієнових вуглеводнів визначаються їхньою будовою і, у першу чергу взаємним розташуванням двох подвійних зв'язків у молекулі. Якщо ці зв'язки розташовані поруч, то вони називаються кумулірованими або алленовими: СН2=С=СН2 [пропадієн (аллен)]. Два подвійні зв'язки можуть бути розділені одним простим зв'язком. Такі зв'язки називаються супряжінними або конъюгированими: СН2=СН—СН=СН2 [бутадиен-1,3 (дівинил)]. Дієни, у молекулах яких подвійні зв'язки розділені двома або декількома простими зв'язками, називаються дієнами з ізольованими, або несупряжінними, зв'язками:
СН2=СН—СН2—СН2—СН2—СН==СН2 (гептадієн-1,6).
З цих трьох видів дієнових вуглеводнів найбільше значення мають дієни зі супряжінними подвійними зв'язками. Вони спроможні полімерізуватися й утворювати цінні полімерні матеріали.
Засоби добування
Роздивимося деякі засоби добування найбільш важливих представників дієнових вуглеводнів - похідних алкадієнів-1,3.
1.Дівинил і ізопрен у невеличких кількостях можуть бути виділені з продуктів піролізу нафти.
2.Основний промисловий засіб одержання бутадієна-1,3 (дівинила) складається в дегидрированії н-бутану або н-бутілену над хромоалюмініевим (оксид кульгава на оксиді алюмінію) каталізатором:

48
бутадієн-1,3
Дегідрированієм ізопентану або ізоаміленов (пентан-пентенової фракції газів крекінга нафти) одержують ізопрен:
Виробництво ізопрену - більш складаний процес, чим одержання бутадієна- 1,3, тому що в умовах дєгідрування можуть утворюватися різні ізомері.
3. Дівинил і ізопрен одержують також дегідратацієй гликолей:
4. Вперше в СРСР дівинил був отриманий методом каталітичного перетворення етилового спирту по С. В. Лебедєву (1931). Цей метод був потім призначений в основу промислового синтезу дівинила. Процес протікає з
застосуванням каталізаторів , що дегидратирующе-дегидрируют , (МgО-Zn0) при 450о С:
5. Метод Принса:
По цій реакції в промисловості одержують і ізопрен (М. И. Фарбер, М. С. Нємцов):

49
6. Ізопрен можна одержувати з ацетону й ацетилену по методу А. Е. Фаворского.
Фізичні властивості
Деякі фізичні властивості дієнових вуглеводнів подані в табл. 6.
Загальні закономірності, властиві для гомологичних рядів, просліджуються і для дієнових вуглеводнів.
У ИК-спектрах сполучення двох подвійних зв'язків призводить до появи інтенсивних смуг поглинання в області 16501600 см-1. УФ-поглинання бутадієну виявляється в області 217 нм. Збільшення числа сполучених подвійних зв'язків викликає зсув максимуму поглинання у видиму область.
Хімічні властивості
Реакції приєднання. Дієни, що містять несопряженні подвійні зв'язки, поводяться як звичайні алкени. Приєднання йде незалежно до кожного з цих зв'язків. При цьому можуть затрачуваться дві молекули реагенту (галогену, галогеноводороду й ін.):
гексадієн-1,5 1, 2,5, тетрабромгексан У той же час дієнові вуглеводні зі сполученими подвійними зв'язками мають
настільки своєрідні властивості, що їх варто роздивитися особо. Такі вуглеводні відрізняються винятково високою реакційною спроможністю і значною стійкістю в порівнянні з дієнами, що містять кумулировані або ізольовані подвійні зв'язки. Ці з'єднання приєднують реагент не тільки по одному або двом окремим подвійним зв'язкам (1,2-приєднання), але і до протилежних кінців молекули (1,4-приєднання):
Вихід продуктів 1,4- або 1,2-приєднання визначається характером реагенту й умовами проведення реакції. Наприклад, приєднання бромоводорода в присутності пероксидних з'єднань йде в 1,4-положення, а в відсутності- у положення 1,2.
Водень у момент виділення приєднується в положення 1,4, а газоподібний водень над Ni гидрирує дієн до бутану або приєднується в положення 1,2:
50
бутен-1 Гипогалогенні кислоти приєднуються до дієнів переважно в 1,2-положення:
1 -бромбутен-З-ол-2 Якщо 1,2-приєднання не потребує особливого пояснення - воно випливає з
загальних властивостей непредельних вуглеводнів з одним подвійним зв'язком, то причина приєднання в положення 1,4 потребує в такому поясненні.
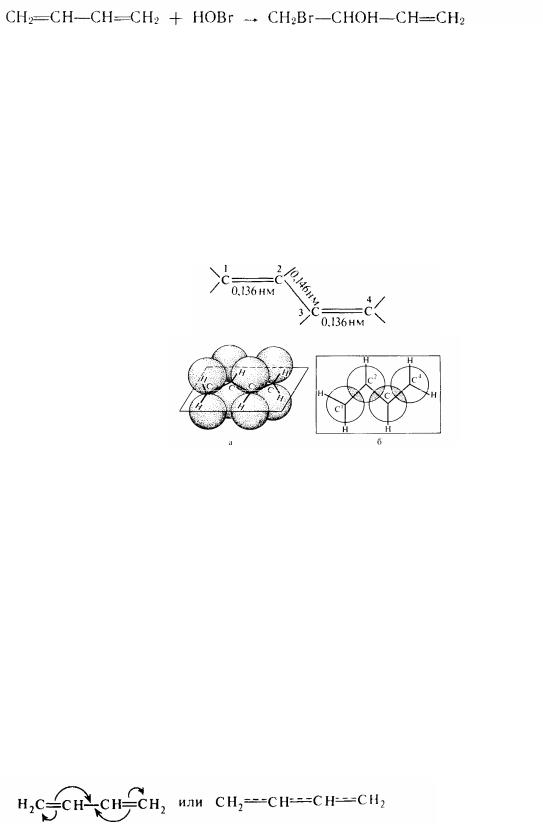
У результаті електронографічного дослідження бутадієна-1,3 було встановлено, що подвійні зв'язки між С' і С2, а також між С3 і С4 декілька довще, чим подвійний зв'язок у етілені. У той же час простий σ -зв'язок між С2 і С3 коротше звичайного - зв’язку в молекулі етану і по довжині декілько наближається до подвійний. Формулу молекули бутадієна-1,3 можна зобразити в такому виді:
Утворення -звязків у молекулі бутадієна-1,3 за рахунок перекривання 2рорбіталей: а - вигляд збоку; б - вид поверх
(порівняйте: довжина звичайної -связи дорівнює 0,154 нм, а етиленової— 0,134 нм). Таким чином, у цих системах намічається тенденція до вирівнювання довжин вуглерод-вуглеродних зв'язків. Встановлено також, що молекулабутадієна-1,3 плоска, тобто її атоми розташовані в одній площині. У інший же площині, перпендикулярної перший, знаходяться 2p-орбіталі всіх чотирьох вуглецевих атомів . У результаті відбувається перекривання електронних хмар не тільки між С1 і С2, С3 і С4, але і між С2 і С3 (в останньому випадку, правда, це перекривання декілька менше). Отже, у молекулі бутадієна- 1,3, що подає собою сполучену систему -електронів, немає «чистих» подвійних і простих зв'язків, а спостерігається досить рівномірний розподіл π -електронної щільності по всій молекулі з утворенням єдиної молекулярної орбітали. Схематично це можна уявити такою уявою:
Взаємодія двох або декількох сусідніх -звязків з утворенням єдиної хмари - электронів, у результаті чого може легко відбуватися передача взаємовпливу атомів цієї системи, як відомо, називається ефектом сполучення. Цей ефект сприяє зниженню загальної енергії молекули. Тому дієни зі сполученими
