
конспекты / ------------------
.pdf
31
вуглеводнів провів у 1888 р. М. И. Коновалов (ця реакція й одержала його ім'я), діючи на алкани розведеною (12-14%-ной) азотною кислотою при нагріванні
(~140°С):
2-нитробутан
Швидкість такого жидкофазного нітрування невелика і вихід нітросполук досить низький. Крім того, ця реакція супроводжується окислювальними процесами. Тому в промисловості нітросполуки одержують парафазним нітруванням (діючи "парами азотної кислоти при 250—500°С) Ця реакція супроводжується розривом молекул вуглеводнів по зв'язку С—С (крекингом) з утворенням мононитропохідних, що мають різноманітну довжину ланцюга.
Реакція нітрування алканів також перебігає за радикальним механізмом. Агентом , що нітрує , (ініціатором) є радикалоподібний диоксид азоту (NО2), що утворюється при участі азотистої кислоти, що завжди присутня в розведеній НNОз:
При нітруванні можуть утворюватися і побічні продукти -ефіри азотистої кислоти. У відсутності НN02 розведена азотна кислота не діє як нітрант.
Тому що велика частина (до 60%) азотної кислоти діє на алкани як окислювач, поряд із нітросполуками можуть утворюватися різноманітні кисневмісні сполуки (спирти, альдегіди, кетони, кислоти і т.д.) і навіть ненасичені сполуки. Докладніше дви. про нітросполуки .
3.Сульфування. Насичені вуглеводні при звичайних умовах стійкі до дії концентрованої сірчаної кислоти. При високій температурі вона діє як окислювач. При слабкому нагріванні сірчана кислота, що димить, сульфує алкани, тобто атом водню в них зміщується на сульфогрупу :
4.Сульфохлорування і сульфоокислення. Ці реакції мають велике практичне значення, тому що вони дозволяють одержувати сульфокислоті з 12-18 і вище атомами вуглецю, які застосовуються в основному у виробництві поверхневоактивних речовин (ПАВ). Реакція сульфохлорування була відкрита Ридом і - Хорном у 1936 р. Вона полягає в дії на алкани сумішшю диоксида сірки і хлору:
алкнлсуль фохлорид
У процесі як каталізатор використовують органічні пероксиди або діють УФвипромінюванням. Отже, сульфохлорування є ланцюговим вільнорадикальним процесом:

32
Сульфохлориди, що утворюються, при омиленні лугами дають солі сульфокислот:
У якості вихідного алкана можна використовувати газову фракцію нафти, що містить велику кількість вуглеводнів нормальної будови, або важкі фракції синтину (суміші синтетичних вуглеводнів).
Сульфокислоти можуть бути також отримані і реакцією сульфоокислення алканів:
Цю реакцію проводять, діючи УФ-випрмінюванням на суміш продуктів, що вводять у реакцію, або при каталізатора.
Реакції розщіплення.
З цих реакцій слід зазначити такі.
1.Відщеплення водню (дегідрування вуглеводнів).У присутності каталізатору
(наприклад, Сг20з) і при нагріванні насичених вуглеводнів за рахунок розриву зв'язку С—Н (відщеплення атомів водню) можна одержати ненасичені вуглеводні:
2.Реакції розщіплення за рахунок розриву С—С-звязку. Ці процеси йдуть при окисленні алканів і крекингу нафти.
Окислення алканів. Реакція окислення алканів широко використовується в промисловості. Окислення насичених вуглеводнів перебігає в газовій або рідкій фазі, можна одержати різноманітні кисневмісні сполуки: спирти, карбонові кислоти, альдегіди, кетони і т.д.
кислювання алканов - складаний багатостадійний автокаталитичний процес, що можна зобразити такою схемою:
У результаті реакції окислення можуть утворюватися малостійкі сполуки, що є джерелами вільних радикалів, які надалі прискорюють цю реакцію. Тому при безконтрольному процесі може утворитися зграбна суміш органічних сполук (складні ефіри, гидроксикислоти, різноманітні моно- і дікарбонові кислоти і т.д.) і навіть продукти горіння з утворенням діоксиду вуглецю і води. З огляду на це, процес окислення вищіх алканів проводять при температурі 110-130 С у
33
присутності солей марганцю (каталізатор). При цьому можна домогтися одержання тільки одного визначеного продукту (із невеличкими домішками). Наприклад, при каталітичному окисленні алканів нормальної будови одержують синтетичні жирні кислоти, що містять від до С1 до С20 і вище, а також синтетичні жирні спирти (С8-С25). Останні використовують для синтезу ПАВ типу
алкилсульфатов .
Окислення алканів перебігає за радикально-ланцюговим механізмом.
Нафта та її переробка
Одним із найважливіших джерел вуглеводнів є нафта, що широко поширена в природі. Значення нафти - «чорного золота» - у сучасній промисловості велике. Нафта - не тільки паливо, але і цінна хімічна сировина для одержання різноманітних органічних продуктів (ПАВ, пластмас, синтетичного каучуку, спиртів, кислот і багатьох інших).
Нафта являє собою складну суміш рідких і невеликої кількості твердих вуглеводнів різноманітної молекулярної маси. Вуглеводні, що входять до складу нафти, можна розділити на трьох групи: 1) насичені вуглеводні з прямим або розгалуженим ланцюгом (у нафті зустрічаються майже всі члени ряду метану ; 2) пяти- і шестичленні циклоалкани (нафтені) і їхні гомологи; 3) ароматичні вуглеводні (бензол і його гомологи).
Ненасичені вуглеводні (алкени) у природній нафті зустрічаються досить рідко (наприклад, вони утримуються в канадській нафті). Алкени в основному утворюються тільки при повторній переробці нафти. Таким чином, у залежності від складу всі нафти діляться головном чином на метанові, нафтенові й ароматичні.
Небажаною домішкою, що міститься в нафті, є сірка і її сполуки (тіоли, тіофен, сульфіди і дисульфіди). Вони викликають корозію металевих труб і апаратури для переробки нафти. У залежності від кількості сірки нафти поділяються на безсірчасті (з сіркою до 0,2%), малосірчаністі (більш 0,2-1 % сірки), сірчаністі (1 - 3% сірки) і високосірчасті (більш 3% сірки).
Нафти містять велику кількість високомолекулярних сполук: нафтових смол і асфальтенов (продуктів конденсації смол). Вміст смолисто-асфальтенових речовин може досягати 10-20%.
У сирій нафті міститься вода і розчинені в ній неорганічні солі (Са, Мg), а також гази (вуглеводні із С1—С5).
Після очищення нафти від цих речовин її перероблюють. Методи переробки можуть бути фізичними і хімічними. Первинним (основним) процесом переробки є пряма перегонка, тобто термічний поділ нафти на її складові частини-фракції (фізичний метод переробки). При цьому майже не відбувається розкладання (деструкції) вуглеводнів. Поділ заснований на різниці температур кипіння окремих нафтових фракцій, що мають різну молекулярну масу. При цьому одержують такі фракції:
а) бензинова (суміш вуглеводнів із С5—С10) - утворюється при нагріванні до 180°С. При більш ретельній разгонці ця фракція може бути розділена на газолін, або петролейній ефір (т. стосів. 40—70°С), власне бензин (т. стосів. 70—120°С) і
34
лигроін (т. стосів. 120—180°С). Слід зазначити, що перша фракція складає до 20% від загальної кількості нафти;
б) гаслова (суміш вуглеводнів із С10—С16). Кипить в інтервалі 180—270°С. У межах 165—200°С перегоняеться легка фракція гасу - уайт-спирит, що застосовується як розчинник для олійних фарб і інших цілей. При 230—300°С може бути отримане дизельне паливо (легкий газойль}. Гасову фракцію використовують як паливо для тракторів і реактивних двигунів;
в) третя фракція - залишок, названий мазутом, що являє собою суміш вуглеводнів із великим числом вуглецевих атомів. Подальшою разгонкою під вакуумом (щоб уникнути осмолення при високій температурі) або перегонкою з водяною парою із мазуту можна виділити деякі фракції, відомі під загальною назвою солярових масел (С12—С20). Ці олії застосовуються як моторне палива. Використовуючи перегонку з водяною парою або вакуумну перегонку, із деяких фракцій попередньої розгонки мазуту можна виділити мастила (С2о—С50) вазелін і суміш твердих вуглеводень-парафін (С19—С35).
Залишок після відгону з мазуту вищезгаданих фракцій називається гудроном (нафтовим пеком}, із якого виробляється бітум, що використовується у будівництві. Розчини різноманітних гудронів, що утворять атмосферо- і корозійні-стійкі покриття, застосовуються як замінники оліфи.
Розвинені авіація, автомобільна і тракторна промисловість потребують все більшої кількості бензину. Тому для збільшення його виходу деякі фракції прямої перегонки і мазут піддають повторній переробці, пов'язаної з частковим розкладанням (деструкцією) вуглеводнів. У цьому випадку мова йде про хімічні методи переробки нафти, що засновані на глибоких хімічних перетвореннях вуглеводнів під впливом температури, тиску і каталізаторів. Серед цих методів особливе значення мають різноманітні види крекінга. За допомогою крекінгу одержують із нафтових фракцій, що высоко кип`ять, (гасно, солярові олії, мазут) що низко кип`ять. Наприклад, вихід бензину із сирої нафти при крекінгі нафтопродуктів підвищується майже в три рази.
Розрізняють два основних типи крекінга, термічний і каталітичний. Термічний крекінг поділяють на жидкофазний (переробка важких фракцій і
залишків від переробки нафти, а також легких фракцій - лігроіну, гасу, газойля при 460560°С і тиску 20,26-70,91 • 105 Па) і парофазний (переробка гудрону, бітумів і крекінг залишків при 550—600°С при нормальному тиску). Якщо термічне розкладання проводять при більш високих температурах (700—800°С) і у відсутністі каталізаторів, то такий процес називається пиролізом. Він пов'язаний із більш глибокими змінами в молекулі вуглеводню аж до утворення елементарного вуглецю (вуглистого залишку, або коксу}.
Основними процесами при крекінгі є гомолітичний розрив вуглецевого ланцюга з одночасною ізомерізацією і циклізацією, а також дегидрогенізація вуглеводню з утворенням ненасичених сполук. Будова цих продуктів визначається будовою вихідного насиченого вуглеводня і технологічного режиму крекінга (температурою, тиском, часом перебування в зоні нагрівання, каталізатором). Наприклад, крекінг н-бутана в залежності від умов може йти з утворенням таких речовин:

35
Місце розриву вуглецевого ланцюга залежить від температури і тиски: із підвищенням температур розрив відбувається ближче до краю ланцюга з утворенням стійких вуглеводнів із короткими ланцюгами. З підвищенням тиску ланцюг розривається ближче до середини. Підвищення температури веде до збільшення швидкості процесу.
Термічний крекінг - вільнорадикальний процес. При високій температурі вуглеводні розпадаються на вільні радикали
R─СН2—СН2—R→2R-СН2
які спроможні розпадатися і далі з утворенням більш простих (метильних або этильних) радикалів. При сутичці останніх із молекулами алкану утворяться ненасичений вуглеводень і новий радикал шляхом відриву атома водню від повторного вуглецевого атома алкана і наступного розриву радикала по δ -зв'язку
Каталітичний крекінг перебігає у присутності каталізаторів (алюмосилікатов або хлориду алюмінію). Процес починається з відщіплення від алкану гидридиона (Н-) з утворенням карбкатиона, що розпадається потім на ненасичену сполуку й інший карбонієвий іон, але з меншим числом вуглецевих атомів:
Карбкатион, що утворився, може перетворитися в два продукти - ненасичену (при відщепленні протона) і насичену (при приєднанні гидрид-иона) сполуку:
Каталітичний крекінг - процес більш розроблений і перспективний. Він дозволяє одержувати не тільки насичені і ненасичені вуглеводні з більш короткими ланцюгами, але і вуглеводні ізостроенія. Це дає можливість одержувати бензини з більш високим октановим числом.
Окремі представники
Метан СН4 входить до складу болотного і рудничного газів (до 90%). У невеличких кількостях він утримується в розчиненому стані в нафті. Метан не володіє ні коліром, ні запахом, погано розчиняється у воді. При горінні дає майже безбарвне полум'я.
Метан використовується в основному яка дешеве паливо. З нього також одержують багато цінних хімічних продуктів: ацетилен, галогенопохідні, метиловий спирт (через синтез-газ, одержуваний окислюванням метану), формальдегід і ін. Метан використовується для виробництва газової сажі:
СН4+02→С+2Н20.
36
У лабораторних умовах метан одержують при прожарюванні суміші ацетату натрію з натронним вапном:
СНз—СОONа + NаОН— СН4 + Nа2СОз
При 850—1000°С при каталізатора (Ni) метан вступає у взаємодію з водяною парою, створюючи синтез-газ (суміш СО+Н2):
СН4+Н20←→СО+ЗН2 Синтез-газ - цінна сировина, що використовують для одержання спиртів,
альдегідів, кетонів і кислот.
Етан С2Нб добувають із нафтових і природних газів, у яких він міститься в кількості 5-10%. Етан не розчиняється у воді, горить слабко світлим полум'ям. Дегідруванням він перетворюється в етілен. Є дешевим джерелом спиртів, ефірів, синтетичного каучуку і т.д.
Пропан СзН8 міститься в природних газах і газах нафтопереробки. Дегідруванням із нього одержують пропілен. Суміш пропану і бутану використовується як паливо (побутовий газ, часто що транспортується в балонах).
Ізооктан С8Н18 (2,2,4-триметилпентан) - цінна складова частина високоякісного пального (бензину):
СН3 —С(СНз)2—СН2—СН(СН2)—СНз Моторне паливо повинно мати максимальну усталеність до детонації.
Детонація в двигунах внутрішнього горіння пов'язана з передчасним запаленням горючій суміші. Це викликає зниження потужності мотора і його передчасний знос.
Найбільш легко детонують вуглеводні нормальної будови, наприклад н-гептан, стійкість до детонації якого прийнята за нуль. Найменш детонують розгалужені вуглеводні, наприклад ізооктан. Його стійкість до детонації прийнята за 100. Тому якість усіх бензинів оцінюють за допомогою «октанового числа». Так, якщо октанове число бензину дорівнює 72, то це означає, що він поводитися так саме, як суміш 72% ізооктану і 28% н-гептану.
Підвищення детонаційної стійкості палива для двигунів внутрішнього горіння можна домогтися, додаючи до нього антидетонатори. До них відноситься тетраетилсвинець (ТЭС) РЬ(С2Н5)4 і ще більш ефективний – марганецорганична сполука типу С5Н5Мп(СО)з, що, на противагу ТЭС, не є отрутним і не забруднює повітря. Застосування цих антидетонаторів дозволяє одержувати паливо з октановим числом до 135.
Середні члени гомологічного ряду метану (С7—С17) використовуються як розчинники і моторне паливо.
Вищі алкани (С18—С44 ) застосовуються для виробництва вищих жирних кислот, синтетичних жирів, мастильних масел, пластифікаторів, ненасичених сполук, що використовуються у синтезі високомолекулярних речовин, ПАВ і ін.
Органічні в'яжучі - бітуми і дьогті
Бітуми - суміш високомолекулярних вуглеводнів, нафтенових і аромаричних сполук і їх похідних (кисневих, азотистих і сірчастих). Бітуми добувають в
37
основному з гудрону прямою перегонкою нафти, мазуту, крекінгу залишків. Вони поділяються на нафтові бітуми (одержувані при переробці нафти), природні і сланцеві (при переробці сланців без доступу повітря).
Дьогті складаються із суміші високомолекулярних ароматичних вуглеводнів і їх кисневий, азотистих і сірчастих похідних. У кам'яновугільному дьогті можуть міститься також бензол і толуол. Дьогті добувають при розкладанні вугілля, торфу, деревини й інших органічних речовин при високих температурах без доступу повітря.
Органічні в'яжучі цього типу можуть мати змішаний характер. Наприклад, дьогтебітумні в'язкі, що складаються із суміші кам'яновугільних (або сланцевих) дьогтів з нафтовими бітумами, і дьогтебітумнополімерні - суміш нафтових бітумів або кам'яновугільних дьогтів і полімерів. За призначенням ці органічні в'язкі діляться на нафтові бітуми будівельні, покрівельні, дорожні і кам'яновугільні дьогті дорожні та ін.
Бітумні і дьогтєві в'яжучі мають цілий комплекс корисних властивостей: вони термопластичні, водонепроникні, погодостійкі і є гарними ізоляторами, до того ж дьоготь, наприклад, гарний антисептик. Тому вони широко застосовуються в будівництві. Наприклад, при будівництві доріг використовується до 75% усього виробництва органічних в'яжучих. Це пояснюється тим, що дорожнє покриття з бетону на цих в'яжучих відрізняється високою ізносостійкістю, тривкістю в різноманітних кліматичних і погодних умовах і легкістю очищення дорожньої полотнини. Органічні в'яжучі на основі бітуму і дьогтю широко застосовуються також при спорудженні промислових будинків, як покрівельні, гідро-, тепло- і пароізоляційні покриття і матеріали. Наприклад, органічні в'яжучі, що володіють високої адгезіей до різноманітних матеріалів і гидрофобними властивостями, застосовують як гидроізоляційні обмазки для захисту фундаментів будинків, трубопроводів, траншей, водоймищ, басейнів і т.д. Бітум використовується в виробництві плит із мінеральної вати, що застосовуються для теплоізоляції будинків, холодильних установок і трубопроводів. Органічні в'яжучі можуть використовуватися для захисту від корозії металів, бетону у вигляді, наприклад, чорних лаків, при спорудженні захисту від радіоактивного випромінювання; застосовуються вони і для стабілізації грунтів. Не обходяться без органічних в'яжучих й інші області народного господарства, наприклад лакофарбова, нафтохімічна (виробництво пластмас), електротехнічна, металургійна й ін.
На основі бітуму і дьогтю роблять рулонні покрівельні і гідроізоляційні матеріали, що володіють прекрасними експлуатаційними властивостями (руберойд, толь, стеклорубероід і ін.). Як основу при їх виготовленні можна використовувати картон, папір, тканини, склоткань. Склорубероідна стріха, наприклад, стійка до впливу мікроорганізмів, бактерій і ін.
При змішанні бітуму (13-60% від загальної маси) із тонко помененими матеріалами, наприклад вапняком (для підвищення усталеності при зміні температур), одержують асфальтобетон - штучний асфальт. Але бувають і природні асфальти. Природний асфальт - це залишок нафти після випару легких фракцій з одночасним збагаченням його нафтовими смолами й іншими природними високомолекулярними речовинами.
38
ЛЕКЦІЯ № 3
НЕНАСИЧЕНІ ВУГЛЕВОДНІ РЯДУ ЭТІЛЕНУ (АЛКЕНИ, АБО ОЛЕФІНИ)
Будова алкенів
Алкенами або олефінами називають вуглеводні, у молекулах яких між вуглецевими атомами є один подвійний зв'язок,
Ненасичені вуглеводні містять у своїй молекулі менше число водневих атомів, чим відповідні їм насичені вуглеводні (із тим ж числом вуглецевих атомів), тому їх називають ненасичені.
Алкени, як і алкани, утворюють свій гомологичний ряд із загальною формулою СnН2n Найпростішим представником цього ряду, його родоначальником, є етілен С2Н4. За назвою цієї сполуки ненасичені вуглеводні такого ряду називаються також етіленовими.
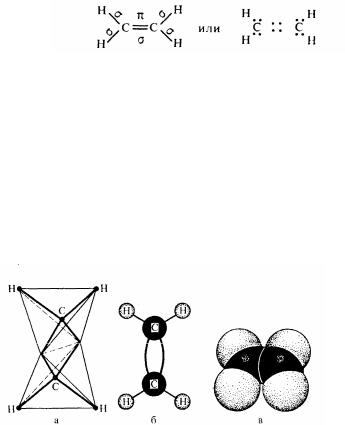
У молекулі етилену атоми вуглецю знаходяться в другому валентному стані (sp2-гибридизация). Нагадаємо, що в цьому випадку з чотирьох орбіталей атома вуглецю (одна 2s- і три 2р-) гібридизовані тільки три (одна 2s- і дві 2р-), а одна остання 2p-орбіталь залишається негібридизованою. Ця орбіталь утворює із 2pорбиталью іншого атому вуглецю якісно новий зв’язок — π -зв'язок. Отже, у молекулі етілену є п'ять σ-зв'язків і один π-зв’язок :
структурна формула октетна формула
Таким чином, подвійний зв'язок між вуглецевими атомами в молекулі етілену не є простимо подвоєнням одинарного зв'язку. Це наочно очевидно з порівняння деяких їхніх фізичних характеристик, наприклад довжин і енергій зв'язків. Дійсно, довжина простого зв'язку і її енергії утворення рівна відповідно 0,154 нм і 350 кДж/ моль. Довжина ж етіленового зв'язку дорівнює 0,134 нм, а енергія складає 612,4 кДж/ моль. Різниця в енергіях (262,4 кДж/ моль) і є приблизним розміром, що характеризує тривкість л-звязоку. На мал.12 приведено моделі молекули етілену.
Мал. 12. Моделі просторової будови молекули етілену:

39
а - тетраедрична; б - шаростержнева; а - по Бриглебу
Номенклатура і ізомерія
Номенклатура. Відповідно до систематичної номенклатури назви етіленових вуглеводнів роблять із назв відповідних алканів із заміною суфіксу -ан на -ен. Наприклад: алкан— алкен, етан —етен, пропан —пропен і т.д. Головний ланцюг повинен обов'язково містити подвійний зв'язок. Нумерацію цього ланцюга починають із того кінця, до якого ближче подвійний зв'язок. Цифру, що позначає положення подвійного зв'язку, ставлять після назви ланцюга, наприклад пентен-1, пентен-2 і т.д. Інший порядок упорядкування назви такий же, як і у випадку алканов:
Алкени простої будови часто називають, замінюючи суфікс -ан у насичених вуглеводнях на -ілен: етан—етілен, пропан— пропілен і т.д. Вживають іноді і раціональні назви. У цьому випадку етіленові вуглеводні розглядають як заміщені етілену:
НзС─СН=СН—СН2─СНз, метилэтилэтилен
Ненасичені вуглеводні радикали за систематичною номенклатурою називають, додаючи до кореня суфікс -єніл: етеніл СН2==СН—; пропеніл-2 СН2=СН—СН2— Але набагато частіше для цих радикалів вживають емпіричні назви - відповідно
звинувачував і алліл.
Ізомерія. Для етіленових вуглеводнів (алкенів) структурна ізомерія стає більш складної. Крім ізомерії, пов'язаної з будовою вуглецевого скелету (як в алканах), з'являється ізомерія, що залежить від положення подвійного зв'язку в ланцюзі. Усе це призводить до збільшення числа ізомерів у ряду алкенових вуглеводнів.
Так, перші два представники гомологічного ряду алкенов - етілен і пропілен - ізомерів не мають і їхню будівлю можна висловити тільки одною формулою.
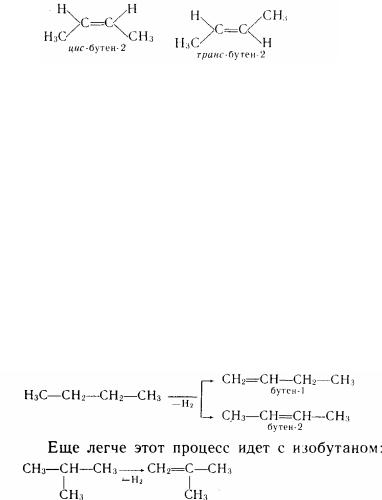
Для бутілену С4Н8 можливі вже три ізомера:
бутен- 1 бутсн-2 2-метилпропен-1
Перші два ізомера відрізняються положенням подвійного зв'язку в нерогалуженому ланцюзі, а третій - характером ланцюга (ізобудова).
Амілен С5Н10 має п'ять ізомерів:
2-метилбутен-2 2-метилбутен-1 3-метилбутен-1
Проте в ряду етіленових вуглеводнів крім структурної ізомерії можливий ще
40
один вид ізомерії - цис-транс-ізомерія, характерний тільки для сполук з подвійним зв'язком.
Енергія молекули з л- зв'язком буде найменшої в тому випадку, якщо всі її атоми будуть знаходитися в одній площині, тобто при дотриманні умови копланарности. Тоді спостерігається максимальне перекривання 2p-орбиталей при утворенні л- зв'язку. Поворот однієї частини молекули щодо іншій (навколо С==С- зв'язку) зменшує ступінь такого перекривання. До того ж це потребує визначеної енергії. Наприклад, для повороту навколо подвійного зв'язку на 180оС однієї групи атомів (=СНС1) щодо інший у молекулі СНС1=СНС1 потрібно витрата енергії порядку 209,35 кДж/ моль (цієї енергії достатньо для розриву деяких хімічних зв'язків). Отже, відсутність вільного обертання навколо подвійного зв'язку призводить до існування геометричних ізомерів, або цис- транс-ізомерів для тихий алкенов, у яких при кожному з двох атомів вуглецю, пов'язаних подвійним зв'язком, є різні замісники. Геометрична ізомерія є одним із видів просторової ізомерії.
Ізомери, у яких однакові замісники розташовані по одну сторону від подвійного зв'язку, називаються цис-ізомерами, а по різну - транс-ізомерами:
Цис- і транс-ізомери відрізняються не тільки просторовою будівлею, але і багатьма фізичними і хімічними (і навіть фізіологічними) властивостями.
транс-ізомери більш стійкі в порівнянні з цис-ізомерами. Це пояснюється більшою далекістю в просторі груп при атомах, пов'язаних подвійним зв'язком, у випадку транс ізомерів (мал. 13).
Засоби добування
1.Газоподібні алкени (етілен, пропілен, бутілен) виділяють із газів нафтопереробки (термічний крекінг). Крекінг алканов, що утримуються в нафті, є промисловим засобом одержання алкенів, що використовуються у виробництві полімерів. У великій кількості алкени утворяться також при піролізі нафти.
2.У промисловості алкени також добувають дегидрогенізаціею алканов. Наприклад, на алюмохромокалиєвих каталізаторах (К2О—Сг2Оз—Аl2Оз) при 5бО—620°С із н-бутана утворюються бутілени:
2-метилпропен-1
3. Дегидратацією спиртів, використовуючи каталізатори - сірчану або фосфорну
