
конспекты / ------------------
.pdf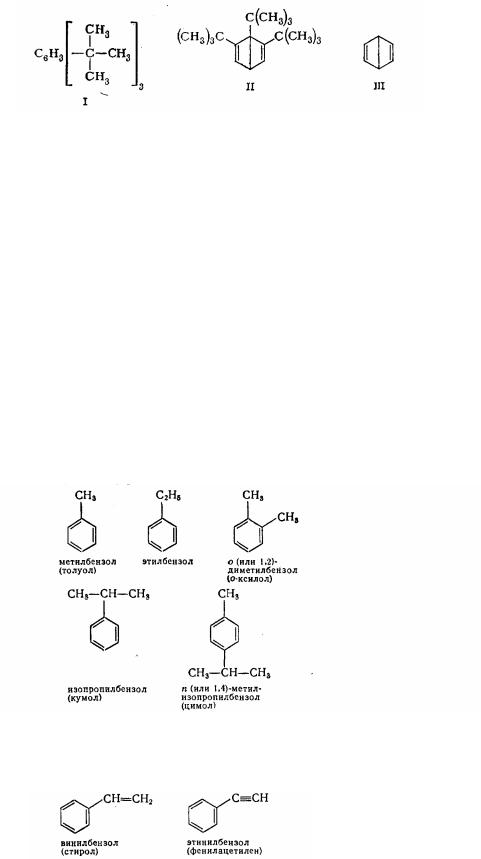
151
було отримана сполука, що має структуру (II):
Пізніше був виділений біцикличний вуглеводень (III) - дьюаровский бензол С6Н6. Ця сполука одержала таку назву внаслідок подібності його формули з формулою бензолу, запропонованої в 1865 р. Дьюаром.
Дьюаровский бензол відрізняється від бензолу характером зв'язків між атомами вуглецю, а також хімічними властивостями. При нагріванні до 90 °С він швидко (а при кімнатній температурі поступово) ізомеризуеться в бензол.
Похідні бензолу, що можна розглядати як продукти заміщення атомів водню бензолу алкільними радикалами, називають гомологами бензолу. Загальна формула таких вуглеводнів СпН2п-б. Вуглеводніми заступниками можуть бути також ненасичені радикали (алкенильні, алкинильні). У молекулах бензоідних вуглеводнів розрізняють дві частини: бензольне ядро і бічний ланцюг. Ізомерія цих сполук обумовлена будовою радикалів, їхніми розмірами і розташуванням.
Номенклатура. Назви вуглеводнів ряду бензолу складаються з назв радикалів бічних ланцюгів із додаванням закінчення бензол. Для багатьох із них употребительни :
Можна користуватися і скороченими записами формул. Наприклад, 1,2-діметилбензол С6Н4(СНз)2-1,2 і т.д.
Приклади назв проізводних бензолу з ненасиченими бічними ланцюгами:
Загальна назва ароматних углеводнів—арени. Загальна назва ароматних радикалів арили. Приклади назв радикалів: СбНз—фенил, СбН4—фенилен (о-, м-, п-}; СНзСбН4— толил (о-, м-, п-); СбНзСНг—бензил; С6Н5СН—бензиліден.
152
Наприклад:
(Назва фенил запозичено від стародавньої назви бензолу —фен.)
Засоби одержання гомологів бензолу. Ароматні вуглеводні можна синтезувати, виходячи з ароматних і неароматичних сполук.
Знеароматичних сполук арени одержуються декількома засобами,
1.Каталітичним дегідруванням циклогексану і його проізводних. Ця реакція відкрита Н. Д Зелинским у 1911 р. (каталізатор-палладієва чернь, 300°С):
Зараз у промисловості використовують у якості каталізатора платину на окисі алюмінію, температура біля 450°С. Ця реакція є оберненої гідруванню бензолу
2. Каталітичною дегідроциклізацією алканов-отщепленням водню з одночасним замиканням циклу (Б. А. Казанський,' А. Ф. Платэ, Б. Л. Молдавский). Каталізатором може служити платиноване вугілля при 300 °С, а також окисли кульгавий, молібдену, ванадію. Найбільше часто використовують окис кульгава на окисі алюмінію напуватити 500 °С і 30 кг/смз
Аналогічно з октану можуть бути отримані етилбензол, ксілоли.
Обидві розглянуті реакції в даний час лежать в основі так названої ароматизації нафти; вони дозволяють перекладати алканові і циклоалканові вуглеводні нафти в ароматні, що має велике практичне значення.
3.Шляхом полімеризації ацетилену і його гомологів .
4.З ацетону (конденсація під впливом сірчаної кислоти):
Останні два засоби є тільки лабораторними. З ароматних сполук арени
153
одержують такими засобами.
1. Алкилированнєм ароматних вуглеводнів галогенводними й олефінами (реакція Фриделя-Крафтса):
. 2. Відновлення ароматних кетонів:
Вихідні кетони також одержують по реакції Фриделя - Крафтса, діючи на бензол хлорангідридом кислоти (реакція ациліровання).
3. Синтезом Вюрца—Фиттига (1864 р.). Суміш ароматного галогенпроізводного й алкилгалогеніду опрацьовують металевим натрієм:
СбН5Вг + ВгС2Н5 + 2Na →С6Н5—С2Н5 + 2NaBr
етилбензол
Як установив П. П. Шоригин (1881-1939 р.), спочатку утвориться натрійорганічне зєднання -фенілнатрий, що потім реагує з бромистим етилом:
СбНвВг+2Ма → CeHeNa+NaBr CeHsNa + ВгСзНз → CsHg-CzHs + NaBr
4.З лужних солей ароматних кислот шляхом сплавки HY гп щелочью або натронной вапни:
5.Декарбоксилірованнєм ненасичених ароматних кислот:
Фізичні властивості, бензол і його найближчі гомологи—безкольорові рідини з характерним запахом, що высли гомологи-тверді речовини (табл. 8). Температури кипіння і плавлення залежать від розмірів і ізомерії бічних ланцюгів, від розташування бічних ланцюгів у циклі Ізомери з розгалуженими бічними ланцюгами звичайно киплять нижче, чим із нормальними; пару
Таблиця 8. Фізичні властивості деяких оренів
|
Т. плавл. , о |
|
Відносна |
Назва |
Т. стосів. , |
Щільність, |
|
|
|
°С |
|
|
|
|
|
|
|
154 |
|
|
Бензол Толуол |
|
80,1 |
0,879 |
|
+5,5 |
|
|||
Етилбензол |
-95 |
110,6 |
0,866 |
|
Ксилол |
-94 |
136,2 |
0,896 |
|
о- |
-25 |
144,4 |
|
|
М~ |
-47 |
|
0,881 |
|
П-Пропілбензол |
+13 |
138,4 |
0.854 |
|
Кумол |
-99 |
159,2 |
0,861 |
|
(ізопропілбензол) |
-96 |
152,4 |
0,862 |
|
Стирол |
31 |
145,0 |
0,906 |
|
(вінилбензол) |
142,0 |
|
||
-45 |
0,930 |
|
||
Фенілацетилен |
|
|
||
|
|
температуру плавлення. Щільність |
||
ізомери мають найбільше високу |
||||
аренов завжди менше одиниці. Всі вони мало розчинні у воді, але у всіх співвідношеннях мішаються з органічними розчинником-спиртом, ефіром, ацетоном, рідкими вуглеводнями. Рідкі арени самі є гарними розчинниками органічних речовин. Вони легко воспламеняються і горять яскравим, що сильно коптить полум'ям. Пари і рідини токсичні, деякі речовини канцерогенні (є збудниками ракових захворювань), при роботі з ними потрібно особлива
обережність.
Хімічні властивості бензолу і його гомологів. Реакції электрофільного заміщення в ароматному ряду. При явній не насиченості складу С6Н6 (недостача восьми водневих атомів у порівнянні з гексаном) бензол виявляє насичений характер. Це позначається в схильності до реакцій заміщення й усталеності до дії окислювачів. Навпаки, реакції приєднання утруднені, для їхнього проведення необхідні особливі умови.
Найбільше характерні для ароматних сполук реакції електрофільного заміщення, хоча відомі і реакції нуклеофільного заміщення, і радикальні реакції.
Механізм реакцій електрофільного заміщення в ароматному ряду має загальні риси з електрофільним приєднанням до алкенів. Це також двостадійний іонний процес. Ароматне ядро, що володіє рухливими
π - електронами, є зручним об'єктом для атаки електрофільних реагентів. Процесу заміщення передує розпад молекули реагенту XY з утворенням
електрофільной частки X+ і аніона Y-:
X−Y ↔ X++ Y-
Електрофільна частка взаємодіє з л-електронною хмарою ароматного ядра. Вона притягається негативним зарядом всю ароматну секстету електронів, але поки не сполучена дійсним хімічним зв'язком, а утворить л-комплекс:
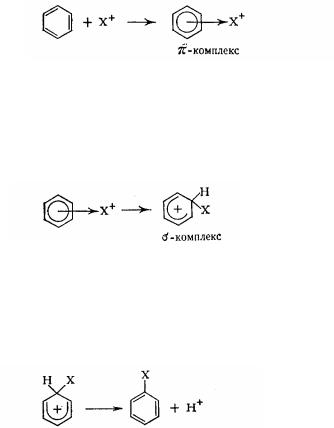
155
Потім два електрони із шести л- електронів циклу локалізуються в одного атома вуглецю і беруть участь в утворенні нової ковалентної а-связі з заступником , що вступає, а інші чотири електрони розподіляються між п'ятьма атомами вуглецю циклу. Утвориться проміжний карбкатион, у якому порушена ароматичність, так названий σ-комплекс:
При утворенні карбонієвого іона один із шести атомів вуглецю переходить із стану sp2- у стан sp3 - гибридизації. Конфігурація його стає тетраєдричною.
Порушення ароматного стану невигідно, оскільки ароматне ядро має особливу усталеність. Тому відбувається швидка втрата протона й ароматичність відновляється.
Протон , що отщепился , утворить з аніоном Y побічний продукт реакції:
Н+ + Y- → H−Y
Основна відмінність реакцій електрофільного заміщення в ароматному ряду від електрофільного приєднання в ряду алкенів полягає у швидкому відщепленні протона. Ароматичність воссоздається легше, ніж здійснюється реакція між проміжним катионом і аніоном Y реагенту. У випадку алкенов проміжний катион, що утвориться, дає з нуклеофільною часткою реагенту (аніоном) стійкий продукт приєднання.
Краще протікання реакцій заміщення в бензолу обумовлене тим, що ці реакції не потребують великої витрати енергії. Приєднуватися ж можуть тільки реагенти, багаті енергією: вільні атоми хлору, що виникнули фотохімічним шляхом із молекул хлору при освітленні; атоми водню, активовані каталізатором; багатий енергією озон.
Реакції електрофільного заміщення в ароматному ряду мають велике значення для синтезів, використовуваних у лабораторії й у промисловості. Нижче приведені найбільше важливі з них.
1. Нітрування—введення нітрогрупи NO2. Реакцію проводять звичайно сумішшю концентрованих азотної і сарною кислот. Чинним агентом нітрування є катіон нітронію , що утвориться в цій суміші , NO2
++
НΝΟ3 +2Н2SΟ4<=> NO2 + 2HSO4-+ H3O
Далі нітронний -катіон взаємодіє з ароматним вуглеводнем, атакуючи л-
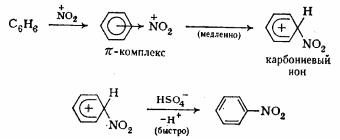
156
облако бензолу, у результаті чого спочатку утвориться π-комплекс, а потім σ-комплекс (карбонієвий іон) із ковалентним зв'язком
між нітрогрупою і вуглецевим атомом бензольної каблучки. У останній стадії іон HSO відриває іон водню й утвориться продукт заміщення - нітросполука:
Схематично реакцію можна записати так. Ar+HONO → ArNО+HO
Присутність у реакційній суміші води мішає плину реакції, тому що вода бере участь у процесі, оберненому утворенню катиона нитрония. Тому для зв'язування води, що виділяється в реакції, беруть надлишок концентрованої сірчаної кислоти.
2. Галогенування в ядро проводять за допомогою галогенів при каталізаторах. Частіше усього використовують галогениди алюмінію і заліза: А1С1з, А1Вгз, FеС1з, FеВгз і ін.
Іон гідроксонія є присутнім у водяних розчинах мінеральних кислот. Він утвориться з протона Н* і молекули води:
" * |
Г |
" |
Т1" |
НгО+Н^ ^=fc Н:0:Н |
|
|
|
•• |
L |
•• |
J |
н
Каталізатори сприяють створенню активної електрофільної частки шляхом поляризації зв'язку між атомами галогену. Наприклад, у безводному хлористому алюмінії атом алюмінію має лише шість електронів на зовнішньої орбіталі. Він доповнює це угруповання до октету за рахунок вільної електронної пари атома хлору; у результаті відтягування електронів другий атом молекули хлору набуває позитивного заряду і тим самим підвищену електрофільність:
С1 |
р С1 -в-• « |
•• •• |
у+ | |
•• I |
|
:С1—С1:+А1:СГ—> С1 С1:А1:С1 |
|
|
|||
|
•• •• |
•• |
|
| •• |
| |
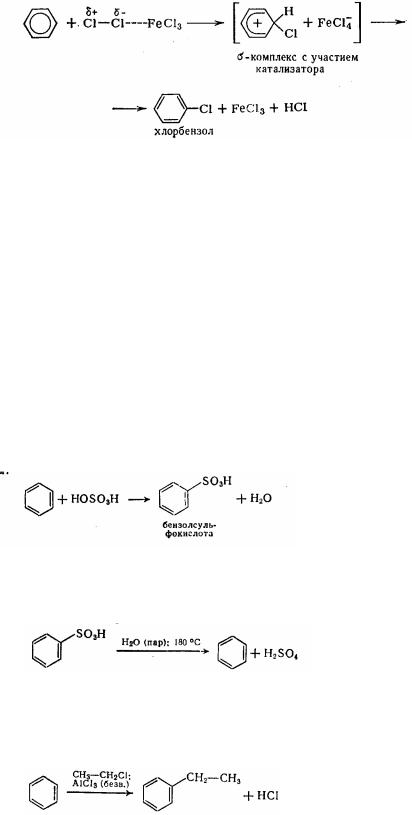
157
С1 |
L С1 -' |
Такою же уявою діє і безводне хлорне залізо:
Реакційна спроможність галогенів убуває в ряду:
F2 > С12 > Вг2 > I2
Фтор занадто активний, тому фторпроізводні звичайно одержують непрямим шляхом. Пряме іодированнє не дає гарних результатів - йод малоактивний, тому йодпроізводні одержують також іншим засобом, через діазосполучення.
Дія хлору і брому на ароматні сполуки в умовах радикальної реакції (світло, нагрівання) прізводить до заміщення водню в бічному ланцюзі або до приєднання галогену з утворенням проізводних циклогексану.
3. Сульфірованнє - заміщєннє водню в бензольному ядрі сульфогрупою. Звичайно реакцію здійснюють нагріванням ароматного вуглеводню з концентрованою сірчаною кислотою або - олеумом. У результаті утворяться ароматні сульфокислоти.
Реакція сульфіровання, на відміну від реакцій нитровання і талогенировання - оборотна.
4. Алкилированнє—введення в ядро алкильної групи, у результаті чого утворяться гомологи бензолу. Алкилированнє здійснюється двома шляхами.
а) Дією на бензол алкилгалогенидами при катализаторах – безводних галогенидів алюмінію (алкилированнє по Фриделю—Крафтсу, 1877 р.):
Аналогічно розглянутому вище галогенуванню роль каталізатора в реакції алкилировання також полягає в збільшенні полярності реагенту:
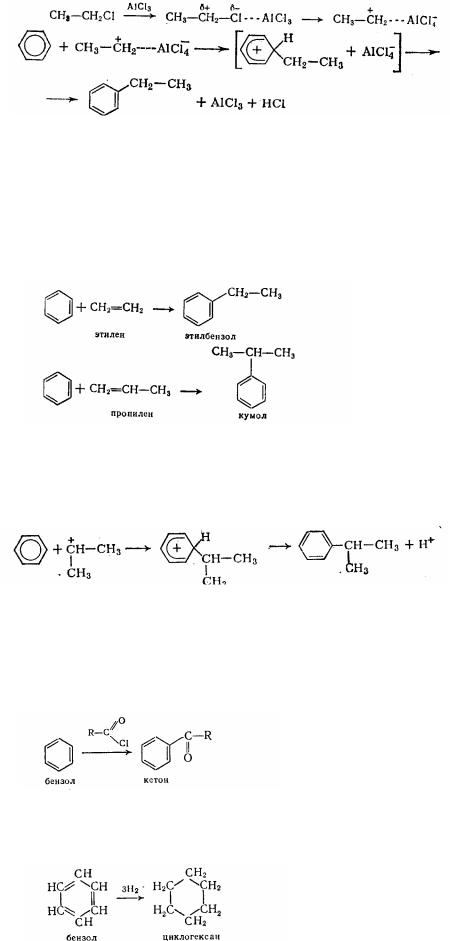
158
Реакція ускладнюється подальшим алкилированнєм, тому що гомологи бензолу вступають у цю реакцію легше, чим бензол.
У цій області відомі роботи російського вченого Г. Г. Густавсона.
б) Алкилированнєм бензолу олефінами при хлористого алюмінію або інших каталізаторів (трехфтористий бор, фосфорна кислота). Ці реакції широко використовуються в промисловості для одержання етилбензолу і ізопропілбензола (кумола) ,із бензолу і газів крекінгу:
Механізм реакції подібний із попередніми: протон кислоти з молекулою олефіну дает карбкатион
. СНз—СН=СН2 + Н+ → + СН3—СН—СНз який вступає в реакцію з бензолом:
I
5. Ацилированнє - введіннє в ядро ацильної групи R-С=0. У результаті подібних реакцій утворяться кетони. Цей синтез називають ацилированнєм по Фриделю-Крафтсу. Реагентом, що ацилирує, є хлорангідриди або ангідриди кислот при безводного хлористого алюмінію:
Реакції приєднання до ароматних вуглеводнів.
1. Приєднання водню. Каталітичне гідрування йде гладко при нікелевих (150°С) і платинових (50°С) каталізаторів:
Похідні бензолу дають при цьому похідні циклогексану. Це практично
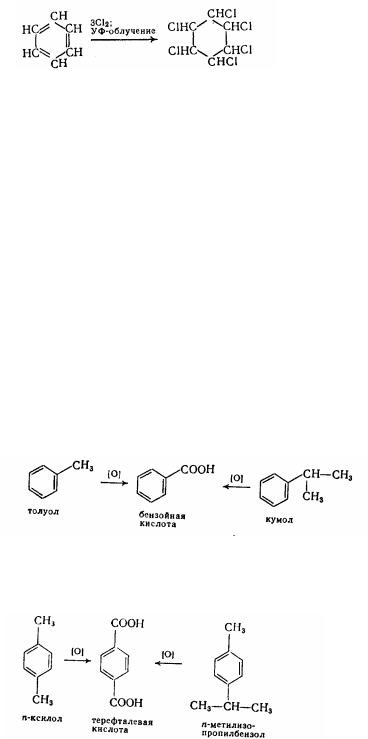
159
важлива реакція, тому що циклогексан - гарний розчинник, а також напівпродукт для синтезу адипінової кислоти і капролактама.
2. Приєднання хлору на світлі (фотохімічне хлорування бензолу) дає гексахлорциклогексан (гексахлоран), що широко використовується в якості інсектициду:
Реакції окислювання.
Усталеність бензольного ядра до окислювання є одним із найважливіших властивостей ароматних сполук. Такі окислювачі, як азотна кислота, хромова суміш, розчин перманганата калію, перекис водню, при звичайних умовах на бензол не діють. До цих окислювачів він навіть більш стійкий, чим парафінові вуглеводні. Ця властивість відрізняє також ароматні сполуки від сполук із подвійними зв'язками.
При дії кисню повітря на бензол при каталізатора пятиокиси ванадию при високій температурі (400°С) утворюється малеїновий ангідрид (промисловий cnnrnfil )
При дії окислювачів на гомологи бензолу окислюванню піддаються бічні ланцюги - алкильні радикали. Якої б складності ні був ланцюг, вона під дією сильних окислювачів руйнується («згоряє»), за винятком найближчого до ядра атома вуглецю, що окисляється в карбоксильну групу.
Гомологи бензолу з одним бічним ланцюгом дають одноосновну кислоту
бензойну:
Два бічні ланцюги, дають двохосновні:
По утворившимся ароматним кислотам, що у результаті окислювання, можна судити про положення бічних ланцюгів і їхнього числа.
Озонування.
Молекула бензолу легко приєднує три молекули озону, створюючи
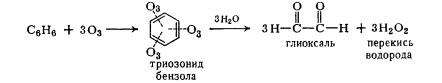
160
триозонид - украй хитлива сполука. Під дією води триозонид руйнується й утвориться діальдегид - глиоксаль:
Орієнтація при електрофільному заміщенні в бензольному ядрі.
З'ясовування закономірностей при реакціях заміщення в бензольному ядрі явилося предметом багатьох досліджень. Класичні дослідження в цій області ставляться ще до минулого сторіччя і пов'язані з ім'ям німецького ученого Голлемана.
Як уже було відзначено , унаслідок рівноцінності всіх атомів вуглецю в бензолі ,однозміщені бензоли ізомерів не мають. При вступі в молекулу другого заступника можуть утворитися три ізомери, що різняться взаємним положенням замісників орта-, мета- або параізомери.
Місце вступу нового електрофільного заступника визначається природою вже наявного в ароматному ядрі заступника. Іншими словами, заступник що стоїть в ароматному ядрі робить при подальшому заміщенні визначену направляючу ( що орієнтує) дію
Всі заступники по їхній орієнтуючий дії при реакціях електрофільного заміщення в бензольному ядрі можна розділити на дві групи
: заступники першого роду - спрямовують переважно в орто- і пара-положенні - це орто-пара -орієнтанти. До них ставляться алкільні
радикали, групи —ОН, -NH2, -NHR, -NR2, галогени й ін.;
заступники другого роду - спрямовують переважно в мета-положенні—це мета-орієнтанти. До них відносяться групи
—СНз, -N02, -SO3H, -COOH, -CN і ін.
У табл. 9 приведені кількісні дані, отримані в результаті нітрування монозаміщених бензолів.
З приведених прикладів очевидно, що не всі заступники діють строго виборочно, наприклад група CHCl2 впливає так, що утвориться суміш, що містить значні кількості всіх трьох ізомерів. Співвідношення ізомерів, що утворяться, може також змінюватися під впливом природи реагенту, його концентрації, типу розчинника, каталізаторів, температури.
Заступники першого і другого роду по-різному впливають на реакційну спроможність бензольного ядра. Заступники першого роду (за винятком галогенів) активують ядро, полегшують уведення нового заступника, унаслідок чого реакції електрофільного заміщення протікають значно легше, ніж для самого бензолу. Заступники другого роду утрудняють подальше електрофільне заміщення.
Таблиця 9. Вплив різноманітних груп , що орієнтує , у реакції нітрування
