
конспекты / ------------------
.pdf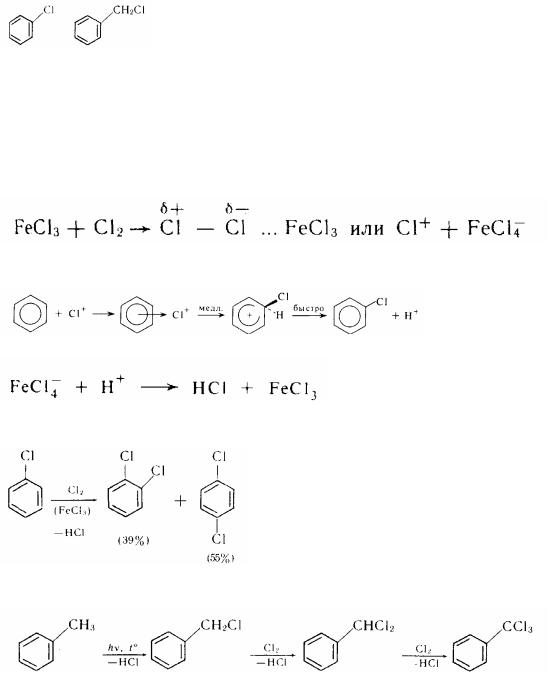
171
ЛЕКЦИЯ14
Галогенонітро і сульфопохідні ароматичних вуглеводнів
Галогенпроізводні духмяних вуглеводнів - це речовини, що містять у молекулі один або декілька атомів галогену, пов'язаних або безпосередньо з ароматним ядром, або знаходяться в бічному ланцюзі:
хлорбензол хлористий бензил Одержання. У залежності від розумів проведення реакції галогенування можуть
утворюватися Галогенпроізводні з галогеном у ядрі або в бічному ланцюзі. Якщо реакцію проводити при каталізаторів (FеС1з, А1С1з, SdС1з), ті утворяться похідні з галогеном у духмяному ядрі. Роль каталізаторів полягає в поляризації молекули галогену з утворенням позитивно зарядженого центру, що электрофільно атакує бензольне ядро:
Реакція галогенування йде по механізмі:
-комплекс |
-комплекс хлорбензол |
Галоген ставитися до заступників I роду, і тому при подальшому галогенуванні бензолу інший атом галогену вступає переважно в /г-положення:
При введенні галогену в бічний ланцюг необхідно нагрівання. Реакцію проводять на світлі у відсутність каталізаторів. Реакція йде по радикальному механізмі:
хлористий бензил |
хлористій |
бензотрихлорид |
|
бензилиден |
|
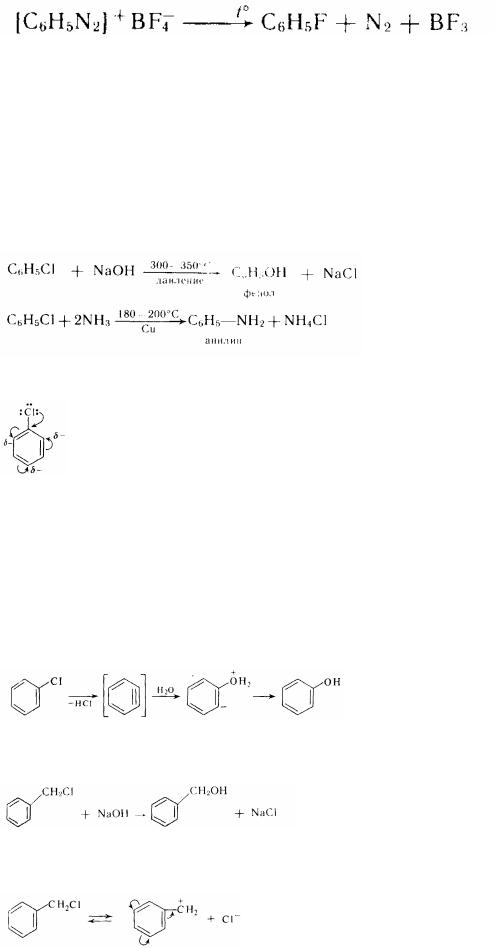
Фторпохідні звичайно одержують косвеним шляхом. Це пов'язано з високою активністю фтору. Наприклад, із цією метою можна використовувати діазосполучення (Шиманн):
172
Фізичні властивості. Галогенпроізводні духмяного ряду - важкі рідини або кристалічні речовини. Якщо галоген знаходиться в ядрі, те такі похідні мають слабкий «духмяний» запах. Різкий, що дратує запах мають Галогенпроізводні з галогеном у бічному ланцюзі. Всі ці з'єднання не розчиняються у воді. Температур кипіння підвищуються при переході від фтор до иодпроізводних. Хімічні властивості. Ароматні Галогенпроізводні з галогеном у ядрі - досить пасивні речовини в порівнянні з галогенопроізводними аліфатичного ряду. Смердоти на превелику силу вступають у реакції нуклеофільного заміщення. Для проведення реакцій галогенарилов із їдкими луками необхідні жорсткі умови (скроні температура і тиск):
Така низька активність атома галогену в галогенарилах пояснюється частковою двоесвязанностью його з бензольнім ядром:
хлорбензол Це нагадує поводження галогенопроізводних ненасичених вуглеводнів, у яких
атом галогену знаходиться при вуглецевому атомі, що має подвійний зв'язок, наприклад у хлористого звинувачувала СН2=СН—С1.
Механізм реакції нуклеофільного заміщення галогену в духмяному ряду має свої особливості. Можливо, що при дії сильних нуклеофільних реагентів відбувається спочатку відщеплення галогеноводорода з утворенням дуже активного проміжного продукту - дегидробензола (бензину), що відразу ж реагує з нуклеофільним реагентом:
легилробенюл фенол Якщо ж галоген знаходиться в бічному ланцюзі, те він досить легко вступає в
реакції нуклеофільного заміщення:
бензиловый спирт "
Рухливість такого галогену пояснюється високою усталеністю катіона, що виникає при відщепленні галогену:

173
Ароматні галогенопроизводні, подібно галогенопроизводним аліфатичного ряду, утворять металлорганичні з'єднання:
Реакції электрофільного заміщення (галогенування, нітровання і сульфіровання) протікають сутужніше, чим із незаміщеним бензолом, тому що атоми галогену, володіючи негативним індуктивним ефектом, зменшують електронну щільність у бензольному ядрі.
Окремі представники. Хлорбензол С6Н5Сl - безбарвна рідина з
tкип == 132°С. У промисловості утворюється хлоруванням бензолу при каталізатора (FеС1з). Незважаючи на незначну рухливість атома хлору, хлорбензол широко використовується для синтезу різноманітних органічних речовин (фенолу, барвників і ін.)-
Хлористий бензил С6Н5СН2Сl - рідина з різким запахом, tкип = 179°С. На відміну від хлорбензолу має дуже рухливий атом хлору, що легко заміщується на інші атоми і групи. Застосовується в якості проміжного продукту при виробництві бензилового спирту і складаних ефірів бензойної кислоти.
Нітросполуки ароматичного ряду
Нітросполуками духмяних вуглеводнів називаються похідні бензолу, що містять одну або декілька нітрогруп. Нітрогрупа може бути пов'язана з бензольнім ядром або може знаходитися в бічному ланцюзі.
Нагадаємо, що нітрогрупа містить семиполярну зв'язок:
Одержання. Ароматні нітросполук із нітрогрупою у ядрі одержують нітрированієм духмяних вуглеводнів сумішшю , що нітрує, що являє собою суміш азотної і сарною кислот. При взаємодії цих кислот утвориться іон нітронія NО2, що є агентом , що нітрує:
Іон нітронія потім атакує бензольне каблучка:
π-комплекс σ -комплекс нітробензол
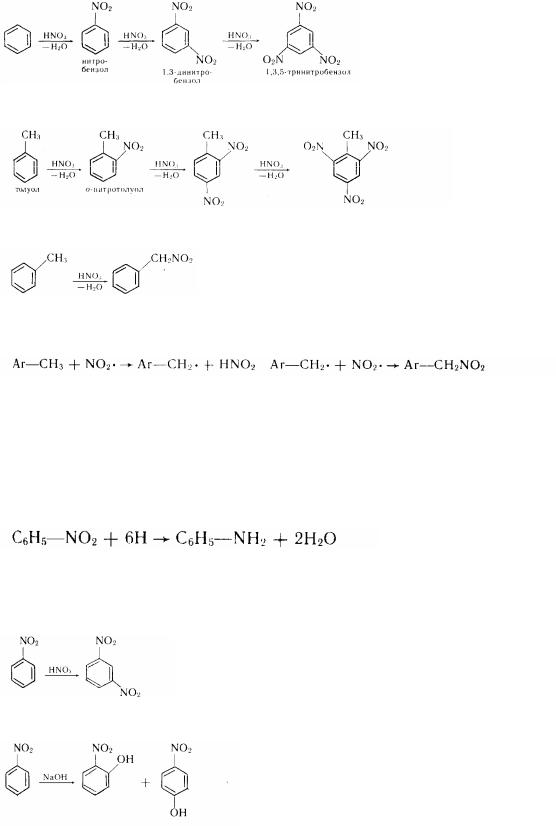
Сірчана кислота в цій реакції, приходячи каталізатором, сприяє утворенню іона нітронія. З цією ціллю звичайно застосовують 90%-ну сірчану кислоту. Присутність нітрогрупи зменшує швидкість подальшого нітрування. Проте в досить жорстких умовах можна ввести другу і навіть третину нітрогрупи, що розташовуються в ^-положеннях щодо один одного:
174
Заступники I роду сприяють реакції нітрування, а заступники II роду утрудняють. Так, толуол нітрується в 24 разу швидше, чим бензол:
Нітросполуки з нітрогрупою у бічному ланцюзі утворюються тими ж методами, що і нітросполуки масного ряду (реакція Коновалова) :
фенилнитрометан
Як відомо, у цьому випадку агентом, що нітрує, є радикалоподібний діоксид азоту (А. И. Титов):
Фізичні властивості. Мононітрообєднання духмяного ряду - рідкі або тверді речовини, що мають запах гіркого мигдалю, отрутний, особливо нітробензол. Не розчиняються у воді. Гарні розчинники.
Хімічні властивості. Хімічні властивості духмяних нітросполук визначаються нітрогрупою і бензольнім каблучкою, що впливають один на одного. Для них характерні реакції відновлення і заміщення.
1. Відновлення:
анілин Ця реакція була відкрита Н. Н. Зініним у 1842 р.
2. Заміщення, а) У реакціях электрофільного заміщення нітрогрупа утрудняє вступ нового заступника в ядро (орієнтація в м-положенії):
б) У реакціях нуклеофільного заміщення нітрогрупа сприяє вступу нового заступника в ядро (орієнтація в о- і п-положенні):
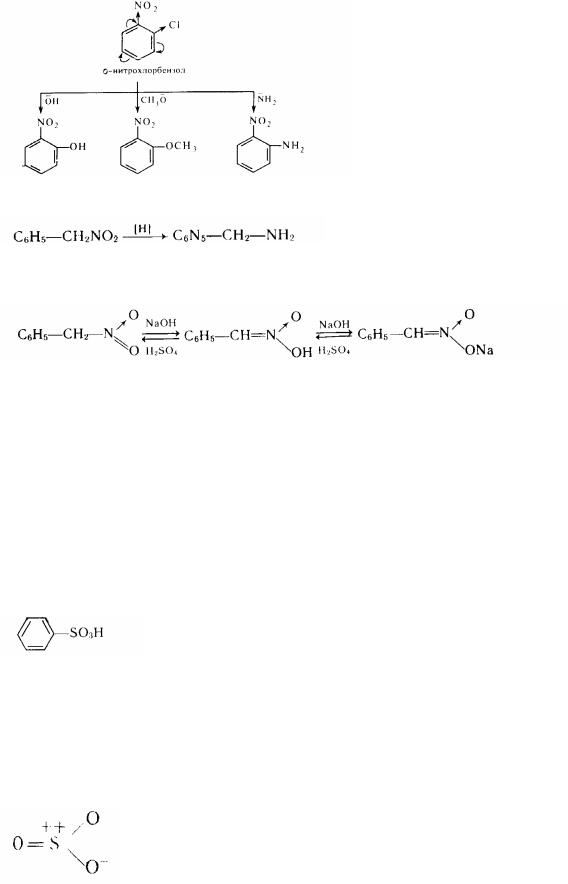
Якщо в бензольному каблучці в о- або п-положенні до нітрогрупи знаходиться атом галогену, те він набуває високої рухливості і може легко заміщуватисья на нуклеофільні агенти:
175
о- нитрофенол про -метокси нітробензол о-аминонитробенэол
Нітросполуки з нітрогрупою у бічному ланцюзі при відновленні утворять аміни:
бензиламин
З луками такі нітросполуки (подібно аліфатичним нітрообєднаннєм) можуть давати солі аци-нитро-форми:
ацн-нитро-форма |
натрієва сіль аци-нитро-формы |
Ця реакція служити відмінністю нітросполук із нітрогрупою у бічному ланцюзі від нітросполук із нітрогрупою у ядрі.
Окремі представники. Нітробензол С6Н5—N02 - блідо-жовта оліїста рідина з tкип = 210,9°С. Має запах гіркого мигдалю. Отрутний. Нерозчинених у воді. Застосовується при виробництві аніліну і бензидину.
2,4,6-Тринітротолуол (тротил) СН3С6Н2(NH2)3 - жовті кристали з
tпл =80,6°С. Використовується як сильна вибухова речовина бризантного дії. Підриває тільки від детонації.
ульфопроізводні духмяного ряду
Сульфопроізводнимі духмяного ряду називаються з'єднання, що містять сульфогрупу, пов'язану з ароматним ядром:
ульфопроізводні вуглеводнів також називають сульфокислотами. Одержання. Сульфірованіє звичайно проводять надлишком концентрованої (94-96%) сірчаної кислоти при нагріванні (120160°С), а також олеумом і S03. Сульфірованіє— реакція електрофільного заміщення.
Роздивимося реакцію сульфіровання, у котрої агентом , що сульфірує , є сірчаний ангідрид. У молекулі S03 електронна щільність розподілена таким чином, що атом сірки набуває частковий позитивний заряд:
Володіючи властивостями сильного електрофіла, атом сірки атакує ? -електронну систему ароматної каблучки:

176
σ-комплекс |
сульфокислота |
Якщо ж для сульфіровання застосовують концентровану сірчану кислоту, то активним електрофільним агентом, що атакує духмяна каблучка, буде бісульфонієвий іон S0з, що утвориться за схемою
При сульффірованії гомологів бензолу сульфогруппа стає в о- або n-положення. Якщо ароматні вуглеводні сульфіровати сірчаною кислотою , що димить , при нагріванні і при каталізаторів, те можна одержати ді - і трисульфокислоти.
При електрофільному заміщенні сульфогруппа орієнтує новий заступник у м- положенії:
м-нитробензол - сульфокислота
Фізичні властивості. Сульфокислоті духмяного ряду - кристалічні речовини, добрі розчинні у воді. Смердоти дуже гигроскопічні і розпливаються на повітрі. Хімічні властивості. Ароматні сульфокислоті - досить сильні кислоти (для бензосульфокислоти рКа ≈ Про,4). З хімічних властивостей варто зазначити такі. I. Утворення солей:
2. Утворення сульфохлоридов:
хлорсульфоновая
кислота
3.Реакції гідролізу:
4.Реакція лужного плавлення:
(80-85%) фенолят натрію
Окремі представники. Бензолсульфокислота С6Н5—S0зН - кристалічний продукт. Добрі розчиняється у воді і спирті, погано - у бензолі. Безводна бензолсульфокислота плавитися при 171—172°С. Широко використовується її натрієва сіль: при сплавці з їдким натром утворяться фоноли. Бензол сульфокислота застосовується в якості отвердителя при одержанні деяких полімерів. Її добавляють у сировинну суміш для бетонних виробів із метою поліпшення їхніх фізико-хімічних властивостей.
Бензолсульфохлорид С6Н5—S02С1 - важка рідина (tпл. = 14,5°С,

177
tкип = 251,5°С). Застосовується для одержання різноманітних органічних сполук, у тому числі і лікарських препаратів.
Алкільні й ацильні похідні духмяних вуглеводнів
При алкілірованії й ацилірованії духмяних вуглеводнів утворюються відповідно їх алкільні й ацильні похідні.
Реакції алкіліровання й ациліровання духмяних вуглеводнів, що ставляться також до реакцій электрофільного заміщення, називаються реакціями Фриделя - Крафтса.
Алкильні похідні духмяних вуглеводнів утворюються звичайно при дії галогеналкилов на бензол при каталізатора А1С1з. Ця реакція має багато загального з реакціями галогенування. Роль каталізатора полягає в утворенні позитивно зарядженого катіона, що электрофільно атакує бензольне каблучка:
У якості агентів, що алкілірує, замість галогеналкилов можна застосовувати також непредельні вуглеводні і спирти. У цьому випадку в якості каталізатора використовують мінеральні кислоти, що перекладають алкени або спирти у відповідні карб-катіони:
Таким засобом одержують, наприклад, етилбензол і ізопропілбензол (кумою):
стирол
Стирол застосовують у виробництві синтетичних каучуків і пластмас, використовують у якості добавки в сировинну будівельну суміш при виготовленні ячеістого бетону для підвищення його тривкості і гідрофобности. Виробам із бетону і залізобетону можна додати водонепроникність і морозостійкість, якщо їх після сушіння наситити стиролом, а потім при підвищеній температурі " перекласти його в полістирол.
178
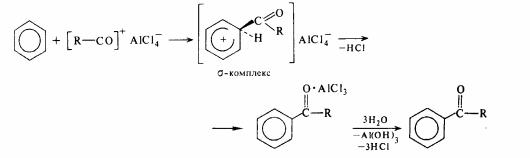
У результаті реакції ациліровання утворяться ацильні похідні бензолу і його гомологів. У якості агентів , що ацилірує , використовують ангідриді або галогенангідриди кислот, а в якості каталізатора А1С1з.
При каталізатора ангідриді і хлорангідриді кислот утворять комплекс [R— СО]+AlCl4-, що потім взаємодіє з бензолом:
179
ЛЕКЦІЯ 15
АРОМАТНІ АМИНЫ
Ароматні аміни і їх похідні
Ароматні аміни - з'єднання, у молекулах яких аміногрупа -МН2 пов'язана безпосередньо з ароматним ядром.
Якщо в молекулі амина з азотом пов'язані одночасно й ароматні, і аліфатичні радикали, те такі аміни називаються жирно-духмяними.
Ароматні аміни, як і аміни аліфатичного ряду, можуть бути первинними (I), повторними (II) і третинними (III):
Аг-NН2 (Аг)2NН (Аг)з
I II III
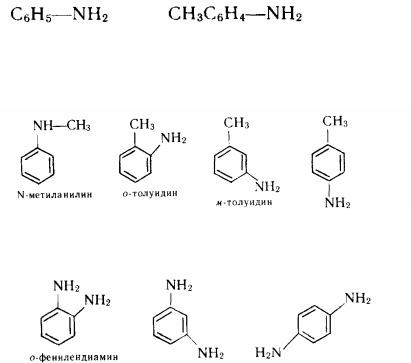
З'єднання, що містять у молекулі дві аміногрупи, називаються діамінами. Номенклатура і ізомерія. Для назви духмяних амінов звичайно використовують тривіальну номенклатуру, наприклад С6Н5NН2 - анілін (від порт. аnil - «індиго»), С6Н5NНСН3— N-метиланілін, СН3С6Н4NН2 - толуїдин. По систематичній номенклатурі назви амінов утворять із назв радикалів із додаванням закінчення - амін або приставки аміно- і назви відповідного вуглеводню:
фениламин, або |
толуенамин, |
аминобензол |
або аминотолуол |
N-Метіланіліну відповідають три ізомерних з'єднання, похідні толуолів - толуїдині:
З'єднання з двома аміногрупами - фенілендіаміни - відомі в трьох ізомерних формах:
м-фенилендиамин n-фенилендиамин
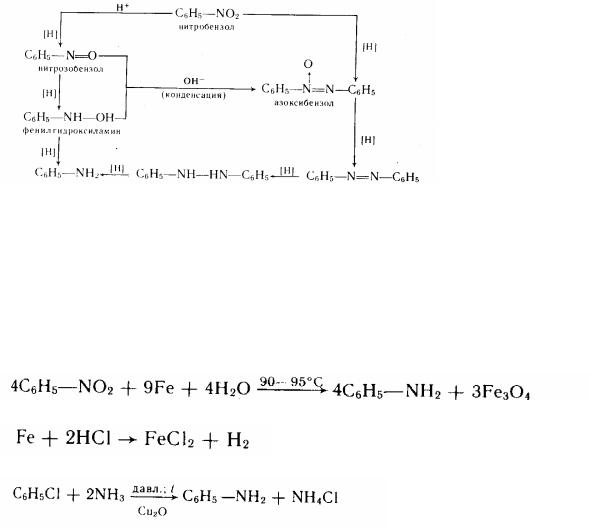
Одержання. Анілін - первинний духмяний амін - одержують відновленням нітробензолу (реакція Н. Н. Зініна). У залежності від розумів відновлення утворяться різноманітні проміжні продукти. При цьому істотний вплив робить р середовище. При відновленні в кислому середовищі нітробензол спочатку перетворюється в нітрозобензол, а потім - у фенілгід-роксіламін, що при подальшому відновленні переходити в анілін. При відновленні нітробензолу в лужному середовищі спочатку утворяться нітрозобензол і фенілгідроксіламін, що в результаті наступної конденсації (каталізатор - лука) переходять в азоксібензол,
180
а потім в азобензол і гідразобензол. При подальшому відновленні гідрозобензол переходити в анілин.
Усе сказане можна зобразити у виді схеми:
анілин гидразобензол азобензол
Будь-який із цих проміжних продуктів можна одержати відновленням нітробензолу, підібравши для цього відповідний восстановитель. Кінцевим продуктом відновлення й у кислої, і в лужному середовищі є анілін.
Для відновлення духмяних нітросполук у кислому середовищі частіше усього застосовують соляну кислоту і метали. У якості восстановителей у лужному середовищі використовують сульфід амонію і цинк, а також сульфід натрію. Одним з основних і поширених методів синтезу аніліну є відновлення нітробензолу чавунними стружками при електроліту (FеСl2):
FеСl2 утвориться при протравлянні чавунних стружок соляною кислотою:
Анілін можна також одержувати з духмяних галогенопроізводних і аміаку:
Ця реакція є реакцією нуклеофільного заміщення. Смердота протікає при досить жорстких умовах: високий тиск і температура, а також каталізатор - мідь або її з'єднання.
