
конспекты / ------------------
.pdf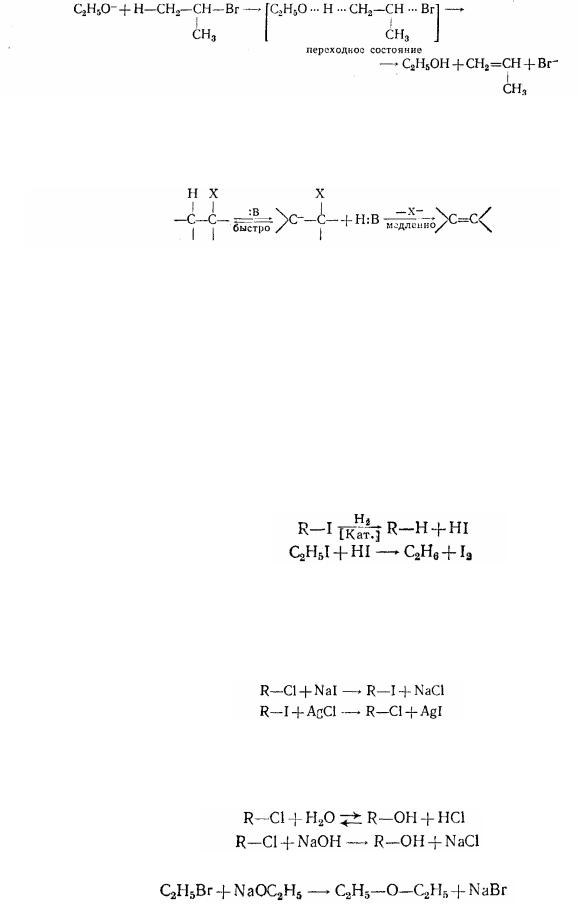
71
протоном у тій мірі, у якій відбувається відщеплення галогену, наприклад:
Швидкість такої реакції пропорційна концентрації обох реагентів. Звичайно одночасно з відщепленням відбувається і нуклеофільне заміщення за механізмом SN2. Крім зазначених механізмів відщеплення галогеноводнів існує ще особливий механізм, при якому відрив протону передує втраті групи, що йде:
У цьому випадку швидкість реакції обмежується найбільш повільною другою стадією. Швидкість реакції на цій стадії, як і у випадку бімолекулярного відщеплення, залежить від концентрації аніона. Механізми SN2 і Е1сЬ можна розрізнити, використовуючи метод мічених атомів. За механізмом Е1сЬ реакції відщеплення проходять порівняно рідко. Активність основ у реакціях, що
протікають за механізмом Е2, змінюється в тому ж напрямку, що і їхня сила: RН2- >С2Н5 > ОН- > СНзСОО-.
При обох механізмах швидкість відщеплення галогеноводнів убуває в ряду: третинні > вторинні > первинні і I > Вг > С1.
Розглянемо окремі реакції галогенопохідних:
1. При каталітичному гідруванні галогеналкилів або дії на них водню в момент виділення, а також йодистого водню відбувається заміщення галогену воднем:
2.Дією розчину солей галогеновднів у спирті або ацетоні на галогенопохідні можна замінити один галоген іншим. При заміщенні галогену з великою атомною масою галогеном із меншою атомною масою варто застосовувати солі срібла, тому що йодид срібла менш розчинен, чим бромид і особливо хлорид:
3.Велике значення (для одержання спиртів із вуглеводнів) має реакція галогеналкилів із водою (гідроліз). Гідроліз ведуть в розчинах їдких лугів або карбонатів лужних металів при нагріванні, іноді вище температур кипіння води (в автоклаві):
4. При дії на галогеналкили алкоголятів утворюються прості ефіри:
діетиловий ефір
72
Крім того, утворюються ненасичені вуглеводні.
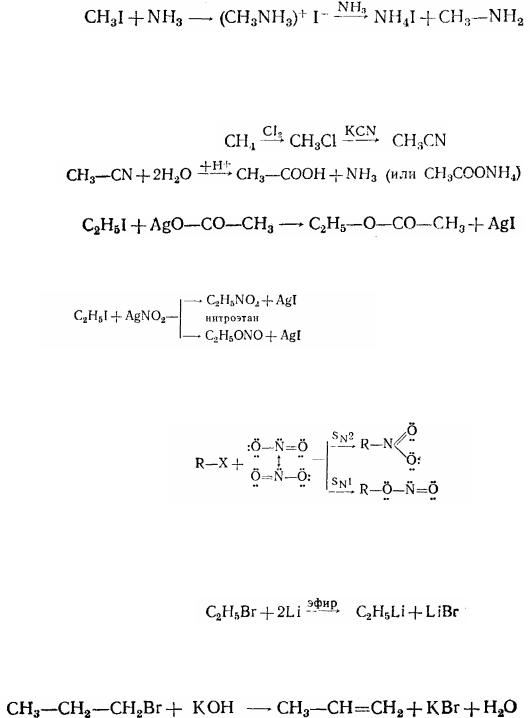
5. При взаємодії з аміаком і амінами галогеналкили алкилують їх з утворенням відповідних первинних, вторинних або третинних амінов, а також солей амонієвих основ:
йодистий метиламмоній |
метиламін |
6.Реакцією галогеналкилів із солями синильної кислоти одержують ціанисті алкили (нітрили) і ізонітрили. Використовуючи цю реакцію, можна перейти від насичених вуглеводнів до карбонових кислот:
7.Нагрівання із солями органічних кислот призводить до складних ефірів:
8.При нагріванні з нітритом срібла вони утворюють нітросполуки й ефіри азотистої кислоти:
Нуклеофільна частка, що атакує в цій реакції - іон NО2 виявляє двоїсту реакційну спроможність, тобто може приєднувати радикал за азотом (механізм SN2) або киснем (механізм SN1)
Механізм реакції, а отже, і її напрямок сильно залежать від природи розчинника. Розчинники , що сольватують, (вода, спирти) сприяють утворенню ефіру.
9.При дії на галогеналкили багатьох металів галоген заміщується металом. Це найбільше важливий метод синтезу металорганічних сполук. Наприклад:
10.При дії спиртового розчину їдких лугів або органічних сполук (хінолин, діметиланілін) галогеналкили отщепляють галогеноводень дають олефіни. Наприклад:
спиртовий розчин
Окремі представники. Застосування
У техніці з галогеналкилів найбільше застосування мають хлористий метил і хлористий етил. Їх одержують хлоруванням відповідних насичених вуглеводнів. Хлористий етил одержують також приєднанням сухого хлористого водню до етілену у присутності хлориду заліза FеС1з. У хімічній промисловості хлористий

73
метил і хлористий етил застосовуються як засоби для алкилування. Крім того, вони використовуються для наповнення манометричних термометрів. Хлористий етил застосовується у великих кількостях для добування антидетонатора тетраетилсвинцю (ТЭС), а також у медицині для короткочасного наркозу і для місцевої анестезії, зокрема, у зуболікарській практиці.
ДІТА ПОЛІГАЛОГЕНОПОХІДНІ НАСИЧЕНИХ ВУГЛЕВОДНІВ
Ді - і полігалогенопохідні можуть мати однакові або різні атоми галогенів у
того самого або у різних атомів вуглецю. |
|
Ізомерія. Номенклатура |
|
Галогенопохідні з атомами галогену у того самого |
атома вуглецю |
називаються гемінальними, у поруч стоячих атомів вуглецю - віцинальними. Приклади полігалогенопохідних:
Назви відповідно: діхлорметан, хлористий метилен; трихлорметан, хлороформ; тетрахлорметан, четирьоххлористий вуглець; 1,1-дихлоретан, хлористий етіліден 1,2-діхлоретан, хлористий етілен; 1,1,2-трихлоретан; 1,1,1-трихлоретан; 1,1,1,2-тетрахлоретан; 1,1,2,2-тетрахлоретан.
Засоби добування
Полігалогенопохідні добувають із вуглеводнів або зі сполук, що містять кисень.
1.Ді - і поліхлориди можуть бути виділені з продуктів хлорування насичених вуглеводнів.
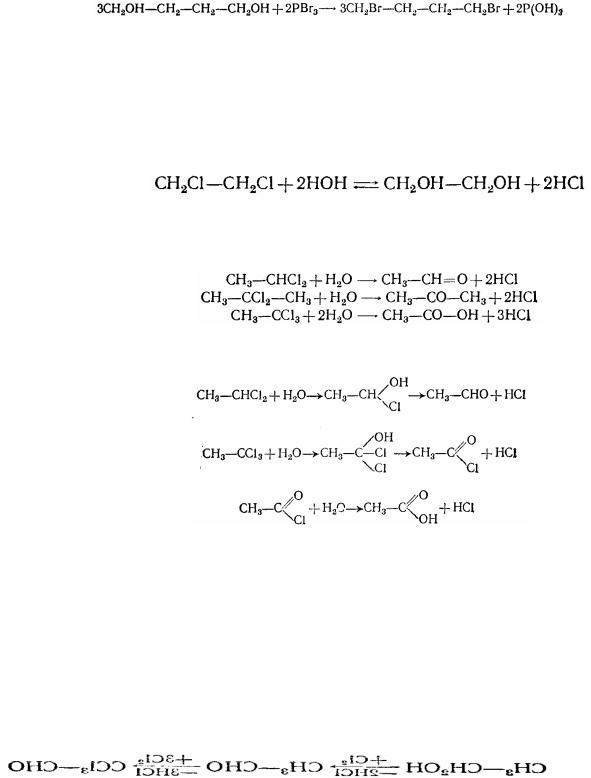
2.Гемінальні дигалогенопохідні утворюються при дії пентагалогенидів фосфору на альдегіди і кетони. Наприклад:
3.Віцинальні дігалогенопохідні можна одержати приєднанням галогенів до ненасичених вуглеводнів:
74
1,2-дибромпропан
4. Ді- і полігалогенопохідні з атомами галогенів у різноманітних вуглецевих атомів утворюються при дії галогеноводнів, галогенидів фосфору, хлористого тіонилу на гліколі або інші багатоатомні спирти:
Фізичні і хімічні властивості
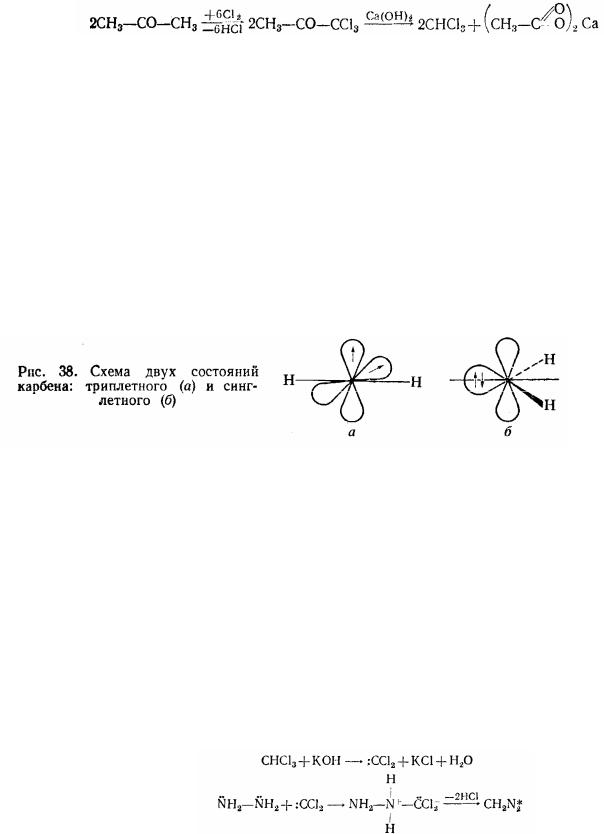
Ді- і полігалогенопохідні - важкі рідини або кристалічні речовини, нерозчинені у воді. Вони, як і галогеналкили, вступають у різноманітні реакції нуклеофільного заміщення (із водою, аміаком і т.п.). Якщо атоми галогену знаходяться при різних атомах вуглецю, то при гідролізі утворюються двохатомні спирти (гліколі). Наприклад:
Якщо атоми галогену знаходяться при однім вуглецевому атомі (гемінальні сполуки), то при гідролізі утворюються альдегіди, кетони або кислоти. Наприклад:
Реакції в усіх випадках йдуть через ряд стадій:
Окремі представники. Застосування.
Найбільше значення мають у техніці продукти хлорування метану і етану, а також фторхлориди.
Хлористий метилен СН2С12—рідина із Ткип.41°С. Застосовується як негорючий і легко літкий розчинник.
Хлороформ. Кипить при 61°С. Застосовується як розчинник (раніше він застосовувався головним чином у медицині для загального наркозу). У промисловості хлороформ одержують дією хлору або хлорного вапна на спирт:
2СС13-CHO+Cа(ОН)2 СНС13+Са(НО2)2
хлороформ форміат кальцію
або на ацетон:
75
хлороформ |
ацетат кальцію |
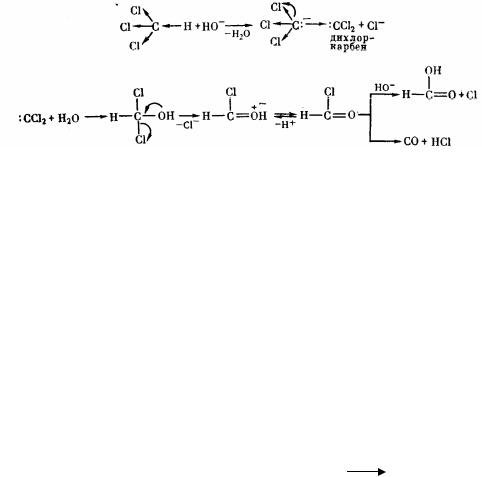
При дії на хлороформ лугів утворюється діхлоркарбен, який використовується в сучасній органічній хімії для введення метиленової групи. Діхлоркарбен може розглядатися яка галогенопохідне найпростішого двовалентного радикалу метилену. Спеціальну назву карбени одержали тому, що за властивостями вони не є повними аналогами одновалентних радикалів. Наявність двох незв'язаних електронів у того самого атому вуглецю надає карбенам специфічні властивості. Спини цих електронів (у залежності від природи карбену і методу його одержання) можуть бути рівнобіжними (триплетний стан) і антипараллельнимі (синглетний стан).
У триплетному стані карбени виявляють деякі властивості бірадикалів. У синглетному вони, з одному боку, мають дефіцит електронів, що ріднить їх з іонами карбонія, з іншого боку, мають вільну електронну пару, що робить їх аналогами карбаніонів. Тому карбени можуть виявляти як электрофільні, так
і нуклеофільні властивості в залежності від спроможності пов'язаних із карбеновим вуглецем атомів, а також від характеру реагенту.
У триплетному метилені має місце sp-гібридізація і два вільних електрони розташовані на двох негібридізованих p-орбіталях, у синглетному - обидва електрони знаходяться на гібридній орбіталі, що має більший s-характер і, отже, меншу енергію. Таким чином, варто було б очікувати, що синглетний стан буде більш стійким. Проте зменшення взаємного відштовхування електронів у триплетному стані (внаслідок того, що електрони розташовані на р-орбіталях і спини їх рівнобіжні) компенсує виграш енергії, пов'язаний із великим s- характером, і для незаміщеного метилену в незбудженому стані триплетний стан більш стійкий, чим синглетний. У той же час для діхлоркарбена більш стійкий синглетний стан.
Прикладами реакцій, що йдуть за участю дихлоркарбену, можуть служити реакції добування діазометану:
і згаданий вище гідроліз хлороформу:
76
Четиррьоххлористий вуглець. Застосовується як непальний розчинник, зокрема при гасінні пожеж, якщо горять рідини з щільністю нижче 1; для добування фреону-12.
1,2-Діхлоретан, Ткип. 84 °С. Дешевий, але отрутний розчинник. Вихідний продукт для синтезу хлористого винилу при синтезі пластичних мас.
Гексахлоретан. Кристалічна речовина з Тпл.187-188 °С. Застосовується як інсектицид (засіб боротьби зі шкідливими комахами), як глистогінний засіб (у ветеринарії), а також для виробництва димових шашок.
Велике застосування в техніці охолодження одержали поліфторхлоруглеводні (фреони). Фрєони— дуже стійкі сполуки, вони не гідролізуються і тому не метал під його дією не руйнується; їх використовують також як хладоагенти, як розчинники инсектофунгицидів для утворення аерозолей і як проміжні продукти в синтезі фторпохідних. Найбільш поширено фреон-12, який добувають з СС14 і НF у присутності каталізатору:
СС14+2НF [SЬF5] |
2НС1+СF2Сl2 |
Важливе застосування має фторотан СFз-СНС1Вг- безбарвна важка рідина з |
|
запахом, що нагадує хлороформ. Це |
одне з найефективніших засобів для |
загального наркозу. Має ряд переваг перед хлороформом: мало токсичен, майже не дає стадії порушення, наркоз швидко проходить.
ГАЛОГЕНОПОХІДНІ НЕНАСИЧЕНИХ ВУГЛЕВОДНІВ Номенклатура і ізомерія галогенопохідних ненасичених вуглеводнів у принципі не відрізняються від номенклатури і ізомерії насичених
галогенопохідних. Приклади:
СН2=СНСl |
хлоретен, хлористий винил; |
CCl2=CH2 |
1,1-діхлоретен, хлористий виніліден; |
CHCl=CHCl |
1. 2-діхлоретен; |
CHCl=CH-CH3 |
1-хлор-1-пропен; |
CH2=CH-CH2Cl |
3-хлор-1-пропен, хлористий алліл. |
Для одержання ненасичених галогенопохідних можуть бути використані методи одержання галогенидів насичених сполук.
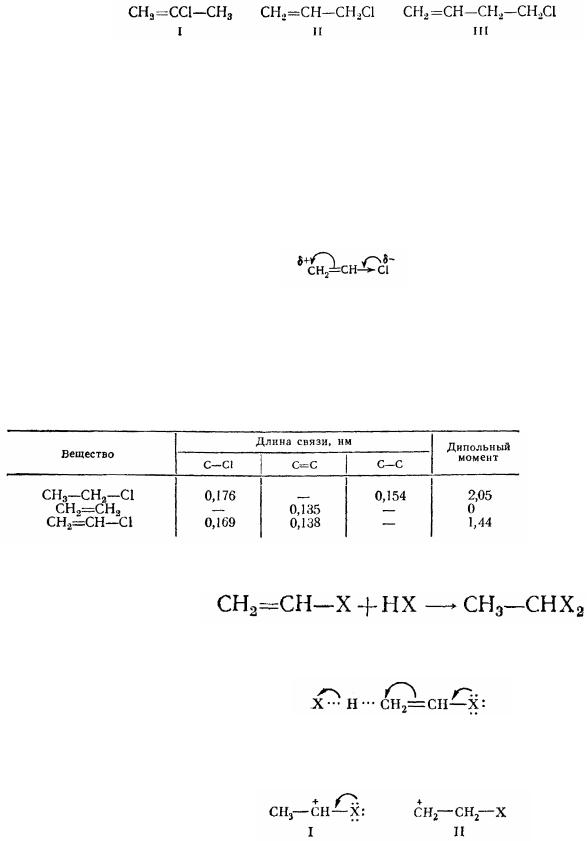
Фізичні властивості в гомологічному ряді підпорядковуються звичайним закономірностям. Великий інтерес подають розходження в хімічних властивостях нєнасичених галогенопохідних у залежності від положення атому галогена і подвійного зв'язку. За цією ознакою всі ненасичені галогенопохідні
77
можуть бути поділені на три групи:
1)з атомами галогену при вуглецю з подвійним зв'язком (I);
2)з атомами галогену в -положенні до подвійного зв'язку (II);
3)галогенопохідні з атомом галогену, віддаленим від подвійного зв'язку (III):
Для галогенопохідних першої групи характерна мала реакційна здатність атому галогена і подвійного зв'язку. Отут атоми галогену далеко не завжди можна замістити на які-небудь інші атоми і групи. Реакції приєднання за подвійним зв'язком йдуть дуже повільно. Взаємний вплив подвійного зв'язку й атому галогена пояснюється сполученням між вільними електронами атомів галогену і подвійного зв'язку. У результаті цього сполучення зв'язок галогену з вуглецем укорочується. Діпольний момент зв'язку знижується, тому що індукційна складова дипольного моменту і значно менший момент, що виникає завдяки сполученню, спрямовані в різні сторони:
Індукційний ефект атома галогену сильно зменшує електронну щільність
Таблиця 8. Довжина зв'язків і дипольні моменти насичених і нєнасичених
хлоропохідних
подвійного зв'язку, завдяки чому затрудняється электрофільне приєднання. Приєднання в цьому випадку йде за правилом Марковнікова:
По-перше, при электрофільній атаці тільки в цьому випадку можливо супряжний перехідний стан:
По-друге, із двох можливих проміжних катіонів більш стійкий, а отже, більш ймовірний катіон I, тому що його заряд частково компенсується сполученням із галогеном:
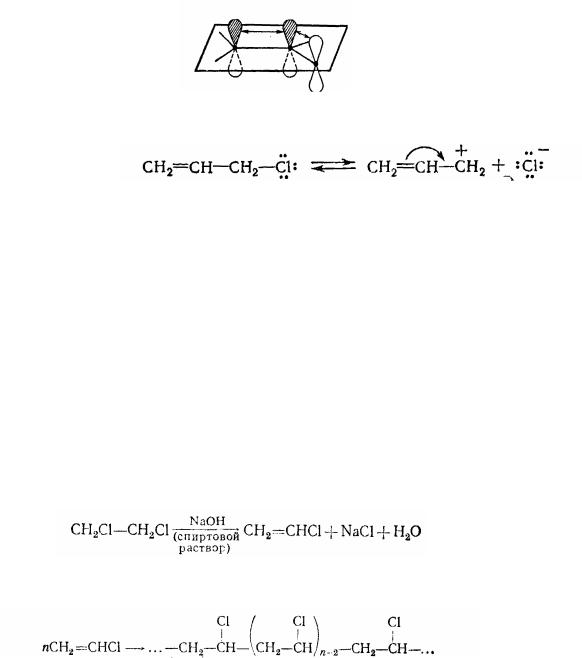
У випадку галогенопохідних іншої групи атом галогену легко заміщується. Це
78
пояснюється великою усталеністю (завдяки сполученню) карбонієвого іона, що виникає при дисоціації галогенопохідного типу:
В аллільному карбонієвому іоні обидві можливі насичені структури рівноцінні, що вказує на делокалізацію електронної щільності, а отже, на стабільність іону. Незважаючи на те, що в молекулах галогеналілів атом галогену сильно відтягає електрони, электрофільні реагенти приєднуються до них відповідно до правила Марковнікова. Тільки при подальшому накопиченні галогенів, наприклад у випадку трифторпропену СFз─СН═СН2, приєднання йде з порушенням правила Марковнікова.
Галогенопохідні третьої групи істотно не відрізняються за властивостями від насичених галогенопохідних, з одному боку, і від олефінов - з іншого.
Окремі представники. Найбільше технічне значення з галогенопохідних нєнасичених вуглеводнів мають хлористий винил, хлористий алліл, тетрафторетілен, хлоропрен.
Хлористий винил при звичайних умовах - газ. Одержують його або приєднанням хлористого водню до ацетілену, або відщепленням хлористого водню від дихлоретану:
Хлористий винил спроможний до фотохімічної, термічної і каталітичної полімеризації за схемою
полівінілхлорид
Полімери хлористого винилу широко застосовуються у виробництві ізоляційних матеріалів, непромоклих тканин і інших виробів.
Хлористий алліл - безбарвна рідина з Ткип 45°С. Утворюється хлоруванням пропіляну при високій температурі. Застосовується як вихідна речовина для одержання аллілового спирту і гліцерину.
Хлоропрен (Ткип 59°С) добувають приєднанням хлористого водню до винилацетілену у присутності Сu2Cl2. Застосовується для одержання дуже цінного виду синтетичного каучуку, стійкого до стирання, вогню, що важко пропускає гази. Полімеризація хлоропрену і вулканізація отриманого каучуку відбуваються самовільно під впливом кисню повітря.
Тетрафторетілен - безбарвний газ, Тпл76,3°С, Ткип.-142,5°С, щільність 1,533 (—80°С). Утворюється при піролізі фреона-22:

79
У присутності пероксидних каталізаторах під тиском тетрафторетілен полімерізується з утворенням продукту з молекулярною масою від 500 000 до 2 000 000, відомого за назвою тефлон. Відмітна властивість цього полимеру—
надзвичайная хімічна інертність. Він стійкий до всіх реагентів, за винятком розплавлених лужних металів. Водяні розчини лугів, концентровані кислоти (Н2SО4, НNO3), пероксид водню й інші окислювачи та органічні розчинники на нього не діють. Він може бути використаний в інтервалі температур від -70 до +250°С. З тефлону виготовляють стійкі до дії агресивних середовищ деталі апаратури.
Етіленові фторпохідні дуже часто в реакціях приєднання не підпорядковуються звичайним правилам, що визначають напрямок приєднання, внаслідок сильної електронегативності атому фтора.
ЛЕКЦІЯ № 7
ОДНОТА БАГАТОАТОМНІ СПИРТИ
Спиртами, або алкоголями, називають гідроксильнопохідні вуглеводнів. Спирти можуть бути насиченими і нєнасиченими. Атомність спиртів визначається числом гідроксильних груп (—ОН).
НАСИЧЕНІ ОДНОАТОМНІ СПИРТИ
Насичені одноатомні спирти мають загальну формулу СnН2n+2О або СnН2n+1ОН. У залежності від того, при якому вуглецевому атомі, первинному, вторинному або третинному, знаходиться гідроксил, розрізняють спирти первинні R—СН2ОН, вторинні R2СНОН і третинні RзС—ОН .
Ізомерія. Номенклатура
Ізомерія спиртів залежить від будови вуглецевого ланцюга і положення гідроксила в ланцюзі. Так, наприклад, спирти складу С4Н90Н можна розглядати як похідні вуглеводнів С4Н10 нормального бутану і ізобутану, у яких один атом водню заміщений групою ОН. Для нормального бутану:
Звичайно спирти називають за радикалом, що пов'язаний з гідроксильною групою. За систематичною номенклатурою назва спирту складається з назви відповідного насиченого вуглеводню з додаванням до суфіксу -ан суфіксу -ол і

80
вказівкою номера вуглецевого атому, при якому знаходиться гідроксил (табл. 9). Крім того, спирти можна називати як заміщені метилового спирту— карбінолу.
Засоби добування
Існує багато засобів добування спиртів. Приведимо лише найпростіші з них. 1. Спирти одержують гідролізом галогеналкилов при нагріванні з водою або
водяним розчином лугів. У першому випадку реакція оборотна:
2. Синтез спиртів здійснюється дією металорганічних, зокрема магнийорганічних, сполук на альдегіди, кетони і складні ефіри. Вперше такий синтез із застосуванням цинкорганічних сполук було здійснено О.М.Бутлеровим. Синтез спиртів за допомогою магнийорганічних сполук розроблено Гриньяром і проходить за такою схемою. У альдегідах, кетонах і складаних ефірах є
Номенклатура спиртів
карбонильна група, у якій електронну хмару усунуто до атому кисню. Завдяки цьому зсуву на атомі вуглецю виникає деякий позитивний заряд, а на атомі кисню дрібній негативний заряд. У магнийгалогеналкилі R—МgВг залишок R поводитися як нуклеофільная частка, що легко приєднується до вуглецевого атому карбонильной групи. Реакція пеоебігає за схемою:
Добута сполука (магнійбромалкоголят) легко гідролізується з утворенням відповідного спирту:
а) синтези за цією схемою з мурашиним альдегідом призводять до первинних спиртів:
б) із всіма іншими альдегідами утворюються вторинні спирти:
в) взаємодією магнійгалогеналкилів із кетонами одержують третинні спирти:
