
конспекты / ------------------
.pdf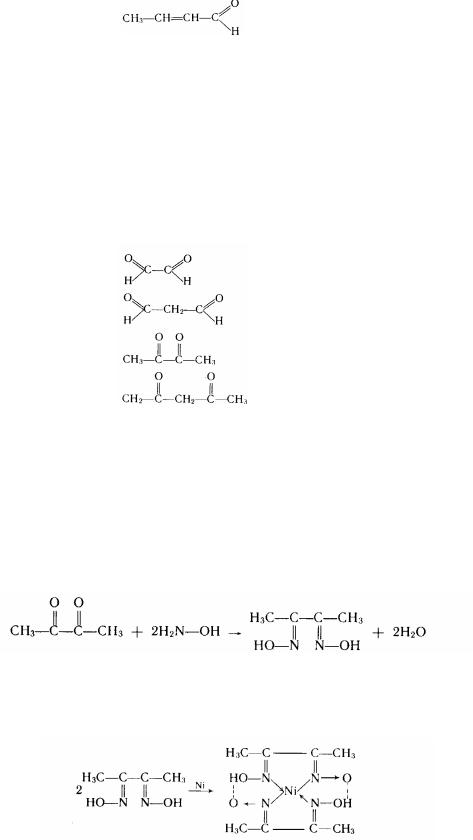
111
Кротоновий альдегід(бутен-2'аль) Він легко полімерізуеться і застосовується для одержання деяких полімерів. Це рідини з різким подразним запахом. Утворюється кротоновою конденсацією оцтового альдегіду. При окисленні дає кротонову кислоту, ефіри якої використовують для одержання полімерів.
Дікарбонильні сполуки
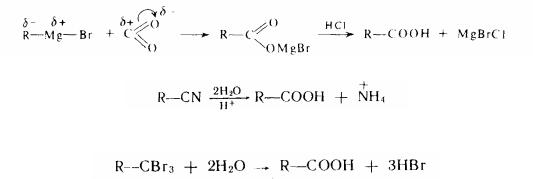
Існують сполуки, що містять у молекулі дві карбонільні групи: діальдегіди і дікетони:
-глиоксаль, або этандіаль
-малоновый альдегід, або пропандіаль
-діацетил, або бутандіон-2,3
-ацетилацетон, або иентандіон-2,4
Властивості діальдегідів і дікетонів залежать від взаємного розташування карбонільних груп. Сполуки, що містять карбонільні групи поруч ( --положення), мають підвищену реакційну спроможність. З таких варто назвати діацетил, що легко утворить діоксим
діметилгліоксим
Ця сполука є реактивом на нікель, із яких він утворює комплекс, пофарбований у рожевий колір:
Сполуки, що містять карбонільні групи в -положенні, виявляють особливі властивості. Наприклад, у молекулі ацетилацетону (пентандион-2,4) СНз—СО— СНз—СО—СНз водневі атоми метиленової групи, що знаходиться між двома карбонілами, мають підвищену рухливість (рКа ==25). Один із цих воднів у виді

112
протону мігрує до кисню карбонільною групи, створюючи єнольну форму, що є ізомерною формою ацеилацетону:
кетонна форма (15%) |
єнольна форма (85%) |
Це один із випадків кето-єнольної таутомерії Незважаючи на звичайну нестійкість єнольної форми, у даному випадку вона стає стабільною за рахунок утворення внутримолекулярного водневого зв'язку, що замикає систему в стійке шестичленное кільце.Енольна форма ацетилацетону спроможна утворювати стійкі єноляти з багатовалентними металами (Сu, Ni, Ве, А1, Сг, Fе й ін.). Такі сполуки називають внутрикомплексними сполуками або хелатами (від грек. сhе1а - клішня):
Хелатні сполуки знаходять застосування в аналітичній хімії як реактиви, а також для одержання металів високої чистоти.
ЛЕКЦІЯ № 9
КАРБОНОВІ (АЛКАНОВІ) КИСЛОТИ І ЇХ ПОХІДНІ
Карбоновими кислотами називають похідні вуглеводнів, що містять у молекулі одну або декілька карбоксильних груп - СООН. Карбоксильну групу можна розглядати як формальне сполучення карбонільної групи і гідроксила («карбоксил»). Загальна формула карбонових кислот R—СООН.
У залежності від природи радикала, пов'язаного з карбоксильною групою, карбонові кислоти поділяють на насичені і ненасичені. Число карбоксильних груп визначає основність кислот: кислоти з одною карбоксильною групою є одноосновними, з двома - двохосновними і т.д. Крім того, за кількістю вуглецевих атомів у радикалі розрізняють кислоти нижчі (низькомолекулярні) і вищі (високомолекулярні). Вивчення карбонових кислот краще починати з розгляду одноосновних насичених кислот, загальна формула котрих
СпН2п+1СООН.
Номенклатура і ізомерія
Номенклатура. Карбонові кислоти частіше усього називають відповідно до тривіальної номенклатури. Назви ці звичайно пов'язані з джерелами, із яких вони

113
були виділені вперше: наприклад, мурашинв кислота - із мурашів, оцтова кислота - з оцту, масляна кислота - з олії і т.д. Карбонові кислоти можна розглядати як похідні оцтової кислоти і називати за раціональною номенклатурою:
діметилуксусна кислота Назви карбонових кислот за систематичною номенклатурою складають від назв
відповідних (із тим ж числом вуглецевих атомів) насичених вуглеводнів із додаванням закінчення -овая і слова «кислота». Нумерація головного ланцюга починається з вуглецю, що входити до складу карбоксильною групи.
Ізомерія карбонових кислот, як і альдегідів, залежить від будови вуглецевого ланцюга (радикала), пов'язаної з карбоксильною групою. Перші три представники гомологічного ряду насичених одноосновних карбонових кислот (мурашина НСООН, оцтова СНзСООН і пропіонова С2Н5СООН) ізомерів не мають. Ізомери в цьому ряду з'являються з масляної кислоти, що містить чотири вуглецевих атоми в молекулі:
ізомасляна, або метилпропанова кислота
Валеріановая кислота має вже чотири ізомери:
валеріановая, або пентановая, |
изовалеріановая, або |
кислота |
2-метилбутанова, |
ізовалеріанов, або |
триметилоцтова або 2,2-диметил- |
3-метилбутанова кислота, |
пропановая,кислота |
Засоби добування
Карбонові кислоти зустрічаються в природі у вільному стані (наприклад, мурашина кислота - у кропиві, фруктах; ізовалеріянова - у валеріяновому корені і т.д.), а також у вигляді їх похідних, в основному у вигляді складаних ефірів. Проте основним джерелом одержання карбонових кислот є органічний синтез. Їх можна одержувати такими засобами.
1.Окислення спиртів, альдегідов і кетонів, парафінів.
2.Оксо-синтез:
Каталізаторами при цьому можуть бути концентровані кислоти (Н2S04 і НзР04)
114
або Ni(СО)4 (тетракарбонил нікелю). Процес проводять при високій температурі і тиску.
3.Взаємодія магнійорганічних сполук із діоксидом вуглецю:
4.Гідроліз нітрилов (К-С=N) у кислому або лужному середовищі при нагріванні:
Гідроліз три галогенпохідних
Фізичні властивості
Перші три члени гомологічного ряду карбонових кислот: мурашина, оцтова і пропіонова - рухливі рідини з гострим запахом, що змішуються з водою в усіх відношеннях. Починаючи з масляної кислоти (С4) - оліїсті рідини, погано розчинні у воді, із різко неприємним запахом. Вищі кислоти (із С10) -тверді тіла, що не мають запаху. Вони практично нерозчинні у воді, але розчиняються в ефірі і бензолі. При перегонці в звичайних умовах розлагаються.
Фізичні властивості деяких карбонових кислот приведені в табл. 10.
Зі збільшенням молекулярної маси кислот підвищується їхня температура кипіння і знижується щільність. Відзначено цікаву залежність: температура плавлення кислот, що містять четне число вуглецевих атомів, вище, чим температура плавлення сусідніх гомологів із нечетним числом атомів вуглецю. Температура кипіння кислот із нормальною будовою вуглеводневого радикалу вище, чим кислот із ізобудовою. Карбонові кислоти в порівнянні зі спиртами (із тим же числом вуглецевих атомів) мають більш високі температур кипіння і плавлення. Це можна пояснити значною асоціацією молекул кислот за рахунок більш тривких, чим у спиртах, водневих
Таблиця 10. Фізичні властивості деяких насичених одноосновних кислот
115
зв’язків (зв'язок О-Н у кислотах більш поляризована), що утворюються при взаємодії гідроксильного водню однієї молекули з киснем карбонільної групи іншої:
циклічний дімер
Для карбонових кислот більш характерна асоціація за циклічним дімерним типом.Перебування молекул карбонових кислот у стані асоціації, причому попарної, доведене визначенням їхньої молекулярної маси, що виявилася подвоєною. Дімерна структура зберігається у всіх агрегатних станах кислот. Тільки вплив високих температур (наприклад, понад 250°С для оцтової кислоти) може призвести до розпаду ассоціатов на окремі молекули.
У ІК-спектрах коливання карбоксильної групи дімеру виявляються широкою й інтенсивною смугою в області 1720-1700см-1. Внаслідок сильного межмолекулярного водневого зв'язку спостерігається широка смуга поглинання в області 33002500см"1, характерна для валентних коливань асоційованих гідроксильних груп. В УФ-спектрах карбонових кислот є смуга поглинання при
^200 нм:
Хімічні властивості
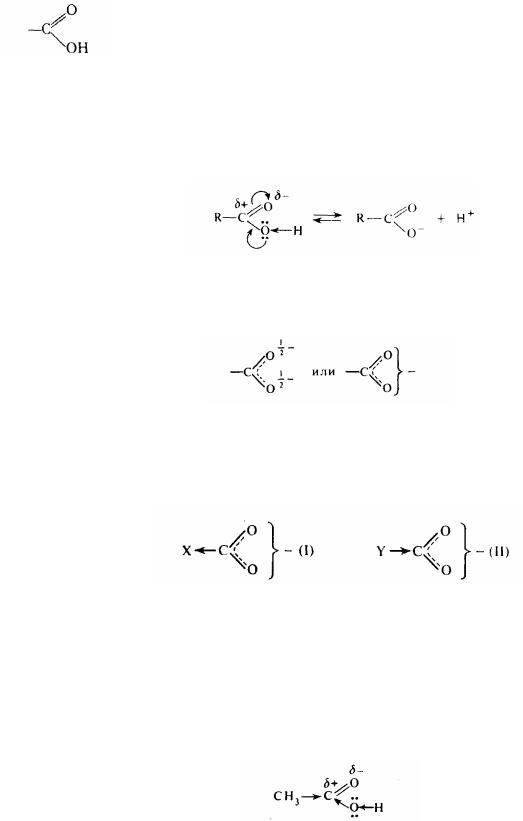
Хімічні властивості карбонових кислот визначаються будовою карбоксильної групи:
116
У цій групі електронна щільність зв'язку О—Н усунута до атому кисню, що має велику електронегативність. У свою чергу під впливом поляризованої карбонільної групи такий зсув посилюється ще в більшому ступені. У результаті полегшується відрив атому водню у вигляді протону - відбувається процес кислотної дисоціації (у водяному розчині протон перетворюється в іон гідроксонія НзО+):
Відповідно до рентгеноструктурних досліджень обидва атоми кисню в карбоксілат-іоні знаходяться на однаковій відстані від вуглецю. На підставі цього можна уявити структуру такого іона з рівномірним розподілом електронної щільності між двома зв'язками О-С:
Отже, присутність карбоксильної групи є причиною появи кислотних властивостей у карбонових кислотах. Але сила цих кислот залежить і від природи радикалів, пов'язаних із карбоксилом. Якщо радикал має електроноакцепторні властивості, то сила кислоти збільшується (I). Навпаки, електронодонорні замісники викликають обернений ефект (II):
(X стабілізує аніон) |
(V дестабілізує аніон) |
У першому випадку радикал стабілізує аніон, а в другому - робить його менше стійким (дестабілізує).
З карбонових кислот найдужчої є мурашина кислота; інші члени гомологічного ряду - досить слабкі кислоти (див. табл. 10). Вони набагато слабші більшості мінеральних кислот (але сильніше вугільної). Справа в тому, що алкильні радикали, що володіють електронодонорними властивостями (+1- ефект), понижають частковий позитивний заряд на вуглеці карбонілу:
оцтова кислота Це призводить до зменшення зсуву електронної щільності з бокові
гідроксильної групи, а це значить - до зменшення сили кислоти. У той ж час заміна водневих атомів у радикалі на електронегативні (електроноакцепторні) атоми, наприклад галогени, призводить до збільшення кислотності цих сполук:

117
Приведемо приклади, що показують вплив таких замісників на силу кислот:
Як бачимо з цих прикладів, галогенозаміщені кислоти - найбільш сильні кислоти. У цьому випадку позначається прояв індуктивного -/-ефекту атомів хлору. Проте вплив галогенів швидко слабшає в міру віддалення їх від карбоксильної групи:
Включивши карбонові кислоти в ряд сполук, простежимо зміну значень рКа:
Як бачимо, що кислотні властивості зменшуються зліва праворуч. Зупинимося тепер більш докладно на властивостях карбонових кислот.
1. Утворення солей. Карбонові кислоти вступають у взаємодію з металами, їхніми оксидами, із лугами або основами, створюючи солі:
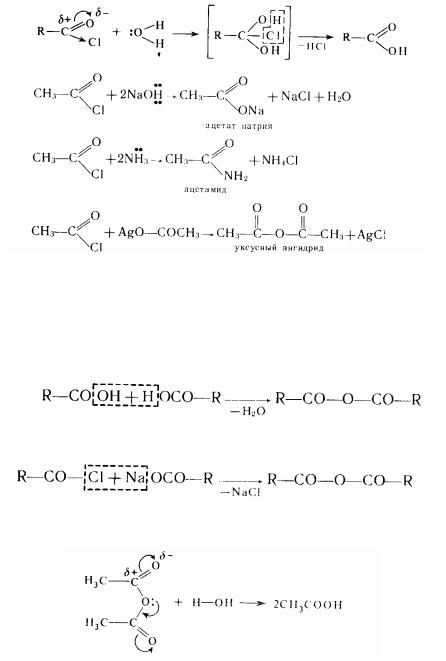
2. Утворення галогенангідридів. Галогенангідриди - продукти заміщення гідроксильних груп у карбоксилі на галоген. Вони утворюються при взаємодії карбонових кислот із галогенидами фосфору (РС15, РС1з) або хлористим тионілом SОСl2:
Одновалентний залишок R—СО-, пов'язаний із галогеном, називають кислотним радикалом або ацилом. Назви ацилов утворені від латинських назв кислот, наприклад:
формил ацетил пропіонил
Назва галогенангідридів складають від назв галогенів і пов'язаних із ними кислотних радикалів (ацилов):
хлористий формил бромистий ацетил |
. |
118
(формилхлорид) |
(ацетил бромід) |
Галогенангідриди мають велику реакційну спроможність. Атом галогену, пов'язаний з ацильной групою, надзвичайно рухлив і легко вступає в реакції обміну. Це відбувається при взаємодії галогенангідридів із сполуками, що містять атом металу або активний (рухливий) атом водню. Спочатку нуклеофільний реагент атакує позитивно заряджений атом вуглецю карбонільної групи, а потім рухливий атом водню приєднується до кисню цієї групи. Проміжний продукт , що утворився , утрачає галогеноводень з утворенням кінцевого продукту:
Такі реакції називають реакціями ацилювання, тому що вони дозволяють ввести в
молекулу багатьох речовин ацильний радикал R-CO-, і йдуть за механізмом нуклеофільного заміщення.
3. Утворення ангидридів. При відібранні молекули води від двох молекул карбонової кислоти утвориться ангідрид:
Практично це можна здійснити, діючи на сіль карбонової кислоти її галогенангидридом:
Ангідриди кислот, як і галогенангідриди, є агентами , що ацилюють , й активно реагують із речовинами, що володіють нуклеофільними властивостями:
Ангідриди нижчих кислот - рідини з їдким запахом, нерозчинні у воді.
3.Утворення амідов кислот. Докладніше про засоби одержання і про властивості амідів кислот див. нижче
4.Утворення пероксидів і гідропероксидів

119
гідропероксиду |
ацетилу ацетилу |
Пероксид і гідропероксид ацетилу дуже хитливі і вибухові. При їх нагріванні відбувається утворення вільних радикалів:
5. Утворення складаних ефірів (див. гл. III, § 27). Карбонові кислоти і спирти при мінеральних кислот утворять складні ефіри:
Окремі представники одноосновних насичених кислот
Мурашина кислота (метанова) НСООН - перший представник гомологічного ряду карбонових кислот. Безбарвна рідина з різким запахом. Свою назва кислота одержала в зв'язку з виділенням її вперше з червоних лісових муравьев (від лати. Formica rufa) звідси і її латинське назваFormikum acidum Мурашина кислота зустрічається у вільному вигляді.Вона міститься в соку кропиви, хвої, фруктах, а також у поті і мочі. У промисловості одержують із її натрієвої солі, що утворюється при пропусканні оксиду вуглецю крізь розплавлений гідроксид натрію:
Мурашина кислота - сама активна в ряду інших карбонових кислот. Це пояснюється тимо що її карбоксильна група пов'язана не з радикалом, а з атомом водню, що не зменшує (але і не збільшує) кислотні властивості цієї групи: її рКа=3,75. Подивившись декілька інакше на структуру мурашиної кислоти, можна переконатися, що її молекула містить альдегідну групу:
Тому вона, подібно альдегідам, є сильним відновником:
При нагріванні з концентрованою сірчаною кислотою ця кислота розкладається з утворенням оксиду вуглецю і води:
Форміат натрію (натрієва сіль мурашиної кислоти) при сплавлінні утворює сіль щавлевої кислоти:

120
Мурашину кислоту застосовують у текстильній промисловості (як протрави при фарбуванні), шкіряній (дубління шкір), медицині, виробництві деяких полімерів, а також в органічному синтезі.
Оцтова кислота (этанова) СН3—СООН при звичайній температурі - безбарвна рідина з різким запахом. Безводна оцтова кислота, що замерзає при 16,6°С, називається крижаної. Водяний розчин (70-80%) оцтової кислоти називається оцтовою есенцією, а 3-5% водяний розчин -столовим оцтом.Оцтова кислота широко зустрічається в природі. Вона міститься в мочі, поті, жовчі і шкірі тварин, у рослинах. Утворюється при оцтовокислому бродінні рідин, що містять спирт (вино, пиво й ін.). Це відбувається під впливом «оцтового грибка», що завжди присутній у повітрі:
У промисловості оцтову кислоту одержують при жидкофазному окисленні вуглеводнів нафти у присутності солей марганцю (каталізатор):
Крім того, її можна одержати з ацетилену (через оцтовий альдегід) за реакцією Кучерова або окисленням етилового спирту. Оцтова кислота - слабка кислота, її рКа==4,75. Вона широко використовується в хімічній промисловості у виробництві ацетатного шовку, барвників, складаних ефірів, ацетону, хлороцтової кислоти, оцтового ангідриду, солей і т.д. Застосовується в харчовій промисловості, а також в органічному синтезі (наприклад, як агент , що ацилює).
Хлороцтова кислота (хлоретанова) С1СН2—СООН—тверда кристалічна речовина, що існує в трьох модифікаціях ( , і γ). Одержують при хлоруванні оцтової кислоти у присутності червоного фосфору (реакція Гелля-Фольгарда- Зелинского) :
Атом хлору посилює кислотні властивості (рКа=2,861). Хлоруксусна кислота - цінний продукт при виробництві індіго-барвників, карбоксиметилцеллюлози і інших органічних сполук.
Трифтороцтова кислота (трифторетанова) СFз—СООН - рідина. Ця кислота з рКа==0,23 ще більш сильна, чим хлороцтова. Застосовується як каталізатор при ацилюванні спиртів і целюлози.
Одноосновні ненасичені кислоти
Одноосновні ненасичені кислоти містять ненасичені вуглевододні радикал,
пов'язаний із карбоксильної групою. Загальна формула таких кислот (з одним подвійним зв'язком) має вид СпН2п-1СООН. У молекулі ненасичених карбонових кислот можуть міститися два і більш етіленові зв'язки, а також потрійний зв'язок. Прикладами таких кислот можуть бути: акрилова кислота СН2=СН—СООН, метакрилова кислота СН2=С(СНз)—СООН, кротонова кислота СНз—СН==СН— СООН, пропінова кислота СН С—СООН, а також вищі ненасичені кислоти (олеінова, линолева і линоленова).
Ізомерія цих кислот подібна ізомерії ненасичених вуглеводнів.
Акрилова кислота СН2===СН—СООН, що містить три вуглецевих атоми, не має ізомерів, а ненасичена кислота з чотирма вуглецевими атомами має три ізомера:
