
конспекты / ------------------
.pdf
181
Повторні ароматні аміни і жирно-ароматні аміни, будівля яких можна висловити загальними формулами Аг2NН і Аг—NH—А1к, одержують:
а) нагріванням первинних духмяних амінов із їхніми солями:
дифениламин
б) алкілірованієм первинних духмяних амінов за допомогою спиртів або галогенопроізводних:
солянокислий
метиланилин
Третинні ароматні і жирно-ароматні аміни (Агз, Аг2N - А1к, Аг А1к2) часто одержують алкілированієм або арілірованнєм первинних або повторних духмяних амінов:
діметиланілін
Фізичні властивості. Ароматні аміни - токсичні рідини або тверді речовини. Частково розчинних у воді (насичений водяний розчин анілину при 20°С містить 3,4% цієї речовини). З збільшенням числа аміногруп розчинність підвищується. Хімічні властивості. Властивості духмяних амінов визначаються присутністю аміногрупи, пов'язаної з ароматним ядром. Якщо аміногрупа знаходиться в бічному ланцюзі, те такі аміни мають звичайні властивості аліфатичних амінов. Роздивимося основні хімічні властивості духмяних амінов на прикладі анілину. 1. Анілін, володіючи основними властивостями, утворить із кислотами солі, наприклад:
Проте ароматні аміни володіють меншої основноcтью, чим аліфатичні. Це обумовлено сполученням вільної електронної пар атома азоту з ? -електронною системою бензольного каблучки:
анілін Таке сполучення понижає спроможність вільної пар зв'язувати протон при
взаємодії анілину з кислотами. Розташувавши аміни в міру ослаблення основності, одержимо такий ряд:
Таким чином, чим більше атомів водню в молекулі аміаку зміщено на бензольні каблучки, палимо нижче основність духмяних амінов, що утворилися. Наприклад, тріфеніламін майже зовсім не має основні властивості.
2. Ароматні аміни, як і аміни масного ряду, вступають у реакції алкілірованія й ацилірованія. У першому випадку утворяться алкильні, а в другому - ацильні похідні:
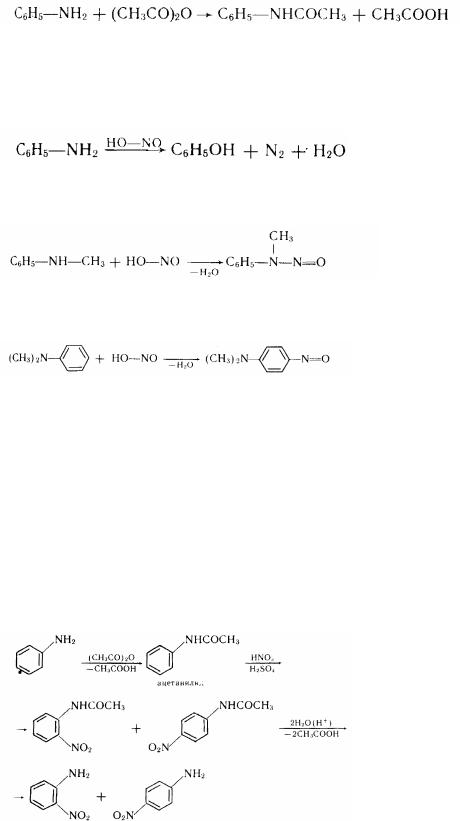
182
йодистоводородний метіланілін
ацетанілід
Ацільні похідні аніліну називаються анілідами.
3. Ароматні аміни, у залежності від того, чи є смердоти первинними, повторними або третинними, по-різному взаємодіють з азотистою кислотою. Первинні аміни при цьому утворять феноли:
Як відомо, аліфатичні аміни в цих умовах утворять спирти.
Повторні аміни, подібно аліфатичним амінам, з азотистою кислотою дають нітрозоаміни:
N-нітрозометіланілін
Взаємодія третинних амінов з азотистою кислотою призводить до одержання n- нітрозообєднань із нітрозогрупою у ядрі:
n-нітрозодіметиланілін
Аліфатичні третинні аміни з азотистою кислотою, як відомо, не взаємодіють.
4.Ароматні аміни на відміну від амінов аліфатичного ряду, легко окисляються. Наприклад, хромова суміш перетворює анілін у «чорний анілін» - барвник чорного цвіту, що застосовується в техніку. Так, «пігмент глибоко-чорний» - продукт окислювання анілину, використовується для фарбування полімерів.
5.Ароматні аміни легко вступають у реакції электрофільного заміщення. Проте аміногрупа, приходячи заступником першого роду, робить настільки сильний вплив, що активує, на бензольне ядро, що при деяких реакціях електрофільного заміщення, наприклад при нітрованії, може відбутися «окислювання» молекули анілину. Тому аміногрупу перед нітрованієм попередньо «захищають» ацилірованієм:
о-нітроанілін n-нітроанілін
При цьому утворяться головним чином n - ізомери.
6. При дії на анілін сірчаною кислотою утвориться серно - кисла сіль анілину, що в середовищі о-діхлорбензола при 175180°С перегруповується в сульфанілову кислоту. Вода , що виділяється при реакції , отгоняється у виді азеотропної суміші з о-діхлорбензолом:
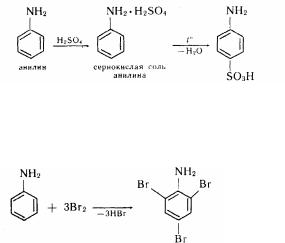
183
сульфаніліва кислота
7. Реакція галогенування духмяних амінов протікає настільки легко, що навіть дія бромної або хлорної води на анілін призводить до утворення 2,4,6-трибром- або трихлораніліну:
триброманілін
При галогенуванні вільними галогенами для одержання моногалогенозамещенного анілину необхідний попередня «захист» аміногрупи. Окремі представники. Анілін (феніламін) С6Н5—NН2 - безбарвна рідина, що швидко сутеніє при збереженні в результаті окислювання;
t стосів =184,4°С. Для очищення анілину використовують метод перегонки з водяним пар.
Анілін - цінний хімічний продукт. Він застосовується у виробництві анілінових барвників, фармацевтичних препаратів, пришвидшувачів вулканізації до антиоксидантів.
N,N-Діметиланілін С6Н5N(СНз)2 - рідина з t стосів =194°С. Використовується у виробництві барвників і вибухових речовин.
Толуїдині (толуєнаміни) С6Н4(СНз)NН2
- ізомері. n-Толуїдин кристалічна речовина; tпл=45°С. Інші ізомері - рідини. Застосовуються у виробництві барвників.
Сульфанілова кислота Н2N-СеН4-S0з - кристалічна речовина з t пл = 290°С (із розкладанням). Являє собою внутрішню сіль
HзN—С6Н4—S0з за рахунок взаємовпливу двох груп - аміногрупи (властивості підстави) і сульфогрупи (властивості кислоти); рKа = 3,2.
Сульфанілова кислота широко використовується в анілінофарбової промисловості й у медицині (для одержання сульфамідних препаратів - стрептоциду, норсульфазолу, сульфадимезину, етазолу й ін.). Може застосовуватися в якості пришвидшувача твердіння бетону.
ДИАЗО- І АЗОСОЕДИНЕНИЯ Ароматні діазосполучення
Ароматні діазосполучення - це речовини з загальною формулою Аг—N2Х, у молекулах яких утримується група з двох атомів азоту - азогруппа (-N=N-), пов'язана одночасно з ароматним радикалом Аг і залишком сильної кислоти (частіше з галогеном) або з гідроксилом, Найважливішими представниками духмяних діазосполучень є солі діазонія.
Прикладом таких солей може бути хлорид фенілдіазонія: [С6Н5—N2] +Сl-
Діазокатіон таких солей має така будівля:

184
Позитивний заряд у ньому розподілений на обох атомах азоту, але найближчий до духмяного ядра має більший заряд, чим крайній (? +>? '+).
Одержання. Солі діазонія утворяться при дії азотистої кислоти на солі анілину:
Ця реакція відома як реакція діазотированія. Смердота відкрита П. Гриссом у 1858 р. Реакцію діазотированія проводять при температурі від 0 до —5°С (не вище) при перемішуванні. Замість хитливої у вільному стані азотистої кислоти застосовують її сіль і сильну мінеральну кислоту (частіше соляну). Ця реакція пришвидшується при электроноакцепторних заступників у духмяному ядрі.
Солі діазонія звичайно не виділяють у твердому виді, тому що смердоти надзвичайно вибухові. Звичайно використовують їхні водяні розчини.
Механізм реакцій діазотированія можна уявити такою уявою. У водяному розчині азотиста кислота в дужекислой середовищі утворить декілька
агентів , що діазотирують : протоніровану азотисту кислоту (Н2NО2), оксид азоту (III) (N20з) і ін. При взаємодії з анілином будь-який із них може утворити первинний духмяний нітрозамін:
нитрозамин |
|
|
Нітрозамін перетворюється потім у свою таутомерну форму - діазогідрат, |
що |
|
при дії кислоти переходити в сіль діазонія: |
|
|
діазогідрат |
сіль діазонія |
|
У водяному розчині існує декілька ізомерних форм діазосполучень, що знаходяться між собою в складаному кислотно-основному і таутомерному рівновазі:
Краще існування кожній із цих форм визначається р середовище. Діазогідрат у вільному стані не виділений. У водяних розчинах він виявляє амфотерні властивості:
диазотат натрію
Діазоаніон (діазотатіон) існує у виді двох просторових ізомерів (син- і антиформ).
Хімічні властивості. Ароматні діазосполучення - дуже реакционноспособні. Їхні хімічні перетворення можна розділити на два типи:
I. Реакції, що протікають із виділенням азоту. 1. Реакція розкладання солей діазонія (утворення фенолів):
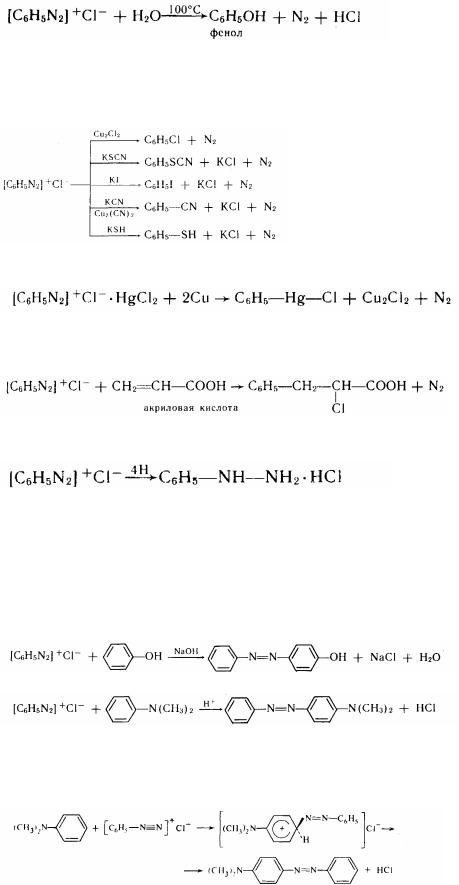
185
2.Реакція Гаттермана - Зандмейера. Ця реакція дозволяє заміщати діазогрупу на галогени, СМ, 8СМ, М02 і інші групи при каталізаторів (солей одновалентної міді) у соляно-кислому розчині:
3.Реакція А. Н. Несмеянова. За допомогою цієї реакції можна одержати металлорганічні з'єднання багатьох металів:
подвійна сіль діазонія
4. Реакція Меервейна. Солі діазонія спроможні взаємодіяти з з'єднаннями, що містять сполучені подвійні зв'язки:
II. Реакції, що йдуть без виділення азоту. 1. Утворення фенілгідразина (відновлення солей діазонія):
солянокислий фенилгідразин Так у промисловості одержують фенилгідразин. У якості восстановлювача
застосовують SnСl2 у НС1 або суміш сульфіта і гідросульфіта натрію.
2. Реакція азосочетання. Ця реакція має велике практичне значення. Смердота дозволяє одержувати азокрасителі - представники одного з найбільших по чисельності класів барвників. Солі діазонія легко взаємодіють із фонолами в слабощелочном розчині і з духмяними амінами - у слабокислом:
фенол п -оксиазобензол
диметиланилин n-диметиламиноазобензол
Сполучення завжди йде в n-положенні, а якщо воно зайнято, ті в о-положении. Азосочетаніє ставитися до реакцій електрофільного заміщення.
Диазокатіон - найдужчий электрофільний реагент:
п-діметиламіноазобензол
Азобєднання й азокрасителі
Речовини, що утворяться по реакції азосочетання, ставляться до класу духмяних азообєднаня. Азообєднання - органічні речовини, у молекулах яких утримується

186
азогрупа -N=N-, пов'язана з двома духмяними радикалами. Найпростішим представником духмяних азообєднаня є азобензол, що є основним угрупованням азокрасителей:
Азобензол - пофарбоване в жовтогарячий цвіт з'єднання. Його фарбування пов'язане з палимо, що до складу молекули азобензолу входять азогрупа» який спроможна поглинати світло у видимій області спектра. Проте самий азобензол не є барвником.
Довжина хвилі, нм.
Малий. 33. Поглинання світла тілом (речовиною) і його фарбування
Фарбування речовини пов'язана з його спроможністю поглинати з видимої частини спектра (в інтервалі довжин хвиль від 800 до 400 нм) тільки деякі промені з визначеними довжинами хвиль, тобто з визначеною енергією. При цьому непоглощенні промені, що є додатковими до поглинених, отражаясь від тіла, сприймаються нами як його фарбування. Наприклад, якщо тіло поглинає всі промені, крім червоних (620-400 нм), ті ми бачимо його пофарбованим у червоний цвіт (800620 нм) (малий. 33).
Поглинання світла визначається станом електронів у молекулі. Оскільки енергія поглинених променів витрачається на порушення зовнішніх електронів, стан яких може бути різноманітним (? - або π -електрони), ті, змінюючи хімічну будівлю молекули барвника, можна в широкому інтервалі змінювати інтенсивність і характер поглинання світла. Для порушення електронів, що утворять прості σ - зв'язку (σ -електрони), потрібно велика енергія. Тому насичені з'єднання поглинають тільки в далекої ультрафіолетової
187
області, промені якої мають достатню енергію. У тієї ж час з'єднання, що мають подвійні зв'язки, поглинають у видимій області або на її межі, тому що вхідні в молекулу π -електрони потребують для свого порушення меншої енергії. Таким чином, для появи фарбування необхідно наявність у молекулі речовини достатньо довгої сполученої системи подвійних зв'язків або інших
спроможних до поглинання в цій області спектра угруповань (-N=N-, С=0 і ін.). Така система сполучених зв'язків» відповідно до сучасної теорії
кольоровості, є основною хромофорною групою (від греч. сhгоmа - цвіт і рhогоs - несучий) барвників. Введення інших груп у молекулу барвника - ауксохромов (від греч. аuхсаnо - збільшую) сприяє поглибленню фарбування, підвищенню її інтенсивності. Ауксохромні групи (—ОН, —NН2, —СООН, —S0зН-та ін.), володіючи электронодонорнимі і электроноакцепторнимі властивостями, призводять до зсуву π -електронної щільності по системі сполучених подвійних зв'язків під впливом світлової енергії.
Таким чином, органічні барвники - це з'єднання, що містять ланцюг сполучених подвійних зв'язків і принаймні два ауксохрома, між якими розподілений іонний заряди. Так, оксид- і аміноазобензол є барвниками, тобто смердоти спроможні офарблювати інші предмети, наприклад тканина.
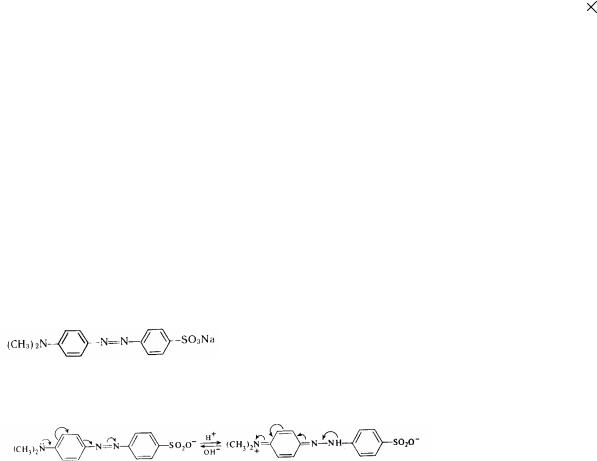
Багато азокрасителі використовуються в якості індикаторів, тому що їхнє фарбування може змінюватися в залежності від середовища. Дуже часто в аналітичній практика використовується індикатор - метиловий жовтогарячий:
Під впливом кислот він може змінювати фарбування від оранжево-жовтої до червоної. Це пов'язано з виникненням в однім із бензольних каблучок хиноидной структури:
оранжево-жовте фарбування |
червоне фарбування |
Інтервал такого переходові спостерігається при р 3,1-4,4.
Азокрасителі можна синтезувати безпосередньо на волокні. При цьому барвник, що утвориться, буде міцно пов'язаний із волокном тканини. Оскільки процес діазотировання й азосочетання проводять при охолодженні льодом, цей метод фарбування одержав назву крижаного фарбування.
Азокрасителі (азопігменти й азолаки) застосовують також і для фарбування полімерів, штучних і синтетичних волокон, а також у якості пігментів для малярських і інших фарб.
З'ЄДНАННЯ ДУХМЯНОГО РЯДУ, щ МІСТЯТЬ КИСЕНЬ
Феноли Органічні сполуки, що містять гидроксильну групу, пов'язану безпосередньо з
бензольнім ядром, називають фононами: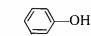
У залежності від числа гідроксильних груп у

188
ядрі розрізняють одно-, двух- і трехатомні феноли.
Номенклатура і ізомерія. Феноли називають або тривіальними назвами, наприклад С6Н5ОН - фенол, СНз—С6Н4—ОН - крезол, або по систематичній номенклатурі (частіше для заміщених фенолу) -додаючи суфікс -ол до назви духмяного вуглеводню:
бензентриол-1,2,4
Метильному гомологу фенолу відповідають три ізомеру:
n-крезол
Двохатомні феноли (діоксибензоли) також існують у виді трьох ізомерів:
Існують і три ізомерних трїхатомних феноли (триоксибензола):
Одержання. Фенол (монооксибензол) і його метильні гомологи - о-, м- і n-крезоли утримуються в значних кількостях у кам'яновугільній смолі. Проте фенол частіше усього одержують синтетичними засобами.
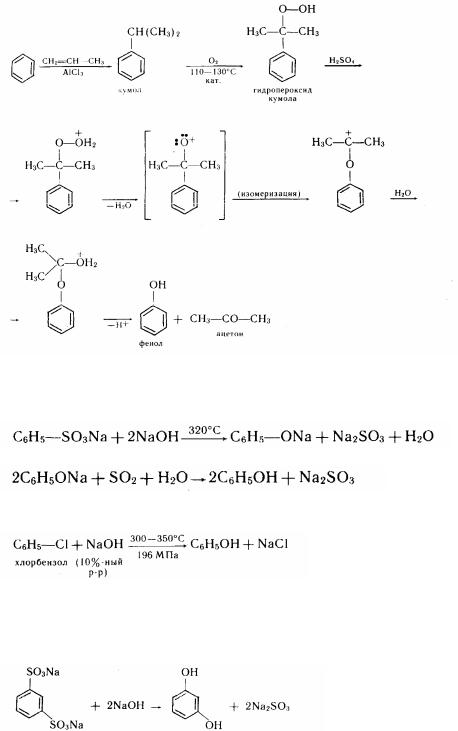
1. Одержання з кумолу (ізопропіл бензолу) (П. Г. Сергєєв, Б. Д. Кружалов, Р. Ю. Удрис, М. Е. Нємцов, 1949). У якості вихідної сировини використовують бензол і проулен. Процес протікає за схемою
189
Цей метод дозволяє одночасно одержувати два дуже цінних продукти - фенол і ацетон.
2. Одержання із солей сульфокислот (лужний плав):
фенолят натрію
фенол
3.Одержання з духмяних галогенопроизводних (гідроксилірованнє):
4.Розкладання солей діазонія (див. с. 290).
Двух- і трехатомные феноли одержують багатьма засобами, що придатні для синтезу одноатомного фенолу. Наприклад, при лужному плавленні солей дысульфокислот одержують резорцин:
Фізичні властивості. Одноатомні феноли - труднорозчинені у воді кристалічні речовини. З збільшенням числа гідроксильних груп розчинність деяких фенолів збільшується. Так, двохатомні феноли вже легко розчиняються у воді. Феноли - отруйні речовини. Добре обчищаються перегонкою з водяним паром.
Хімічні властивості. Хімічні властивості фенолів визначаються гыдроксильноъ групою і пов'язаним із ній бензольнім ядром. 1. Кислотні властивості. Сполучення неподыленної пар електронів атома кисню гідроксильної групи з ? - електронною системою бензольного каблучки призводить до зсуву електронної щільності убік каблучки. У результаті зв'язок О-Н настільки . ослаблено, що атом водню гідроксильної групи може отщепляться у виді протона з утворенням фенолятіону:

190
Такий електронний зсув у фенолят-іоні пояснює і його підвищену усталеність. Тому феноли значно перевершують по кислотних властивостях аліфатичних спирти (для фенолу рKа=10).
Кислотність фенолів залежить від характеру заступників у ядрі. Введення в бензольне ядро электроноакцепторних заступників (нітрогрупи, атомів галогенів і ін.) призводить до збільшення кислотних властивостей фенолу. Наприклад, тринітрофенол (пікринова кислота) по силі наближається до соляної кислоти (рKа=0,4).
2. Взаємодія з луками . При взаємодії з луками феноли утворять солі - феноляті:
Оскільки кислі властивості фенолів виражені досить слабко, феноляті разлагаются навіть такою слабкою кислотою, як вугільна (рKа=6,37). У результаті утвориться вільний фенол:
3. Реакції з галогеналкілами, ангідридами і галогенангідридами кислот. При взаємодії фенолятів із галогеналкілами утворяться прості ефіри фенолів:
фенілметиловий ефір (анізол)
Феноляті вступають у реакцію з ангідридами і галоген ангідридами кислот з утворенням складаних ефірів фенолів:
4. Гідрування. При каталітичному (№) гідруванні фенолу утвориться циклогексанол (tкип= 161°С):
циклогексанол
Циклогексанол при окислюванні перетворюється в циклогексанон або в адипіновую кислоту, що застосовуються у виробництві штучних капронові- капрону-волокна-капрону й аніда (найлону).
5. Реакції электрофільного заміщення (SE). Гідроксильна група, приходячи заступником першого роду, призводить до підвищення електронної щільності в о- і σ бензольного каблучки. Це значно полегшує реакції электрофільного заміщення:
