
конспекты / ------------------
.pdf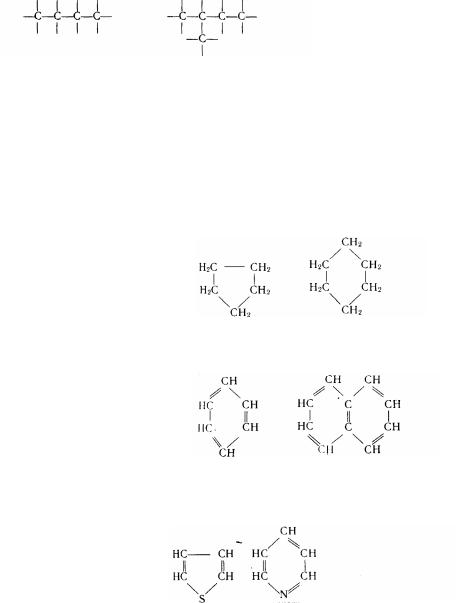
21
Багато які з цих груп позначаються в назвах сполук спеціальними суфіксами: подвійний зв'язок -ен, потрійний - ін, гідроксильна група -ол, альдегідна група -ал(-аль), карбонільна група -он і т.д.
Окремі приклади назв будуть докладно розглянуті при вивченні відповідних класів органічних речовин.
КЛАСИФІКАЦІЯ ОРГАНІЧНИХ СПОЛУК
Всі органічні сполуки в залежності від будови вуглецевого ланцюга - скелета, діляться на такі великі поділи:
I. Ациклічні сполуки - сполуки з відкритим (незамкненим) ланцюгом вуглецевих атомів (прямим або розгалуженим):
Такі сполуки називаються також аліфатичними сполуками або сполуками жирного ряду.
II. Циклічні обеднання— сполуки, у яких вуглецеві атоми утворять цикли. Ці сполуки діляться на карбоциклічні і гетероциклічні.
1.Карбоциклічні (ізоциклічні) -циклічні сполуки, що утворено тільки вуглецевими атомами. У свою чергу карбоциклічні сполуки можуть бути
аліцикличними
циклопентан циклогексан
та ароматичними
бензол нафталін
2. Гетероциклічні сполуки - цикли, до складу яких крім атомів вуглецю входять і інші атоми - гетероатоми:
тиофен піридин
Найбільше простими представниками сполук ациклічного, аліцикличного й ароматичного рядів є вуглеводні, молекули яких складаються тільки з двох елементів - С та Н. З цих з'єднань і починають звичайно вивчення органічної хімії.
22
При зміні атомів водню у вуглеводнях на інші атоми або групи атомів - функціональні групи, утворяться численні класи органічних сполук, наприклад:
Вуглеводні |
R—Н; |
Складні ефіри |
R—СООR; |
Галогенопроизводні R—Hа1; |
Нітросполуки |
R-N02; |
|
Спирти |
R—ОН; |
Аміносполуки |
R—NН2; |
Альдегіді |
R-СНО; |
Сульфокислоти R-S0зН; |
|
Кетони |
R-СО-R'; |
Металлорганичні сполуки |
|
Кислоти |
R—СООН; |
R—Ме, R—Ме—На1 |
|
Прості ефіри |
R—О—R' |
|
|
З цього ряду очевидно, що функційна група, пов'язана з радикалом, визначає клас сполуки. Органічні речовини, що містять дві або більш різноманітні функціональні групи, називаються сполуками зі змішаними функціями.
Кожний із цих класів ділиться, у залежності від характеру зв'язку між вуглецевими атомами, на дві групи: насичені і ненасичені.
Для зручності вивчення кожного класу фактичний і теоретичний матеріал розглядається в такому порядку: 1) визначення і загальна формула речовин даного класу; 2) будова; 3) номенклатура й ізомерія; 4) засоби одержання; 5) фізичні властивості; 6) хімічні властивості; 7) окремі представники і їхнє практичне використання в загалі та частково у будівельній індустрії для добування різноманітних будівельних матеріалів.
ЛЕКЦІЯ № 2
Вуглеводні аліфатичного ряду
Вуглеводні - найбільше прості органічні сполуки, до складу яких входять тільки вуглець і водень. Якщо замініти в цих сполуках атоми водню на інші атоми або функційні групи, можна одержати різноманітні чисельні похідні вуглеводнів - практично усі відомі класи органічних сполук.
Вуглеводні - дуже великий клас органічних сполук. Вони різняться між собою будовою вуглецевого ланцюга, що може бути прямим, розгалуженим і замкнутим
вцикл (карбоциклічні вуглеводні).
Уцьому поділі будуть розглянуті сполуки з відкритим ланцюгом – вуглеводні аліфатичного ряду.
Всі аліфатичні вуглеводні можна розділити за характером зв'язків між атомами
вуглецю на дві великі групи: насичені і ненасичені вуглеводні.
НАСИЧЕНІ ВУГЛЕВОДНІ (АЛКАНИ, АБО ПАРАФІНИ)
Будова алканів. Гомологічний ряд. Радикали
Алкани, або парафіни, - аліфатичні насичені вуглеводні, у молекулах яких атоми вуглецю пов'язані між собою простим (одинарним) σ -зв'язком.
Як відомо, атом вуглецю в граничних вуглеводнях знаходиться в першому валентному стані (SP3-гібридизация). Це значить, що атоми вуглецю в алканах
23
цілком насичені воднем, тобто всі їхні одиниці валентності, що не витрачено на зв'язок з іншими атомами вуглецю, сполучені з атомами водню.
Найпростішим представником і родоначальником насичених вуглеводнів є метан СН4. За назвою цієї сполуки всі насичені вуглеводні називають також
метановими вуглеводнями.
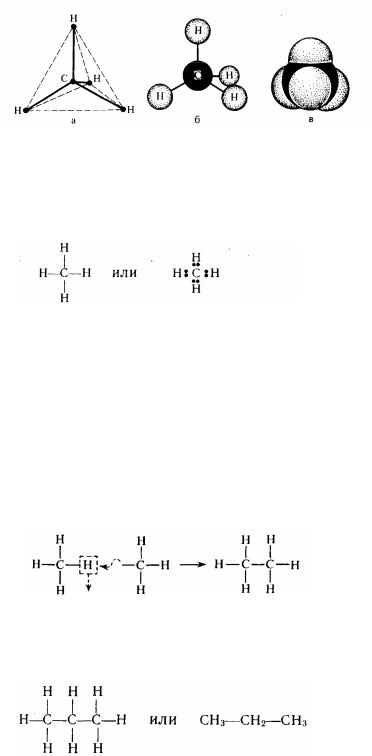
Мал. 7. Моделі просторової будоіи молекули метану:
а - тетраедрична; б - шаростержнева; в - за Бриглебом.
Будову молекули метану можна уявити структурної або електронної (октетною) формулою:
В октетної формулі позначаються всі зовнішні електрони атомів, що складають молекулу. Ці електрони або утворять хімічний зв'язок, або залишаються вільними.
При . sp3-гибридизації вуглецю чотири його електронні орбіталі, як відомо, складають між собою кут 109о28'. Просторове розташування атомів у молекулі метану можна показати за допомогою тетраедричних і шаростержневих моделей (мал.7). Особливо наочні моделі Бриглеба (мал.7, в). Вони виготовляються відповідно до дійсного співвідношення ковалентних і ван-дер-вальсовых радіусів атомів.
Замінюючи атом водню в молекулі метану на метильну групу СНз, можна вивести структурну формулу такого за метаном вуглеводню - етану С2Н6:
Просторова будівля молекули етану показане на мал. 8.
Таким же чинои з етану можна одержати й інший найближчий представник насичених углеводородів-пропан (С3Н8):
Всі насичені вуглеводні, або алкани, об'єднують у ряд, керуючись при цьому ростом числа вуглецевих атомів у цих вуглеводнях:

24
Мал. 8. Моделі просторової будівлі молекули етану:
а - тетраедрична; б - стрижнева; в - по Бриглебу
Співставляючи між собою два будь-які найближчі представники цього ряду, можна відзначити, що вони відрізняються друг від друга за складом на одну СН2- группу. Подібний ряд сполук, представники якого мають близькі хімічні властивості і характеризуються закономірною зміною фізичних властивостей, а за будовою відрізняються друг від друга на одну або декілька СН2-групп, називають гомологічним рядом. Окремі члени цього ряду називаються гомологами.
Назва гомологічного ряду визначається назвою першого його представника (наприклад, гомологічний ряд метану). Усі класи органічних сполук (спирти, альдегіди, кетони й ін.) утворюють свої гомологічні ряди. Для кожного такого ряду може бути виведена одна загальна формула, що відбиває співвідношення кількостей атомів вуглецю і водню в любого з його членів. Іншими словами, гомологічний ряд - це систематичний ряд речовин, що відрізняються друг від друга своїми індивідуальними властивостями, але сукупність яких може бути виражена одною загальною формулою. Для гомологічного ряду насичених вуглеводнів загальна формула має вигляд СnН2n+2.
Поняття гомологічного ряду значно полегшує вивчення величезного фактичного матеріалу в органічній хімії. Так, знаючи хімічні властивості одного з членів гомологічного ряду, можна передбачити хімічне поводження й інших членів цього ряду.
Гомологічні ряди є своєрідним і яскравим прикладом, що ілюструє один з основних діалектичних законів - закон перехода кількісних змін у якісні.
* У приведених назвах радикалів використовують позначення: N - нормальний, втор- - повторний, трет- - третинний.
Вмикання в молекулу кожної такої СН2-группы викликає закономірну зміну властивостей, тобто спостерігається перехід кількості в якість.
Якщо вуглеводень позбавляється одного (або декількох) атомів водню, то утвориться частка, названа вуглеводородним радикалом (не варто змішувати з вільним радикалом!). У залежності від числа загублених водневих атомів
25
радикали можуть бути одно-, двух- і тривалентними. Якщо в радикалі вільна валентність знаходиться в первинного атома вуглецю, то такий радикал називається первинним, Відповідно до цього бувають вторинні (вільна валентність у вторинного атому вуглецю) і третинні (вільна валентність у третинного вуглецевого атома) радикали:
—СНз - первинний одновалентний радикал (метил)
—СН(СНз)2- - вторинний одновалентний радикал(изопропил)
—С(СНз)з - третинний одновалентний радикал (третбутил)
›СН2 - вторинний двовалентний радикал (метилен)
Одновалентні вуглеводні радикали називаються алкілами. Назви радикалів будуються з назв відповідних вуглеводнів із заміною суфіксу -ан (що характерно для назви насичених вуглеводнів) на -ил. Наприклад, метан - метил, етан - етил, пропан – пропил т.д. (див. табл.). Назви двохвалентних радикалів (із двома вільними валентностями у того ж самого атому вуглецю) провадяться заміною суфіксу
-ан на -іліден (виняток - радикал метилен CH2). Тривалентні радикали мають
суфікс -илидин (виняток-радикал метин ->СН).
Скорочено радикали позначають R або А1k<. Загальна формула одновалентних радикалів СnН2n+1.
Номенклатура й ізомерія Номенклатура. Для назви насичених вуглеводнів використовують в
основному систематичну і раціональну номенклатури.
Назви перших чотирьох членів гомологічного ряду метану тривіальні: метан, етан, пропан і бутан. Назви таких гомологів, починаючи з п'ятого, утворяться сполученням грецького числівника і суфіксу -ан.
Загальна назва насичених ациклічних вуглеводнів - алкани. Частіше усього застосовують систематичну номенклатуру органічних сполук. Відповідно до неї назви вуглеводнів складають таким чином.
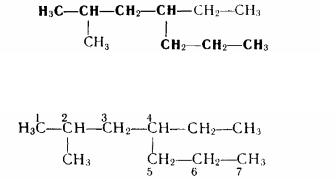
1. У молекулі вуглеводню вибирають головний ланцюг — самий довгий, наприклад:
2. Потім цей ланцюг нумерують із того кінця, до котрого ближче замісник (радикал, що має менше число вуглецевих атомів) :
3. Вуглеводень називають у такому порядку: спочатку вказують (цифрою) місце розташування замісника, потім цей замісник (радикал), а наприкінці добавляють назву головного (самої довгого) ланцюга. Вищенаведений

26
вуглеводень може бути назв: 2-метил-4-этилгептан.
Якщо в головному ланцюзі утримується декілька однакових замісників, то їх кількість у ланцюзі позначають грецьким числівником (ди-,
У першому випадку всі чотири зв'язки між вуглецевими атомами утворюють прямий, або нормальний, ланцюг, а в другому - розгалужений (ізобудова). Необхідно пам'ятати, що у вуглеводнях навіть із «прямим» ланцюгом атоми вуглецю в дійсності розташовуються не по прямої, а мають «зигзагоподібну» форму, що пов'язана зі зберіганням міжвалентних (I09о28/).
Сполуки з прямим ланцюгом називають нормальними (їх скорочено позначають буквою н-), а з розгалуженим - ізосполученнями (приставка ізо-). Таким чином, молекули бутану й ізобутана, маючи однаковий склад, різняться хімічною будовою. Такі сполуки називаються ізомерами. Ізомери відрізняються друг від друга хімічними і фізичними властивостями.
В органічній хімії існує декілька видів ізомерії. У даному випадку це самий простий вид ізомерії, при якому ізомери відрізняються друг від друга тільки порядком зв'язків атомів у молекулі. Такий вид ізомерії називається структурною ізомерією.
При складанні структурних формул окремих ізомерів треба діяти таким чином:
1.Відповідно до загального числа вуглецевих атомів у молекулі спочатку записують прямий вуглецевий ланцюг (вуглецевий скелет). Наприклад, ланцюг молекули пентану С5Н12 складається з п'ятьох атомів вуглецю: С─С─С─С─С
2.«Відчеплюючи» потім крайні вуглецеві атоми [С1 і (або) С°], розташовують їх у різноманітних атомів вуглецю , що залишилися в ланцюзі, домагаючись при цьому максимально можливого числа різноманітних переміщень. При цьому початковий вуглецевий ланцюг укорочується і стає більш розгалуженим.
Необхідно пам'ятати, що, «зігнувши» довільно молекулу, не можна одержати новий ізомер.
Наприклад: С-С-С-С-С і С-С-С вуглецевий скелет тієї самої сполуки
| |
СС
Утворення ізомерів спостерігається лише в тому випадку, коли порушується початкова будова сполуки.
3. І нарешті, дотримуючи умови чотирьохвалентності вуглецевих атомів,

27
заповнюють валентності , що залишилися , атомами водню:
|
2,2 диметилпропан |
Отже, пентан має три ізомера: |
один - нормальної будови і другий - |
ізобудови. |
|
Роблячи аналогічно, одержимо п'ять ізомерів для гексану С6Н14:
н-гексан 2-метилпентан
З-мстилпентан |
2,3-диметилбутан |
2,2-диметилбутан |
Чим більше в молекулі сполуки атомів вуглецю, тим більше у нього ізомерів. У залежності від положення у вуглецевому ланцюзі атом вуглецю може бути первинним (якщо вуглець затрачає одну валентність безпосередню на зв'язок з іншим вуглецевим атомом), вторинным (якщо він атом вуглецю сполучений із двома іншими вуглецевими атомами), третинним (у випадку його зв'язку з трьома іншими атомами вуглецю) і четвертинним (якщо він пов'язаний із
чотирма вуглецевими атомами). Сказане можна пояснити на прикладі:
На схемі, що приведено первинні вуглецеві атоми укладені в кружок, вторинний атом - у квадрат, третинний - у трикутник, четвертинний - у пунктирний кружок.
Як очевидно з табл. 3, у ряду радикалів також має місце явище ізомерії. Проте число ізомерів у радикалів значно більше, ніж у відповідних їм вуглеводнів. Наприклад, пропан ізомерів не має, а радикал пропил має два ізомера: н-пропил і ізо-пропил.
Засоби добування алканів
При добуванні насичених вуглеводнів використовують в основному природні джерела (газ, нафта, вугілля, гірський віск, деревина, торф і т.д.) і синтетичні методи одержання.

28
Природні джерела. Насичені вуглеводні, або алкани, досить широко поширені в природі. Вони утримуються в природному газі, нафті і т.д. Наприклад, метан, етан, пропан і інші знаходяться в природному газі або розчинені в нафті. Метан утворюється при дії анаеробних мікробів, що розвиваються без доступу повітря, на різноманітні рослинні органічні залишки (наприклад, целюлозу):
Багато вуглеводнів можна добути методом гідрування торфів. Для цього їх змішують і нагрівають із важкими мастилами і каталізатором (залізом):
Природною сумішшю вуглеводнів є гірський віск, або озокерит. Це різновид твердого природного бітуму, що являє собою суміш твердих високомолекулярних алканів.
Алкани можна одержувати і сухою перегонкою (нагріванням без доступу повітря) деревини, вугілля, торфу і пальних сланців.
З промислових засобів добування алканів варто згадати синтез з оксиду вуглецю і водню (синтез-газ). В даннаму процесі як каталізатор використовують кобальт-торий-магнієву або залізо-кобальтову суміш:
Суміш алканів, що утворилася, називають «синтином» (синтетичним бензином). Виділення індивідуальних насичених вуглеводнів при цих методах добування - задача досить важка. Тому для одержання алканів часто використовують синтетичні методи.
Синтетичні методи.
1. Гідрування ненасичених вуглеводнів (етіленових або ацетиленових) у присутності каталізаторів (Рt, Рb, Ni):
2. Синтез Вюрца (1870). Цей метод дозволяє одержувати насичені вуглеводні збільчим числом атомів вуглецю в ланцюзі, чим у вихідних сполуках. Реакція полягає в дії металевого натрію на галогеналкили:
П. П. Шоригин показав, що в результаті такої реакції як проміжні продукти утворюються натрійорганічні сполуки, що взаємодіють потім із галогеналкилами:
Синтез Вюрца
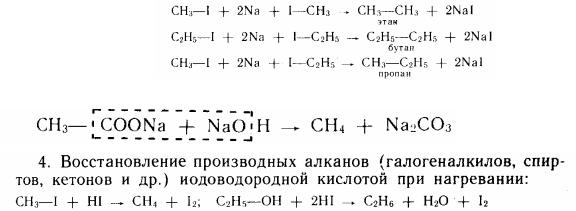
29
3. Плавління солей карбонових кислот із лугами, наприклад:
Фізичні властивості.
Фізичні властивості деяких представників ряду метанових вуглеводнів нормальної будови залежать від складу і будови їхніх молекул. Збільшення молекулярної маси призводить до підвищення температур кипіння і плавлення, а також до росту щільності.
Перші чотири члени гомологічного ряду метану - газоподібні речовини, починаючи з пентану - рідини, а вуглеводні з числом вуглецевих атомів 16 і вище - при звичайній температурі тверді речовини. Збільшення числа вуглецевих (і водневих) атомів тісно пов'язано із появою нових властивостей в органічних речовинах. Вуглеводні з розгалуженим ланцюгом киплять при більш низькій температурі, чим відповідні їм з'єднання нормальної будови, а температура плавлення, навпаки, вище в ізомерів із розгалуженим ланцюгом.
Насичені вуглеводні - сполуки неполярні і важко поляризуємі.Вони легше води й у ній практично не розчиняються, але спроможні розчинятися в більшості органічних розчинників. Рідкі алкани - гарні розчинники для багатьох органічних речовин.
Насичені вуглеводні - пальні речовини. Слід зазначити, що метан і етан, а також вищі насичені вуглеводні не мають запаху, але серед інших легко летучих нижчих вуглеводнів зустрічаються з'єднання, що володіють слабким запахом.
В ІК-спектрах алканів валентні коливання зв'язку С—Н лежать в області 30002850 см-1 , ,а їхні деформаційні коливання - в області 1470-1380 см-1 (зв'язок С—Н у метильної і метиленових групах).
Алкани поглинають УФ-випромінювання в області довжин хвиль λ <200 нм (наприклад, метан має смугу поглинання при 125 нм, этан - при 135 нм).
Хімічні властивості
У молекулах насичених вуглеводнів всі атоми пов'язані між собою тривкими δ-зв'язками, а валентності вуглецевих атомів цілком насичені воднем. Тому насичені вуглеводні не вступають у реакції приєднання. Вони виявляють при звичайних умовах надзвичайно скрону хімічну інертність: не взаємодіють з іонними реагентами (кислотами, лугами), окислювачами, активними металами (тому, наприклад, металевий натрій можна берегти в керосині). З цієї заподії насичені вуглеводні у свій час одержали назву парафінів.
Основні хімічні перетворення насичених вуглеводнів йдуть тільки при наданні їм достатньо високої енергії (за рахунок нагрівання або УФ-випромінюванні). При
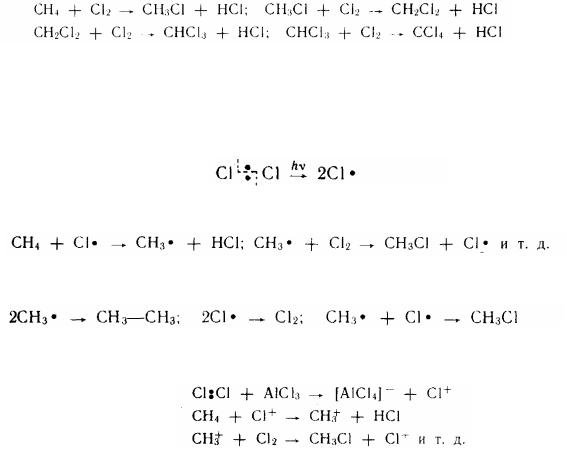
30
цьому може відбутися або розрив зв'язку С-Н і наступно з заміною атома водню на інший атом або групу атомів, або ж розрив молекули по зв'язку С-С. Незважаючи на те, що енергії цих зв'язків рівні відповідно 415-420 (для первинних вуглеводнів) і 350 кДж/моль(для вторинних), розрив йде по зв'язку С-Н. Це пов'язано з більшою доступністю зв'язку С-Н для атаки з бокові хімічних реагентів.
Зв'язки С—С і С—Н, володіючи незначною полярністю, при розриві утворюють головним чином не іони, а радикали, тобто це розірвання йде по гомолітичному, а не гетеролітичному механізму.
Таким чином, для насичених вуглеводнів розрізняють два основних типи хімічних реакцій:
1)реакції заміщення водню з розривом зв'язку С—Н;
2)реакції розщіплення молекули з розривом як С—Н- так і С—С-звязків.
Реакції заміщення. У цих реакціях легше усього відбувається заміщення атома водню, пов'язаного з третинним вуглецевим атомом, сутужніше - із вторинным зовсім важко - із первинним. Це можна пояснити, якщо зіставити енергії зв'язків С—Н у первинного (біля 420 кДж/моль), вторинного (390 кДж/моль) і третинного (370 кДж/ моль) атома вуглецю.
Розглянемо основні реакції заміщення насичених вуглеводнів.
1. Галогенування (дія галогенів). Це одна з найважливіших реакцій насичених вуглеводнів. Вона перебыгаэ з заміщенням атомів водню в алканах на галоген
Реакція галогенування йде на світлі (фотохімічна) або при нагріванні (наприклад, термічне хлорування при 300°С, використовуване в промисловості). Як було встановлено акад. Н. Н. Семеновим, ця реакція має радикальноланцюговий характер. Н а першій стадії цього процесу відбувається розпад молекули хлору на два вільних радикали - зародження, або ініцювання, ланцюга:
Потім починається ріст ланцюга, пов'язаний із взаємодією вільного радикалу з молекулою алкана:
Реакція закінчується обривом ланцюга, що наступає в результаті взаємодії між собою вільних радикалів:
Якщо хлорування ведуть у присутності каталізаторів (наприклад, А1Сl3), то реакція має ланцюговий іонний механізм:
2. Нітровування (дія азотною кислотою). При звичайній температурі насичені вуглеводні з концентрованою азотною кислотою практично не взаємодіють. При нагріванні ця кислота діє як окислювач. Вперше реакцію нітровання насичених
