
конспекты / ------------------
.pdf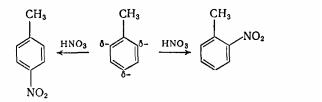
|
|
|
|
|
161 |
|
|
|
|
|
монозаміщених бензолів |
|
|
|
|
|
|
|
|||
Замісник |
|
Вміст |
|
|
|
Вміст |
|
|
|
|
|
ізомера , що |
Замісн |
утвореного ізомера. |
|
|
|||||
у ядрі |
утворився, % |
ик у |
% |
|
|
|
|
|
||
Ор |
мет |
Пара- |
орто |
|
Мета |
пара- |
|
|
||
|
ядрі |
|
|
|
||||||
|
то- |
а- |
|
|
- |
|
- |
|
|
|
ОН |
40 |
— |
60 |
СРз |
— |
|
100 |
— |
|
|
СНэ |
56 |
4.0 |
40 |
NOa |
6,5 |
|
93,2 |
0,3 |
|
|
С(СНз)э |
12 |
8 |
80 |
CN |
17 |
|
81 |
2 |
|
|
F |
12 |
— |
88 |
COOH |
18.5 |
|
80 |
1.5 |
|
|
С1 |
30 |
1 |
69 |
снсь |
23 |
|
35 |
42 |
|
|
Вг |
36, |
1 |
62,5 |
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для тлумачення дії заступників , що орієнтує , пропонувалася множина теорій. В даний час це питання цілком вияснене на основі електронних уявлень,
орто-пара- Орієнтантами є електронодонорні групи, що подають у бензольне ядро електрони. Збільшуючи електронну щільність у бензольному ядрі, вони тим самим роблять його більш активним у реакціях електрофільного заміщення
(виняток складають галогени, мета - орієнтантами є електроноакцепторні групи,
що відтягають електрони з ядра. Зменшуючи електронну щільність у бензольному ядрі, вони зменшують його активність у реакціях електрофільного заміщення.
Зміни електронної щільності відбуваються головним чином в орто - і параположеннях стосовно заступника , що орієнтує. Під впливом
заступників першого роду електронна щільність в орто- і пара - положеннях підвищується, тому туди переважно і направляється електрофільна група. Так, наприклад, при нітруванні толуолу утвориться головним чином суміш орто і пара - ізомерів (див. табл. 9):
Якщо в ядрі стоїть заступник другого роду, то він відтягає електронну щільність у першу чергу з орто - і пара - положень, зменшуючи тим самим їхню активність. Заступник , що вступає , направляється в пара - положення, із якого відтік електронної щільності менше, тобто електронна щільність тут буде декілька вище в порівнянні з орто- і параположеннями, що й обумовлює велику реакційну спроможність цього положення. Наприклад, при введенні другої

162
нітрогрупи в нітробензол утвориться в основному метаізомер:
Щоб зрозуміти природу впливу , що орієнтує, необхідно глибоко знати властивості функціональних груп, типи їхнього взаємного впливу (індуктивний і мезомерний ефекти), тому більш докладне обговорення цього питання буде приведено пізніше.
Сировинні джерела ароматних сполук. Практичне використання бензолу і його гомологів.
Головними сировинними джерелами ароматних сполук є кам'яне вугілля і нафта.
При коксуванні кам'яного вугілля при 1000-1200 °С утворяться кокс (75% від маси вугілля), коксовий газ (300 м3 на 1 т вугілля), кам'яновугільна смола (2- 5% від маси вугілля) і аміачна вода.
З продуктів коксування вугілля одержують велике число ароматних сполук. Коксовий газ містить біля 25-35 г/м3 ароматних вуглеводнів. Після їх відділення промиванням на холоду важкими оліями коксовий газ використовують у якості палива. До складу газу входять метан, водень, окис вуглецю, етилен, ацетилен, азот, синильна кислота, двоокис вуглецю й ін.
Кам'яновугільна смола—чорно - коричнева олія, важче води, із характерним запахом. Склад смоли залежить від температури коксування вугілля. При температурі до 500°С утвориться первинна (низькотемпературна) смола, що містить багато алканов і циклоалканов. Смола, отримана при високих температурах коксування (1000°С і вище), містить вже в основному ароматні сполуки (до 300 різноманітних речовин). Хоча вихід смоли від загальної маси вугілля складає усього 2-5%, загальна кількість одержуваної смоли велика, тому що коксуванню піддаються сотні мільйонів тонн вугілля.
Кам'яновугільну смолу піддають перегонці, звичайно виділяючи такі фракції.
1.Легка олія (біля 2% від загальної маси смоли) отгоняється до 170°С, містить бензол, толуол, ксилоли, стирол, етилбензол, піридин і ін.
2.Середня олія (до 12% від загальної маси смоли) отгоняється в інтервалі 170-240 °С, містить нафталін, фенол, крезоли.
3.Важка олія (до 10% від загальної маси смоли) отгоняється в інтервалі 240-270 °С, містить нафталін і його похідні.
4 Антраценова олія (до 25% від загальної маси смоли) отгоняється в
інтервалі 270-360 °С, містить антрацен, фенантрен і ін.
5. Пік (50-60% від загальної маси смоли)-твердий смолистий залишок після перегонки. Застосовується для виготовлення будівельних (покрівельних)
163
матеріалів, брикетів палива й ін.
Індивідуальні з'єднання виділяють із фракцій шляхом повторної перегонки і кристалізації твердих продуктів Речовини з кислотними властивостями, (фоноли) виділяють із сумішей обробленням водяними розчинами лугів, а речовини з основними властивостями (піридин)-витягом розведеної сірчаної кислоти. З 1 т кам'яновугільної смоли утворюється біля 16 кг бензолу, 2,5 кг толуолу, 0,3 кг ксилолів, 40-60 кг нафталіну, 5-20 кг антрацену, 20 кг речовин фенольного характеру.
Коксохімічна промисловість - важливе сировинне джерело для виробництва продуктів органічного синтезу. Проте унаслідок швидкого росту хімічної промисловості коксохімія не може задовольнити потребу в ароматній сировині. Крім того, продукти коксохімічного походження важко одержувати достатньо чистими.
Дуже важливим джерелом ароматної сировини є нафтопереробна промисловість.
Нафта деяких родовищ містить значну кількість ароматних вуглеводнів, але основна кількість ароматних з'єднань утвориться при так називаній ароматизації нафти, тобто при каталітичній дегідроциклізації алканів у каталітичному дегідрируванні циклоалканів . У промисловості цей процес називають каталітичним риформінгом. У якості каталізатора використовують платину на окисі алюмінію (500 °С, 30-40 кг с/см2). Сировиною служить нафтова фракція, що википає до 180 °С. У продуктах риформінгу співвідношення бензолу, толуолу і ксилолів складає 1:4:5.
Деякі приклади використання бензолу і його гомологів приведені на схемі -3. Важливими проізводними бензолу є також такі з'єднання.
О -Ксилол використовують для одержання фталевого ангідриду - дуже важливої вихідної речовини для виробництва поліефірів і синтетичних смол.
п- Ксилол застосовують для одержання терефталевої кислоти С6Н4(СООН)2-1,4, що є важливою сировиною для виготовлення синтетичного волокна лавсан.
Дірол (1,2,4,5 -тетраметилбензол) утворюється при каталітичному риформінгу нафти і складає до 10% від загальної маси вихідних речовин. Використовується для синтезу термостійких полімерів і твердників для епоксидних смол
Цимол (п- метилізопропил бензол) утримується в багатьох ефірних оліях, у скипидарі. Використовується для одержання терефталевой кислоти.
Стирол (вінілбензол, фенілетилен)-рідина з приємним запахом. Вперше виділений із смоли «стиракс». Утримується в погоні кам'яновугільної смоли - легкої олії. У промисловості його одержують дегідрируванням етилбензолу. Хімічні властивості стиролу визначаються наявністю бензольного ядра і подвійного зв'язку в бічному ланцюзі. Характерною рисою стиролу є його велика

164
схильність до полімеризації (утворення полістиролу).

165
ЛЕКЦІЯ № 13
СПОЛУКИ АРОМАТИЧНОГО РЯДУ, ЩО МІСТЯТЬ КИСЕНЬ
Феноли
Органічні сполуки, що містять гидроксильну групу, пов'язану безпосередньо з
бензольнім ядром, називають фенолами: У залежності від числа гідроксильних груп у ядрі розрізняють одно-, двох- і трьохатомні феноли.
У залежності від числа гідроксильних груп у ядрі розрізняють одно-, двох- і трьохатомні феноли.
Номенклатура і ізомерія. Феноли називають або тривіальними назвами, наприклад С6Н5ОН - фенол, СНз—С6Н4—ОН - крезол, або за систематичною номенклатурою (частіше для заміщених фенолу) -додаючи суфікс -ол до назви ароматичного вуглеводню:
бензентриол-1,2,4
Метильному гомологу фенолу відповідають три ізомеру:
n-крезол
Двохатомні феноли (діоксибензоли) також існують у вигляді трьох ізомерів:
Існують і три ізомерних трьохатомних феноли (триоксибензолу):
Добування.
Фенол (монооксибензол) і його метильні гомологи - о-, м- і n-крезоли містяться в значних кількостях у кам'яновугільній смолі. Проте фенол частіше усього добувають синтетичними засобами.
1. Одержання із солей сульфокислот (лужний плав):

166
фенолят натрію
фенол
2.Одержання з ароматичних галогенопохідних (гідроксилювання):
3.Одержання з кумолу (ізопропилбензолу) (П.Г.Сергєєв). Як вихідну сировину використовують бензол і пропілен.
Цей метод дозволяє одночасно одержувати два дуже цінних продукти - фенол і ацетон.
4. Розкладання солей діазонію (див. вище).
Двух- і трехатомные феноли одержують багатьма засобами, що придатні для синтезу одноатомного фенолу. Наприклад, при лужному плавленні солей дісульфокислот одержують резорцин:
Фізичні властивості. Одноатомні феноли - труднорозчинені у воді кристалічні речовини. Зі збільшенням числа гідроксильних груп розчинність деяких фенолів збільшується. Так, двохатомні феноли вже легко розчиняються у воді. Феноли - отруйні речовини.

167
Хімічні властивості. Хімічні властивості фенолів визначаються гідроксильною групою і пов'язаним із нею бензольним ядром.
1. Кислотні властивості. Сполучення неподіленої пари електронів атому кисню гідроксильної групи з -електронною системою бензольного кільця призводить до зсуву електронної щільності убік кільця. У результаті зв'язок О-Н настільки . ослаблено, що атом водню гідроксильної групи може відщепляться у вигляді протону з утворенням фенолят-іону:
Такий електронний зсув у фенолят-іоні пояснює і його підвищену усталеність. Тому феноли значно перевершують за кислотними властивостями аліфатичні спирти (для фенолу рKа=10). Кислотність фенолів залежить від характеру замісників у ядрі. Введення в бензольне ядро електроноакцепторних замісників (нітрогрупи, атомів галогенів і ін.) призводить до збільшення кислотних властивостей фенолу. Наприклад, тринітрофенол (пікринова кислота) за силою наближається до соляної кислоти (рKа=0,4).
2. Взаємодія з лугами . При взаємодії з лугами феноли утворять солі - феноляти:
Оскільки кислотні властивості фенолів виражені досить слабко, феноляти розклагаються навіть такою слабкою кислотою, як вугільна (рKа=6,37). У результаті утворюється вільний фенол:
3. Реакції з галогеналкилами, ангідридами і галогенангідридами кислот. При взаємодії фенолятів із галогеналкилами утворюються прості ефіри фенолів:
фенілметиловий ефір (анізол)
Феноляти вступають у реакцію з ангідридами і галогенангідридами кислот з утворенням складних ефірів фенолів:
4. Гідрування. При каталітичному (Ni) гідруванні фенолу утворюється циклогексанол (tкип= 161°С):
циклогексанол
Циклогексанол при окисленні перетворюється в циклогексанон або в адипіновую кислоту, що застосовуються у виробництві штучних волокон-капрону й аніда (найлону).
5. Одержання поліоксиетіленових ефірів алкилфенолів

168
Ці ефіри мають властивості поверхнево-активних речовин (ПАВ). Особливо широко застосовуються поліоксиетіленові ефіри октилфенолу, відомі як ОП-7 і
ОП-10.
6. Реакції электрофільного заміщення (SE). Гідроксильна група, замісник першого роду, призводить до підвищення електронної щільності в о- і п- положенняж бензольного кільця. Це значно полегшує реакції электрофільного заміщення:
7.Одержання фенолоформальдегидних полімерів
8.Взаємодія з ацетоном:
4,4'-діоксіди феніл пропан (діан)
Цей продукт, отриманий російським вченим А.Н.Диановым (у його честь цей продукт і був назв діаном), використовується для виробництва епоксидних полімерів .
9. З FеС1з (у розведених водяних або спиртових розчинах) фенол утворює комплексну сіль, пофарбовану у фіолетовий колір Ця реакція є якісної на фенол:
.Двух- і трехатомні феноли в багатьох хімічних реакціях можуть брати участь одна, дві або три гідроксильні групи.

169
Двохатомні феноли - більш сильні кислоти, чим одноатомний фенол. Вони легко окисляються і є сильними відновниками. Так, гідрохінон при окисленні перетворюється в n-бензо-хінон (або просто хінон). Це окислення йде через стадію утворення проміжного продукту - хінгідрону - сполуки бензохінону з гідрохіноном за рахунок утворення комплексу з переносом заряду (типу л- комплексу):
гідрохінон хінгідрон n-бензохінон
Пірокатехін при окисленні утворює о-бензохінон:
о-бензохінон
Хіноні мають будову ненасичених дікетонів. У хімічному відношенні вони дуже реакційноздатні: приєднують різноманітні нуклеофільні реагенти (спирти, галогени, аміни, гідроксиламіни, кислоти і т.д.):
Хіноні вступають також у реакції дієнового синтезу. Незважаючи на те що між хінонами і двохатомними фенолами існує тісний зв'язок, хінони не ароматичні сполуки в суворому змісті слова. Це очевидно з реакцій приєднання. Дві структури - бензоідна і хіноідна - легко переходять друг у друга:
Слід зазначити, що n- і о-хіноідна угруповання відносяться до важливим хромофорнім систем у молекулах барвників.
Окремі представники.
Фенол (бензенол, монооксибензол, або карболова кислота) С6Н5ОН - кристалічна речовина, tпл=43°С. Сутеніє на повітрі. Погано розчиняється у воді (насичений розчин фенолу при 15°С містить біля 8% його). Є антисептиком. При влученні на шкіру викликає її опіки. З водою утворює кристаллогідрат (tпл=16°С).Фенол - дуже цінний продукт органічного синтезу. Він використовується для виробництва барвників, полімерів (при конденсації з формальдегідом), лікарських препаратів, вибухових речовин і т.д.
Пірокатехін (бензендіол-1,2) - кристалічна речовина з tпл=104°С. Зустрічається в рослинах. Застосовується як проявник плівки у фотографії і як вихідний продукт в органічному синтезі.

170
Резорцин (бензендіол-1,3) - кристалічний продукт із t пл= 114°С. Використовується для одержання барвників і в медицині.
Гідрохінон {бензендіол-1,4) - кристалічна речовина, tпл= 169°С. При окислюванні переходить в хінон (через утворення хінгідрону). Широко використовується у фотографії як проявник.
Пірогалол (бензентріол-1,2,3) - кристалічна речовина з tпл=132°С. Лужні розчини пірогалолу використовуються в газовому аналізі для поглинання із суміші газів кисню. Застосовується і при синтезі багатьох барвників.
Флороглюцин (бензентріол-1,3,5) - кристалічна речовина, tпл=218°С. Використовується в аналітичній хімії для визначення пентози і відкриття речовин, що входять до складу деревини. Існує у вигляді двох таутомерних форм:
фенольна кетонна форма форма
Пікринова кислота (2,4,6-тринітрофенол) С6Н2 (N02)зОН - кристалічна речовина жовтого коліру, гірка на смак, tпл=121,8°С. Має сильні кислотні властивості (р Ка =0,38), що викликано впливом трьох нітрогруп. Володіє високою вибуховою силою (особливо її солі - пікрати).
