
- •Курс лекцій з фізики
- •I. Фізичні основи механіки…………………………………………………….18
- •II. Електростатика…………………………………………………………….....47
- •III. Постійний електричний струм………………………………………..77
- •IV. Електромагнетизм………………………………………………………….…91
- •V. Коливання та хвилі……………………………………………...…122
- •VI. Хвильова оптика……………………………………………….…150
- •VII. Ядерна фізика…………………………………………………….244
- •VIII. Основи молекулярної фізики і термодинаміки……………...261
- •IX. Фізика твердого тіла………………………………………..…283
- •Змістовний модуль № 1
- •Вступна лекція
- •Роль фізики у розвитку техніки та вплив техніки на розвиток фізики
- •I. Фізичні основи механіки
- •Механічний рухполягає в зміні з часом взаємного розташування тіл, або їх частин у просторі.
- •1. Основи кінематики поступального руху
- •В). Циліндрично-полярні координати ρ, φ, z.
- •Якщо траекторія – пряма лінія , то такий рух називають прямолінійним, а якщо крива – криволінійним. Найпростішим прикладом криволінійного руху є рух матаеріальної точки по колу :
- •2. Основи кінематики обертального руху
- •3. Абсолютні і відносні швидкості та прискорення
- •І закон Ньютона
- •Іі закон Ньютона
- •III закон Ньютона
- •5. Закон збереження імпульсу
- •6. Рух тіла із змінною масою. Реактивний рух
- •Імпульс системи
- •7. Центр мас. Закон руху центра мас
- •Одержана формула виражає закон руху центра мас
- •7.1. Сили інерції
- •Приклади руху тіл у нісв
- •8.1 Момент сили та момент імпульса
- •Напрям вектора визначається за правилом векторного добутку.
- •Проекція вектора на довільну вісьZ, що проходить через точку о , називаєтьсямоментом сили відносно цієї осі :
- •8.2 Рівняння моментів
- •8.3 Момент інерції тіла відносно осі обертання
- •8.4 Рівняння динаміки обертального руху
- •8.5 Закон збереження момента імпульса
- •9. Пружні напруження. Закон Гука. Деформація стрижнів
- •10. Робота. Енергія
- •10.1 Кінетична енергія Знайдемо роботу , яку виконує силапри переміщенні матеріальної точки масоюmіз положення 1 в положення 2.
- •10.3 Закон збереження механічної енергії
- •10.4 Кінетична енергія тіла при обертальному русі
- •11. Рівняння руху та рівноваги твердого тіла
- •Іі. Електростатика
- •15. Закон збереження електричного заряду. Електричне поле. Напруженість електричного поля
- •16. Потік вектора напруженості.
- •17. Теорема Остроградського-Ґаусса
- •18. Застосування теореми Остроградського-Ґаусса до розрахунку напруженості електростатичних полів
- •20. Напруженість як градієнт потенціалу
- •Розглянемо випадок переміщення одиничного додатнього точкового заряду q iз точки 1 в точку 2 вздовж осі X.
- •17. Провідники у електростатичному полі
- •Явище перерозподілу поверхневих зарядів на провіднику у зовнішньому електростатичному полі називається електростатичною індукцією, а перерозподілені заряди –індукованими зарядами.
- •17.1 Електрична ємність
- •17.2 Взаємна електроємність
- •18. Енергія зарядженого відокремленого провідника, конденсатора. Енергія електростатичного поля. Об’ємна густина енергії
- •19. Діелектрики у електростатичному полі
- •19.1 Типи діелектриків. Електронна і орієнтаційна поляризація
- •19.2 Неполярні діелектрики. Електронна поляризація
- •19.3 Полярні діелектрики. Дипольна, або орієнтаційна поляризація
- •19.4 Іонні діелектрики. Іонна поляризація
- •20. Механічні ефекти в діелектриках. Електрострикція та п’єзоефект. Сегнотелектрики.
- •22.Закон Ома у диференціальній формі
- •23. Закон Джоуля-Лєнца
- •24. Закон Ома у інтегральній формі
- •25. Розрахунок параметрів електричних кіл
- •26. Електричний струм у вакуумі
- •27. Робота виходу електронів з металу. Контактна різниця потенціалів
- •28. Термоелектричні явища
- •29. Електричний струм у газах
- •29.1. Типи газових розрядів:
- •IV. Електромагнетизм
- •Якщо контур зі струмом повернути на 90°від рівноважного положення, то на нього буде діяти максимальний обертальний моментМmax.
- •31. Закон Біо-Савара-Лапласа
- •32. Закон повного струму для магнітного поля у вакуумі. Вихровий характер магнітного поля
- •Якщо контур не охоплює провідник зі струмом, то
- •33. Cила Лоренца
- •34. Контур зі струмом у магнітному колі
- •35. Магнітний потік. Теорема Остроградського-Ґаусса
- •36. Робота переміщення провідника і контуру зі струмом у магнітному полі
- •Матеріал для самостійної роботи
- •37. Магнітні моменти атомів. Намагніченість. Атоми в магнітному полі
- •39. Магнітне поле в речовині. Закон повного струму для магнітного поля в речовині. Напруженість магнітного поля
- •40. Феромагнетики
- •41. Явище електромагнітної індукції. Закон Ленца. Закон електромагнітної індукції (закон Фарадея)
- •42. Явище самоіндукції. Індуктивність
- •43. Явище взаємної індукції
- •44. Енергія магнітного поля
- •Змістовний модуль 4
- •V.Коливання та хвилі
- •45. Гармонічні коливання. Диференціальне рівняння гармонічних коливань
- •46. Вільні електромагнітні коливання
- •Графік залежності хвід часу наведено на рис.1
- •48. Диференціальне рівняння вимушених коливань і його розв’язок. Резонанс
- •49. Вимушені коливання у електромагнітному коливальному контурі. Кола змінного струму. Закон Ома
- •50. Резонанс напруг
- •51. Розгалуження змінних струмів.
- •54. Інтерференція хвиль. Рівняння стоячої хвилі
- •55.Звукові хвилі та їх властивості. Ефект Допплера.
- •Ефект Допплера
- •56. Основи теорії Максвелла для електромагнітного поля. Струм зміщення
- •57. Рівняння Максвелла для електромагнітного поля
- •58. Основні властивості електромагнітних хвиль
- •Змістовний модуль 8
- •Vіii. Основи молекулярної фізики і термодинаміки
- •99. Статистичний і термодинамічний
- •100. Рівняння молекулярно-кінетичної теорії ідеального газу для тиску
- •101. Середня кінетична енергія
- •102. Розподіл Максвелла молекул
- •103. Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •104. Закон рівномірного розподілу енергії за ступенями вільності молекул
- •105. Перший закон термодинаміки. Робота газу при зміні його об'єму
- •106. Теплоємність. Класична молекулярно-кінетична теорія теплоємностей ідеального газу та її обмеженість.
- •107. Застосування першого закону термодинаміки до ізопроцесів
- •108. Адіабатний процес. Застосування першого закону термодинаміки до адіабатного процесу ідеального газу
- •109. Коловий процес. Теплові двигуни і холодильні машини. Оборотні і необоротні процеси
- •110. Цикл Карно і його коефіцієнт корисної дії для ідеального газу
- •111. Другий закон термодинаміки
- •112. Ентропія. Ентропія ідеального газу
- •113. Теорема Нернста та її наслідки
- •Іх. Фізика твердого тіла
- •114. Поняття про квантові статистики Бозе – Ейнштейна і Фермі - Дірака
- •115. Розподіл електронів провідності в металі за енергіями. Енергія Фермі
- •116. Енергетичні зони в кристалах
- •117. Розподіл електронів по енергетичних зонах. Валентна зона і зона провідності. Метали, діелектрики і напівпровідники
- •118. Власна провідність напівпровідників
- •119. Домішкова провідність напівпровідників
- •121. Люмінесценція твердих тіл
- •123.Рідкі кристали
108. Адіабатний процес. Застосування першого закону термодинаміки до адіабатного процесу ідеального газу
Адіабатний - це такий процес, який відбувається без обміну теплотою (Q = 0) між термодинамічною системою і середовищем.
Розглянемо, при яких умовах можна реально здійснити адіабатний процес. Можливо в трьох випадках здійснити процес, який буде адіабатним.
В першому випадку необхідна адіабатна оболонка, теплопровідність якої дорівнює нулю. Такою оболонкою може служити посудина Дьюара. В такій посудині з подвійними посрібленими стінками, з простору між якими відкачано повітря, передачі теплоти через стінки практично не буде.
Другий випадок адіабатичних процесів - це процеси, що відбуваються дуже швидко. При швидкому стиску газу затрачається робота А, внаслідок чого збільшується внутрішня енергія dU, що викликає підвищення температури. При підвищенні температури деяка кількість теплоти Q повинна бути передана навколишньому середовищі, що знаходиться при нижчій температурі, але процес теплопередачі вимагає деякого часу, тому при швидкому стиску теплота не встигає поширитись з даного об'єму.
Третій випадок - це процеси, що відбуваються в дуже великих об'ємах газу, наприклад, в атмосфері. Якщо в атмосфері відбудеться зменшення тиску - розрідження, яке виникає внаслідок атмосферної діяльності, то кількість теплоти, яка повинна бути передана із навколишнього простору для того, щоб вирівняти температуру, яка понизилась внаслідок адіабатичного розширення, просто не встигне поширитися упродовж значного проміжку часу.
Перший закон термодиниміки у випадку адіабатичного процесу має такий вигляд:
![]()
Продиференціювавши рівняння Менделєєва - Клапейрона, знайдемо вираз для dТ:
![]()
де R = Ср - СV.
П![]() ідставивши
значення dT у вираз першого закону
термодинаміки, отримаємо
ідставивши
значення dT у вираз першого закону
термодинаміки, отримаємо
![]()
де - показник адіабати, або коефіцієнт Пуассона.
Проінтегруємо отриманий вираз:
![]()
рV = соnst або p1V1 = p2V2.
Цей иираз називається рівнянням Пуассона.
Побудуємо графіки рівнянь:
1) рV = соnst (адіабата);
2) рV = соnst (ізотерма) (рис. 53).
Д
![]() иференціюючи
рівняння рV=соnst, отримуємо pdV + Vdp = 0,
звідси для ізотерми маємо
иференціюючи
рівняння рV=соnst, отримуємо pdV + Vdp = 0,
звідси для ізотерми маємо
Диференціюючи рівняння рV = соnst,
маємо рV-1dV + Vdp = 0.
З![]()
 відси
відси
Отже, тангенс кута нахилу адіабати в разів більший, ніж в ізотерми. Це пояснюсгься тим, що при адіабатному стиску 1-3 тиск газу збільшується не лише внаслідок зменшення його об'єму, як при ізотермічному стиску, але і підвищенням температури. При адіабатному розширенні газу 1-2 його температура знижується і тому тиск зменшується швидше ніж при iзотермічному розширенні.
Розрахуємо роботу, яку виконує газ при адіабатному процесі 1-2. Вона вимірюється числово площею, заштрихованою на рис. 53. Якщо газ адіабатно розширюється від об'єму V1 до V2, то його температура зменшується від Т1 до Т2 і робота розширення iдеального газу

Оскільки.
![]()
т ому
ому
Якшо використати рівняння адіабатного процесу у змінних T, V i T, p, отримуємо

Тоді роботу газу при адіабатному процесі можна записати в такому вигляді:
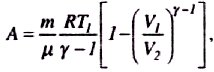

Робота, яка виконується газом при адіабатному розширенні 1-2, менша, ніж при ізотермічному. Це пояснюється тим, що при адіабатичному розширенні відбувається охолодження газу, тоді як при ізотермічному - температура підтримується постійною за рахунок припливу ззовні еквівалентної кількості теплоти.
