
- •Биохимия печени
- •Особенности обмена аминокислот, белков и других азотсодержащих веществ в печени
- •Особенности обмена углеводов в печени
- •Особенности обмена липидов в печени
- •Дифференциальная диагностика наследственных желтух
- •Определение общего билирубина сыворотки крови
- •Определение прямого билирубина сыворотки крови
- •Диагностика желтух
- •Проба Гмелина на желчные пигменты
- •Проба Богомолова на уробилин
- •Контрольные вопросы к теме биохимия печени
- •Контрольные задачи
- •Ситуационные задачи
- •Литература
- •Биохимия крови
- •Синтез гема и гемоглобина
- •Регуляция синтеза гема и гемоглобина
- •Нарушения биосинтеза гема. Порфирии
- •Обмен железа
- •Дыхательная функция крови
- •Буферные системы крови
- •Определение гемоглобина крови
- •Определение протромбинового времени
- •Определение времени свертывания крови
- •Тимоловая проба
- •Контрольные вопросы
- •Контрольные задачи
- •Рекомендуемая литература
- •Функции и состав плазмы крови
- •Белковые фракции крови
- •Строение молекулы иммуноглобулина. Фибриноген. Белки-ферменты плазмы крови
- •Главнейшие протеолитические системы крови
- •Система свертывания крови и фибринолиза
- •Система регуляции сосудистого тонуса
- •Антикоагулянты. Функциональные особенности системы свертывания крови и фибринолиза
- •Определение содержания общего белка биуретовым методом
- •Определение белковых фракций сыворотки крови турбидиметрическим методом
- •Контрольные вопросы
- •Рекомендуемая литература
- •Определение кальция в сыворотке крови и слюне комплексометрическим методом
- •Определение неорганического фосфата в сыворотке крови
- •Контрольные вопросы
- •Рекомендуемая литература
- •Биохимия мочеобразования и мочи Особенности метаболизма почечной ткани
- •Мочеобразование
- •Свойства мочи
- •Компоненты мочи
- •Цвет мочи
- •Основные симптомы опн и хпн
- •Реакция рН
- •Определение титруемой кислотности и аммиака мочи по методу Мальфатти
- •Качественные реакции на патологические составные части мочи
- •5. Кетоновые тела.
- •Экспресс методы обнаружения «сахара» и кетоновых тел в моче
- •Экспресс-метод определения «сахара» в моче
- •Экспесс-метод определения кетоновых тел в моче
- •Органические компоненты мочи
- •Типы органической протеинурии
- •Рекомендуемая литература
- •Биохимия соединительной ткани Состав соединительной ткани
- •Клетки Коллагеновые Межуточное соединительной эластические вещество ткани волокна
- •3 Главных молекулярных компонента
- •Коллагеновое волокно
- •Проколлаген
- •Проколлагенпептидаза
- •Тропоколлаген
- •Турбидиметрический метод определения уровня серогликоидов в сыворотке крови
- •Контрольные вопросы
- •Контрольные задачи
- •Ситуационные задачи
- •Ответы на контрольные задачи
- •Ответы на ситуационные задачи
- •Рекомендуемая литература
- •Биохимия нервной ткани Структура и функции нервной ткани. Особенности ее состава и метаболизма
- •Функции нервной ткани
- •Особенности химического состава
- •Особенности метаболизма нервной ткани
- •Функции липидов нервной ткани:
- •Метаболизм и особенности энергетического обеспечения нервной ткани
- •Метаболизм аминокислот и белков
- •Функции глутамата в нервной ткани
- •Биохимические основы возникновения и проведения нервного импульса
- •Понятие о синапсах. Нейромедиаторы. Пептиды
- •Классификация пептидов:
- •Биохимические основы возникновения некоторых заболеваний нервной системы
- •Определение активности холинэстеразы в сыворотке крови колориметрическим методом
- •Контрольные вопросы
- •Литература
- •Особенности строения мышечного волокна
- •Химический состав поперечно-полосатых и гладких мышц
- •Химизм мышечного сокращения
- •Метаболизм в мышечной ткани
- •Цнс - - - → возбуждение - - → синапс
- •Креатинофосфат
- •Время работы c
- •Утомление и тренировка
- •Окоченение мышц
- •Инфаркт миокарда
- •Открытие дегидрогеназы янтарной кислоты в мышцах
- •Определение молочной кислоты в мышцах
- •Нитропруссидная реакция (реакция Вейля) на креатинин
- •Количественное определение креатинина в моче
- •Контрольные вопросы
- •Задачи и упражнения
- •Литература
Литература
1. Пустовалова Л.М. Практикум по биохимии. Ростов-на-Дону «Еникс», 1999.
2. Николаев А.Я. Биологическая химия. Москва, МИА, 2001.
3. Биохимия. Под ред. Е.С. Северина, М., «ГЭОТАР –Медиа», 2008.
4. Березов Т.Т., Коровкин Б.Ф. Биологическя химия. М. «Медицина», 1998. Стр. 625, 644.
БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ
Мышцы составляют более 40% массы тела. Вся деятельность организма связана в той или иной мере с работой мышц. Функция сосудов и сердца, дыхание, пищеварение, выполнение работы обусловлено деятельностью мышечной ткани. Биохимия мышц служит основой для понимания многообразных функций мышечной ткани и играет большую роль в развитии знаний по физиологии, гигиене, понимании патогенеза заболеваний, связанных с поражением мышечной ткани (инфаркт миокарда, миодистрофии, коллагеновые болезни). В биоэнергетике мышечной ткани большое значение играет метаболизм адениловых и гуаниловых нуклеотидов, содержимое которых изменяется при патологических состояниях.
Цель: изучить молекулярную организацию мышечного волокна, дать представление о метаболических процессах, обеспечивающие мышцы энергией.
Особенности строения мышечного волокна
Мышца состоит из отдельных волокон, которые представляют собой мышечные клетки, окруженные плазматической мембраной (сарколемой). В цитоплазме находятся многочисленные ядра (100-200), митохондрии и другие обычные для клеток органеллы.
В мышечной клетке имеются миофибриллы (пучки белков), располагающиеся вдоль клетки, которые построены из белковых нитей (филаментов) двух типов – толстых (миозин) и тонких (актин). Функциональной единицей миофибриллы является участок, ограниченный двумя Z-пластинками, к М-линии прикреплены миозиновые нити своей серединой, активные нити прикреплены кZ-пластинкам. Чередование толстых (А-диски) и тонких (I-диски) нитей создает поперечную полосатость мышц.

Структура мышечного волокна
Химический состав поперечно-полосатых и гладких мышц
а) Сократительные белки: актин, миозин;
б) регуляторные белки: тропомиозин, тропонин.
Сокращение – один из характерных признаков живого. Сокращение
живой протоплазмы – основа многообразных движений. Функция мышц обусловлена рядом биохимических процессов, при которых в мышечных волокнах химическая энергия трансформируется в энергию, совершаемую мышцей при сокращении. Всю мускулатуру животного организма можно подразделить на две группы: поперечно-полосатые или скелетные мышцы, обеспечивающие все произвольные движения, выполнение физической работы, и гладкие – непроизвольные движения внутренних органов.
Структурная единица мышцы – мышечное волокно (его длина до 10-12 см., диаметр 0,1-0,02 мм).
Оболочка мышечного волокна построена из эластичных нитей – белков стромы, позволяющей клетке сокращаться и растягиваться. Сократительными элементами мышечной ткани являются миофибриллы, расположенные в форме пучков в цитоплазме мышечного волокна. Под микроскопом видна поперечная исчерченность из-за оптической неоднородности входящих в их состав белков.
Скелетные мышцы теплокровных животных содержат 74-78% Н2О и 26-22% сухого вещества. Основная масса сухого вещества приходится на долю белков 18-20%. Липиды составляют 1-3%, соли 1,5-2%, углеводы 0,5-3%. Содержание белковых мышц достигает 20,9%.
На основании растворимости белки можно разделить на фракции (содержание в % к общему белку мышц):
миогеновая фракция - 28%
группа глобулина Ŷ - 20%
группа миозина - 30-50%
группа актина - 10-12%
группа стромы - 9,5%
тропомизин - 2,5%
миоглобин - 0,2-0,6%
Миогеновая фракция: легко извлекается из мышц водой, представляет собой белки типа альбуминов. Ряд белков этой фракции обладает ферментативной активностью, катализируют процессы анаэробного и аэробного распада углеводов. Это – альдолаза, изомераза.
Глобулин Ŷ – также обладает ферментативной активностью.
Миозин представляет собой две полипептидные цепи, свернутые в двойную спираль. Конец (головка) молекулы миозина имеет глобулярное строение и связан нековалентно с четырьмя дополнительными короткими полипептидными цепями. При обработке трипсином миозин распадается на 2 фракции: легкий меромиозин и тяжелый меромиозин Н.
Миозин – высокомолекулярный белок (более 440 000). Имеет участки,
обладающие АТФ-азной активностью, проявляющейся в присутствии Са2+
.
 Структура миозина
Структура миозина
Легкий мирозин отличается от тяжелого по аминокислотному составу свойствами. Тяжелый миозин обладает ферментативной активностью. Он является аденозинтрифосфотазой и гидролитически расщепляет АТФ. Это можно описать: АТФ + H2O → АДФ + H3PO4 + W (энергия).
Актин – белок с более низкой молекулярной массой (42000). Может быть в двух формах: глобулярной (G) или фибриллярной (F). После прибавления солей G-актин легко переходит в F-актин. F-актин является полимером G-актина. Этот переход осуществляется под влиянием ионов К+: актин глобулярный → актин фибрилярный F. Актин F легко соединяется с миозином и образует новый белок-актомиозин.
F-актин состоит из двух филаментов скрученных в спираль.

Структура актина
Для актомиозина характерны следующие свойства:
способность разлагать АТФ;
освобождать энергию макроэргических связей;
превращать эту энергию в работу.
Тропомиозин – состоит из двух полипептидных цепей образующих двойную спираль, располагается в бороздке на поверхности – F актина по длине соответствует 7 субъектам - G-актина. Комплекс тропонина состоит из трех субъединиц с глобулярной структурой и расположен примерно на концах Тm. Tропонин Т (TnT) обеспечивает связь с Тm. Tропонин С (TnC) образует связь с ионами Са2+ на поверхности Тm, в результате чего изменяется его конформация.
Тропонин I (TnI) может предотвращать взаимодействие актина с миозином. Положение ТnI переменно и зависит от концентрации Са2+. В присутствии Са2+ изменяется конформация ТnC. Это приводит к изменению положения TnI по отношению к актину, в результате он может взаимодействовать с миозином.
Т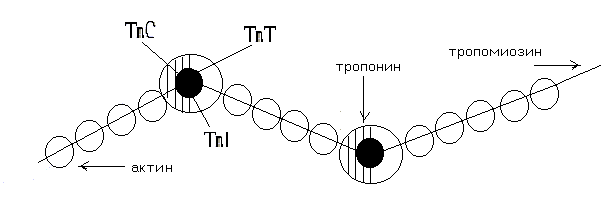 ропомиозин
и тропонин
ропомиозин
и тропонин
 Точное
пространственное расположение главных
белков сократительной мышцы - необходимое
условие сокращения и расслабления, а
также регуляции этих процессов. Сокращение
связано с образованием комплекса между
актином и миозином, в котором каждая
субъединица актина взаимодействует с
сегментом, содержащим головку миозина
(F1).
Расслабление происходит при сокращении
этого взаимодействия. Взаимодействие
А и М регулируется T, который находится
в бороздке актина. Изменение конформации
Т передается на T, который погружается
глубже в бороздку разрешая взаимодействие
актина с головкой миозина.
Точное
пространственное расположение главных
белков сократительной мышцы - необходимое
условие сокращения и расслабления, а
также регуляции этих процессов. Сокращение
связано с образованием комплекса между
актином и миозином, в котором каждая
субъединица актина взаимодействует с
сегментом, содержащим головку миозина
(F1).
Расслабление происходит при сокращении
этого взаимодействия. Взаимодействие
А и М регулируется T, который находится
в бороздке актина. Изменение конформации
Т передается на T, который погружается
глубже в бороздку разрешая взаимодействие
актина с головкой миозина.
Состояние миофибриллы: а) покой; б) сокращение
Миоглобин – сложный белок хромопротеин, по строению близок к гемоглобину, находится в красных мышцах, способен связывать и отдавать кислород, способствуя снабжению мышечных волокон кислородом.
В состав белков протоплазмы входят ферменты гликолиза с высокой ферментативной активностью. Ферменты биологического окисления сосредоточены в митохондриях, где осуществляется окислительное фосфорилирование. В рибосомах, лизосомах содержатся ферменты, осуществляющие превращение белков и липидов.
Оксимиоглобин отдает кислород только при значительном снижении парциального давления. Миоглобин извлекается из тканей аммиачным раствором. Соединительнотканные белки входят в состав оболочек клетки и субклеточных образований, стенок сосудов, нервов. Их содержание составляет до 20% от общего количества мышц. Это главным образом коллаген; они не извлекаются даже растворами солей.
В мышце имеются аминокислоты, полипептиды, а также азотосодержащие вещества, которые легко извлекаются водой. Их называют экстрактивными веществами. К ним относятся креатин и креатинфосфат, на долю которых приходится до 60% всего небелкового азота. В покое весь креатин мышц представлен в виде креатинфосфата. Его концентрация в мышце довольно высокая (0,2-0,55%), в связи с тем, что он играет важную роль в передаче макроэргических связей внутри клетки, и обеспечивает ресинтез АТФ.
Креатинфосфат (КрФ) - макроэргическое соединение, способное отдавать фосфорную группу на АДФ; реакцию катализирует креатинфосфаткиназа по схеме:
АДФ + Крф → креатинфосфаткиназа АТФ – Кр (креатин)

Креатин синтезируется в почках из аргинина.

В мышцы креатин доставляется с кровью.
Креатинфосфат (Крф) резерв макроэргических связей в мышце.
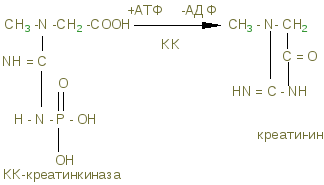
В мышцах можно обнаружить и некоторое количество креатинина, образующегося при разрушении Крф (креатинфосфата).
К числу азотосодержащих экстрактивных веществ относится ансерин, карнитин, карнозин (β-аланин-гистидин). В мышцах высоко содержание адениловых нуклеотидов, которые относятся к экстрактивным веществам (до 0,4 %) АТФ, АМФ, АДФ.
Углеводы представлены в основном гликогеном (0,5-0,8%). Основная масса гликогена организма сосредоточена в мышцах, хотя в печени его концентрация выше (5%). Моносахариды представлены преимущественно в виде гексозофосфатов, их концентрация не превышает концентрацию глюкозы в крови.
Минеральные вещества – (зола) составляет 1-1,5% массы мышц. Наряду с К+ и Na+ в мышцах содержится Ca2+ и Мg2+, которые играют важную роль в механизме мышечного сокращения. В условиях покоя Са2+ сосредоточен преимущественно в трубочках и пузырьках саркоплазматического ретикулума.
Основная масса фосфора (около 80%) мышечной ткани входит в состав макроэргических соединений (АТФ и креатинфосфат), 10% представлено в виде солей неорганического фосфата, 5% связано с гексозами и 5% входит в состав АДФ, АМФ и других нуклеотидов.
Химический состав гладких мышц включает те же вещества, что и поперечно-полосатые мышцы, но в других количественных соотношениях. В них меньше актомиозина и миозина, но больше миоальбумина и нерастворимых белков стромы (коллагена). Содержание гликогена менее 0,5%, меньше и экстрактивных веществ. Содержание Са2+ в гладких мышцах ниже.
