
2683
.pdf
На основании (17) получаем:
V |
1 |
|
|
1/ 2 |
|
1,38 10 23 273 |
|
3,8 10 10 м3 |
0,38мм3 . |
|
|
p/kT |
10 16 105 |
||||||
2n |
c |
|
|
|
|||||
|
|
|
|
|
|
|
|
||
6.183. N атомов гелия находятся при комнатной температуре в кубическом сосуде объемом V 1,0см3 . Решим два вопроса а) и б).
а) Какова вероятность того, что все атомы соберутся в одной половине сосуда?
Достаточно воспользоваться формулами (4) и (5) задачи 6.182, положив в ней m n N и p 1/2:
P(V V /2,N) c |
N |
p |
N |
q |
N n |
p |
N |
1 |
N |
|
1 |
|
|
N |
|
|
|
|
|
|
|
|
. |
||||
|
|
|
|
2N |
|||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|||
б) Найти число молекул N, которые могли бы собраться в одной половине сосуда за время t 1010 лет.
В рассматриваемом случае каждый помеченный атом гелия может находиться в одном из двух состояний, положим в левой или правой половине сосуда.
Полное число возможных размещений пронумерованных атомов по половинам сосуда равно 2N . Макросостояние, когда атомы соберутся в одной половине сосуда реализуется одним способом. Переход атома от одного состояния к другому (из одной половины сосуда в другую) обусловлен тепловым движением и занимает некоторый малый промежуток времени . Этот промежуток приближенно определим тем временем, за которое атом переместится из одного края сосуда к другому.
Если линейный размер сосуда а (a 3 V ), а средняя скорость движения атомов (
V ), а средняя скорость движения атомов ( 
 3RT /M ), то a/ . По условию а=1 см, Т=300 К, M=4 10 3 кг/моль, тогда 10мкс. Обозначим через t время от момента, когда система еще находилась в равновесии, до момента, когда все атомы соберутся в одной половине сосуда. Точно указать это время невозможно.
3RT /M ), то a/ . По условию а=1 см, Т=300 К, M=4 10 3 кг/моль, тогда 10мкс. Обозначим через t время от момента, когда система еще находилась в равновесии, до момента, когда все атомы соберутся в одной половине сосуда. Точно указать это время невозможно.
161

Очевидно, что наиболее вероятным этому событию будет момент времени t 2N , отсюда получим:
N ln 2 ln(t / ) N ln(t / ) . ln 2
Для t 1010 лет 365,25 24 3600с и 10мкс, N 80.
6.184. Наиболее вероятным состоянием системы является равновесное состояние, в котором имеет место равномерное распределение молекул по объему сосуда и, следовательно, в среднем одинаковое их число в половинах сосуда. Если в сосуде содержится N молекул, то статистический вес этого числа молекул 2N . В состоянии равновесия число молекул в одной половине сосуда N/2 (N – четное).
Статистический вес наиболее вероятного распределения
1 cNN/2 N!/ N /2!2 ,
а вероятность такого распределения
|
N /2 |
|
N |
|
N /2 |
|
c |
N /2 |
1 |
N |
|
1 N /2 |
||
P(N /2,N) c |
N |
p |
|
q |
|
|
N |
|
|
|
1 |
|
. |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
2 |
|
|
2 |
||||
Для N=10
1 10!/ 5!2 252,
P(5,10) 1 252 24,6%.
210
6.185. В сосуде, мысленно разделенном на две равные половины А и В, находится N молекул идеального газа. Укажем вероятность того, что в половине А окажется n молекул.
Воспользуемся формулой биноминального распределения случайной величины n с параметрами распределения N и p=1/2:
P cn |
pnqN n |
N! |
|
1 |
, |
|
n!(N n)! 2N |
||||||
n N |
|
|
||||
|
162 |
|
|
|
|
|
где q 1 p 1/2.
Рассмотрим случай, когда N=5 и n=0,1,2,3,4,5.
1) |
n=0 (все молекулы находятся в положении В). |
|||||||||||||||||||||||
|
P |
|
5! |
|
|
1 |
|
|
|
1 |
|
; |
|
|
|
|
||||||||
|
0!(5 0)! 25 |
32 |
||||||||||||||||||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2) |
n=1 |
|
|
|
|
5! |
|
|
|
|
1 |
|
|
|
5 |
|
|
|
|
|||||
|
|
P |
|
|
|
|
|
|
|
|
|
; |
||||||||||||
|
|
|
1!(5 1)!25 |
|
|
|
|
|||||||||||||||||
3) |
n=2 |
1 |
|
32 |
|
|
|
|
||||||||||||||||
|
|
|
|
5! |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
10 |
|
|
|
|||
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
; |
||||||||||
|
|
2!(5 2)! 25 |
|
|
|
|
||||||||||||||||||
4) |
n=3 |
2 |
32 |
|
|
|||||||||||||||||||
|
|
|
|
5! |
|
|
|
|
1 |
|
|
|
|
|
10 |
|
|
|
||||||
|
|
P |
|
|
|
|
|
|
|
|
|
; |
||||||||||||
|
|
|
3!(5 3)! 25 |
|
|
|
||||||||||||||||||
5) |
n=4 |
3 |
|
32 |
|
|
|
|||||||||||||||||
|
|
|
|
5! |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
5 |
|
|
||||
|
|
P |
|
|
|
|
|
|
|
|
|
|
; |
|||||||||||
|
|
4!(5 4)! 25 |
|
|
|
|||||||||||||||||||
|
|
4 |
32 |
|
|
|||||||||||||||||||
6) |
n=5 (все молекулы в половине А) |
|||||||||||||||||||||||
|
|
P |
|
|
5! |
|
|
|
|
|
1 |
|
|
|
1 |
. |
||||||||
|
|
|
5!(5 5)! 25 |
|
|
|||||||||||||||||||
|
|
5 |
|
32 |
|
|
||||||||||||||||||
6.186. В задаче 6.182 приведена формула (3). В той формуле заменим отношение N1 / N на V /V0 . Тогда искомая ве-
роятность
|
N! |
|
|
|
|
V |
n |
|
|
V |
N n |
|
N! |
n |
N n |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 p . |
Pn n!(N n)! |
|
|
|
|
|
|
|
|
n!(N n)! p |
|
||||||||||
V |
1 V |
0 |
|
|
|
|||||||||||||||
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Здесь p N1 / N V /V0 , q 1 p. |
В частности при V V0 /2 |
|||||||||||||||||||
|
P |
|
|
|
N! |
|
|
|
|
1 |
, где p 1/2. |
|
|
|||||||
|
n!(N n)!2N |
|
|
|||||||||||||||||
|
n |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
163 |
|
|
|
|
|
|
|
|
|
||

6.187. В той же задаче 6.182 была представлена формула (17), определяющая относительную флуктуацию числа частиц в объеме V1 , являющемся частью V объема газа:
|
|
( m)2 |
|
1 |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
(1) |
||
|
|
m |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
ncV1 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
где nc - равновесная концентрация молекул, |
nc p/kT . Из (1) |
|||||||||||||||||||
получаем: |
|
|
|
|
1 |
|
|
kT |
|
|
|
|
|
|
|
|||||
V |
|
|
|
. |
|
|
|
|
|
|||||||||||
|
2nc |
|
|
|
|
|
|
|||||||||||||
1 |
|
|
|
2 p |
|
|
|
|||||||||||||
Поскольку выделенный объем V1 |
ограничен сферой, то диа- |
|||||||||||||||||||
метр этой сферы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
6kT |
|
|
|
||||
d |
|
|
6V1 / |
|
|
|
|
|
(2) |
|||||||||||
3 |
|
3 |
2 p . |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Среднее число молекул газа в объеме V1 равно
1
N1 ncV1 2 .
Для 1,0 10 3 при нормальных условиях d 0,4мкм, N1 1,0 106 .
6.188. Некоторая система поделена на три части. Пусть статистические веса этих частей есть 1, 2, 3 . Пренебрегая
влиянием границ раздела, для энтропии системы в целом напишем
S kln ( 1 2 3) S1 S2 S3 .
Значения S и S1 известны. Требуется найти статистические веса частей 2 и 3, соответствующие значениям энтропии S2 и S3 при условии, что макросостояния частей одинаковы.
Поскольку система находится в равновесии, то давление и температура во всех трех частях системы одинаковы. Так как макросостояния частей 2 и 3 одинаковы, то и значения третье-
164
го параметра V , надо полагать, равны, V2 V3 . Отсюда следу-
ет, что S2 S3 |
S и |
2 3 . Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
S |
|
k ln |
|
|
|
|
S S |
|
|
|
|
|
|
|
S S |
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
и |
|
exp |
|
1 |
. |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2k |
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Для S=10Дж/К, S1 6Дж/К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23 |
|
|
|
|
|
|
|
6,310 |
23 |
|
|||||||||
|
|
exp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
exp1,45 10 |
|
10 |
|
|
. |
|
||||||||||||||||||||||||||||
|
|
2 1,38 10 |
23 |
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
6.189. В равновесном процессе Q TdS . При T const |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
Q T(S |
2 |
S ) kT(ln |
2 |
ln ) kT ln |
2 |
kln . |
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Для Т=350 К и |
|
|
1,0 109 система получает тепло- |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||
ту, равную |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Q 1,38 10 23 |
350ln(1,0 109) 1,0 10 19 Дж . |
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
6.190. S (S |
2 |
|
S ) kln |
2 |
kln . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|||||||
TdS Q |
dU C dT |
|
|
C dT |
|
|
|
|
|
dT ; |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
1 |
|
|
V |
|
|
|
|
1 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
R dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R T0 T |
dT |
|
|
R T T |
|||||||||||||||||||||||||||
dS |
|
|
|
|
|
|
, |
S2 S1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
ln |
|
|
0 |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
T |
|
|
|||||||||||||||||||||||||||||||||||||
1 |
|
T |
|
|
|
|
|
|
1 |
|
|
|
T |
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
||
|
|
|
|
|
R |
|
|
ln(1 |
T |
) |
|
|
ln |
|
NA |
|
ln(1 |
T |
). |
|
|
||||||||||||||||||||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
T0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T0 |
|
|
|
|
|||||||||||||||
|
|
|
ln ln(1 |
T |
)NA / 1 |
|
(1 |
T |
)iNA /2 . |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T0 |
|
|
|
|
|
|
||||||||||
Для T0 300K , |
T 1,0K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
3 6,021023 /2 |
|
|
1,311021 |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
(1 |
|
|
|
|
) |
|
|
|
|
|
|
|
|
10 |
|
|
|
. |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
300 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
165 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
5. ЯВЛЕНИЕ ПЕРЕНОСА
6.191. Молекулы газа, находясь в тепловом движении, непрерывно сталкиваются друг с другом. Под столкновением молекул подразумевают процесс взаимодействия межу молекулами, в результате которого молекулы изменяют направление своего движения. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. Величина
(1)
называется эффективным сечением молекулы. Введение понятия эффективного сечения позволяет считать налетающую частицу точечной, а частицу – мишень – площадкой с поперечным размером . Столкновение молекулы с другой моле-
кулой является случайным собы- |
|
|
|
тием, а частота столкновений - |
|
|
|
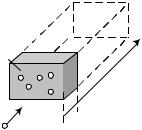
случайной величиной. Пусть па- |
|
x |
|
дающая частица попадает на пло- |
S |
||
щадку S в том объеме, в котором |
|
|
|
|
|
||
расположены частицы – мишени с |
|
|
|
концентрацией n0 |
(см. рис.). В |
|
dx |
|
|||
слое толщины dx |
находится чис- |
|
|
|
|
||
ло n0dV n0Sdx частиц, а сумма
их поперечных сечений, которая как бы закрывает часть площади S равна n0Sdx. Из этого следует, что вероятность попа-
дания налетающей частицы в одну из частиц-мишеней в слое dx равна
dP |
dS |
n dx. |
(2) |
|
|||
|
S |
0 |
|
|
|
|
Величины и n0 не зависят от x . Поэтому вероятность события столкновения растет пропорционально проходимому падающей частицей пути. Длина пути при котором эта вероятность равна единице, называется средней длиной сво-
166

бодного пробега. Для её определения из (2) получаем уравне-
ние 1 6n0 , из которого следует, что |
|
1/6n0 . |
(3) |
Формулы (2) и (3) написаны в предположении, что час- тицы-мишени неподвижны. В действительности все молекулы находятся в состоянии движения. Поэтому частота столкновений молекулы будет определяться не абсолютной скоростью ее движения, а относительной скоростью сближения с части-
цами |
– |
мишенями. |
Нетрудно |
показать, |
что |
||||||
отн |
|
2 |
абс . В связи с этим в формулу (3) вносится |
||||||||
поправка и эта формула получает вид |
|
|
|||||||||
|
|
|
|
|
|
1 |
. |
|
(4) |
||
|
|
|
|
|
|
|
|
||||
|
|
|
|
26n0 |
|
||||||
|
|
|
|
|
|
|
|
|
|||
Среднюю длину свободного пробега молекул часто обо- |
|||||||||||
значают через |
( ) и в дальнейшем мы будем пользо- |
||||||||||
ваться новыми обозначениями. |
|
|
|
|
|
|
|
||||
Теперь положим, что на нормальную площадку S |
в на- |
||||||||||
правлении оси x направляется моток из N частиц. Приращение потока (точнее ослабление) на пути dx равно
dN NdP N6n0dx. |
(5) |
Решая уравнение dN / N 6n0dx, получим |
|
N N0e 6n0x N0e x/ , |
(6) |
где N0 N x 0 , 6n0 1/ .
Отсюда следует, что относительное число молекул газа,
пролетающих путь без столкновения, равно |
|
||
|
N |
e / . |
(7) |
|
|
||
|
N0 |
|
|
Далее ответим на вопросы задачи.
а) Подставляя в формулу (6) значение x , получим число частиц, пробежавших расстояние без столкновений:
167

N1 |
N( ) N0e 1 |
N0 |
. |
(8) |
|
||||
|
|
e |
|
|
Относительная доля этих частиц
N / N0 1/e 0,37 37%.
б) Число молекул пробежавших путь x 2 в направлении оси x без столкновений, равно
N2 N(2 ) N0e 2 .
Число молекул с длиной свободного пробега от до 2
N N1 N2 e 1 0,23 23%.
N0 N0 e2
Сопоставляя результаты а) и б) видим, что свободный пробег частицы газа не превышает двух значений среднего пробега молекул.
6.192. Пусть к началу отрезка пути равен N0 , тогда
согласно формуле (7) задачи 6.191 поток частиц в конце отрезка будет равен
N e / . N0
По условию N / N0 1/ , тогда |
1/ e / и |
/ln . |
|
6.193. По условию вероятность возможного столкновения молекул газа за время dt равна dPст dt , где - постоян-
ная. Понятно, что вероятность столкновения молекулы за время t равна Pст t . Обозначим время свободного перемеще-
ния молекулы на пути среднего пробега со средней статистической скоростью через . В конце этого пути молекула сталкивается с другой молекулой. Вероятность состоявшегося события столкновения равна единице. В результате имеем равенство 1 . Отсюда заключаем, что молекула в течение вре-
168

мени 1/ не испытывает столкновения и время является средним временем между столкновениями.
Вследствие разброса направлений движения сталкивающихся молекул, их число в заданном направлении уменьшается. Для интенсивности потока молекул можно написать:
dI IdP I I dt I I0e t .
Отсюда получаем вероятность события, состоящего в том, что молекула не испытывает столкновения в течение времени t:
P I / I0 e t .
6.194. Найдем среднюю длину свободного пробега и среде время между столкновениями молекул азота.
Решение задачи можно получить с помощью известных формул:
|
|
|
1 |
, n |
p |
, |
|
|
|
8kT |
|
8RT |
, |
|
. |
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
2 d2n |
|
|
|
|
|
kT |
|
|
|
m |
M |
|
||||||||||
Диаметр молекулы азота d 0,37нм. |
|
|
|
|
|
|
||||||||||||||||||
а) при нормальных условиях: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
n |
|
|
|
|
|
105 |
|
|
|
|
25 |
|
м |
3 |
; |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
2,7 10 1/ |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
1,38 10 23 273 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
8 8,31 273 |
|
|
|
450м/c; |
|
|
|
|
|
||||||||||
|
|
|
3,14 28 10 3 |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
0,06мкм; |
|||||||
|
|
|
|
|
|
(0,37 10 9)2 |
2,7 1025 |
|||||||||||||||||
|
|
|
|
|
2 |
|||||||||||||||||||
6 10 8 1,3 10 10 0,13нс . 450
б) Т=273К, p=1,0нПа=1,0 10-9 Па : по сценарию пункта а) получим: 6 106 м, 3,8ч .
169

6.195. Длина свободного пробега молекул азота при нормальных условиях 0,06мкм (см. пункт а) задачи 6.194); среднее расстояние между молекулами при н.у.
|
1 |
|
|
1 |
|
1/3 108 м. |
||
|
|
|
|
|
|
|||
|
3 n |
3 2,7 1025 |
||||||
|
|
|
||||||
Отношение / 6 10 8 3 108 18.
6.196. Начнем с идеального газа. Идеальный газ – это огромная совокупность невзаимодействующих (на расстоянии) между собой частиц, непрерывно совершающих хаотические движения в заданном пространстве V . При рассмотрении ряда вопросов суммарным объемом частиц идеального газа пренебрегают по сравнению с объемом сосуда V . Параметры идеального газа удовлетворяют уравнению
pVm RT , (1)
где Vm - объем одного моля газа. Давление р газа обусловлено
бомбардировкой частицами поверхности сосуда и определяется кинетической энергией поступательного движения частиц.
Параметры макросостояния газа не удовлетворяют уравнению (1). Неприменимость соотношения (1) по отношению к реальным газам становится наиболее очевидной при больших давлениях. В случае реального газа необходимо учитывать имеющиеся силы притяжения между молекулами и собственные размеры молекул. В связи с этим в уравнение (1) вводятся поправки на давление и объем газа. При внесении поправок уравнение состояния реального газа получает вид
(p |
a |
)(V |
m |
b) RT . |
(2) |
|
|||||
V 2 |
|
|
|||
|
m |
|
|
|
|
Уравнение (2) называется уравнением Ван-дер-Ваальса, а величины a и b называются постоянными Ван-дер-Ваальса. Уравнение (2) не является универсальным. Постоянные a и b для разных газов имеют различные значения и определяются опытным путем.
170
