
2683
.pdf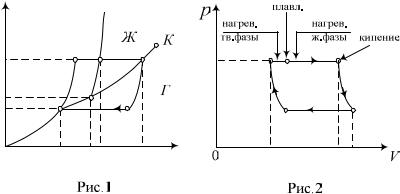
p |
|
|
|
|
|
|
|
|
1 |
A |
2 |
|
p1 |
1 |
2 |
|
Tв |
|
|
|
|
||
|
Тр |
|
|
|
Aд2 |
Aд1 |
|
pБ |
4 |
|
|
p2 |
4 |
3 |
|
|
3 |
|
|||||
|
|
|
|
|
|||
0 |
Т ТБТА |
Т1 |
Т |
|
VT VT |
VЖ VГ |
|
Пусть изотермические участки цикла соответствуют
температурам |
нагревателя Т1 T T |
и холодильника |
Т2 T T , |
где T - температура тройной |
точки, T T . |
Фазовые переходы первого рода всегда связаны с выделением и поглощением теплоты и, следовательно, сопровождаются скачкообразным изменением внутренней энергии и плотности вещества. Вместе с этим полное изменение энтропии системы за обратимый цикл равно нулю.
На участках 1 2 3 цикла системе сообщается тепло,
на участках 3 4 1 |
|
– отнимается. Приращения энтропии, |
|||||||||||||||||||||||||||||||
соответствующие этим участкам цикла равны: |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
c mdT |
|
m q |
|
dm |
|
|
c |
|
mdT |
|
m q |
dm |
|
|
|
|
|
Q |
|||||||||||||||
S1 |
T |
|
|
|
|
П |
|
|
|
|
|
ж |
|
|
|
|
И |
|
|
|
|
|
|
|
|||||||||
|
T |
|
|
T |
|
|
|
T |
|
|
T |
|
|
T |
|
||||||||||||||||||
1 A |
|
|
0 |
|
|
|
П |
|
A 2 |
|
|
|
|
0 |
|
K |
|
|
2 3 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
qИ |
|
|
|
|
|
|
TП |
|
|
|
|
TK |
|
|
|
|
|
|
|
|||||||
|
|
|
|
qП |
|
|
|
|
|
|
|
|
|
cж ln |
|
; |
|
|
|
|
|
||||||||||||
|
|
|
|
|
T |
|
|
|
T |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
m T |
|
m cT ln |
|
T |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
П |
|
|
|
K |
|
|
|
|
|
1 |
|
|
|
|
П |
|
|
|
|
|
|
|||||||||
|
|
cГ mdT |
|
m |
|
qcdm |
|
|
|
Q |
|
|
|
|
|
T3 |
|
qc |
|
||||||||||||||
S2 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
m cT ln |
|
|
|
|
|
. |
||||||||||||||||
T |
|
|
|
T |
|
|
T |
|
T |
|
T |
||||||||||||||||||||||
4 3 |
|
|
|
|
|
|
0 |
|
c |
|
4 1 |
|
|
|
|
|
|
|
4 |
|
|
|
c |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
331 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Здесь сТ, сж, сГ=ср – удельные теплоемкости твердой фазы, жидкой фазы и пара; qП, qИ, qс – значения удельной теплоты плавления, испарения и сублимации – соответственно; ТП, ТК, Тс - температуры плавления, кипения, сублимации.
Полное приращение равно
|
|
|
|
|
|
|
|
S 0 S1 S2 |
|
|
|
|
||||
|
|
|
qИ |
|
qc |
|
|
|
TП |
|
TK |
|
T3 |
|
||
|
qП |
|
|
|
|
ln |
cж ln |
cГ ln |
|
|||||||
|
T |
|
T |
|
T |
|||||||||||
m T |
|
T |
m cT |
T |
|
. |
||||||||||
|
П |
|
K |
|
c |
|
|
1 |
|
|
П |
|
4 |
|
||
Поскольку цикл осуществляется в малой окрестности тройной точки, то можно положить: ТП, ТК, Тс T , а лога-
рифмы отношений температур принять практически равными нулю. Тогда
m
S T qП qИ qc 0
и, следовательно, qП= qс – qИ=0,78-0,57=0,21 (кДж/г).
6.356. Жидкость испаряется при любой температуре. С
этой точки зрения нагрев воды от 10 C до 100 C будем считать достаточно быстрым с тем чтобы пренебречь массой испарившейся воды. Полное испарение воды будет считать про-
исходящим при 100 C (при температуре кипения). Далее отметим, что испарение происходит в свободное пространство и, следовательно, в процессе испарения никакой работы не совершается. На основании этих соображений можно написать
|
Q |
T2 |
cmdT |
|
qdm |
|
T |
|
q |
|
|
S S2 S1 |
|
|
|
|
|
|
m(cln |
2 |
|
|
). |
T |
T |
T |
|
T |
T |
||||||
|
|
T |
|
2 |
|
|
1 |
2 |
|||
|
|
1 |
|
|
|
|
|
|
|
|
|
Для воды с=4,18 Дж/г К, q=2250 Дж/г. При m=1,00 кгS 7,2кДж / К .
332
6.357. Пусть масса льда была равна m. Учитывая замечания, сделанные в предыдущей задаче (6.356), для изменения энтропии вещества в процессе превращений лед – вода – пар, получим
S |
qплm |
cmln |
T2 |
|
qисm |
, |
T1 |
T1 |
|
||||
|
|
|
T2 |
|||
где qпл , qис – удельные теплоты плавления льда и испарения воды.
Приращение удельной энтропии системы равно
|
|
S |
уд |
|
S |
|
qпл |
cln |
T2 |
|
qис |
. |
|
|
||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
m T |
|
|
T |
T |
|
|
|
|
|||||||
|
|
|
|
|
1 |
|
|
1 |
|
2 |
|
|
|
|
||||||
Определено |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Sуд |
|
333 103 |
4,18 103 ln |
373 |
|
2,25 106 |
8,6 |
Дж |
. |
|||||||||||
|
|
373 |
|
|
|
|||||||||||||||
|
273 |
|
|
273 |
|
|
|
|
|
г К |
||||||||||
6.358. Если нагреть и расплавить лед, содержащийся в калориметре, потребуется теплота
Q1 50 103(2,09 103 3 333 103) 17кДж.
Теплота, которая могла бы выделиться при остывании куска меди до 0 C , равна
Q 90 10 3 0,39 103 90 3,16кДж .
Из сравнения значений Q1 и Q видно, что лед распла-
виться лишь частично и, следовательно, температура теплово-
го равновесия системы 0 C .
Измерение энтропии меди заданной массы равно
|
Q |
T2 |
c |
M |
mdT |
|
T |
|
273 |
|
Дж |
||
S |
|
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
cM mln |
|
0,38 90ln |
|
|
10 |
|
. |
||
T |
|
|
T |
T |
369 |
К |
|||||||
|
|
T |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
333 |
|
|
|
|
|
|
|
6.359. На основании закона сохранения энергии найдем температуру теплового равновесия данной системы.
Сначала посмотрим, сколько тепла потребуется для плавления всей массы льда:
Q1 qm1 333 100 3,33 104 Дж 33,3кДж.
Затем вычислим количество тепла выделяющегося при остывании воды, находящейся в колориметре от температуры
t |
2 |
до t |
0 C : |
|
|
|
1 |
|
|
|
|
|
|
1) |
t2 |
60 C : |
|
|
|
|
|
Q2 cm2 (t2 t1) 4,18 100 60 25кДж ; |
|
|
|
2) |
t2 |
94 C : |
|
|
|
|
|
Q2 cm2 (t2 t1) 4,18 100 94 39,3кДж . |
|
|
|
Из сравнения величин Q1 , Q2 и |
Q1 , Q2 видно, что в |
||
первом случае лед растает частично, во втором – полностью.
Далее |
найдем приращение энтропии в рассматриваемых |
|||||||||||||||||
случаях. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а) t2 60 C . |
Здесь приращение энтропии определяется |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
процессами плавления некоторой части льда массы m и ох- |
||||||||||||||||||
лаждением |
воды |
массы |
m2 |
от температуры |
t2 60 C до |
|||||||||||||
t1 0 C . |
Масса |
m1 |
cm2(T2 |
T1) |
. |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
q |
|
|
|
|
|
|
|
|
|
m1 |
qdm |
T1 cm2dT |
|
qm1 |
|
|
T1 |
|
T2 |
|
T2 |
|||||||
S |
|
|
|
|
|
|
|
|
|
cm2 ln |
|
cm2( |
|
1 ln |
|
). |
||
T |
|
|
|
T |
T |
|
T |
T |
T |
|||||||||
0 |
1 |
|
|
T2 |
|
|
|
1 |
|
2 |
1 |
1 |
|
|||||
|
б) |
Сначала найдем температуру установившегося |
||||||||||||||||
теплового равновесия:
qm1 cm1( T1) cm2 (T2 )
334

|
m1T1 m2T2 |
|
qm1 |
|
|
|
|||
|
m1 m2 |
c(m1 m2) |
||
m1T1 m2T2 qm1 /c . m1 m2
Приращение энтропии
|
|
|
qm |
|
cmdT |
|
cm dT |
|||||||||||||
S |
|
|
|
|
1 |
|
|
1 |
|
|
|
|
2 |
|
|
|
||||
T |
|
|
T |
T |
|
|||||||||||||||
|
1 |
T |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
qm1 |
|
cm ln |
|
cm ln |
T2 |
|
|||||||||||||
|
T |
|
|
|
||||||||||||||||
|
|
|
1 |
|
|
T |
2 |
|
|
|
|
|||||||||
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||||
|
qm |
c(m ln |
|
m ln |
T2 |
). |
||||||||||||||
|
|
|
||||||||||||||||||
|
|
T |
|
|
1 |
|
|
T |
2 |
|
|
|
|
|
||||||
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|||||
6.360. Вылитый в калориметр расплавленный свинец сначала закристаллизуется, а затем остынет до 0 C . При этом в калориметре расплавится часть льда некоторой массы m1 .
Тепловое равновесие достигается при условии
qлm1 qcm cm(t2 t1) .
Отсюда имеем |
|
m1 m qc c(T2 T1) /qл . |
(1) |
Здесь с – удельная теплоемкость свинца, qл , qc |
– значе- |
ния удельной теплоты плавления льда и свинца. |
|
Приращение энтропии системы свинца – лед к моменту установления теплового равновесия равно
S |
qлm1 |
|
qcm |
cmln |
T2 |
. |
|
|
(2) |
||||||
T1 |
T2 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
T1 |
|
|
|
|||||
При постановке (1) в (2) получим: |
|
|
|
|
|
|
|||||||||
|
1 |
|
|
|
|
|
T2 |
|
|
||||||
|
1 |
|
|
|
|
T2 |
1 ln |
|
(3) |
||||||
|
|
|
|
T |
|||||||||||
S mqc T T |
mc T |
. |
|||||||||||||
1 |
2 |
|
1 |
|
|
|
1 |
|
|
||||||
|
|
|
|
|
335 |
|
|
|
|
|
|
|
|
||

6.361. Напишем уравнение первого начала термодинамики для моля насыщенного водяного пара
|
|
Q dUM pdVM . |
(1) |
||||
Поделим равенство (1) на dT: |
|
|
|
|
|||
|
Q |
C |
dUM |
p |
dVM |
. |
(2) |
|
dT |
dT |
|
||||
|
|
|
dT |
|
|||
Принимая насыщений пар воды за идеальный газ, полу-
чим:
|
|
|
|
dUM |
|
C |
; pV |
M |
RT |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
dT |
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
pdV |
|
V |
|
dp RdT p |
dVM |
V |
|
|
dp |
R |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
M |
|
M |
|
|
|
|
|
|
|
|
|
dT |
|
|
|
|
M dT |
|
|
|
|
|
|
|||||
|
|
|
|
p |
dVM |
R V |
dp |
. |
|
|
|
|
|
|
|
|
|
|
(3) |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
dT |
|
|
|
M dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Подставим (3) в (2): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
C C |
R V |
|
dp |
C C |
|
|
V |
|
|
|
dp |
|
(4) |
||||||||||||||||
M dT |
|
|
M dT |
||||||||||||||||||||||||||
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
p |
|
|
|
|
|||||||||||
Согласно уравнению Клаперона–Клаузиуса |
|
|
dp |
|
qM |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dT |
TVM |
|||
при условии, что объем пара. Буквы q и М означают удельную теплоту парообразования и молярную массу воды.
Итак, молярная теплоемкость насыщенного пара вблизи состояния конденсации равна
C Cp VM |
dp |
, |
Cp 4R . |
(5) |
|
||||
|
dT |
|
|
|
При T 373Kтеплоемкость
C 4 8,31 2,25 106 18 10 3 74Дж / К моль. 373
336
6.362. Один моль жидкой фазы воды был полностью переведен в насыщенный пар. Приращение энтропии системы при таком переходе равно
|
|
Q |
|
Q |
|
|
|
Q |
|
|
T2 CpMdT |
M qdm |
||||||||||||
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
T |
T |
|
T |
|
T |
|
T |
|
|||||||||||||||
|
|
|
|
нагр |
|
|
|
исп |
|
|
|
|
|
|
T |
|
0 |
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|||
|
|
|
|
C |
p |
ln |
T2 |
|
qM |
, T T . |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
T |
|
T |
2 |
1 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||||
Для |
воды |
удельная |
|
теплоемкость |
c 4,18 |
|
Дж/г К., |
|||||||||||||||||
удельная |
теплота |
парообразования |
q 2,25 106 Дж/кг, |
|||||||||||||||||||||
M 18 10 3 кг/моль. |
Молярная теплоемкость водяного пара |
|||||||||||||||||||||||
при постоянном давлении Cp 4R . |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
В рассматриваемом случае температуры |
не заданы, по- |
|||||||||||||||||||||||
этому остановимся на выражении |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
S 4Rln |
T2 |
|
qM |
. |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
T2 |
|
|
|
|
|
|
||
ЗАКЛЮЧЕНИЕ
Данный выпуск является завершающей частью учебного пособия «Практика решения задач по физике». Авторы учебного пособия по практике решения физических задач смеют надеяться, что все составляющие выпуски пособия принесут студентам существенную помощь при изучении одной из важнейших наук – физики.
337
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Иродов И.Е. Задачник по общей физике / И.Е. Иродов.
–Лаб.баз.знан. физ.-мат.лит., 2002. 431 с.
2.Савельев И.В. Курс общей физики / И.В. Савельев. –
М.:Наука, 1982. Т.1. 432 с.
3.Матвеев А.Н. Молекулярная физика / А.Н. Матвеев.-
М.: Высш.шк., 1981. 395 с.
4.Ландау Л.Д. Статистическая физика / Л.Д. Ландау,
Е.М. Лифшиц. – М.: Наука, 1964. 567 с.
5.Рейф Ф. Статистическая физика / Ф. Рейф. – М.: Наука, 1977. Т.V. 350 с.
338
|
ОГЛАВЛЕНИЕ |
|
ПРЕДИСЛОВИЕ……..………………………………...…….. |
3 |
|
1. |
Уравнение состояния газа. Процессы……………………. |
4 |
2. |
Перовое начало термодинамики. Теплоемкость……...... |
22 |
3. |
Молекулярно-кинетическая теория. Распределение |
|
Максвелла и Больцмана. …….…………………………….... |
55 |
|
4. |
Второе начало термодинамики. Энтропия.……………… |
109 |
5. |
Явление переноса. ………………………………………… |
166 |
6.Тепловое излучение ………………………………………. 199
7.Твердое тело ………………………………………………. 217
8.Капиллярные явления …………………………………….. 275
9. Фазовые превращения ……………………………….…… 300
ЗАКЛЮЧЕНИЕ…………………………………………….… 337
БИБЛИОГРАФИЧЕСКИЙ СПИСОК………………………. 338
339
Учебное издание
Евсюков Василий Афанасьевич Татьянина Елена Павловна
ПРАКТИКА РЕШЕНИЯ ЗАДАЧ ПО ФИЗИКЕ
Часть 6
ФИЗИКА МАКРОСИСТЕМ
В авторской редакции
Подписано к изданию 28.09.2012 Объем данных 2,0 Мб
ФГБОУ ВПО «Воронежский государственный технический университет»
394026 Воронеж, Московский просп., 14
340
