
2683
.pdf
а) V const. dS |
dU |
|
|
CV dT |
. |
|
|
|
|
|
|||
T |
T |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
|
T2 dT |
|
|
|
T |
|
|
|
|
|
|||
S S2 S1 CV |
|
|
CV ln |
2 |
CV lnn. |
|
|
|
|||||
T |
|
T |
|
|
|
||||||||
|
T |
|
|
1 |
|
|
|
|
|
||||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
Для 1 углекислого газа (CV |
|
3R) и n=2 |
|
|
|
||||||||
|
SM 3Rln2 17,4Дж/моль∙К. |
|
|
|
|||||||||
б) p const. |
Здесь p RT /V |
и dS |
CV dT |
|
RdV |
. |
|||||||
T |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
V |
||
Для CO2
S R (3ln T2 ln V2 ).
|
|
|
|
|
|
|
|
|
|
T1 |
|
V1 |
|
|
|
|
|
|
|
|
||
|
Для одного моля газа SM R (3ln |
T2 |
ln |
T2 |
)=4Rln |
T2 |
; |
|||||||||||||||
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
T1 |
|
|
|
T1 |
|||
|
|
|
|
SM 4 8,3 ln2 23,2 Дж/моль∙К. |
|
|
|
|
|
|||||||||||||
|
6.154. Изменение энтропии идеального |
газа в количестве |
||||||||||||||||||||
|
молей при T const равно S. Найти V2/ V1 . |
|
V2 |
|
|
|
||||||||||||||||
|
В этом случае dS |
pdV |
R |
dV |
и S R ln |
. Отсю- |
||||||||||||||||
|
|
|
|
|
|
|
|
|
T |
|
V |
|
|
|
|
|
|
V1 |
||||
да |
V |
/ V =exp |
S |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
2 |
1 |
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
S=23 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Для |
4 |
|
и |
|
Дж/К |
отношение |
|||||||||||||||
|
|
|
23 |
0,7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
V2/ V1 =exp |
|
|
e |
|
2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
4 8,3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
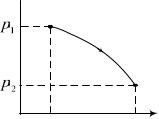
6.155. Идеальный газ в количестве молей совершает процесс, диаграмма которого показана на рисунке. При этом p1/ p2 =n. Найти приращение энтропии газа в этом процессе.
131

|
Поскольку отрезки |
1 2 и |
p |
|
|
|
|
|
|
|
|||||||||||
2 3 |
пути |
процесса |
|
являются |
|
|
1 |
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||
обратимыми, |
|
то |
весь |
процесс |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
1 2 3 эквивалентен |
изотер- |
|
|
|
|
|
|
(T1 const) |
|||||||||||||
мическому процессу 1 3. В изо- |
|
|
|
2 |
|
|
3 |
|
|||||||||||||
термическом |
|
|
|
|
|
процессе |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
dS |
Q |
|
pdV |
и, следовательно, |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
0 |
V1 |
|
V3 V |
|||||||||||||||
|
T |
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
||||||
|
S= |
|
|
V3 dV |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
(3) pdV |
|
|
|
V |
|
p |
|
|
|
|
|
||||||||
S3 S1 |
|
|
R |
|
|
3 |
|
|
1 |
|
|
|
|
|
|||||||
|
|
Rln |
|
Rln |
|
|
, |
|
|
|
|
||||||||||
T |
V |
V |
p |
|
|
|
|||||||||||||||
|
|
(1) |
|
|
|
|
V |
|
1 |
|
|
2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
так как |
|
p1V1 p2V3 . |
|
|
|
|
S= Rlnn. Для 2 и |
||||||||||||||
|
По условию |
p1/ |
p2 =n, тогда |
||||||||||||||||||
n=3,3 S=20 Дж/К.
6.156. Гелий массы m совершил
процесс, показанный на рисунке. При |
|
|
p |
|
|
|
||||||||||||||||||
|
|
|
|
1 |
|
|
|
|||||||||||||||||
расширении газа его объем увеличил- |
|
|
|
|
||||||||||||||||||||
ся в n раз. Найти изменение энтропии |
|
|
|
|
|
|
|
Q 0 |
||||||||||||||||
газа в этом процессе. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Из рисунка видно, что заданный |
|
|
|
|
|
|
|
|
2 |
|
||||||||||||||
процесс 1 2 3 |
эквивалентен |
по |
|
|
|
|
3 |
|
|
|||||||||||||||
|
|
|
|
|||||||||||||||||||||
результату |
изохорному |
|
процессу |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
0 V1 |
V2 V |
||||||||||||||||||||
1 3. Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
dS |
Q |
|
dU |
|
CV dT |
|
|
R |
|
dT |
|
|
|
|
|
|
|
|
|
|||||
T |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
T |
|
T |
|
|
1 |
|
T |
|
|
|
|
|
|
|
|
|
|
|||||
и |
|
|
|
|
|
R T3 dT |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
R T |
|
|
|
||||||||||||
|
|
S=S3 S1 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
ln |
|
|
. |
|
|
|
|
||||||||||
|
|
1 |
T |
|
1 |
|
T |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
T |
|
|
1 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
132
Из соотношений |
pV RT , |
p V RT |
|
имеем |
T3 |
|
|
p2 |
, |
||||||||||||
|
|
||||||||||||||||||||
|
|
1 |
1 |
|
1 |
2 |
1 |
|
|
|
3 |
|
|
|
T1 |
|
p1 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
T3 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|||||||
а учитывая, что |
p1V1 p2V2 |
, получаем |
T |
|
|
n |
|
|
, а за- |
||||||||||||
V |
|
|
|
||||||||||||||||||
тем |
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
||
|
S= |
|
Rlnn |
|
|
Rlnn. |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
1 |
|
|
1 |
M |
|
|
|
|
|
|
|
|
|
|
|||||
Для He |
M 4 10 3кг/ моль, |
5/3. Для |
m=1,7 |
кг |
и |
||||||||||||||||
n=3,0 изменение энтропии S 10Дж/К |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
p 
1
2
0 V1 |
V2 V |
6.157. Идеальный газ в количестве двух молей с известным показателем адиабаты совершает некоторый процесс (см.рис.), причем V2/ V1 =α, p1/ p2 = . Найти приращение энтропии газа в этом процессе. Для дифференциала энтропии в ходе обратимого процесса имеем
dS |
Q |
|
dU |
|
pdV |
= C |
dT |
p |
dV |
C |
dT |
R |
dV |
. (1) |
|
T |
|
T |
|
T |
V |
T |
|
T |
V |
T |
|
V |
|
Путем интегрирования (1) получим: |
|
|
|
|
|
|||||||||
|
|
|
|
|
T2 |
dT |
V2 dV |
|
|
|
|
|
|
|
|
T |
|
|
|
V |
|
||||||||||||
S S2 S1 CV |
|
|
|
R |
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|||||||||||||
|
|
|
|
|
= (CV ln |
|
|
|
Rln |
|
) . |
(2) |
|||||||||||||||||||||
T |
|
V |
T |
V |
|||||||||||||||||||||||||||||
|
|
|
|
|
T |
|
|
|
|
V |
|
|
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|
|||||||
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
p2V2 |
|
|
|||||
Из уравнений pV RT |
и p V |
2 |
RT |
имеем: |
|
, а по- |
|||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
|
|
1 |
1 |
|
|
1 |
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
T1 |
|
p1V1 |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
скольку p |
/ |
p =1/ и |
V |
/ V =α, то |
|
|
и, следовательно, |
|
|||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
2 |
|
1 |
|
|
|
|
2 |
1 |
|
|
|
|
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
S ( |
|
ln |
|
Rln ) R( |
1 |
|
|
ln |
|
ln ). |
(3) |
||||||||||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
133 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Для заданных значений 2, 1,30, α=2,0 и =3,0 прира-
щение энтропии S -11 |
Дж/К. |
|
|
|
|||||||||
|
Примечание. Выражение (3) можно представить в виде: |
||||||||||||
|
S |
R |
(ln ln ln ln ) R( ln ln )/( 1). |
||||||||||
|
1 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
6.158. В двух сосудах объемами V1 и V2 находится гелий |
||||||||||||
в |
газообразном |
состоянии |
|
|
в равных |
количествах, |
|||||||
1 |
2 1,2моль . Температура газа в первом сосуде T1 , во |
||||||||||||
втором - T2 . Известно, что V2/ V1 =α=2,0, T1 /T2 |
1,5. Най- |
||||||||||||
ти разность энтропии газа в этих сосудах (S2 S1 ). |
|||||||||||||
|
Исходя из формулы для энтропии идеального газа |
||||||||||||
|
|
|
|
|
|
S RlnV CV lnT S0 , |
|
||||||
для энтропий газа в сосудах напишем: |
|
||||||||||||
|
S1 RlnV1 CV lnT1 S0 , S2 RlnV2 CV lnT2 S0 . |
||||||||||||
Для разности S2 S1 |
получим: |
|
|
|
|
|
|||||||
|
|
S |
|
S =Rln |
V2 |
C ln |
T2 |
Rln C ln = |
|||||
|
|
|
|
T |
|||||||||
|
|
|
2 |
1 |
|
V |
V |
|
|
V |
|
||
|
|
|
|
|
1 |
|
|
1 |
|
|
|
||
|
|
|
|
|
|
R(ln |
|
|
|
ln ) |
|
||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
1 |
|
|||
Для заданных значений γ, α и
S2 S1 =0,83 Дж/К.
Замечание: энтропия моля идеального газа
SM RlnVM CV lnT S0 ,
для молей того же газа
S RlnV CV lnT S0 ,
где V VM .
6.159. Здесь достаточно воспользоваться первым началом термодинамики и уравнением политропы:
134

dSM |
|
QM |
|
dUM |
|
pdVM |
|
CV dT |
|
RdV |
, |
(1) |
T |
T |
T |
T |
|
||||||||
|
|
|
|
|
|
V |
|
|||||
|
|
TVn 1 |
T Vn 1 . |
|
|
|
|
(2) |
|||||||
|
|
1 |
1 |
2 |
2 |
|
|
|
|
|
|
||||
Интегрируя (1) вдоль пути процесса, получим: |
|
||||||||||||||
S |
|
S |
=C ln |
T2 |
Rln |
V2 |
. |
|
(3) |
||||||
|
|
|
|||||||||||||
|
T |
|
|||||||||||||
|
2 |
1 |
|
V |
|
|
|
|
|
V |
|
|
|||
|
|
|
|
|
1 |
|
1 |
|
|
|
|||||
|
|
|
|
|
|
V2 |
|
1/(n 1) |
|
|
|||||
Из равенства (2) имеем |
|
|
T1 |
|
1/(n 1) |
, при том, |
|||||||||
V |
|
||||||||||||||
|
|
|
|
|
|
T |
|
|
|
||||||
|
|
|
|
|
1 |
|
2 |
|
|
|
|||||
что T2 /T1 . Тогда
S |
2 |
S |
1 |
= |
R |
ln |
|
1 |
|
ln |
R(n )ln |
. |
(4) |
|
|
|
1 |
|
n 1 |
|
( 1)(n 1) |
|
|||||
6.160. Аргон в количестве двух молей совершает процесс так, что давление газа увеличивается прямо пропорционально его объему. Надо найти приращение энтропии газа, соответствующее увеличению его объема в 2,0раза.
Помня, что энтропия есть функция состояния и что идеальный газ совершил обратимый процесс, напишем формулу для изменения энтропии
S |
|
S = |
R |
ln |
T2 |
Rln |
V2 |
. |
(1) |
|
|
|
|
|
|||||||
|
1 |
T |
||||||||
|
2 |
1 |
|
|
V |
|
||||
|
|
|
|
|
1 |
|
1 |
|
|
|
Из уравнений процесса |
p V ( - |
коэффициент про- |
||||||||
порциональности) и состояния pV RT имеем:
|
2 |
|
|
2 |
|
|
|
2 |
|
|
T2 |
|
|
2 |
|
|
V |
RT |
V1 |
RT1 , |
V2 |
RT2 |
|
|
|
V2 |
|
|
|||||
|
|
|
T |
|
||||||||||||
|
|
|
V |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
|
|
|
|
T2 |
2 , |
|
|
|
|
|
|
(2) |
||
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
поскольку V2 .
V1
С учетом (2) равенство (1) принимает вид
135

S |
|
S = |
R |
|
(2ln ( 1)ln )= |
1 |
Rln . |
(3) |
|
2 |
1 |
1 |
|
1 |
|
||
Для 2, 5/3(аргон) и 2,0 приращение энтропии
S2 S1 =46 Дж/К.
6.161. Осуществлен политропический процесс сжатия идеального газа, при котором объем газа уменьшается в раз, а совершенная им работа A 2 U . Надо найти приращение энтропии газа в этом процессе.
Обозначение кратности уменьшения объема буквой при переходе из одного состояния в другое будем воспринимать как число молей газа.
Поскольку энтропия системы является функцией ее состояния, то изменение энтропии идеального газа в обратимом процессе, независимо от характера этого процесса, попрежнему, можно определить выражением
S |
|
S = |
R |
ln |
T2 |
Rln |
V2 |
. |
(1) |
|
|
|
|||||||
|
|
|
|
||||||
|
2 |
1 |
1 T |
|
V |
|
|||
|
|
|
1 |
1 |
|
|
|||
Однако, взаимосвязь между относительными величинами
T2 и V2 определяется характером процесса.
T1 V1
В рассматриваемом случае имеем:
|
|
|
|
|
|
|
|
|
n 1 |
|
|
|
|
|
n 1 |
|
|
T2 |
|
|
|
|
n 1 |
|
|
n 1 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
T1V1 |
|
|
T2V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
(2) |
||||||||||
|
|
|
|
|
|
|
|
|
|
T |
V |
|
|
|
|
|
||||||||||||||||||||||
где n – показатель политропы. |
|
1 |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 U получим: |
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Далее из условия A |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
RT1 |
|
|
|
|
n 1 |
2 R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
1 |
V1 |
|
|
|
T T |
T1 |
|
|
1 n 1 |
|
|
2 |
T T |
||||||||||||||||||||||||
|
n 1 |
V |
|
|
1 |
|
2 |
|
1 |
|
|
n 1 |
|
|
|
|
|
|
1 |
2 |
1 |
|||||||||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
n 1 |
2 |
|
|
|
|
|
|
1 |
n 1 |
|
2 |
|
n 1 |
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
1 |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
n 1 |
|
1 |
T |
|
|
n 1 |
|
|
1 |
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
136 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n 1 1 /2. |
|
|
|
|
|
|
|
|
|
(3) |
||||||||||||||
Соотношение (3) дает возможность определить |
|
|||||||||||||||||||||||||
|
|
|
T2 |
( 1)/2 . |
|
|
|
|
|
|
|
|
|
(4) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
T1 |
|
|
|
|
|
|
V2 |
|
|
|
1 |
|
|
||||||||||
Подставляя (4) в (1) и учитывая, что |
|
|
, получаем |
|||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|||||||
S |
|
S = R( |
1 |
ln ln ) |
3 |
Rln . |
(5) |
|||||||||||||||||||
2 |
|
|
|
|||||||||||||||||||||||
|
1 |
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
6.162. Идеальный |
|
газ |
совершает |
|
процесс по |
закону |
||||||||||||||||||||
p p0 V , где |
p0, 0. Найти объем газа, |
при котором эн- |
||||||||||||||||||||||||
тропия максимальна. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Из первого начала для обратимого процесса имеем |
|
|||||||||||||||||||||||||
|
|
dS= |
|
R |
|
|
dT |
Rln |
dV |
. |
|
|
|
(1) |
||||||||||||
|
|
|
1 |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
T |
V |
|
|
|
|
|||||||||||||||
Поделим (1) на dV и приравняем левую часть нулю (ус- |
||||||||||||||||||||||||||
ловие экстремума), получим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
dT |
( 1) |
T |
0. |
|
|
|
(2) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
dV |
|
|
V |
|
|
|
|
|
|
|
|
|
|
|||||||||
Далее воспользуемся уравнениями процесса и состояния:
(3)
(4)
Из (3) и (4) следует:
T |
|
|
p |
|
p0 V |
(5) |
|
R |
R |
||||
V |
|
|
||||
иp0V V2 RT p0dV 2 VdV RdT
(p0 2 V)dV RdT
dT |
|
p0 2 V |
. |
(6) |
dV |
|
|||
|
R |
|
||
Подставляя (5) и (6) в (2) получаем:
137
|
p0 2 V |
( 1) |
p0 V |
0 |
|
||
|
|
|
|
||||
|
R |
|
|
R |
|
||
p0 2 V ( 1)(p0 V) 0. |
(7) |
||||||
Из уравнения (7) находим |
|
||||||
|
V |
p0 |
. |
(8) |
|||
|
|
||||||
|
|
|
( 1) |
|
|||
Найденное значение объема (8) соответствует минимуму |
|||||||
энтропии газа в заданном процессе. |
|
||||||
6.163. Моль идеального газа совершает процесс так, что |
|||||||
энтропия S T CV lnT , |
где 0. При этом, когда V V0 , |
||||||
то T T0 . Найти зависимость T f (V).
Заданную зависимость энтропии S T CV lnT для мо-
ля газа сравним с известным выражением энтропии тоже для
моля идеального газа |
S RlnV CV lnT S0 , где |
S0 |
- посто- |
|||||||
янная. При этом получим |
|
|
|
|
|
|
|
|
||
|
T RlnV S0 . |
|
|
|
|
|
(1) |
|||
По условию T0 |
RlnV0 S0 , отсюда |
|
|
|
|
|
|
|||
|
S0 T0 RlnV0 . |
|
|
|
|
|
(2) |
|||
Подставляя (2) в (1) |
получаем: |
|
R |
|
V |
|
|
|||
T RlnV T |
RlnV |
или T =T |
|
ln |
. |
(3) |
||||
|
|
|||||||||
|
0 |
0 |
0 |
|
V |
|
||||
|
|
|
|
|
|
|
0 |
|
|
|
6.164. Предварительно заметим. Внутренняя энергия идеального газа определяется только температурой (U0 CVT ). Внутренняя энергия реального газа и газа Ван-
дер-Ваальса зависит от двух параметров V и T или р и T. В связи с этим формула для приращения энтропии газа Ван-дер- Ваальса получает другой вид по сравнению с формулой для идеального газа.
Внутренняя энергия одного моля вандерваальсовского газа определяется выражением
138

U C |
T |
a |
, |
(1) |
|
||||
V |
V |
|
||
где а – одна из поправок Ван-дер-Ваальса, из которого следует, что
a
dU CV dT V2 dV .
Соответствующее приращение энтропии равно
dS |
dU pdV |
C |
dT |
(p |
a |
) |
dV |
. |
T |
T |
|
|
|||||
|
V |
V 2 |
|
T |
||||
Для изотермического процесса (как это было сказано)
|
|
|
|
|
|
dS (p |
a |
) |
dV |
. |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
V 2 |
|
T |
|||||
Из уравнения состояния газа Ван-дер-Ваальса |
||||||||||||||||
|
|
|
(p |
a |
)(V b) RT |
|||||||||||
|
|
|
||||||||||||||
|
a |
|
RT |
|
|
V 2 |
|
|
|
|
|
|
|
|
|
|
имеем p |
|
|
|
. Следовательно, при T const |
||||||||||||
|
|
|
|
|||||||||||||
V2 |
V b |
|
|
|
dV |
|
|
|
|
|
||||||
|
|
|
|
|
|
dS R |
. |
|
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
V b |
|
|
|
|
||||
При интегрировании от V1 до V2 получим |
||||||||||||||||
|
|
|
S |
2 |
S Rln |
V2 b |
. |
|||||||||
|
|
|
|
|||||||||||||
|
|
|
|
1 |
|
|
|
V1 b |
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
(2)
(3)
(4)
(5)
(6)
6.165. Один моль газа Ван-дер-Ваальса переводится из состояния (V1 ,T1 ) в состояние (V2 ,T2 ). Найти приращение энтропии.
Обратимся к формулам (2) и (4) предыдущей задачи 6.164 и напишем:
dS C |
dT |
R |
dV |
. |
(1) |
V |
T |
V b |
|
||
Интегрирование (1) дает: |
|
|
|
|
|
S CV lnT Rln(V b) const . |
(2) |
||||
Для состояний газа (V1 ,T1 ) и (V2 ,T2 ) будем иметь: |
|
||||
139
S1 CV lnT1 Rln(V1 b) const , S2 CV lnT2 Rln(V2 b) const.
Отсюда приращение энтропии:
S |
|
S |
C ln |
T2 |
Rln |
(V2 |
b) |
. |
(3) |
|
|
|
|||||||
|
T |
||||||||
|
2 |
1 |
V |
|
(V b) |
|
|||
|
|
|
|
1 |
1 |
|
|
|
|
6.166. Один моль газа Ван-дер-Ваальса совершает политропический процесс вида T(V b) const . Найти теплоемкость газа в этом процессе (а) и приращение энтропии (б) при изменении его температуры от T1 до T2 .
а) Обозначим молярную теплоемкость газа в этом процессе через С и напишем первое начало
Q CdT dU
CV dT (p
Отсюда
C Q dT
a
pdV CV dT V2 dV pdV
aRT
V2 )dV CV dT V b dV .
C |
|
RT |
|
dV |
. |
(1) |
|
|
|||||
V |
V b dT |
|
||||
Из уравнения процесса T(V b) |
const имеем: |
|
|
||||||||||||||
(V b)dT TdV 0 |
|
dV |
= |
(V b) |
. |
|
(2) |
||||||||||
|
|
|
|
|
|
|
dT |
|
T |
|
|
|
|
||||
С учетом (2) выражение для теплоемкости получает вид |
|||||||||||||||||
|
|
|
|
C CV R. |
|
|
|
|
|
|
|
|
|
(3) |
|||
б) Для моля газа Ван-дер-Ваальса |
|
|
|
|
|
|
|||||||||||
dS |
Q |
|
dU pdV |
C |
dT |
|
|
R |
dV |
|
|
||||||
|
|
|
|
|
V b |
|
|
||||||||||
|
T |
T |
V |
T |
|
|
|
|
|||||||||
|
|
S C lnT Rln(V b) S |
|
|
|
||||||||||||
|
|
|
|
V |
const |
|
|
|
0 |
|
|
|
|
||||
S C |
lnT Rln( |
) (C R)lnT S |
|
, |
|||||||||||||
|
0 |
||||||||||||||||
|
|
V |
|
|
|
|
|
|
|
|
|
V |
|
|
|
||
T
где S0 S0 Rln(const).
140
