
2683
.pdf
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
a |
|
|
|
|
|
|
2 |
a |
|
|
|||
Q U |
|
U |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
2 |
|
|
1 |
|
|
|
V |
|
2 |
|
|
V |
|
|
|
|
|
V |
1 |
|
V |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
1 |
|
|
||
|
2 |
|
1 |
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
a |
|
V2 |
|
|
|
|
|
V2 . |
|
|
|
|
|
|
|
|||||||||
|
|
a V |
V |
|
|
|
|
V |
|
|
1 |
|
|
|
|
|
|
|
|||||||||||||
|
|
|
1 |
|
|
|
|
2 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Для a 0,367Па м6 / моль, 3,0моль,V1 5,0л,V2 10л
полученная теплота равна
Q32 0,367(10/5 1)/10 10 3 0,33кДж.
6.63.Сделаем несколько вводных замечаний. Одной из функций состояния термодинамической системы является внутренняя энергия. Для простейшей системы, представляющей идеальный газ, внутренняя энергия U определяется кинетической энергией молекул, и, следовательно, только температурой идеального газа. Внутренняя энергия моля идеального
газа U CV T . Внутренняя энергия идеального газа в изотер-
мическом процессе не изменяется. Внутренняя энергия реального газа (тела) включает в себя кроме кинетической энергии молекул, энергию взаимодействия между молекулами и, следовательно, зависит от температуры и какого либо другого параметра, например, от объема V или давления p. Связь между параметрами состояния реального газа приближенно выражается уравнением Ван-дер-Ваальса
|
a |
|
|
|
p |
|
(V b) RT , |
(1) |
|
V 2 |
||||
|
|
|
где V VM - объем моля газа. Воображаемый газ, точно под-
чиняющийся уравнению (1), называется ван-дер-ваальсовским.
51
Внутренняя энергия моля ванн-дер-ваальсовского газа определяется формулой
U CV T a/V . |
(2) |
Введем другую функцию, характеризующую состояние как идеального, так реального газа.
Представим процесс, происходящий в газе (теле) при постоянном давлении. Количество тепла, получаемое газом в этом процессе, равно
Q dU pdV d(U pV). |
(3) |
Функцию состояния H U pV называют энтальпией или тепловой функцией. Отсюда вытекает, что количество тепла, получаемого телом в ходе изобарического процесса равноQ dH или в интегральной форме Q H2 H1 . Если систе-
ма теплоизолирована и адиабатически переходит из состояния
(T1,V1, p1 ) |
в |
состояние |
(T2 ,V2 , p2 ), то |
Q 0 |
и |
||
U1 p1V1 U2 p2V2 . В ходе |
адиабатического |
процесса |
эн- |
||||
|
|
|
тальпия системы |
остается |
|||
|
|
|
постоянной. |
|
|
|
|
T1,V1,p1 |
|
T2,V2,p2 |
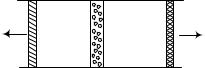
Рассмотрим |
процесс |
|||
|
расширения реального газа |
||||||
|
|
|
|||||
П1 |
A |
П2 |
без теплообмена, |
осущест- |
|||
вляя его следующим обра- |
|||||||
|
|
|
|||||
зом. Пусть имеется теплоизолированный цилиндр, разделенный пористой нетеплопроводящей перегородкой А (см.рисунок). По разным сторонам перегородки один и тот же газ находится под давлением p1 и
p2 . Если p1 p2 , то газ из левой части цилиндра будет проса-
чиваться в правую часть. Для поддержания давлений p1 и p2
постоянными необходимо поршень П1 вдвигать в цилиндр, а
52
поршень П2 выдвигать. Пусть за некоторое время газ в коли-
честве одного моля, занимая объем V1 при температуре T1 и
давлении p1 , просочился через перегородку и занял объем V2
при давлении p2 , имея температуру T2 . Для простоты даль-
нейшего описания будем полагать давление p2 низким, т.е.
просочившийся газ практически идеальный. В принятых условиях расширение газа является адиабатическим и энтальпия газа в начальном и конечном состояниях одинаковы. Это позволяет написать равенство
|
|
|
U1 p1V1 U2 p2V2 . |
|
|
|
|
|
(4) |
||||||||||||||||||||||||
Для разряженного газа U2 p2V2 CV T2 |
RT2 . В рамках |
||||||||||||||||||||||||||||||||
уравнения Ван-дер-Ваальса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
U1 CVT1 a/V1; |
|
|
|
|
|
|
|
|
|
|
(5) |
|||||||||||||||||
p |
|
RT |
|
a |
и p V |
|
RT1V1 |
|
|
a |
. |
(6) |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
1 |
V b V2 |
|
|
|
|
1 |
1 |
V b V |
|
|||||||||||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|||||
Подставляя (5) и (6) в (4), получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
C T |
a |
|
RT1V1 |
|
a |
C T RT |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||
V |
1 |
V |
|
V b |
|
V |
|
|
|
|
V 2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
1 |
1 |
|
|
|
1 |
|
|
RT1V1 |
|
|
|
2a |
|
|
|
|
|
|
|
||||||||||||
C (T T ) R(T T ) |
|
|
RT |
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||
V |
2 |
1 |
2 |
|
|
1 |
|
|
|
|
V b |
|
V |
|
|
1 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
2a |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
(CV R)(T2 T1) RT1 V b 1 V |
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2a |
|
|
|
|
|
|||||||
|
T T2 T1 |
|
|
RT1b |
|
|
|
|
|
|
(7) |
||||||||||||||||||||||
|
C |
|
|
|
V |
|
|
|
|||||||||||||||||||||||||
|
|
|
V b |
. |
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p |
|
1 |
|
|
|
1 |
|
|
|
|
|
|||||||
Равенство (7) выражает интегральный эффект Джоуля- |
|||||||||||||||||||||||||||||||||
Томсона. Из условия |
|
RT1b |
|
2a |
0 |
следует так называемая |
|||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
V1 b |
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
температура инверсии
53
|
T |
|
|
2a(V1 b) |
|
|
|
2a |
. |
(8) |
||||
|
|
bRV1 |
|
bR |
||||||||||
|
|
|
|
|
|
|
|
|
||||||
При температурах |
|
T T |
газ |
|
в |
|
процессе |
Джоуля- |
||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
Томсона охлаждается, при T T |
- нагревается. |
|
||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
6.64. По формуле (8) задачи 6.63 |
T |
|
|
|
|
2a(V1 b) |
опреде- |
|||||||
|
|
|
|
bRV1 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лим температуру инверсии T для водорода. Постоянные Ван- |
||||||||||||||
дер-Ваальса: |
a 0,024Па м6 |
/ моль, b 27 10 6 м3 / моль; |
||||||||||||
T 2 0,024(0,16 10 3 27 10 6 )/(27 10 6 8,31 0,16 10 3 ) 180К
. |
Положительный |
эффект |
|
Джоуля-Томсона, |
т.е. |
||||||||
T 0 (T2 T1) будет иметь место при T1 |
180К . |
|
|||||||||||
|
|
|
1 |
|
RT1b |
|
|
2a |
|
|
|
||
|
6.65. По формуле |
T |
|
|
|
|
найдем прира- |
||||||
|
|
|
|
V |
|
||||||||
|
|
|
C |
|
V b |
|
2 |
|
|
|
|||
|
|
|
|
p |
1 |
|
|
|
|
|
|
||
щение температуры в процессе Джоуля-Томсона для следующих газов:
а) |
водорода:a 0,024Па м6 |
/ моль, b 27 10 6 м3 / моль. |
|||||||||||||||||||||||
Исходные данные: T1 |
300К,V1 0,100л/ моль . |
|
|
|
|
||||||||||||||||||||
|
|
1 |
|
|
|
8,31 300 27 10 |
6 |
|
|
|
2 0,024 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
T |
|
|
|
|
|
|
|
|
|
|
15К . |
||||||||||||||
|
3,5 8,31 |
|
0,100 10 |
3 |
27 10 |
6 |
|
0,100 10 |
3 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
б) |
|
азота: |
a 0,137Па м6 / моль2 , b 39 10 6 м3 / моль. |
||||||||||||||||||||||
Начальные значения V1 и T1 |
те же. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
1 |
|
|
|
|
8,31 300 39 10 |
6 |
|
|
2 0,137 |
|
||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
39К . |
|||||
|
|
|
|
|
|
|
3 |
39 10 |
6 |
0,100 10 |
3 |
||||||||||||||
|
|
|
3,5 8,31 0,100 10 |
|
|
|
|
|
|
|
|||||||||||||||
54
3. МОЛЕКУЛЯРНО – КИНЕТИЧЕСКАЯ ТЕОРИЯ. РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА И БОЛЬЦМАНА
6.66. При откачке из сосуда газа (скорее всего возду-
ха) было достигнуто давление p 4 10 10 Па. Температура
газа T = 300 K. Надо найти концентрацию молекул n и среднее расстояние <d> между ними.
Согласно уравнению состояния идеального газа
n |
p |
|
4 10 10 |
1 |
|
|
|
11 |
|
1 |
|
5 |
1 |
|
||||||||
|
|
|
|
|
|
|
|
|
( |
|
) 1 10 |
|
( |
|
) 1 10 |
|
|
. |
||||
kT |
|
|
|
|
|
|
|
|
|
м3 |
|
см3 |
||||||||||
|
1,38 10 |
23 300 м3 |
|
|
|
|
|
|
|
|
||||||||||||
Среднее расстояние между молекулами газа |
|
|
|
|
||||||||||||||||||
|
|
|
d |
1 |
|
|
1 |
|
|
(см) 0,2мм. |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
3 n |
3 1 105 |
|
|
|
|
|
|
|
|||||||||
6.67.В сосуде объёмом V=50л находиться азот массы
m=1,40 г при T=1800 K. При этой температуре =30% молекул диссоциированно на атомы. Найти давление газа.
Масса молекулярного газа в сосуде m1 |
(1 ) m , ато- |
||||||||||||||
марного m2 m |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Парциальные давления: |
|
|
|
|
|
|
|
|
|
|
|||||
p |
m1RT |
|
(1 )mRT |
, p |
|
|
m2RT |
|
2 mRT |
. |
|||||
|
|
MV |
|
|
(M /2)V |
|
|||||||||
1 |
MV |
|
|
2 |
|
|
MV |
||||||||
Общее давление газа равно |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
p p1 p2 |
(1 ) |
mRT |
. |
|
|
|
|||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
MV |
|
|
|
|
Для азота M 28 10 3( |
кг |
). Вычисляем: |
|
|
|
||||||||||
|
|
|
|
||||||||||||
|
|
|
|
моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
55 |
|
|
|
|
|
|
|
|
|
p (1 0,3) |
1,40 10 |
3 |
8,31 1800 |
Па 1,9 105 Па 1,9атм. |
|
28 10 |
3 |
5,0 10 3 |
|||
|
|
6.68. Величины, относящиеся к гелию будем сопровождать индексом 1, к азоту – индексом 2.
Пусть m1 - масса атома гелия, m2 - молекулы азота.
Плотность газовой смеси
m1n1 |
m2n2 m1n1 |
|
m2 (n n1 ) (m1 |
m2 )n1 m2n . |
(1) |
|||||||||||||||
Здесь n1 - концентрация атомов гелия, |
n |
|
P |
- общая концен- |
||||||||||||||||
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
|||
трация частиц газа. Из (1) |
|
имеем |
|
|
|
|
|
|
|
|
|
|
|
|||||||
n |
m2n |
|
m2n |
|
|
m2(p/kT) |
|
p/kT /m2 |
. |
(2) |
||||||||||
|
m m |
|
|
|||||||||||||||||
1 |
m m |
2 |
|
|
|
m m |
|
|
1 m /m |
2 |
|
|
||||||||
|
1 |
|
|
2 |
1 |
2 |
1 |
|
|
|
1 |
|
|
|
||||||
Учтём соотношение: |
m1 / m2 M1 / M2 , где |
|
M1 и M |
2 - моляр- |
||||||||||||||||
ные массы газов; |
m1 |
M1 / NA , где NA - постоянная Авогадро. |
||||||||||||||||||
Это позволяет равенство (2) представить в виде: |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
n |
p/kT NA /M2 |
. |
|
|
|
|
|
|
(3) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
1 |
|
|
1 M1 /M2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Давление р и температура Т соответствуют нормальным условиям состояния газа
n |
105 |
/(1,38 10 23 273) 0.60 6.02 1023 /28 10 23 |
(1/ м |
3 |
|
|
|
|
|
|
) |
||
|
|
|
||||
1 |
|
|
1 4/28 |
|
|
|
|
|
|
|
|
|
|
1,6 10191/см3 .
6.69.Из формулы для скорости звуковой волны в газе
|
p |
|
2 |
|
|
|
выразим показатель адиабаты |
|
|
. Через число |
|
|
p |
|
|||
|
|
|
|
||
|
56 |
|
|
|
|

степеней |
свободы |
i молекулы |
|
газа |
i |
i 2 |
|
получаем |
|||||||||
i |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
равенство |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
i 2 |
|
v2 |
|
. |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
p |
|
|
|
|
|
|
||||
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
||||
Для |
заданных |
величин |
1,3( |
|
мг |
) =330 (м/с) и |
|||||||||||
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
см3 |
|
||||||
p 1 105 |
(Па) величина |
v2 |
|
1,3 3302 |
1,4. Из |
уравнения |
|||||||||||
p |
|
||||||||||||||||
|
|
|
|
|
|
105 |
|
|
|
|
|
|
|
||||
i 2 1,4 находим i=5.
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.70 |
|
|
|
Скорость звука в газе |
c |
RT |
|
, средняя квад- |
|||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
ратичная |
|
скорость молекул |
кв |
|
3RT |
|
отношение |
|||||||||||||
|
|
M |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
c |
|
|
|
|
|
|
|
|
. Для одноатомного газа i=3 0,75; из |
||||||||||
|
|
|
|
|
i 2 |
|
||||||||||||||
|
3 |
|
||||||||||||||||||
|
кв |
|
|
|
3i |
|
|
|
|
|
|
|
|
|
|
|||||
двухатомных жёстких молекул i=5 =0,68. |
|
|
|
|
|
|
|
|||||||||||||
|
6.71. |
|
Внутренняя |
энергия |
идеального |
газа |
||||||||||||||
U i m RT , где i – число степеней свободы молекулы, m- 2 M
масса газа. По условиям задачи при Т1 число i i1 3, при температуре T2 i i2 5 (вследствие размораживания враща-
тельных степеней свободы молекул). В результате такого нагрева водорода приращение внутренней энергии равно
U (i T |
i T ) |
mR |
. Для T |
=70К , T |
=300К и m=16г прира- |
|
|||||
2 2 |
1 1 2M |
1 |
2 |
|
|
щение внутренней энергии водорода
57

U (5 300 3 700) |
16 10 |
3 8.31 |
43(кДж). |
||
2 2 |
10 3 |
|
|||
|
|
||||
6.72. Применительно к поставленным вопросам задачи приведём основные формулы:
1) Число i, определяющее среднюю энергию молекулы идеального газа (
 i/2 kT), i nпост nвр 2nкол , где
i/2 kT), i nпост nвр 2nкол , где
nпост 3- число поступательных степеней свободы молекулы; nвр – число вращательных степеней свободы равно 2 для ли-
нейной молекулы и 3 для нелинейной молекулы), nкол - число
колебательных степеней свободы: nкол 3N (nпост |
nвр ), |
где |
||||||||||
N- число атомов у молекулы. Для атома nпост 3,nвр |
nкол |
0 |
||||||||||
2) Молярная теплоёмкость газа C |
|
i |
R . |
|
|
|||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
V |
2 |
|
|
|
|
3) Показатель адиабаты |
|
|
i 2 |
. |
|
|
|
|
|
|||
|
|
|
|
|
|
|
||||||
Ответы на вопросы задачи: |
|
|
i |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
а) идеальный газ из N-атомных линейных молекул: |
|
|||||||||||
i 3 2 2(3N 5) 6N 5; |
|
|
||||||||||
Сv |
6N 5 |
R (3N 5/2)R; |
|
|
||||||||
|
|
|
||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
||
|
6N 5 2 |
|
6N 3 |
. |
|
|
||||||
6N 5 |
|
|
|
|||||||||
|
|
|
6N 5 |
|
|
|
|
|
||||
б) газ из N-атомных нелинейных молекул:
i 3 3 2(3N 6) 6N 6;
Сv 6N 6 R (3N 3)R 3(N 1)R ; 2
58

6N 6 2 N 2/3 .
6N 6 |
N 1 |
6.73. Возьмём газ в количестве одного моля ( 1). В
изобарическом процессе в согласии с первым началом термо-
динамики Q U A Cv T p Vm . Из уравнения состоя-
ния газа имеем: p Vm R T A R T T |
A |
. Следо- |
|||||||||||||||||||||
|
|||||||||||||||||||||||
вательно, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Q C |
|
A |
A A(1 |
Cv |
) и |
A |
|
|
|
1 |
|
|
1 |
. |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
v R |
|
|
|
|
R |
|
Q 1 C / R |
1 i/2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
По результатам задачи 6.72. для |
линейной N атомной |
||||||||||||||||||||||
молекулы i1 |
6N 5, для нелинейной молекулы i2 6(N 1). |
||||||||||||||||||||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(A/Q)1 |
|
|
|
1 |
|
|
|
|
|
1 |
|
|
, |
|||||||
|
|
|
1 3N 5/2 |
|
3(N 1/2) |
||||||||||||||||||
|
|
|
(A/Q) |
|
|
1 |
|
|
|
|
|
1 |
. |
|
|
|
|
|
|
||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
1 3(N 1) |
3N 2 |
|
|
|
|
|
|
|||||||||||
6.74. |
Рассмотрим идеальный газ, состоящий из N – |
||||||||||||||||||||||
атомных нелинейных молекул, в двух состояниях. В первом состоянии возбужденны колебательные степени у молекул, во втором – колебательные степени заморожены. В первом случае число i i1 3 3 2(3N 6) 6N 6 , постоянная адиаба-
59
ты |
|
|
|
|
i1 |
2 |
|
6N 4 |
; во втором случае i |
|
|
6 , |
|
|
|
4 |
. По ус- |
||||||||||||||||||||||||||||||||||||
1 |
|
|
|
|
|
|
|
|
2 |
2 |
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
i |
|
6N 6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|||||||||||||||||||
ловию |
2 |
|
1,20 отсюда получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
4(6N 6) |
|
(4 3 )N 2(2 ) N |
2(2 ) |
|
2 0.8 |
4 |
||||||||||||||||||||||||||||||||||||||||||||||
|
3(6N 4) |
|
|
|
|
|
|
|
|
0.4 |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 3 |
|
|
|
|
|
|
|||||||||||||||
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.75. |
|
Воспользуемся формулами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
Cp |
|
|
|
|
|
cp |
|
|
i 2 |
|
|
|
|
|
|
i |
|
|
|
|
|
C |
|
|
|
|
i R |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
(1), C |
v |
|
|
|
|
|
R (2), c |
v |
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
(3). |
|
||||||||||||||||
|
|
|
Cv |
|
|
|
|
|
cv |
|
|
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
M 2 M |
|
|
|||||||||||||||||||||
Из (1) следует i |
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
5. |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
(cp /cv ) 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(0,91/0,65) 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
Из (3) получаем M |
i |
|
R |
|
5 |
|
8,31 |
( |
г |
|
|
) 32 |
|
|
|
г |
. |
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 cV |
|
|
2 |
0,65 |
|
моль |
|
|
|
|
|
|
|
моль |
|
|
|||||||||||||||||||
6.76.В модели жёстких молекул газа число степеней
свободы молекулы равно i. Из формулы |
|
Cp |
|
i 2 |
R находим |
|||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
i 2( |
Cp |
1) . Поскольку |
Cp 29( |
|
Дж |
|
), число степеней |
|||||||||
R |
|
|
|
|
||||||||||||
|
|
|
|
|
|
моль К |
|
|
|
|
||||||
свободы молекулы i=5. |
|
|
|
|
|
|
|
|
|
|
|
|
||||
По определению (для моля газа) |
|
|
|
|
|
|
|
|
||||||||
|
|
C |
Q |
|
dU pdV |
C |
v |
|
pdV |
. |
(1) |
|||||
|
|
|
|
|
||||||||||||
|
|
|
T |
|
dT |
|
|
|
|
|
dT |
|
||||
Далее воспользуемся двумя формулами: pT=const ( по условию) (2), pV RT (3).
Из (2) следует
60
