
2683
.pdf
При температурах T1 и T2 энтропии соответственно рав-
ны:
S1 (CV R)lnT1 S0 ,
S2 (CV R)lnT2 S0 .
Для приращения энтропии получаем
S2 -S1 (CV R)ln T2 .
T1
6.167. Молярная теплоемкость кристаллов при очень низких температурах зависит от температуры и определяется следующей закономерностью C T3 , где - постоянная. Поскольку объем твердых тел при нагревании меняется мало, их теплоемкость при постоянном давлении незначительно отличается от теплоемкости при постоянном объеме и, следовательно, можно положить Cp CV и говорить о теплоемкости С
твердого тела, C Cp CV . Теплоемкость интересующего
кристаллического тела определяется экспериментально. Пренебрегая изменением объема кристалла при нагрева-
нии, внутреннюю энергию и энтропию кристалла можно определить так:
|
dU C dT и |
dS |
Q |
|
dU |
C |
dT |
. |
|
||||
|
V |
|
T |
|
T |
V |
|
T |
|||||
|
При очень низких температурах |
dS T3 |
dT |
T2dT и |
|||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
T |
|||||
|
|
|
|
|
|
|
|
|
T3 |
||||
энтропия моля кристаллического |
тела |
S |
|
|
|
|
. Здесь |
||||||
3 |
|
||||||||||||
S0 |
limS 0 . |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
T 0 |
|
|
|
|
|
|
|
|
|
|
|
|
6.168. Температурная зависимость теплоемкости алюминия в заданном температурном интервале представлена закономерностью C a bT, где a и b – постоянные, имеющие определенные значения.
141
Приращение энтропии алюминиевого образца массы m при нагревании от T1 до T2 будет равно
|
|
|
m (2)CdT |
|
|
m T2 |
a bT |
|
|||||
S S2 S1 |
|
|
(1) |
|
|
|
|
T |
|
dT |
|||
M |
T |
|
M |
T |
|||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
m |
aln |
T2 |
b(T T ) . |
|
|
|||||||
|
|
|
|
||||||||||
|
M |
|
T |
2 |
1 |
|
|
||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
||
Поскольку постоянные a и b даны в удельном смысле, то через приращение энтропии данного образца равно
S m aln |
T2 |
b(T T ) . |
||
T |
||||
|
2 1 |
|
||
|
1 |
|
|
|
При подстановке значений исходных величин получаем
S 2,0кДж/К.
6.169. Дано, что в некотором процессе температура вещества T Sn , и n – постоянные. Найти зависимость
C f (S).
Теплоемкость
C |
Q |
T |
dS |
Sn |
dS |
|
S |
. |
dT |
|
nSn 1dS |
|
|||||
|
|
dT |
|
n |
||||
6.170. Теплоемкость некоторого вещества С. Найти зави-
симость T f (S). Известно, что S |
|
T T0 |
S0 . |
||||||||||||
|
|||||||||||||||
Решение: |
|
|
|
|
|
|
|
|
|
|
|
|
|||
C |
Q |
T |
dS |
|
|
dT |
|
1 |
dS |
||||||
|
|
dT |
|
|
|||||||||||
|
dT |
|
|
|
|
|
T |
|
|
C |
|||||
ln |
T |
|
S |
|
T const eS /C . |
||||||||||
const |
C |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Удовлетворив граничному условию, получим: const T0e S/C , T T0e(S S0 )/C .
142

6.171. Идеальный газ совершает процесс так, что S ,
- постоянная. Температура изменилась от T1 |
|
|
|
|
T |
|||||||||||||||||
до T2 . Найти |
||||||||||||||||||||||
C(T), Q и A . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
а) S |
|
dS |
|
dT , C |
Q |
T |
dS |
|
|
|
. |
|
|
|||||||||
|
T |
|
|
|
|
T2 |
|
|
|
dT |
|
dT |
|
T |
||||||||
|
|
|
|
|
|
T2 dT |
|
|
|
|
T |
|
|
|
T |
|||||||
|
|
|
|
|
dT ;Q |
|
|
|
2 |
1 |
|
|||||||||||
б) Q CdT |
|
|
|
|
ln |
|
|
ln |
|
. |
||||||||||||
T |
|
T |
|
T |
T |
|||||||||||||||||
|
|
|
|
|
|
|
|
T |
|
|
1 |
2 |
|
|||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в) A Q U Q (U2 U1) Q CV (T2 T1). |
||||||||||||||||||||||
A ln |
T1 |
C (T T ) C (T T ) ln |
T1 |
. |
||||||||||||||||||
|
|
|||||||||||||||||||||
|
|
|
V |
2 1 |
V |
1 |
|
2 |
|
|
T2 |
|
|
|
|
|
||||||
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
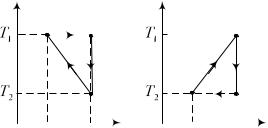
6.172. На рисунке приведены два цикла рабочего вещества, в которых T1 /T2 n. Найдем к.п.д. этих циклов.
1) Для цикла а. Рабочее тело получает теплоту в изотермическом процессе 1 2 равную Q1 T1(S2 S1). Участок
2 3 является адиабатическим, а отбор тепла происходит на отрезке 3 1 цикла. Можно догадаться, что произведенная за цикл работа равна площади треугольника 1,2,3, то есть:
143
T |
|
|
T |
1 |
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
1 |
|
|
|
3 |
|
|
|
||
|
0 |
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
S |
|
|
|
S |
2 |
|
|
|
|
0 |
|
S |
S |
2 |
|
|
|||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
a) |
|
|
|
|
|
|
|
|
|
|
|
|
|
б) |
|
|
|
|
|
|
|
|
|
|
|
|
|
A Q1 Q2 |
|
|
1 |
(T1 T2)(S2 |
S1). |
|
|
|||||||||||||||
|
|
|
|
|
|
2 |
|
|
||||||||||||||||||||
К.п.д. этого цикла |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
A |
|
T1 T2 |
|
|
1 |
|
|
T2 |
|
|
|
|
n 1 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
, поскольку T1 /T2 |
n. |
||||||||||||||||||
|
|
|
|
2 |
|
T |
|
2n |
|
|||||||||||||||||||
Q |
2T |
|
|
1 |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2) Для цикла б. Сценарий тот же, игра – несколько другая. Неиспользованная теплота (отданная вовне) равна
Q2 |
TdS T2(S2 S1). |
|
(1 3) |
Произведенная работа (по площади цикла T S ) равна
A |
1 |
(T T )(S |
|
S ). |
|||||||||
|
|
||||||||||||
2 |
|
|
1 |
2 |
|
2 |
1 |
|
|||||
Поучаемая извне теплота |
|
1 |
|
|
|
|
|
|
|||||
Q1 Q2 A |
(T1 T2 )(S2 S1). |
||||||||||||
2 |
|||||||||||||
К.п.д. цикла б: |
|
|
|
|
|
|
|
|
|||||
|
A |
|
T1 T2 |
|
n 1 |
. |
|||||||
|
T1 T2 |
|
|||||||||||
|
Q1 |
|
|
|
|
n 1 |
|||||||
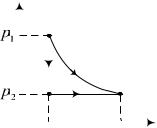
6.173. Пусть параметры состояния и энтропия газа, первоначально находящегося в одном из сосудов (например, сосуде 1) были равны V1 , T1 и S1 . После открытия вентиля газ ока-
144
|
|
|
|
|
зался в неравновесном состоянии |
||
p |
|
|
|
|
и, как изолированная система, |
||
|
1 |
|
|
стал необратимо расширяться до |
|||
|
|
L1 |
|
|
объема V2 nV1 (n 1 - заданное |
||
|
|
|
|
||||
|
L2 |
|
|
число). Пусть температура и эн- |
|||
|
|
|
|
||||
|
2 |
|
3 |
|
тропия в новом равновесном со- |
||
|
L |
|
стоянии будут равны T2 |
и S2 . |
|||
|
|
|
|
||||
|
3 |
|
|
Итак, согласно заданным ус- |
|||
|
|
|
|
|
|||
0 V1 |
V2 V |
||||||
ловиям мы имеем необратимый |
|||||||
|
|
|
|
|
процесс, в ходе которого энтропия |
||
найти S2 S1 . |
|
|
газа увеличивается. |
Требуется |
|||
|
|
|
|
||||
Поскольку газ идеальный и сосуды теплоизолированные, то из условий состояния получим соотношение (см. рис.)
np2 |
|
T2 |
, |
(1) |
|
p1 |
T1 |
||||
|
|
|
Вследствие необратимого характера процесса напрямую первым началом воспользоваться мы не можем. Поэтому рассматриваемый процесс заменим на два последовательных обратимых процесса, конечный результат которых был бы эквивалентен данному.
Тогда
S2 S1 dS dS |
dS |
|
|
dU |
|
|
|
dU |
pdV |
|
||||||||||
|
T |
|
|
|
T |
|||||||||||||||
|
L |
|
L |
L |
L |
2 |
|
|
|
|
L |
|
||||||||
|
1 |
dU |
2 |
p2 |
3 |
|
|
|
|
|
|
|
dT |
|
|
|
p2 |
|
|
|
L |
L |
L |
dV CV L L |
|
|
L |
dV |
|
||||||||||||
T |
T |
T |
|
T |
|
|||||||||||||||
2 |
3 |
|
3 |
|
|
|
|
|
|
2 |
3 |
|
|
3 |
|
|
|
|||
|
|
|
CV ln |
T2 |
|
p2 |
dV . |
|
|
|
|
|
(2) |
|||||||
|
|
|
T |
T |
|
|
|
|
|
|||||||||||
|
|
|
|
|
1 |
|
L |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
Теперь поговорим о соотношении температур T1 началь- |
||||||||||||||||||||
ного состояния и |
T2 |
конечного состояния газа. |
Внутренняя |
|||||||||||||||||
энергия идеального газа определяется только кинетической энергией его частиц, а потенциальная энергия взаимодействия
145

частиц принимается равной нулю (взаимодействие отсутствует). Количественной мерой интенсивности теплового движения частиц газа является температура. Если средняя энергия частиц не изменяется, то независимо от того, какой объем занимает газ, его температура остается постоянной. Итак, внутренняя энергия идеального газа определяется его температурой и не зависит от объема.
Относительно рассматриваемого примера можно заметить: данная система энергетически замкнута; газ, заполняя второй вакуумированный сосуд, не совершает работы. Следовательно, внутренняя энергия газа в равновесных состояниях 1 и 2 одинакова, и температуры газа T1 и T2 равны (T1 =T2 ). Тогда
ln T2 ln1 0
T1
и первое слагаемое в выражении (2) исчезает. Следовательно,
S |
|
S |
p2 |
|
dV . |
|
|
|
(3) |
|||
|
|
|
|
|
||||||||
|
2 |
L |
T |
|
|
|
|
|
|
|||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
Для произвольной точки на изобаре L3 можно написать: |
|
|||||||||||
p V RT , т.е. T |
p2V |
. |
|
(4) |
||||||||
|
||||||||||||
2 |
|
|
|
|
|
|
|
R |
|
|
|
|
Подставляя (4) в (3), получаем |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
|
|
V2 dV |
|
|
V |
|
||||||
S2 S1 R |
|
|
|
|
|
|
2 |
|
|
|||
|
|
Rln |
|
. |
|
|||||||
|
V |
|
V |
|
||||||||
|
|
V |
|
|
|
|
|
1 |
|
|
||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
Поскольку по условию V2 nV1 , то |
|
|
|
|
|
|
||||||
|
|
S2 S1 Rlnn. |
|
|
|
|
||||||
Для заданных 2,2моль и n=3 S2 S1 =20Дж/К. |
|
|||||||||||
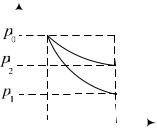
6.174. Примерная диаграмма процесса, совершаемого |
||||||||||||
идеальным газом, приведена на рисунке. Нижняя ветвь L1 |
диа- |
|||||||||||
граммы соответствует необратимому процессу расширения газа в пустоту до объема V1 nV0 (V0 - начальный объем,
146

p |
|
|
|
|
n 2), верхняя ветвь L2 |
отобра- |
|||
|
2 |
|
|
жает обратимый процесс сжатия |
|||||
|
|
|
|||||||
|
|
|
|
газа до начального объема под |
|||||
|
|
0 |
|
|
внешним давлением на поршень. |
||||
|
|
|
|
Особенности |
поведения |
газа на |
|||
|
|
|
1 |
|
необратимом |
участке |
L1 |
пути |
|
|
|
|
|
описаны в |
предыдущей |
задаче |
|||
|
|
|
|
|
|||||
|
|
|
|
|
6.173. Из нарушенного состояния |
||||
0 V0 |
V1 V |
||||||||
равновесия (т.0), когда |
p1 p0 , |
||||||||
|
|
|
|
|
|||||
V V0 при освобождении поршня газ перейдет в состояние 1, когда поршень будет остановлен.
При |
этом |
энтропия |
газа |
увеличится |
на |
|
S S2 |
S1 Rlnn |
|
n 2 Rln2, |
а внутренняя энергия и тем- |
||
|
||||||
|
|
|
|
|||
пература газа в состоянии 1 примут начальные значения. |
|
|||||
Участок пути |
|
L2 представляет собой обратимый адиаба- |
||||
тический процесс (цилиндр теплоизолированный), в ходе которого энтропия не изменяется. Таким образом, приращение энтропии при осуществлении заданного процесса 0 1 2 будет равно
S S |
2 |
S |
1 |
Rlnn |
|
|
Rln 2 5,8 |
Дж |
. |
|
|
||||||||
|
|
|
|||||||
|
|
|
|
1,n 2 |
|
К |
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||
В конце пути L1 (т.е. в состоянии 1) внутренняя энергия газа оказалась равной ее начальному значению U0 . На участке
L2 обратимого адиабатического процесса внутренняя энергия увеличивается за счет работы A внешней силы, приложенной к поршню. При этом
U U2 U1 U2 Uo A
|
|
|
|
|
|
|
|
|
0 dU pdV U pdV A |
. |
|
|
L2 |
|
Приращение внутренней энергии мы можем вычислить
так:
147
|
|
U C (T T ) |
R |
(T T ). |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
V |
|
|
|
2 |
1 |
|
1 |
|
|
|
|
2 |
|
0 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
1 |
|
1 |
|
|
|||||||||
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
||||||||
|
|
T2V0 |
T2V2 |
|
|
|
, т.е. |
T2 T0 |
|
|
|
|
|
|
2 |
|
T0 . |
|||||||||||
|
|
|
|
|
V |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
||||||
|
При этом, приращение внутренней энергии будет равно |
|||||||||||||||||||||||||||
|
|
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|
|
2 |
1 |
|
|
|
|
|||||||
|
|
U |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT . |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
1 RT |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
|
1 |
0 |
|
|
||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
6.175. |
Сравниваются |
два |
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
адиабатических процесса |
|
расши- |
|
|
|
|
|
|
|
0 |
|
|
|
3 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
рения одного и того же газа, один |
|
|
|
|
|
|
|
|
|
|
|
|
L2 |
|
||||||||||||||
из которых |
обратимый |
|
|
|
(L1 ), |
а |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||||||||
другой – необратимый (L2 ). На |
|
|
|
|
|
|
|
|
|
|
|
L1 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|||||||||||||||
рисунке показаны зависимости |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
от V |
для этих процессов. Пока- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
жем, |
что p2 |
p1 . Ожидать совпа- |
0 |
|
|
|
|
|
V0 |
|
|
V1 V |
||||||||||||||||
дения точек конечных состояний 1 и 2 на изохоре V V не прихо-
дится, и поэтому воспользуемся неравенством Клаузиуса мы
не можем. Поскольку оба |
процесса |
адиабатические, |
то |
||||||||||||
Qобр |
0 и Qнеобр 0, т.е. |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
dU pdV 0, |
|
|
|
|
(1) |
|||||
|
|
|
|
|
L1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dU pdV 0. |
|
|
|
|
(2) |
|||||
|
|
|
|
|
L2 |
|
|
|
|
|
|
|
|
|
|
|
Начальное состояние 0 газа охарактеризуем значениями |
||||||||||||||
параметров p0,V0,T0 . |
|
|
|
|
|
|
|
|
|
|
|
||||
|
Давление |
p1 в состоянии 1 определим не решением урав- |
|||||||||||||
нения (1), а из соотношения |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
p p |
V |
p |
V |
|
|
|||||
|
p V |
|
pV |
|
|
0 |
|
|
0 |
, где n |
|
. |
(2а) |
||
|
|
|
|
|
|
V |
|||||||||
|
0 0 |
1 |
|
1 |
0 |
V |
n |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
148 |
|
|
|
|
|
|
|
|
|
Теперь вычислим интеграл I dU pdV левой части
L2
равенства (2), рассматривая состояние (2) (см. рис.) как результат действия двух обратимых процессов 0 3 и 3 2. Тогда
I CV (T3 T0) p0(V V0) CV (T2 T3) 0
|
|
CV (T2 |
T0) p0V0 (n 1). |
|
|
|
|
|
(3) |
|||||||||||||
Из уравнений состояний обратимого процесса 0 3 2 |
||||||||||||||||||||||
имеем: |
|
|
|
|
|
|
|
V |
|
|
T3 |
|
|
|
|
V |
|
|
|
|||
p V RT , |
p V RT |
|
|
|
|
T |
T |
nT . (4) |
||||||||||||||
0 0 |
0 |
0 |
|
3 |
|
V T |
3 |
V |
o |
0 |
||||||||||||
|
|
|
|
|
0 |
|
0 |
|
|
|
0 |
|
|
|
||||||||
p V RT , p V RT |
p0 |
|
|
T3 |
|
|
p0 |
|
nT0 |
|
||||||||||||
0 |
3 |
2 |
0 |
2 |
|
|
|
p2 |
|
|
|
T2 |
|
|
p2 |
|
|
T2 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
T |
|
p2 |
nT . |
|
|
|
|
|
|
|
|
(5) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
2 |
|
p0 |
0 |
|
|
|
|
|
|
|
|
|
||||||
Подставляя (4) и (5) в (3), получим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
I C ( |
p2 |
nT T ) p V (n 1) C T ( |
p2 |
n 1) RT (n 1) |
|||||
V p0 |
0 0 |
o |
0 |
|
V 0 p0 |
|
0 |
||
|
|
|
RT0 |
|
p2 |
|
|
|
|
|
|
|
n |
1 ( 1)(n 1) . |
(6) |
||||
|
|
1 |
p0 |
||||||
|
|
|
|
|
|
|
|
||
Из уравнения I 0 следует
|
p2 |
|
p0 1 ( 1)(n 1) |
. |
|
|
|
(7) |
|
|
|
|
|
||||||
Отношение давлений |
n |
|
|
|
|
||||
|
|
|
|
|
|
||||
|
p2 |
n 1 1 ( 1)(n 1) . |
|
|
|
(8) |
|||
|
p1 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
Выражение (8) |
|
имеет |
смысл при |
условии, |
что |
||||
1 ( 1)(n 1) 0, т.е. когда |
n ( 1) , или |
V |
V0 |
, |
для |
||||
|
|||||||||
|
|
|
|
|
|
|
1 |
|
|
одноатомного газа V 2,5V0 , для трех и большего числа ато-
149

мов |
в молекуле V 4V0 . Формула (8) |
справедлива как для |
|||
n 1 |
(расширение газа), так и при |
0 n 1 (сжатие газа). |
|||
|
В рассматриваемом случае |
1 n /( 1)полученный |
|||
результат не дает очевидного |
ответа |
на вопрос: |
p2 |
1, |
|
|
|||||
|
|
|
|
p1 |
|
p2 p1 , или p2 p1 . Чтобы получить ответ, возьмем производные от выражений (2а) и (7) по х, где x n:
|
dp1 |
|
|
d |
(p |
0 |
x ) |
p0 |
; |
(9) |
|
|
dx |
dx |
x 1 |
||||||||
|
|
|
|
|
|
|
|||||
|
dp2 |
|
|
p0 |
, где x 1. |
|
(10) |
||||
|
dx |
|
|
|
|||||||
|
|
|
|
|
x2 |
|
|
|
|
|
|
Из (9) в (10) видим, |
что p1(V) |
убывает быстрее, |
чем |
||||||||
p2 (V) . Следовательно, точка состояния 1 ниже точки 2 при одном и том же значении объема V .
6.176. Поскольку перегородка неподвижна, ослабевающий поток каждого из газов через отверстие в перегородке из одной части сосуда в другую можно рассматривать как необратимый адиабатический процесс расширения газа в пустоту
(сосуд теплоизолированный). В связи с этим мы можем |
вос- |
пользоваться решением задачи 6.173: S Rlnn, |
где |
n V /V1 (V1 V2 )/V1.
Пусть объем меньшей части сосуда, в котором находился азот в количестве 1 молей, есть V1 , тогда объем большей час-
ти сосуда, в котором содержался кислород в количестве 2 молей, будет равен V2 nV1 .
Благодаря аддитивности энтропии, приращение энтропии в результате смешения газов равно
S S1 S2 R( 1 lnn1 2 lnn2 ) .
Здесь n1 n 1, n2 (n 1)/n , тогда
S= R( 1 2)ln(n 1) 2 ln n) 1Rln(1 n) 2R(1 1) . n
150
