
2683
.pdf
По условию
pид |
1. |
(2) |
|
||
pB |
|
|
Из (1) и (2) получаем выражение для соответствующей температуры:
T a( 1)(Vmb) .
RVm ( Vm b)
У азота постоянные Ван-дер-Ваальса имеют значения:
a=0,37 Па |
м2 |
, b=39 10 6 |
м2 |
. |
|
моль2 |
|
моль |
|
Для V=1,00л и =0,10 температура
T 0,137(0,1 1)(1 10 3 39 10 6) 133K. 8,31 1 10 3(0,1 10 3 39 10 6)
Давление газа при T=133K равно
P |
RT |
|
a |
|
8.31 |
133 |
|
0.137 |
9,9атм |
|
|
1 10 3 39 10 6 |
(1 10 3 )2 |
||||||
B |
Vm b Vm2 |
|
|
|
|||||
6.24. Приведем уравнение Ван-дер-Ваальса для одного моля газа:
|
a |
|
|
|
p |
|
(V b) RT , V Vm . |
(1) |
|
V 2 |
||||
|
|
|
21

При изменении температуры объем газа согласно условию остается постоянным, V=const. Для температур T1 и T2 на основании (1) имеем следующие равенства:
|
|
|
|
|
a |
|
|
|
|
p |
|
|
|
(V b) RT , |
|||||
V 2 |
|||||||||
|
1 |
|
|
|
1 |
||||
|
|
|
|
|
a |
|
|
|
|
p |
|
|
|
|
|
(V b) RT . |
|||
|
V 2 |
|
|||||||
|
|
2 |
|
|
|
2 |
|||
При делении (2) на (1) получим:
p2 |
|
a |
|
|
T2 |
|
V 2 |
|
|
. |
|||
|
|
a |
|
|
||
p1 |
|
|
|
T |
||
V 2 |
1 |
|
||||
|
|
|
|
|
|
|
Отсюда находим постоянную a:
a V 2 T1 p2 T2 p1 . T2 T1
(2)
(3)
(4)
Подставляя (4) в уравнение (2) или (3), получим вторую постоянную b:
b V |
R(T2 T1) |
. |
(5) |
|
|||
|
p2 p1 |
|
|
По данным значениям температуры, давления и объема газа постоянные Ван-дер-Ваальса равны:
a (0,25 10 3)2 |
300 110 105 |
350 90 105 |
0,19Па м2 / моль2; |
||||
350 300 |
|
||||||
|
|
|
|
||||
b 0,25 |
8,31(350 300) |
3 |
|
л/ моль. |
|||
|
10 |
|
0,042 |
||||
110 90 105 |
|
||||||
2. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ТЕПЛОЕМКОСТЬ
6.25. Объем комнаты не является полностью закрытым. При произвольной разности температур воздуха внутри и вне комнаты существуют встречные потоки молекул воздуха меж-
22

ду внутренней и внешней частями пространства. В установившемся температурном режиме эти потоки молекул одинаковы и, следовательно, давление воздуха в комнате будет равно внешнему (атмосферному) давлению.
Практически воздух состоит из молекул кислорода (O2 )
и азота (N2 ), для которых число пространственных и вращательных степеней свободы одинаково и равно i=5. Если m – масса воздуха в объеме комнаты, M – усредненная молярная, то внутреннюю энергию комнатного воздуха можно определить выражением
U |
m |
C |
T |
m |
( |
i |
RT) |
i |
pV . |
(1) |
|
|
M |
|
|
||||||||
|
M |
|
v |
|
2 |
2 |
|
|
|||
Выражение (1) |
можно |
представить через |
показатель |
||||||||
адиабаты (i 2)/i. Отсюда i 2/( 1) и, следовательно,
U pV /( 1). |
(2) |
При постоянном давлении внутренняя энергия воздуха в комнате не зависит от его температуры.
6.26. Внутренняя энергия воздуха, содержащегося в баллонах как при закрытом, так и открытом вентиле равна
U p1V1 p2V2 p(V1 V2 ) ,
1 1 1
где p – давление воздуха в баллонах при открытом вентиле. Отсюда имеем:
p p1V1 p2V2 . V1 V2
Теперь напишем уравнение состояния воздуха в сообщающихся баллонах:
p(V V |
) |
m1 m2 |
RT , p V p V |
2 |
|
m1 m2 |
RT . |
|||
|
||||||||||
|
|
|||||||||
1 |
2 |
|
M |
1 |
1 |
2 |
|
M |
||
|
|
|
|
|
|
|
|
|||
Отсюда
23
T |
M(p1V1 p2V2 ) |
. |
(1) |
||
|
|||||
|
|
(m1 m2 )R |
|
||
Исходные массы воздуха в баллонах равны |
|
||||
m1 Mp1V1 / RT1 ,m2 Mp2V2 / RT2 . |
(2) |
||||
Подставляя (2) в (1), получим |
|
||||
T |
(p1V1 p2V2 )T1T2 |
. |
(3) |
||
|
|||||
|
p1V1T1 p2V2T2 |
|
|||
6.27. Поскольку объем V=const, работа газа или над газом
не совершается. Поэтому Q |
m |
C ( T). Для молекулярного |
||||||||||||||
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
M |
V |
|
|
|
|
|
|
|
|
i |
|
|
5 |
|
|
|
|
|
|
|
|||
водорода C |
|
|
R |
|
|
R , i=5. |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||||
|
|
V |
2 |
|
2 |
|
|
|
|
|
||||||
В объеме |
V |
при |
нормальных значениях |
давления |
||||||||||||
p0=10 |
5 |
Па и температуры |
T0=273K содержится |
m |
|
p0 |
молей |
|||||||||
|
M |
RT |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
водорода. В закрытом сосуде величина m/M = const. При охлаждении газа на ∆T приращение внутренней энергии и количе-
|
|
|
|
S |
p0V |
|||||
ство отданного им тепла равны U Q |
|
|
|
( T). Для |
||||||
2 |
|
|
||||||||
|
|
|
|
|
T0 |
|||||
заданных значений V=5,0 л и ∆T=55K |
|
|
|
|
|
|
||||
U Q |
5 105 5,0 10 3 |
|
55(Дж) 2,5 102 |
Дж 0,25кДж. |
||||||
2 273 |
||||||||||
|
|
|
|
|
|
|
|
|||
6.28. Согласно первому началу термодинамики Q=∆U+A. |
||||||||||
При p=const работа газа |
A=p∆V, ∆U= CV∆T= |
i |
R T . Из |
|||||||
|
||||||||||
|
|
|
|
|
|
2 |
|
|||
уравнения состояния pV=νRT при p=const имеем ∆V=νR∆T/p.
24
Тогда работа газа A=νR∆T. Приращение внутренней энергии азота (i=5) ∆U= 5 νR∆T, т.е. ∆U= 5 A. Сообщенная газу тепло-
|
|
2 |
2 |
||
та Q= |
5 |
A A |
7 |
A. Для A=2,0 Дж, теплота Q=7,0 Дж. |
|
|
|
||||
2 |
2 |
|
|
||
6.29. Приращение внутренней энергии газа определяется разностью температур конечного и начального состояния газа и не зависит от способа нагрева. В рассматриваемом опыте осуществлены два способа нагрева на одно и тоже значение ∆Т
– изобарный и изохорный. Во втором способе работа не совершалась и не затрачивалась. Поэтому можно написать:
∆Q=QP – QV=(∆U+AP) - ∆U= Ap= m R T . M
Отсюда получаем: M = mR∆T/∆Q.
Заданные значения m=0,50кг, ∆Т=10К и ∆Q=1,48 кДж для молярной массы газа дают
M=0,50∙8,31∙10/1,48∙103(кг/моль)=2,81∙10-2кг/моль= 28,1г/моль.
6.30. Для нагрева одного моля некоторого газа на ∆Т при изобарном процессе надо сообщить газу теплоту в количестве,
равном Q i R T R T i 2 R T . Отсюда i 2( 1), где
2 2
Q/ R T , а затем |
|
i 2 |
|
|
. При |
Q=1,60кДж, |
|
|
|
||||||
|
|
i |
|
|
1 |
|
|
∆Т=72К, =2,68, постоянная |
=2,68/1,68=1,6; |
приращение |
|||||
внутренней энергии |
|
|
|
|
|
|
|
|
25 |
|
|
|
|
|
|
U i R T ( 1)R T 1,68 8,31 72Дж 1,0кДж . |
|
||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
p |
|
|
6.31. |
Схема |
процесса |
1-2-3 |
в |
||||
|
|
координатах p-V |
приведена на ри- |
||||||||
|
1 |
|
|||||||||
p |
|
сунке. |
Температура начального со- |
||||||||
1 |
T1 |
const |
стояния 1 газа и конечного состояния |
||||||||
|
|||||||||||
|
|
|
|||||||||
p2 |
|
3 |
3 одна и та же (по условию). Следо- |
||||||||
2 |
вательно, |
изменение |
внутренней |
||||||||
|
|||||||||||
0 V1 |
V3 V |
энергии за осуществленный процесс |
|||||||||
равно |
нулю, |
U U3 U1 |
0 |
и |
|||||||
|
|
|
|||||||||
Q A23 |
p2(V3 |
V2) . При этом p1V1 |
p2V3,V1 |
V2 |
и p2 |
p1 /n . |
|||||
Тогда
Q (p |
/2)(p / p |
|
1)V |
|
n 1 |
pV |
|
n 1 |
RT , T |
T . |
|
|
|
n |
|||||||||
1 |
1 |
2 |
1 |
|
n 1 1 |
|
1 |
1 |
0 |
||
Для 2, n=2,0 и T0 300К количество поглощенного теп-
ла равно Q=2,5кДж.
6.32. Внутреннюю энергию газовой смеси определим выражением:
U |
p1V |
|
p2V |
|
|
(p2 p1)V |
, |
(1) |
|
2 1 |
|
||||||
|
1 1 |
|
1 |
|
||||
где - усредненное |
значение |
отношения |
теплоемкостей |
|||||
CP /CV . Из уравнения состояния компонент смеси имеем: |
||||||||
|
p1 1RT /V , |
(2) |
||||||
|
p2 |
2RT /V . |
(3) |
|||||
Подставляя (2) и (3) в (1), получим:
26
|
1 |
|
|
|
2 |
|
|
1 2 |
|
1 1( 2 |
1) 2 2 ( 1 1) |
(4). |
|
|
1 1 |
|
2 |
1 |
|
1 |
|
2 ( 2 1) 2 ( 1 1) |
|
|
|||
Для 1 = 2,0моль, 1 |
1,4 (кислорода) и 2 |
3,0моль, 2 |
4/3 |
||||||||||
(углекислого газа) показатель данной смеси газов 1,33.
6.33. Сначала напишем выражения для молярных тепло-
емкостей CV и CP двухкомпонентной газовой смеси, а затем делением на усредненную молярную массу M смеси к удель-
ным теплоемкостям CV и CP .
C |
( QV )моль |
|
|
U |
|
|
|
R |
|
|
|
(i |
i |
)/2, |
(1) |
|||||||||
|
|
|
T |
|
|
|
|
|
|
|||||||||||||||
V |
|
T |
|
|
|
|
|
|
1 2 |
1 1 |
|
|
2 2 |
|
|
|||||||||
|
С |
P |
|
|
|
R |
|
|
[(i 2) |
|
(i |
|
|
2) |
|
]/2 . |
(2) |
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
1 |
2 |
|
1 |
|
|
2 |
|
|
2 |
|
|
2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Здесь 1 m1 /M1 , 2 |
|
m2 /M2 , |
i – число степеней сво- |
|||||||||||||||||||||
боды для той или иной молекулы. В условиях задачи имеем: m1 7г, M1` 28г / моль, i 5; m2 20г, M2 40г / моль,i2=3.
Подставляя числовые значения указанных величин в (1) и (2),
найдем: C |
15,3 |
|
Дж |
, C |
|
23,5 |
Дж |
. Молярная мас- |
|
|
|
|
|||||
V |
|
моль К |
P |
|
моль К |
|||
са данной смеси газов |
|
|
|
|
||||
|
M (m1 |
m2 )/(m1 |
/M1 m2 /M2 ) 36г / моль . |
|||||
Итак, удельные теплоемкости будут равны:
c |
C |
/M 15,3/36 0,42 |
Дж |
, |
||
|
|
|||||
V |
V |
|
|
г К |
||
|
|
|
|
|||
cP |
CP |
/M 24,5/36 0,65 |
Дж |
. |
||
|
||||||
|
|
|
г К |
|||
|
|
27 |
|
|
|
|
p |
|
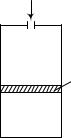
6.34. Нижняя часть |
вертикального |
|
|
цилиндра (см. рисунок) заполнена некото- |
|||
0 |
|
|||
воздух |
|
рым идеальным газом, верхняя – сообща- |
||
|
ется с атмосферой. |
|
|
|
mп |
0 |
Поршень, разделяющий объем ци- |
||
|
|
|||
ид.газ |
|
линдра на части, условно |
невесомый. В |
|
|
состоянии равновесия (поршень в покое) |
|||
|
|
|||
|
|
давление и температура газов в цилиндре |
||
|
|
определяется значениями |
p и T |
атмо- |
сферного воздуха.
Чтобы осуществить медленное перемещение поршня вверх, необходимо температуру газа в нижней части цилиндра повысить хотя бы на бесконечно малую величину dT. В этих условиях процессы расширения идеального газа и выталкивания воздуха из верхней части цилиндра можно считать изо- барно-изотермическими, p=const, T=const. При перемещении поршня будет совершаться работа А, обусловленная действием двух факторов: расширением газа и противодействием давления воздуха в верхней части цилиндра и утечкой воздуха вследствие уменьшения объема. Следовательно, полную работу можно представить в виде суммы двух слагаемых А1 и А2 ,
т.е. А А1 А2 , где А1 и А2 обусловлены действием первого и второго факторов. Найдем А1 и А2 :
A pdV |
RT |
|
|
|
|
|
RT |
|
dV |
|||||||||
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
1 |
RT V2 dV |
|
MV |
|
1 |
|
|
|
MV |
|||||||||
|
|
|
|
|||||||||||||||
|
|
|
RT |
V |
|
|
|
|
RT |
|||||||||
A1 |
|
|
|
|
|
|
ln |
2 |
|
|
|
|
lnn. |
|||||
M |
V |
|
M |
V |
|
|
M |
|||||||||||
|
|
V1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|||
Здесь T=const, V2 /V1 n (по условию).
Для воздуха, содержащего в верхней части цилиндра, можем написать: pV' (m' /M ')RT (p, T – постоянные)
28

pdV' (RT /M |
')dm' |
A (RT /M')dm' . |
|||||||
|
|
|
|
2 |
|
|
|
|
|
A (RT /M')(m' m' ) (RT /M') (V' |
V') |
||||||||
2 |
2 |
1 |
|
|
|
|
2 |
1 |
|
Поскольку V2 V1' (V2 |
V1) |
и pM' / RT , то |
|
||||||
A (RT /M') (pM |
' / RT)(V V ) |
|
|||||||
2 |
|
|
|
2 |
1 |
|
|||
p(V2 V1) pV1(n 1) (RT /M)(n 1) . |
|||||||||
Итак, получили A A A |
|
RT |
(lnn (n 1)). Если пе- |
||||||
|
|||||||||
|
1 |
2 |
|
|
M |
|
|
||
рейти к работе внешнего источника энергии, то |
|
||||||||
A' |
A |
RT |
(n 1 ln n), |
|
|||||
|
|
||||||||
|
|
|
M |
|
|
|
|
|
|
где M – молярная масса идеального газа.
6.35. При изотермическом расширении газа положим, в левой части цилиндра и сжатии газа в правой части соверша-
ются работы: A1 p0V0 ln(V1 V0 ), A2 |
p0V0 ln(V2 V0 ). |
Работа |
||||
совершаемая газом в целом равна A A A |
p V ln |
V1V2 |
. |
|||
|
||||||
|
1 2 |
0 |
0 |
|
V02 |
|
Теперь учтем, что V1 V0 V, V2 |
V0 V . |
По |
условию |
|||
V1 V2 . Получаем: |
|
|
|
|
|
|
(V0 V)/(V0 V) V ( 1)V0 /( 1)
и
V1 V2 ,V2 2V0 /( 1) .
С учетом этих соотношений,
A p0V0 ln VV0222 p0V0 ln ( 4 1)2 p0V0{ln ln4 ln( 1)2}.
В действительности, при осуществлении такого опыта затрачивается работа, равная:
29
A' A p0V0{ln( 1)2 ln ln 4} p0V 0ln ( 1)2 .
4
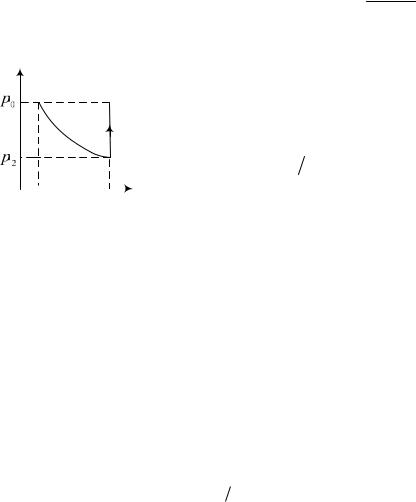
6.36. Диаграмма процесса в ко-
p
ординатах p – V, совершаемого над 1 3 газом, приведена на рисунке. Работа газа при его расширении изотерми-
ческим способом равна
|
|
|
2 |
|
A p0V0 |
ln(V2 V1) p0V0 ln n . |
(1) |
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
V |
Приращение внутренней энергии за |
|||||||||||||
0 |
V0 |
nV0 |
||||||||||||||||
ход |
всего |
|
процесса 1 |
- 2 |
- |
|||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
U (p3V3 p2V2 )/( 1) n(p0 p2 )V0 /( 1). |
(2) |
|
||||||||||||||||
Учтем соотношения: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
p0V0 p2V2 p0V0 |
p2nV0 |
p2 p0 /n. |
(3) |
||||||||||||
Подставим (3) и (2): U (n 1)p0V0 |
/( 1). |
|
|
|||||||||||||||
|
|
Сообщенная газу теплота |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Q U A p V |
|
lnn |
|
n 1 |
. |
|
|
|||||||
|
|
|
|
0 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|||
|
|
Отсюда с учетом p0V0 RT0 |
получим: |
|
|
|||||||||||||
|
|
|
|
|
1 |
|
|
n 1 |
|
|
. |
|
|
|
||||
|
|
|
|
Q RT0 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
ln n |
|
|
||||||||||
По данным v=3, n=5, T0 273К и Q=80кДж постоян-
ная адиабаты 1,4.
6.37. Работа совершаемая при адиабатическом сжатии или расширении газа, определяется выражением
30
