
2683
.pdfT = (100+273) К = 373K.
Приведем приближенную формулу КлапейронаКлаузиуса
|
|
dp |
|
|
|
q12 |
|
|
|
. |
|
|
|
(1) |
|||||
|
|
dT |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
T(V2 |
V1) |
|
|
|
|||||||||||
Здесь q12 q 0 |
- теплота парообразования воды; V1 и |
||||||||||||||||||
V2 - удельные объемы воды и ее пара вблизи температуры |
|||||||||||||||||||
T = 373K. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для |
воды |
удельный |
|
|
|
|
объем |
|
при |
100 C |
|||||||||
V1 1,0 10 3 м3 /кг . По условию |
p 3,2кПа, |
T 0,9K . |
|||||||||||||||||
Из уравнения (1) для V2 получим: |
|
|
|
|
|
|
|
|
|
||||||||||
|
V2 |
V1 + |
q |
|
T |
|
|
|
|
q T |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
. |
|
|
(2) |
|||||||
|
T |
p |
|
T p |
|
|
|||||||||||||
Численно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V2 1,0 10 3 + |
2,25 106 |
|
|
|
0,9 |
|
1,7м3 /кг . |
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
373 3,2 103 |
|
|
|
||||||||||
6.350. Рассматривается двухфазная система вода - насы- |
|||||||||||||||||||
щенный пар при температурах |
T0 |
|
|
= (100+273) К = 373K |
|||||||||||||||
и T = (101,1+273) К = 374,1K . Давление и объем насыщенного |
|||||||||||||||||||
пара при температуре T0 |
обозначим через р0 (нормальное) и |
||||||||||||||||||
V0, при температуре Т |
– через рн и V. |
|
|
|
|||||||||||||||
Массу насыщенного пара m будем полагать практически постоянной. Считая насыщенный водяной пар идеальным газом, для второго его состояния можем написать
p V |
m |
RT . |
(1) |
н
M
Из соотношения (1) устанавливаем:
321

V mRT , Mpн
удельный объем пара при температуре Т равен
V |
V |
|
RT |
. |
(2) |
|
|
||||
|
m |
Mpн |
|
||
Для системы вода – насыщенный пар в окрестности температуры T уравнение Клапейрона-Клаузиуса имеет вид
|
pн p0 |
|
q |
, |
(3) |
|
T |
|
|||
|
|
TV |
|
||
где T T T0 , q – удельная теплота парообразования, |
V - |
||||
удельный объем насыщенного пара. В соотношении (3) удельный объем воды отброшен, поскольку он пренебрежимо мал по сравнению с V . При подстановке (2) в (3) получается:
p |
н |
p |
0 |
|
q T |
|
Mpн |
p |
0 |
|
qM T |
p |
н |
|
|
|
|
|
|||||||||||||
|
|
|
|
T RT |
|
RT 2 |
|
||||||||
(1 |
qM T |
|
)pн p0 pн |
|
p0 |
|
|
||||||||
|
|
|
|
1 qM T / RT2 |
|||||||||||
|
RT 2 |
|
|||||||||||||
Поскольку разность T мала (по условию) то и величина также малая. Тогда давление насыщенного пара при
температуре Т примерно равно
|
pн |
p0 (1 |
qM T |
). |
(4) |
|
|
||||
|
|
|
RT2 |
|
|
Для |
p 1атм, |
q 2,25 106 Дж/кг, |
T 1,1К , |
||
|
0 |
|
|
|
|
M 18 10 3 |
кг/моль, Т=101,1К давление pн 1,04атм. |
||||
6.351. Условимся в обозначениях величин: m1 , |
p1 – мас- |
||||
са и давление насыщенного водяного пара в первом состоянии
(при t1 100 C), |
m2 , p2 - во втором состоянии (при |
|
322 |
t2 101,1 C . Объем пара в обоих состояниях V, поскольку со-
суд закрытый, а объем воды пренебрежимо мал: Уравнение состояния пара:
|
|
|
|
|
|
|
pV |
m1 |
|
|
RT |
|
, |
|
p V |
m1 |
RT . |
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
M |
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
M |
|
2 |
|
|
|
|
|
|
|||||||||||||
Отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
p p |
|
|
p |
|
|
|
R |
|
(m T m T ). |
(1) |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
MV |
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
1 |
|
|
|
2 |
2 |
|
|
1 |
|
|
1 |
|
|
|
||||||||||||||||||
Уравнение Клайперона – Клаузиуса для данной системы |
|||||||||||||||||||||||||||||||||||||||||||||||
дает: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
p |
|
|
|
q |
|
|
|
|
|
p |
qm2 T |
|
|
. |
|
(2) |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
T2V |
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
||||||||||||||
Из (1) и (2) получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
R |
(m T mT ) |
qm2 T |
|
R |
|
(T |
m1 |
|
T ) |
q T |
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||
|
M |
2 2 |
1 1 |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
M |
2 |
|
|
|
m |
2 |
|
|
1 |
|
T |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||||
|
|
|
|
|
|
|
T T |
m1 |
T |
qM T |
; |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
m |
2 |
|
1 |
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
m1 |
|
|
|
|
|
|
|
|
|
qM T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
qM |
|
|
|
|
|
||||||||||||||||||
|
(1 |
|
|
)T1 T |
|
|
|
|
|
|
|
|
T1 |
|
|
|
1 T |
||||||||||||||||||||||||||||||
|
m |
2 |
|
RT |
|
|
|
RT |
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
qM |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
1 . |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Здесь - относительное приращение массы насыщенного |
|||||||||||||||||||||||||||||||||||||||||||||||
пара при переходе 1 2, т.е. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
m |
|
m2 m1 |
|
m2 |
1 1 |
m1 |
. |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
m1 |
|
|
|
|
|
|
m1 |
|
|
|
|
|
|
m1 |
|
|
|
|
|
|
|
|
m2 |
|
|
||||||||||||||
Подставляем числовые значения известных величин и находим:
323

1,1 |
|
2,25 10 |
6 |
18 10 |
3 |
|
|
|
|
|
|
|
100% 3,5% . |
||||
|
|
|
|
|
|
|
1 |
|
|
8,31 374 |
|
||||||
373 |
|
|
|
|
||||
6.352. По известному закону зависимости давления насыщенного пара ртути от температуры
ln p |
a |
blnT c . |
(1) |
|
|||
|
T |
|
|
(a, b, c – постоянные) найти молярную теплоту испарения qM
ртути.
При пренебрежимо малом объеме ртути в закрытом сосуде уравнение Клайперона–Клаузиуса имеет вид
dp |
|
q |
, |
(2) |
|
|
|||
dT |
TV |
|
||
где q – удельная теплота испарения, V - удельный объем паров.
Преобразуем правую часть уравнения (2):
q |
|
mq |
|
|
|
|
Mq |
|
qM /T |
|
qM p |
. |
(3) |
TV |
|
|
|
|
|||||||||
|
TV |
|
m M |
|
TVM |
|
RT / p |
|
RT2 |
|
|||
|
|
|
|||||||||||
Здесь qM qM , pVM RT .
На основании (1) найдем производную dp :
|
|
|
|
|
|
|
|
|
|
dT |
|
|
|
|
1 dp |
|
a |
|
b |
|
dp |
|
a |
|
b |
|
|||
|
|
|
|
|
|
|
|
p |
|
|
|
. |
(4) |
|
p dT T2 |
|
T |
|
dT |
T2 |
|
T |
|
||||||
Подставляем (3) и (4) в (2):
a |
|
b |
|
q |
|
p |
|
|
||
p |
|
|
|
|
= |
|
M |
|
. |
(5) |
|
|
RT 2 |
||||||||
T2 |
|
T |
|
|
|
|||||
Из (5) следует искомая величина |
|
|
|
|
||||||
qM R(a bT) . |
|
(6) |
||||||||
324
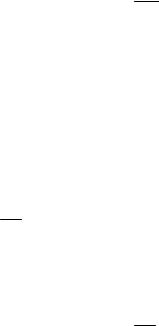
6.353. Обратимся к уравнению Клайперона–Клаузиуса для системы в рамках заданных условий:
dp |
|
q |
(1) |
|
TVП |
||
dT |
|
||
где VП - удельный объем пара вещества.
Далее учтем:
|
VП |
|
V |
|
m |
|
|
|
q |
|
|
qMp |
|
|||||
|
|
|
|
, pV |
|
RT , |
|
|
|
|
|
|
. |
|
||||
m |
M |
TVП |
|
RT2 |
|
|||||||||||||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dp |
|
qMp |
или |
|
dp |
|
qM |
|
dT . |
(2) |
|||||||
|
dT |
|
|
RT 2 |
|
|
|
p |
RT2 |
|
||||||||
Решение уравнения (2) имеет вид:
qM
p Aexp . (3)RT
Из граничного условия p(T0) p0 следует, что постоян-
ная A p0eqM /RT0 .
Итак, зависимость p(T) есть функция
|
qM |
|
|
p p0 exp |
|
. |
(4) |
|
|||
R(1/T0 1/T) |
|
||
6.354. При плавлении большинства веществ объем воз-
растает, так что dp 0: увеличение давления приводит к по- dT
вышению температуры плавления. Однако у некоторых веществ, к числу которых принадлежит и вода, объем жидкой фазы меньше объема твердой фазы (плотность воды больше,
чем плотность льда). В этом случае dp 0 – увеличение дав- dT
ления сопровождается понижением температуры плавления.
325
Подвергнув лед сильному сжатию, можно, не повышая темпе-
ратуры 0 C , вызвать его плавление.
При плавлении необходимо затрачивать теплоту для перехода вещества из твердого состояния в жидкое без изменения температуры. Эта теплота называется скрытой теплотой плавления. При кристаллизации выделяется теплота кристаллизации.
Соотношение между плавлением и температурой при фазовом переходе первого рода дается формулой Клайпе- рона–Клаузиуса.
dp |
q12 |
, |
(1) |
||
|
|
|
|
||
|
|
|
|||
dT |
T(V2 |
V1) |
|
|
|
где q12 - удельная теплота плавления или кристаллизации; V1
и V2 - удельные объемы первой и второй фаз (переход 1 2).
Каждое вещество в газообразном, жидком и твердом состоянии характеризуется определенным соотношением между давлением p, объемом V температурой Т. Если зафиксировать значение одного из параметров, то соотношение между двумя другими изобразится в виде кривой. Координатную плоскость двух переменных параметров называют фазовой плоскостью. Применительно к поставленной задачи нас будет интересовать плоскость p – T. Если на плоскость р – Т нанести множество точек (Т,р) при V=const, соответствующих равновесных двухфазным состояниям вещества, получим три кривые, сходящиеся в одной точке. Эти линии разграничивают области однофазных состояний вещества. Систему этих линий на плоскости р – Т называют диаграммой состояний вещества. Примерная диаграмма состояний для обычного вещества приведена на рис.1.
326
p |
|
dp |
0 |
p |
|
Т |
|
|
|
dT |
p |
|
|
|
|
|
|
|
|
2 |
|
||
|
|
|
|
p0 |
Tв |
р |
|
|
Tв |
|
|
|
|
||
|
|
|
|
1 |
|
||
pБ |
|
|
|
pБ |
|
|
|
A |
|
|
|
A |
|
||
|
|
|
|
|
|
||
0 |
ТБ |
|
Т |
0 |
|
ТБ |
Т |
На диаграмме точка К – критическая точка А – тройная. Тройная точка определяет условия, при которых могут находиться в равновесии одновременно три фазы вещества.
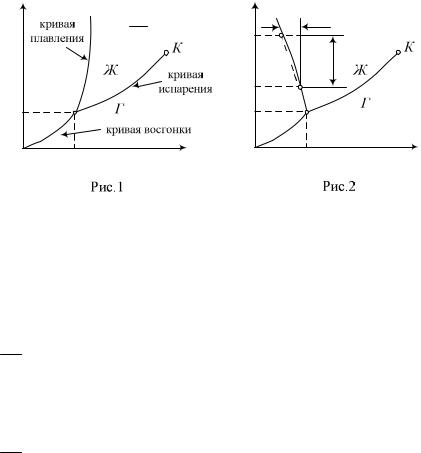
На рис.2 показана диаграмма состояний для аномального вещества, у которого при переходе твердая фаза жидкость
dp 0 . dT
Для воды в тройной точке А давление p 6Па , тем-
пература t 0,01 C , кривая плавления идет очень круто
dp 0 . На диаграмме (рис.2) указан переход воды из состоя- dT
ния твердой фазы (точка 1), соответствующего нормальным условиям, в равновесное двухфазное состояние (точка 2). Пе-
реход 1 2 вызван резким сжатием льда до давления p p0 ,
в результате чего температура плавления льда понизилась в метастабильном состоянии. Лед начнет плавиться, переходя в жидкое состояние. Плавление происходит, пока не будет достигнуто равновесие между фазами.
327

Пусть начальная масса льда была равна m, а после перехода в равновесное двухфазное состояние на m меньше. Система после быстрого сжатия окажется энергетически изолированной. Охлаждение кристаллического льда на
T T0 T , т.е. до температуры плавления Т, сопровождается выделением тепла в количестве cm T , которое полностью пойдет на вынужденное плавление некоторой его части m. Это будет
cm T q m или m c T , m q
где q - удельная теплота плавления, с – удельная теплоемкость льда.
Из уравнения Клайперона–Клаузиуса
|
|
|
|
p |
|
|
|
|
q |
|
|
|
q |
|
, |
|
|
|||
|
|
|
|
T |
|
|
|
T V |
|
|
|
|||||||||
|
|
|
|
|
|
T(V2 V1) |
|
|
|
|
||||||||||
где V V2 V1 , находим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
T |
T V p |
, |
p p p p. |
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
q |
|
|
|
|
0 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Следовательно, |
|
|
|
|
|
cpT V |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
m |
|
|
. |
|
|
|
(2) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
m |
q2 |
|
|
|
|
|
|
|||||
Для льда |
c 2,09Дж / г К , |
|
q 333Дж/кг; |
при |
||||||||||||||||
p p 640атм , |
V 0,09см3 /г относительная часть рас- |
|||||||||||||||||||
таявшего льда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
2,09 103 |
640 105 |
273 0,09 10 3 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,03. |
|
|
m |
|
|
|
|
|
|
(333 103)2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
328

6.355. Зависимость давления насыщенного пара двуокиси углерода от температуры вблизи тройной точки перепишем виде
a b |
(1) |
p 10 T . |
Для процесса сублимации постоянные a1 , b1 ; испарения -
a2 , b2 .
В тройной точке фазы вещества имеют одно и то же дав-
ление p |
и одинаковую температуру T . |
|
|
|
|
|||||||||
а) |
p1 p2 p a1 b1 /T |
a2 b2 /T |
|
|||||||||||
|
|
T |
|
b1 b2 |
. |
|
|
|
|
(2) |
||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
a a |
2 |
|
|
|
|
|
|
||
|
|
|
|
1 |
|
|
|
|
|
|
|
|||
|
T |
|
1800 1310 |
216К . |
|
|||||||||
|
|
|
||||||||||||
|
|
|
|
9,05 6,78 |
|
|
|
|
|
|||||
При T T p p : |
p |
|
|
|
|
1800 |
|
атм 5,1aтт. |
||||||
exp10 9,05 |
|
|
|
|||||||||||
216 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
б) Производные давления по температуре в процессах сублимации и испарения при T T соответственно равны
|
|
|
dp |
|
|
|
b ln10 |
a1 |
|
b1 |
|
|
|
||||||
|
|
|
|
|
|
T , |
(3) |
||||||||||||
|
|
|
1 |
|
|
|
1 |
|
10 |
|
|
||||||||
dT |
|
T2 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
dp2 |
|
|
|
|
b2 ln10 |
10a2 |
b2 |
|
||||||||
|
|
|
|
|
T |
. |
(4) |
||||||||||||
|
|
|
dT |
|
|||||||||||||||
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
||||
С другой стороны: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
dp1 |
|
|
|
|
qc |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
(3 ) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
dT T (VГ VТ ) |
|
||||||||||||||
|
dp2 |
|
|
|
qиc |
|
. |
|
|
|
(4 ) |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
dT T (VГ VТ )
Таким образом,
329

|
b ln10 |
|
|
|
a1 |
b1 |
|
|
|
|
|
|
|
|
q |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
1 |
|
10 |
T |
|
|
|
|
|
|
c |
|
|
|
|
|
. |
|
(5) |
|||||||||||
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T (VГ VТ ) |
|
||||||||||||
|
b2 ln10 |
|
10a2 |
b2 |
|
|
|
|
|
qиc |
|
|
|
|
|
|||||||||||||||
|
|
T |
|
|
|
|
|
|
. |
|
(6) |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T (VГ |
VТ ) |
|
||||||||||
Деля (6) на (5) и полагая VГ VT VГ VT , получаем |
|
|||||||||||||||||||||||||||||
q q |
|
|
|
b2 |
exp |
|
|
|
(a |
|
a |
b2 |
b1 |
). |
(7) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
ис |
c |
b |
|
|
|
|
10 |
|
|
|
|
2 |
1 |
|
|
|
|
T |
|
||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Из равенства (5) при |
|
VГ VT находим |
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
b1 ln10 |
|
VГ 10a1 |
b1 |
|
|
|
|
|
||||||||||||||||
|
qc |
|
|
T |
. |
|
|
|
|
(8) |
||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Далее учтем, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VГ |
|
VГ |
|
|
|
|
|
RT |
|
, |
|
|
|
|
|
|
|
(9) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
m |
|
Mp |
|
|
|
|
|
|
|
|
|||||||||||||||
и подставим (9) в (8):
b1
qc Rb1 ln10 10a1 T .
Mp
Удельная теплота испарения жидкой фазы CO2 вычисля-
ется по формуле (7).
Завершая, установим связь между удельными энергиями испарения, сублимации и плавления. Для этого рассмотрим элементарный обратимый цикл, совершаемый в окрестности и вокруг тройной точки Tp вещества. Интересующий нас цикл в
разных системах параметров схематически показан на рисунках 1 и 2.
330
