
2683
.pdfление» pi в жидкости, обусловленное силами притяжения между молекулами. Давление pi a/VM2 равна объёмной плот-
ности энергии связи молекул pi |
w |
qM |
q |
M |
, где qM - |
|
|
||||
|
VM |
VM |
|||
молярная теплота парообразования жидкости. Выражая молярный объём VM через плотность жидкости (VM M / ), получим
pi q .
Для воды pi 2,25 106 1 103 Па 2,2 104 атм.
6.339. Напишем уравнение Ван-Дер-Ваальса для моля газообразного или жидкого вещества:
(p |
a |
)(VМ b) RT. |
(1) |
|
VM2 |
||||
|
|
|
Далее значок М опустим, но будем помнить, что в последующих действиях величины а, b и V – для моля вещества.
При построении диаграмм в координатах p-V для фиксированных значений температуры Ti (так называемых изотерм)
мы будем уравнение (1) рассматривать как функцию зависимости давления от объёма, т.е.
|
|
p f (V,T ) |
RTi |
|
|
a |
. |
(2) |
|
|
V b |
|
|||||
|
|
i |
V 2 |
|
||||
|
Будем |
также интересоваться изобарными |
сечениями |
|||||
(pi |
const) |
изотерм p f (V,Ti ). При этом равенства |
||||||
|
|
pi f (V,Ti ) |
|
|
|
(3) |
||
относительно переменной V будут кубическими уравнениями. |
||||||||
|
Решая |
уравнения (3) обнаружим, |
что при |
Ti Tk и |
||||
pi |
pk , где Tk и pk - некоторые определённые значения для |
|||||||
вещества, будут иметь три вещественных корня V1,V2,V3 , в то
311

вестных значениях Тk и рk находим постоянные Ван-дер- Ваальса:
b |
RT |
|
|
8,31 304 |
4,3 10 5 |
|
м3 |
0,043л/ моль, |
|
|
|
||||||||||||||||
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
8p |
|
8 73 105 |
моль |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
27(RT )2 |
|
|
|
|
|
|
|
Па м6 |
|
|
|
||||||||
a 27b2 p |
k |
|
|
k |
|
27(4,3 10 5) 73 105 |
|
|
|
|
|
||||||||||||||||
|
64pk |
|
|
моль2 |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
атм л2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
3,6 |
|
|
|
|
. |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
моль2 |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
6.341. Постояннаяb |
RTk |
(см. задачу 6.340.), молярный |
|||||||||||||||||||||||||
8pk |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
критический объем VMk 3b,удельный критический объем |
|
|
|||||||||||||||||||||||||
|
VMk |
|
|
3RTk |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
5 |
|
|
3 |
|
||||
VMk |
|
|
|
|
|
|
|
|
3 831 562/(8 78 10 |
|
47 10 |
|
) 4,7см |
|
/г. |
||||||||||||
М |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
8Mpk |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
6.342. Уравнение Ван-дер-Ваальса для моля газа
имеет вид
(p |
a |
)(V b) RT , |
(1) |
|
|
||||
V2 |
|
|
||
где V VM (значок M опущен). |
|
|
||
Введем безразмерные параметры газа |
|
|||
p/ pk , V /Vk |
и T /Tk , |
(2) |
||
где p, V, T – параметры состояния моля газа в обычных единицах измерений, рк, Vk, Тк – критические значения соответст-
вующих величин. С учётом введенных величин , , выражаем:
p pk , V Vk и T Tk , (3)
Далее напишем соотношения между постоянными Ван- дер-Ваальса и параметрами критического состояния вещества:
313
p |
k |
a/27b2 , |
V 3b, T 8a/27Rb. |
(4) |
||||||||||||
|
|
|
|
|
|
|
|
|
k |
k |
|
|||||
Подставим (3) и (4) в уравнение (1): |
|
|||||||||||||||
( |
a |
|
|
|
a |
|
|
1 |
)( 3b b) R |
8a |
. |
(5) |
||||
27b2 |
|
|
|
|
9b2 |
|
||||||||||
|
|
|
|
2 |
|
|
27bR |
|
||||||||
Если в выражениях, заключенных в скобки, равенства (5) |
||||||||||||||||
вынести множители |
|
a |
|
и b, произвести сокращения в час- |
||||||||||||
27b2 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
тях равенства (5), получим |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
( 3/ 2)(3 1) 8 . |
(6) |
||||||||||
Уравнение (6) представляет уравнение Ван-дер-Ваальса в безразмерных параметрах и в определенном смысле является универсальным для всех веществ.
|
|
Если положить =12, =1/2, то согласно уравнению (6) |
|||||
|
|
|
|
|
|
1,5. |
|
p |
|
|
|
|
|
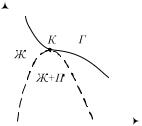
6.343. На рисунке показаны: |
|
|
|
|
|
|
критическая изотерма, точка К |
||
|
|
|
|
||||
|
|
|
|
|
|
критического состояния вещества |
|
|
|
|
|
|
|
и пунктирная кривая, участок «a» |
|
|
|
|
П |
|
|
которой соответствует |
жидкой |
|
|
a |
b |
|
|
фазе вещества, участок «b» - пару |
|
|
|
|
|
|
|
жидкости. |
|
0 |
|
|
V |
Из рисунка видно, |
что наи- |
||
больший объем, занимаемый жидкой фазой и наибольшие давление насыщенных паров дости-
гаются |
|
вблизи |
критической |
точки |
К. |
Поэтому |
|||
V |
ж.max |
|
m |
3b |
3bm |
, где m – масса, M – молярная масса веще- |
|||
|
M |
||||||||
|
|
M |
|
|
|
|
|||
ства, |
pнас.max pk a/27b2 . |
|
|
|
|||||
|
|
Для воды |
M 18 10 3кг/ моль, m=1 кг , |
|
|
||||
|
|
|
|
|
|
314 |
|
|
|

a 0,554 Па м2 , b 30 10 6 м3 / моль, V 5,01л,
моль2 |
ж.max |
|
|
pнас.max 230атм. |
|
6.344. Постоянные Ван-дер-Ваальса для углекислого газа
(CO2 : М=44 10-3 кг/моль) равны:
a 0,367 Па м2 , b 43 10 6 м3 / моль,
моль2
По этим данным получим:
Tk 8a/27Rb 8 0,367/(27 8,31 43 10 6) 300K ;
Vk 3b 1,29 10-4 м3 .
Плотность газа в критическом состоянии
|
|
|
|
k |
|
M |
|
18 10 3 |
0,34 |
г |
. |
|
|
||
|
|
|
V |
|
|
cм3 |
|
|
|||||||
|
|
|
|
|
|
1,29 10 4 |
|
|
|
|
|||||
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
6.345. Из соотношений T 8a/27Rb и p |
k |
a/27b2 |
на- |
||||||||||||
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
||
ходим: b |
RTk |
, |
V 3b= |
3RTk |
. В |
Критическом состоянии |
|||||||||
|
|||||||||||||||
|
8pk |
k |
|
|
|
|
8pk |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
моль эфира занимает пространство сосуда объемом Vk . При комнатной температуре один моль жидкого эфира занимает объем Vж M / , где М – молярная масса, - плотность жид-
кого эфира. Жидкий эфир при комнатной температуре занимает часть объема сосуда, равную
Vж 8Mpk .
V 3 RTk |
|
Для эфира М = 74 г/моль, = 0,72 г/см3, |
pk 35,5атм, |
Tk 467K . По этим данным |
|
315 |
|

8 74 10 3 35,5 105 0,25. 3 0,72 103 467
6.346. Приведем уравнение Ван-дер-Ваальса для моля некоторого вещества:
(p |
a |
)(V b) RT , |
(1) |
|
|||
|
V2 |
|
|
где V VM (значок M опущен).
Для произвольной заданной температуры из уравнения
(1), получим зависимость |
|
|
p f (V,Ti |
const), |
(2) |
которую назовем изотермой уравнения (1) (изотермой |
Ван- |
|
дер-Ваальса). Как следует из основного уравнения (1), для ря-
да фиксированных температур Ti на плоскости p–V будем иметь семейство кривых (изотерм Ван-дер-Ваальса). Вид той
|
|
|
|
|
|
или иной изотермы зависит от |
||||
p |
|
A |
|
|
|
значения выбранной температу- |
||||
|
|
|
|
ры Ti . Составить представление |
||||||
|
|
T const |
|
|
||||||
|
|
|
|
о различии изотерм (2) для раз- |
||||||
|
|
|
4 |
|
|
|||||
|
|
3 |
5 |
|
ных температур можно с помо- |
|||||
|
1 |
II |
|
|||||||
|
I |
|
B |
щью изобарных сечений. |
Для |
|||||
|
|
2 |
|
|
|
температур |
Ti Tk |
каждая |
из |
|
|
|
|
|
|
|
изотерм |
пересекается с любой |
|||
0 |
|
|
|
V |
||||||
|
|
|
|
|
|
изобарой |
в |
одной |
точке. |
Для |
температур Ti |
Tk |
- в трех точках. Один из таких случаев при- |
||||||||
веден на рисунке. |
|
|
|
|
|
|
|
|||
|
Изотермы для температур выше критической (Ti Tk |
) по |
||||||||
своему виду хорошо согласуется с реальными изотермами га-
316
за. Изотермы для Ti Tk существенно отличаются от экспери-
ментальных изотерм реального газа. Участок 2–4 изотермы Ван-дер-Ваальса (см.рис.) характеризуется тем, что на нем давление растет с увеличением объема. Понятно, что ни в одной из точек этого участка система не может находиться в устойчивом равновесии – малейшие флуктуации плотности должны самопроизвольно усиливаться. Поэтому область 2–4 не может устойчиво существовать. В областях А–1–2 и 4–5–В давление с увеличением объема падает и, следовательно, соответствующие состояния могут существовать физически. Возникает вопрос: как же система может перейти из первой области во вторую, если промежуточная область 2–3–4 является абсолютно неустойчивой?
Как показывают опыты, система осуществляет этот переход через двухфазное состояние, причем изотерма в этом переходе горизонтальна (отрезок 1–3–5). Снова возникает вопрос, на каком уровне провести эту прямую?
Переход из состояния (1) в состояние (5) можно осуще-
ствить как по изотерме 1–4–5, так и по изотерме |
1–2–4– |
5. Энтропия в состояниях 5 и 1 имеет определенные значения. Изменения энтропии по первому или второму обратимому пути должны быть равными т.е.
|
|
Q |
|
|
Q |
|
|
|
|
|
|
|
. |
|
(3) |
||
|
T |
T |
|
|||||
1 3 5 1 |
|
1 2 4 5 1 |
|
|
||||
Принимаем во внимание, |
что T1 const , |
Q dU pdV |
||||||
из (3) находим |
|
|
|
|
|
|
|
|
U(5) U(1) |
pdV U(5) U(1) |
pdV . |
(4) |
|||||
|
1 3 5 |
|
|
|
1 2 4 5 |
|
||
Следовательно, горизонтальная прямая 1-3-5 должна быть проведена так, чтобы выполнялось равенство
317
pdV |
pdV , |
(5) |
1 3 5 |
1 2 4 5 |
|
означающее, что площади по кривой 1-2-4-5 и прямой 1-3-5 должны быть одинаковыми или что то же самое, работа при переходе по двум путям должна быть одинаковой. Это возможно в тм случае, если площади областей I и II (см.рис.) одинаковы.
6.347. Процессы кристаллизации и плавления твердых тел относят к фазовым переходам первого рода. Фразовые переходы происходят при определенных условиях, характеризуемых значениями температуры и давления. В процессе плавления (кристаллизации) температура остается постоянной. Температура плавления зависит от давления, а само вещество представляет собой двухфазную систему, проходящую последовательность равновесных состояний.
Не рассматривая механизмы кристаллизации и плавления, скажем, что вещество при определенных условиях может оказаться в состоянии неустойчивого равновесия (метастабильном состоянии). Это например, переохлажденная жидкость. Жидкость с высокой степенью чистоты может длительно находиться в метастабильном состоянии. При возникновении каких-либо флуктуаций (плотности, зарядов и др.) жидкость очень быстро переходит из метастабильного состояния в двухфазное состояние, практически адиабатическое.
В данной задаче рассматривается переход переохлажденной воды в систему лед-вода. Поскольку давление нормальное,
превращение переохлаждений t0 0 C .
Пусть масса переохлажденной воды до температуры t 20 C равна m, теплота плавления q, масса образовавшегося льда m1.
318
Для спонтанного перехода воды из метастабильного состояние в двухфазное равновесное состояния можно написать:
Q 0 dU pdV или dU pdV 0.
Изменениями объемов воды и льда, а, следовательно, и работой можно пренебречь. Тогда рассматриваемый процесс можно охарактеризовать изменением внутренней энергии системы, т.е.
cm(0 t) qm1 0 .
Отсюда находим отношение
m1 ct . m q
Для льда q 333Дж/ г , воды c 4,18 Дж/г К.
При t 20 C отношение
m1 4,18 20 0,25. m 333
6.348. Процесс плавления или кристаллизации твердого тела представляется как направленная последовательность равновесных состояний. Две любые фазы вещества могут находиться в равновесии при определенном давлении, величина которого зависит от температуры. Общий вид этой зависимости устанавливается уравнением Клапейрона-Клаузиуса
|
dp |
|
|
q12 |
|
||
|
|
|
|
|
|
. |
(1) |
|
dT |
|
|
|
|||
|
|
T(V2 |
V1) |
|
|||
Здесь за положительное |
направление отсчета |
принято |
|||||
направление перехода от правой фазы вещества ко второй. То-
гда и V1 и |
V2 |
- удельные объемы первой и второй фаз соот- |
||
ветственно; |
q12 |
q |
- при плавлении q12 0 |
(q12 q ) и при |
|
|
|
319 |
|

