
2683
.pdf

Поэтому m m |
(V |
V)/V |
|
pM |
V V . |
||||
|
|||||||||
2 0 |
0 |
|
0 |
|
RT |
0 |
|||
Итак, масса жидкой фазы |
|
|
|
|
|||||
|
m |
|
|
pM |
(V V), |
(7) |
|||
|
|
|
|||||||
|
|
2 |
|
RT |
0 |
|
|
||
где p – давление насыщенного пара при T 373K. Подставляя числовые значения известных величин, на-
ходим
m2 101,3 103 18 10 3 3,4 10 3 кг 2 10 3 кг 2г. 8,31 373
6.329. Пусть V0 есть начальный объём насыщенного па-
ра некоторого вещества; m1,V1 – масса и объём пара после сжатия, m2 ,V2 – масса и объём образовавшейся жидкости, m – масса вещества.
Напишем очевидные равенства:
m1 m2 m,V1 V2 V , где V V0  n, n 1;
n, n 1;
|
|
|
|
|
|
pV |
m |
|
RT , pV |
|
m1 |
RT , |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
0 |
|
|
M |
1 |
|
|
M |
|
|
||||||||||||||
где p pH |
– давление насыщённого пара при T const. Из |
||||||||||||||||||||||||||||
этих соотношений следует: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
V0 |
|
m |
|
V0 |
|
m1 m2 |
1 |
m2 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
V1 |
|
|
m1 |
|
|
|
V1 |
m1 |
|
|
|
|
|
|
m1 |
. |
|||||||||
|
V |
V |
V' |
|
|
|
V |
V' |
|
|
V |
||||||||||||||||||
|
|
|
|
|
|
V |
|||||||||||||||||||||||
|
|
0 |
1 |
|
2 |
|
2 |
|
1 |
2 |
|
1 |
|
0 |
1 N |
2 |
|
||||||||||||
|
|
|
V V' |
V |
|
|
V |
||||||||||||||||||||||
|
|
V |
|
|
|
|
|
V' |
|
|
|
V |
|||||||||||||||||
|
1 |
|
|
|
1 |
|
1 |
|
1 |
2 |
1 |
|
|
|
1 |
|
|||||||||||||
Здесь V2' и V1' – удельные объёмы жидкости и пара при заданной температуре.
Далее представим последовательность действий:
302

|
|
|
n(V1 V2) |
1 N |
V2 |
|
|
(n 1) (N n) |
V2 |
|
||||||||||||||||||
|
|
|
|
V1 |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
V1 |
|||||||||
|
V2 |
|
|
n 1 |
|
V2 |
|
|
n 1 |
|
V V2 |
|
N n |
. |
||||||||||||||
V1 |
|
|
|
|
|
|
N n |
|
|
|
|
|
||||||||||||||||
|
|
N n |
V V2 |
|
|
|
|
|
V2 |
n 1 |
||||||||||||||||||
|
|
|
|
V |
|
N n |
1 |
N 1 |
|
V2 |
|
n 1 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
V2 |
n 1 |
|
|
|
|
n 1 |
|
|
V N 1 |
|||||||||||||||
В том случае, когда точка состояния системы соответствует середине горизонтального участка на диаграмме p – V, согласно правилу рычага m1 m2.
Это уравнение даёт:
|
V |
2 |
V' V V' V V |
2 |
V' |
V' |
N и |
|||||||
|
|
2 |
1 |
1 |
1 |
1 |
2 |
|
|
|||||
|
V V2 |
N |
V |
N 1 * |
V2 |
|
1 |
|
||||||
|
|
|
N 1 |
|||||||||||
|
V2 |
|
|
V2 |
|
|
|
|
V |
|
|
|||
6.330. Из термодинамического соотношения dS Q/T следует, что приращение энтропии системы при испарении жидкости равно
S S2 S1 |
Q/T . |
|
(1 2) |
Для кипящей жидкости температура жидкости равна температуре кипения TK , т.е.T TK , причём T const при внешнем давлении p p0 const. Тогда
|
S |
1 |
m qdm qm/TK , |
|
|
TK |
|||
|
|
0 |
|
|
где q- удельная |
теплота |
парообразования. Для воды |
||
q 2,25МДж/кг К , |
|
при |
p p0 1атм 105 Па |
|
ТК 100о С 373К. Если m=1 кг, то
S 2,25 106 1/373 6кДж/К.
При кипячении воды количество пара увеличивается и при p=const пар расширяется и совершает работу
303

A p V p0V , где V mRT . Следовательно A mRT/M ,
Mp0
где T TK 373K . На основании первого начала термодинамики получим приращение внутренней энергии системы:
U T S A qm mRT /M m(q RT /M).
U 1(2,25 106 8,31 373/18 10 3) 2,1МДж.
6.331. Для нагревания воды |
в количестве |
m=20г от |
||
0о С до |
температуры |
кипения |
потребуется |
теплота |
Q cm T 4,18 103 20 10 3 100 8,36кДж. |
Выходит, |
1 |
|
чтоQ Q1 и, следовательно вода в заданном количестве нагре- |
|
ется до температуры кипения TK 373K , а затем при постоян- |
|
ном внешнем давлении p pатм. p0 установится динамиче-
ское равновесие, если прекратить подачу тепла.
В ходе испарения воды при кипении пар совершает работу A p0Sh, где h – высота подъёма невесомого поршня. По энергетическому балансу
Q mc T qm1 p0Sh , |
(1) |
где m1 - масса испарившейся воды (масса пара). Из уравнения состояния пара по идеальному варианту при T TK следует,
что m1 p0VM /RTK . Тогда уравнение (1) получит вид
|
Q mc T ( |
qM |
1)p0Sh. |
(2) |
|||||
|
RTK |
||||||||
|
|
|
|
|
|
|
|
|
|
Из (2) находим: |
|
|
|
|
|
|
|
||
|
h |
|
Q mc T |
|
RT |
K |
. |
(3) |
|
|
|
|
|
|
|||||
|
|
p0S(qM RTK ) |
|
|
|||||
В |
заданных |
условиях |
|
qM=40,5 |
кДж/моль, |
||||
RTk 3,1кДж/моль. В |
связи с |
этим можно |
положить |
||||||
qM RTK |
qM и |
|
|
|
|
|
|
|
|
|
|
|
304 |
|
|
|
|
|
|
|
h |
Q mc T |
RT . |
(4) |
|
|
|
||||
|
|
p0SqM |
K |
|
|
|
|
|
|
||
Численно |
|
|
|
|
|
h |
20 103 |
8,36 103 |
|
м 20см. |
|
105 440 10 4 2,25 106 18 10 3 |
|||||
6.332. Примем следующие обозначения исходных и расчетных величин:
m0 ,T - начальные значения массы и температуры водяно-
го пара. Поскольку давление насыщенного пара равно атмосферному(p pатм. 105 Па), температура пара
T 100 237 273K.
m,T0 - масса и температура введённой в сосуд воды.
m-масса сконденсировавшегося водяного пара при завершении процесса.
Для построения физической модели процесса предварительно сделаем оценки значений некоторых величин.
1) Предположим, что введённая в сосуд холодная вода нагревается от температуры Т0 22 273 295К до темпера-
туры T=373K. Для этого потребуется теплота, равная
Qcm(T T0 ) 4,18 1 (373 295)Дж 326Дж.
2)Допустим, что весь содержащийся насыщенный пар
при t0 1000C сконденсировался. При этом должна выделиться энергия, равная qm0 2250 1 2250Дж.
Из оценок 1) и 2) видно, что холодная вода нагреется до температуры пара за счёт теплоты, выделившейся при конденсации части пара (точнее m m 1
m 1 7 ). При этом температура системы в целом будет равна T (температуре начального состояния пара). Образная картина процесса показана на рисунке.
7 ). При этом температура системы в целом будет равна T (температуре начального состояния пара). Образная картина процесса показана на рисунке.
305
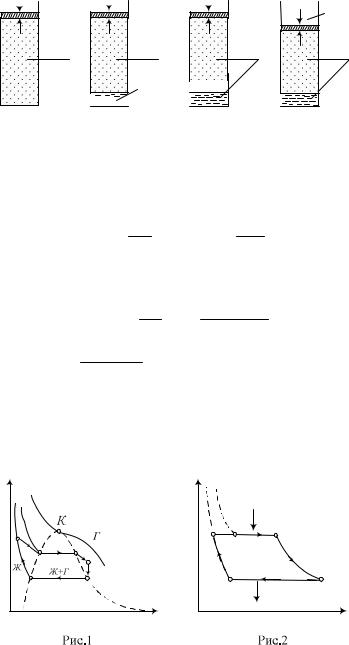
а) |
б) |
в) |
г) |
||
|
p |
|
p |
|
p |
|
|
|
|||
|
0 |
|
0 |
|
0 |
|
p0 |
p |
V |
p0 |
0 |
|
|
p0 |
p0 |
Т=373 К |
Т=373 К |
Т=373 К |
Т=373 К |
пар пар
T0 295K |
|
V |

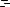



 вода
вода
Отсюда следует, что cm(T T0 ) q m, т.е.
m cm(T T0 )/q.
Из уравнений состояния водяного пара в рамках его идеализации имеем:
p V m RT V m RT. M pM
Следовательно, работа, совершённая над системой силой атмосферного давления, будет равна
A p V m RT cm(T T0 ) RT
MqM
4,18 1 78 8,31 373(Дж) 25Дж. 2250 18
6.333. На рис.1 представлен обратимый цикл 12341 тепловой машины, рабочим веществом которой, является вода. Изотермические участки А-В-2 и 3-4 цикла соответствуют
p |
|
|
|
p |
|
|
|
|
|
|
|
A |
Q1 |
1 |
T1 |
|
|
1 |
B |
|
A |
|
|
|
|
T1 |
|
B |
2 |
|
|
4 |
|
|
|
|
П |
|
|
3 |
|
4 |
T2 |
3 |
|
|
Q2 |
|
|
|
T2 |
||||
0 |
|
|
V |
0 |
|
V |
306

двухфазным состояниям вещества (вода-пар). Участки 1-А и 4- 1 совместно не могут быть изотермическими, поскольку они пересекаются в точке 1. Однако приближенно, последние будем считать изотермическими для жидкой фазы при температурах T1 и T2 . Участок 2-3 так же не есть изотермический и вместе с участком В-2 описывает парообразное состояние вещества.
Изменением объёмов жидкой фазы 1-А и 4-1 в ходе процессов, как нагрева, так и охлаждения, можно пренебречь.
На основании сделанных замечаний мы можем перейти к приближенному циклу тепловой машины, приведённому на рис.2.
На ломаном участке 1-А-В-2 цикла энтропия получает приращение, равное
S1 Q/T |
Q/T q1m/T1. |
|
A B |
На изотермическом участке 3-4 приращение энтропии равно
S2 Q/T2 q2m/T2.
3 4
Здесь q1 и q2 - значения удельной теплоты парообразования жидкости при температурах Т1 и Т2 соответственно.
В ходе адиабатических процессов В-3 и 4-3 энтропия не изменяется.
Полное изменение энтропии за обратимый цикл равно нулю. Следовательно,
S1 S2 m(q1 q2 ) 0.
T1 T2
Отсюда имеем q1 (T1 /T2 )q2 (T1 /T2 )q, где q q2. Работа, совершённая телом за цикл А Q1 Q2' , где Q1 -
теплота, полученная телом от нагревателя, Q2' - теплота, от-
данная холодильнику. В данном случае Q1 mq1 , Q2' mq2 и, следовательно,
307

A m(q q |
|
) m( |
T1 |
q |
|
q2) mq( |
T2 |
1). |
|
|
T |
|
|
||||||
1 |
2 |
|
|
|
2 |
|
T |
||
|
|
2 |
|
|
|
1 |
|
||
Итак, в конечном виде искомая работа равна |
|||||||||
|
|
A mq( |
T1 |
1). |
|||||
|
|
T2 |
|||||||
|
|
|
|
|
|
|
|
||
6.334. Вполне насыщенный водяной пар при температуре Т=300К можно считать идеальным газом. Тогда давление на-
сыщенного пара |
pH H RT /M , где H |
- плотность пара. По |
||||||||||
условию |
/ H |
, т.е. |
|
4 H |
|
M |
или |
d |
4 M |
, |
||
|
|
H RT |
|
|||||||||
где - плотность воды. |
|
d |
|
RT |
||||||||
|
|
|
|
|
|
|
|
|
||||
Для |
воды |
|
73 10 3 Н / м , |
М 18 10 3 кг/ моль, |
||||||||
1 103 кг/ м3 , следовательно, диаметр капли |
|
|
|
|||||||||
|
|
|
4 73 10 3 18 10 3 |
|
|
|
|
|||||
|
d |
|
|
|
|
|
0,24мкм. |
|
|
|
||
|
1 10 2 |
|
|
|
|
|
|
|
||||
|
|
|
103 8,31 300 |
|
|
|
|
|||||
6.335. Концентрация молекул насыщенного пара при температуре Т n pH /kT , где pH - давление пара. Число молекул пара, попадающих на единичную площадку поверхности жидкости в единицу времени, равно
N 0,25n ,
где < > 
 8kT / m - средняя скорость молекул пара, m – масса молекулы.
8kT / m - средняя скорость молекул пара, m – масса молекулы.
По условию задачи число молекул, задерживаемых поверхностью, равно
N' N 0,25 n .
При динамическом равновесии число молекул, вылетающих за единицу времени с единичной поверхности жидкости, так же равно N’. Масса всех этих N’ молекул
|
|
mN' 0,25 n |
|
|
|
|
|
||||||||
|
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,25 m |
|
|
p |
|
|
m |
|
p |
|
|
M |
. |
|||
|
8kT / m |
H |
H |
||||||||||||
kT |
2 kT |
|
|||||||||||||
|
|
|
|
|
|
2 RT |
|||||||||
|
|
308 |
|
|
|
|
|
|
|
|
|
|
|||

При температуре t0 1000C давление pH pатм. p0.
Т.о.,
p0 
 M /2 RT .
M /2 RT .
Для Т=373К и 0,036 величина
3,6 10 3 105 
 18 10 3 /2 8,31 373 0,35 г/с см2 .
18 10 3 /2 8,31 373 0,35 г/с см2 .
6.336. Предлагается двухфазная система металл – насыщенный пар металла, в которой протекает неравновесный процесс при определённой температуре Т, выражающийся в уменьшении числа атомов твёрдой фазы металла. Испаряющиеся атомы металла, переходя в газообразное состояние осаждаются на внутренних стенках вакуумированного баллона.
Давление насыщенного пара металла в вакуумированном баллоне в конечном итоге найдём по формуле: pH nkT , где n
– установившаяся концентрация атомов в пространстве баллона. Концентрацию атомов n найдём, исходя из следующих соображений.
При отсутствии осаждения металла на стенках баллона в свободном пространстве установилась бы определённая концентрация атомов, которую можно было бы назвать фоновой. Однако, вследствие непрерывного прилипания атомов к стенкам баллона, в пространстве возникает направленный поток атомов от поверхности металла к стенкам сосуда. Поток атомов металла очень слабый. По известной потере массы еди-
ничной поверхностью металла за единицу времени, |
равной , |
плотность потока атомов у этой поверхности равна |
~ |
j M /m , |
где ~- масса атома. m
Теперь допустим, что поток представляет собой параллельный пучок атомов, падающий на единичную площадку стенки баллона. За единицу времени на эту площадку будет падать N 0,25n атомов.
309

В стационарном режиме должно выполняться равенство
~
/m 0,25n , где < > - средняя скорость теплового движения атомов. Отсюда получаем
4
n ~ , m
а затем выражение для давления насыщенного пара металла:
|
|
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
2 kT |
|
|
|
2 RT |
|
|
|
|||||
pH nkT kT |
|
m |
|
|
|
|
. |
|||||||||
~ |
|
8kT |
|
|
~ |
|
M |
|||||||||
|
m |
|
|
|
|
m |
|
|
|
|
|
|||||
Для вольфрама при Т=2 103 К |
и |
|
1,2 10 13 г/с см2 |
|||||||||||||
давление |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
pH 1,2 10 12 |
|
2 8,31 2 103 |
|
(Па) 0,9нПа. |
|
|
||||||||||
|
|
184 10 3 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
6.337. Представим жидкость (в данном случае воду) как сверхплотный газ частиц. Состояние газа при большом давлении приближённо определим уравнением Ван-Дер-Ваальса
a
(p VM2 )(VМ b) RT.
Поправка p a/VM2 обусловлена силами притяжения между молекулами газа. Между молекулами жидкости силы притяжения уравновешиваются силами отталкивания. Если виртуально выключить силы притяжения между молекулами жидкости, останутся только силы отталкивания, которые приведут к резкому скачку давления жидкости на стенки сосуда на
величину |
p a/VM2 . |
Для |
газа |
H2O |
|
a 0,554 |
Па м2 |
,VM 18 10 6 кг/ моль, |
|
|
|
моль2 |
|
|
|||
|
|
|
|
|
|
p 1,7 109 Па 1,7 104 атм.
6.338. Если уравнение Ван-Дер-Ваальса распространить на жидкости, то поправка a/VM2 определяет «внутреннее дав-
310
