
- •Пищевая инженерия производства жировой продукции
- •Введение
- •1. Пищевая ценность и качество пищевых продуктов
- •1.1. Пищевая ценность
- •Коэффициенты энергетической ценности
- •Энергетическая ценность нутриентов
- •Калорийность некоторых пищевых продуктов
- •1.2. Качество пищевых продуктов
- •2. Основы питания
- •2.1. Физиологическая потребность человека в пище
- •2.2. Основы сбалансированного питания
- •Формула сбалансированного питания
- •2.3. Основы адекватного питания
- •2.4. Основы рационального питания
- •2.4.1. Баланс энергии
- •Нормы энергозатрат для групп работающих в различных условиях
- •2.4.2. Потребность организма в пищевых веществах
- •Нормы физиологической потребности населения в основных пищевых веществах
- •Нормы физиологических потребностей в некоторых пищевых и биологически активных веществах для человека (1859 лет)
- •2.4.3. Режим приема пищи
- •Рекомендуемые размеры потребления пищевых продуктов в среднем на душу населения России
- •3. Белковые вещества
- •3.1. Строение и свойства белков
- •3.1.1. Основные свойства белков
- •3.1.2. Аминокислоты
- •Строение и некоторые свойства аминокислот
- •3.2. Классификация белков
- •3.2.1. Простые белки (протеины)
- •3.2.2. Сложные белки (протеиды)
- •3.3. Пищевая ценность белков
- •3.3.1. Нормы потребления белков
- •Массовая доля белков в некоторых пищевых продуктах, %
- •3.3.2. Биологическая ценность белков
- •Амикислотная шкала для расчета аминокислотного скора фао/воз
- •3.3.3. Характеристика белков сырья пищевых продуктов
- •3.4. Ферменты
- •3.4.1. Классификация ферментов
- •3.4.2. Номенклатура выпускаемых ферментных препаратов
- •3.4.3. Основные способы производства ферментных препаратов
- •4. Углеводы
- •4.1. Моносахариды
- •4.2. Сахароподобные полисахариды (олигосахариды)
- •4.3. Полисахариды, не обладающие свойствами сахаров
- •4.4. Превращения углеводов при производстве пищевых продуктов.
- •4.4.1. Гидролиз ди- и полисахаридов
- •4.5. Значение углеводов в питании
- •5. Липиды
- •5.1. Жирные кислоты
- •5.1.1. Насыщенные жирные кислоты
- •Основные характеристики и свойства некоторых насущенных жирных кислот
- •5.1.2. Ненасыщенные жирные кислоты
- •5.1.2.1. Жирные кислоты олеинового ряда
- •Основные характеристики и свойства некоторых жирных кислот олеинового ряда
- •5.1.2.2. Полиолефиновые кислоты
- •5.1.2.3. Ацетиленовые (алкиновые) кислоты
- •5.1.2.4. Жирные кислоты с дополнительными кислородсодержащими функциональными группами
- •5.1.3. Структура молекул жирных кислот
- •5.1.4. Физические свойства жирных кислот
- •5.2. Вещества, сопутствующие жирам
- •5.2.1. Свободные жирные кислоты
- •5.2.2. Фосфолипиды
- •5.2.2.1. Эфирные фосфатиды
- •5.2.2.2. Жирные кислоты фосфатидов
- •5.2.3. Общие свойства фосфатидов
- •5.2.4. Стеролы и стериды
- •5.2.5. Воски
- •5.3. Пищевая ценность жиров
- •5.4. Биологическая ценность жиров
- •5.5. Биохимические и физико-химические изменения жиров
- •5.6. Окислительная порча жиров
- •6. Витамины
- •6.1. Водорастворимые витамины и витаминоподобные вещества
- •6.2. Жирорастворимые витамины и витаминоподобные вещества
- •Биологическая активность изомеров токоферолов
- •Содержание различных изомеров токоферолов в % от их общего количества
- •6.3. Антивитамины
- •7. Фенольные соединения
- •8. Нуклеиновые кислоты
- •8.1. Пурины и пиримидины
- •8.2. Состав и свойства нуклеиновых кислот
- •9. Минеральные вещества
- •9.1. Макроэлементы
- •9.2. Микроэлементы
- •9.3. Токсичные минеральные вещества
- •9.4. Вода в пищевых продуктах
- •9.4.1. Строение молекулы воды
- •9.4.2. Структура и свойства льда
- •9.4.3. Свободная и связанная влага в пищевых продуктах
- •9.4.4. Взаимодействие «вода – растворенное вещество»
- •9.4.5. Жесткость воды
- •9.4.6. Активность воды
- •10. Метаболизм пищевых веществ
- •10.1. Основы пищеварения
- •10.2. Биологическое окисление
- •10.3. Метаболизм основных продуктов распада макронутриентов
- •10.3.1. Метаболизм сахаров
- •10.3.2. Метаболизм жирных кислот
- •10.3.3. Метаболизм аминокислот
- •10.4. Взаимопревращения жиров, аминокислот и углеводов
- •10.5. Биосинтез в процессах метаболизма
- •10.5.1. Синтез гликогена
- •10.5.2. Синтез жирных кислот
- •10.5.3. Превращение жирных кислот в жиры
- •10.5.4. Синтез белков
- •11. Пищевые добавки
- •Функциональные классы пищевых добавок
- •11.1. Пищевые красители
- •Основные натуральные и синтетические пищевые красители
- •11.2. Вещества, изменяющие консистенцию
- •11.2.1. Загустители и студнеобразователи
- •11.2.2. Эмульгаторы и стабилизаторы
- •11.3. Ароматические вещества
- •Ароматические вещества некоторых пищевых продуктов
- •Ароматические вещества
- •11.4. Подсластители
- •Свойства основных подсластителей
- •Максмально применяемая массовая доля подсластителей в продуктах. Мг/кг
- •11.5. Химические консерванты
- •Ориентировочные дозы внесения взаимозаменяемых консервантов в пищевые продукты, г/100 кг продукта
- •11.6. Антиоксиданты и их синергисты
- •11.7. Ферментные препараты
- •12. Природные токсиканты и загрязнители
- •12.1. Природные токсиканты
- •12.2. Загрязнители
- •12.2.1. Пестициды
- •12.2.2. Токсичные элементы
- •12.2.3. Радиоактивные загрязнения
- •12.2.4. Микотоксины
- •12.2.5. Канцерогенные вещества
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Б.А. Рогов пищевая инженерия производства жировой продукции Справочное пособие
6.2. Жирорастворимые витамины и витаминоподобные вещества
К жирорастворимым витаминам относятся витамины групп А, D, Е и К.
Ретинол (витамин А). Витамины группы А (аксерофлоты) являются витаминами роста. Они, кроме того, предохраняют от ослабления зрения (ксерофтальмии). Отсутствие витаминов А в пище вызывает также понижение стойкости организма к заболеваниям.
Витамины А в растительных объектах не обнаружены. Они встречаются исключительно в животных тканях и в продуктах животного происхождения. Витамины А образуются при действии фермента каротиназы на каротины, которые попадают в организм животных вместе с пищей. Превращение каротина в витамин А1 происходит в результате разрыва углеродной цепи с одновременным присоединением элементов воды по месту разорвавшейся двойной связи. Из β-каротина образуется две молекулы витамина А1 по схеме, изображенной на следующей странице.
Таким образом, витамин А1 является ненасыщенным спиртом и поэтому способен образовывать с органическими кислотами соответствующие эфиры (ацетат, пальмитат, стеарат и др.).
Витамин А1 – кристаллическое вещество светло-желтого цвета. Его эфиры растворяются в маслах и в большинстве органических растворителей. В воде они нерастворимы.
Индивидуальный витамин А1 легко разрушается при окислении и каталитическом гидрировании, особенно при повышенных температурах. При окислении на воздухе из витамина А1 получается героновая кислота.
Н3С
СН3
Н3С
СН3
С
СН3 СН3
СН3
СН3 С
│ │
│ │
Н2С
С–СН=СНС=СНСН=СНС=СНСН
= СНС=СНСН=СНС
=СН–С
СН2 +
│ ║
║ │ Н2С
С
С СН2
СН2 СН3
Н3С
СН2
β-каротин
Н3С
СН3
С
СН3 СН3
│
│
+
2Н2О
2 Н2С С–СН=СНС=СНСН=СНС=СНСН2ОН
│ ║
Н2С
С
СН2
СН3СН3 витамин
А1
Н3С
СН3
С
Н2С
СООН
│ ║
Н2С
СООН
СН2
героновая кислота
Значительно лучше витамин А1 сохраняется в масляных растворах и виде водных суспензий.
В природе, кроме витамина А1, в свободном и этерифицированном состоянии встречаются витамин А2 и так называемый неовитамин А.
Витамин А2 был открыт в печени пресноводных рыб. В отличие от витамина А1, он имеет шесть двойных связей. Этот витамин образует желтые игольчатые кристаллы. Неовитамин А является стереоизомером витамина А1, по биологическому действию аналогичен витамину А1. Содержание его в печеночных жирах рыб доходит до 30 % от общего количества витаминов группы А. Витамин А2 имеет следующее строение


Н3С
СН3
С
СН3
СН3
│
│
Н2
С С – СН =
СНС =
СНСН =
СНС =
СНСН2ОН
│ ║
НС С
СН
СН3

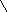
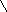
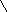
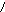

Для обогащения пищевых жиров растительного происхождения применяются растворы синтетического кристаллического препарата ацетата витамина А1 в маслах, а также концентраты витаминов группы А, получаемые путем молекулярной дистилляции жиров из печени рыб и морских млекопитающих.
В
СН3
СН3
СН3
│
│
СН–СН
=
СН – СН – СН
Н3С
С
│ С СН3
│
С
С С
Н2С
│ │ │
С
║ С С—С
║
С
С С
│ │ ║
НО
– С С С
С
С
Витамин D2 (кальциферол) – бесцветные кристаллы, хорошо растворяющиеся в жирах и во многих органических растворителях и не растворяющиеся в воде. Как и всякий спирт, витамин D2 образует с органическими кислотами эфиры, в частности, ацетат, пропионат и олеат.
Важное значение по биологической активности также имеет витамин D3, образующийся при облучении 7-дегидрохолестерола.
СН3
СН3
│
СН–СН2–
СН2
– СН2
– СН
Н3С
С
│ С СН3
│
С
С С
Н2С
│ │ │
С
║ С С—С
║
С
С С
│ │ ║
НО
– С С С
С
С
Витамин D3 – бесцветное кристаллическое вещество, нерастворимое в воде, но хорошо растворяющееся в маслах и ряде органических растворителей. Биологическая активность у витаминов D2 и D3 одинакова.
При облучении 22-дигидроэргостерола образуется витамин D4
СН3
СН3 СН3
│
│
СН–СН2–
СН2 – СН – СН
Н3С
С
│ С СН3
│
С
С С
Н2С
│ │ │
С
║ С С—С
║
С
С С
│ │ ║
НО –
С С С
С
С
Витамин D4 отличается от витамина D2, как видно из формулы, отсутствием этиленовой связи в боковой цепи.
Витамин D5 образуется в результате действия ультрафиолетовой радиации на 7-дегидроситостерол. Витамины D4 и D5 обладают значительно более слабыми антирахитическими свойствами, чем витамины D2 D3.
Витамины группы D неустойчивы к действию кислорода и высоких температур.
Витамины группы Е являются веществами, регулирующими функции органов размножения. Они представляют собой высокомолекулярные циклические спирты, получившие название токоферолов. Они содержатся в разных количествах в растительных маслах. Особенно ими богаты масла зародышей пшеницы, кукурузы и других злаков. В растениях токоферолы чаще всего сопутствуют каротиноидам и хлорофиллам. В животных жирах токоферолы содержатся лишь в незначительных количествах, а в рыбьих жирах почти полностью отсутствуют.
В настоящее время известно восемь изомерных форм токоферолов: α-, β-, γ-, δ-, ε-, ζ-, ζ1- и η-токоферолы, имеющие общую структурную формулу:
 НО
НО
R
О СН3
В этой формуле R обозначает алифатический насыщенный или насыщенный углеводородный радикал. Цикл вместе с насыщенным радикалом
(СН2– СН2– СН2– СН)3 –СН3
│
СН3
называют токолом, а с ненасыщенным радикалом – токотриенолом.
(СН2– СН2– СН = С)3 – СН3
│
СН3
Токоферолы – маслянистые жидкости, застывающие при температуре 0°C. Взаимодействуя с нитробензойной и аллофановой кислотами токоферолы дают хорошо кристаллизующиеся эфиры, по температурам плавления которых можно идентифицировать изомерные формы токоферолов.
Температура плавления аллофанатов α-токоферола 161…162 °C; β-то-коферола 138…139 °C; γ-токоферола 136…137 °C.
Токоферолы хорошо растворимы в жирах и в большинстве органических растворителей, несколько хуже – в ацетоне. В воде они нерастворимы. К действию кислот и щелочей при невысоких температурах токоферолы устойчивы.
Биологическая активность токоферолов (табл. 6.1) зависит от числа метильных групп, от их положения в цикле и от строения алифатического радикала. По сравнению с другими изомерами α-токоферол обладает наибольшей биологической активностью, δ-токоферол – наименьшей. Правовращающие оптические изомеры проявляют более выраженные витаминные свойства по сравнению с рацемическими смесями.
Таблица 6.1
