
- •Пищевая инженерия производства жировой продукции
- •Введение
- •1. Пищевая ценность и качество пищевых продуктов
- •1.1. Пищевая ценность
- •Коэффициенты энергетической ценности
- •Энергетическая ценность нутриентов
- •Калорийность некоторых пищевых продуктов
- •1.2. Качество пищевых продуктов
- •2. Основы питания
- •2.1. Физиологическая потребность человека в пище
- •2.2. Основы сбалансированного питания
- •Формула сбалансированного питания
- •2.3. Основы адекватного питания
- •2.4. Основы рационального питания
- •2.4.1. Баланс энергии
- •Нормы энергозатрат для групп работающих в различных условиях
- •2.4.2. Потребность организма в пищевых веществах
- •Нормы физиологической потребности населения в основных пищевых веществах
- •Нормы физиологических потребностей в некоторых пищевых и биологически активных веществах для человека (1859 лет)
- •2.4.3. Режим приема пищи
- •Рекомендуемые размеры потребления пищевых продуктов в среднем на душу населения России
- •3. Белковые вещества
- •3.1. Строение и свойства белков
- •3.1.1. Основные свойства белков
- •3.1.2. Аминокислоты
- •Строение и некоторые свойства аминокислот
- •3.2. Классификация белков
- •3.2.1. Простые белки (протеины)
- •3.2.2. Сложные белки (протеиды)
- •3.3. Пищевая ценность белков
- •3.3.1. Нормы потребления белков
- •Массовая доля белков в некоторых пищевых продуктах, %
- •3.3.2. Биологическая ценность белков
- •Амикислотная шкала для расчета аминокислотного скора фао/воз
- •3.3.3. Характеристика белков сырья пищевых продуктов
- •3.4. Ферменты
- •3.4.1. Классификация ферментов
- •3.4.2. Номенклатура выпускаемых ферментных препаратов
- •3.4.3. Основные способы производства ферментных препаратов
- •4. Углеводы
- •4.1. Моносахариды
- •4.2. Сахароподобные полисахариды (олигосахариды)
- •4.3. Полисахариды, не обладающие свойствами сахаров
- •4.4. Превращения углеводов при производстве пищевых продуктов.
- •4.4.1. Гидролиз ди- и полисахаридов
- •4.5. Значение углеводов в питании
- •5. Липиды
- •5.1. Жирные кислоты
- •5.1.1. Насыщенные жирные кислоты
- •Основные характеристики и свойства некоторых насущенных жирных кислот
- •5.1.2. Ненасыщенные жирные кислоты
- •5.1.2.1. Жирные кислоты олеинового ряда
- •Основные характеристики и свойства некоторых жирных кислот олеинового ряда
- •5.1.2.2. Полиолефиновые кислоты
- •5.1.2.3. Ацетиленовые (алкиновые) кислоты
- •5.1.2.4. Жирные кислоты с дополнительными кислородсодержащими функциональными группами
- •5.1.3. Структура молекул жирных кислот
- •5.1.4. Физические свойства жирных кислот
- •5.2. Вещества, сопутствующие жирам
- •5.2.1. Свободные жирные кислоты
- •5.2.2. Фосфолипиды
- •5.2.2.1. Эфирные фосфатиды
- •5.2.2.2. Жирные кислоты фосфатидов
- •5.2.3. Общие свойства фосфатидов
- •5.2.4. Стеролы и стериды
- •5.2.5. Воски
- •5.3. Пищевая ценность жиров
- •5.4. Биологическая ценность жиров
- •5.5. Биохимические и физико-химические изменения жиров
- •5.6. Окислительная порча жиров
- •6. Витамины
- •6.1. Водорастворимые витамины и витаминоподобные вещества
- •6.2. Жирорастворимые витамины и витаминоподобные вещества
- •Биологическая активность изомеров токоферолов
- •Содержание различных изомеров токоферолов в % от их общего количества
- •6.3. Антивитамины
- •7. Фенольные соединения
- •8. Нуклеиновые кислоты
- •8.1. Пурины и пиримидины
- •8.2. Состав и свойства нуклеиновых кислот
- •9. Минеральные вещества
- •9.1. Макроэлементы
- •9.2. Микроэлементы
- •9.3. Токсичные минеральные вещества
- •9.4. Вода в пищевых продуктах
- •9.4.1. Строение молекулы воды
- •9.4.2. Структура и свойства льда
- •9.4.3. Свободная и связанная влага в пищевых продуктах
- •9.4.4. Взаимодействие «вода – растворенное вещество»
- •9.4.5. Жесткость воды
- •9.4.6. Активность воды
- •10. Метаболизм пищевых веществ
- •10.1. Основы пищеварения
- •10.2. Биологическое окисление
- •10.3. Метаболизм основных продуктов распада макронутриентов
- •10.3.1. Метаболизм сахаров
- •10.3.2. Метаболизм жирных кислот
- •10.3.3. Метаболизм аминокислот
- •10.4. Взаимопревращения жиров, аминокислот и углеводов
- •10.5. Биосинтез в процессах метаболизма
- •10.5.1. Синтез гликогена
- •10.5.2. Синтез жирных кислот
- •10.5.3. Превращение жирных кислот в жиры
- •10.5.4. Синтез белков
- •11. Пищевые добавки
- •Функциональные классы пищевых добавок
- •11.1. Пищевые красители
- •Основные натуральные и синтетические пищевые красители
- •11.2. Вещества, изменяющие консистенцию
- •11.2.1. Загустители и студнеобразователи
- •11.2.2. Эмульгаторы и стабилизаторы
- •11.3. Ароматические вещества
- •Ароматические вещества некоторых пищевых продуктов
- •Ароматические вещества
- •11.4. Подсластители
- •Свойства основных подсластителей
- •Максмально применяемая массовая доля подсластителей в продуктах. Мг/кг
- •11.5. Химические консерванты
- •Ориентировочные дозы внесения взаимозаменяемых консервантов в пищевые продукты, г/100 кг продукта
- •11.6. Антиоксиданты и их синергисты
- •11.7. Ферментные препараты
- •12. Природные токсиканты и загрязнители
- •12.1. Природные токсиканты
- •12.2. Загрязнители
- •12.2.1. Пестициды
- •12.2.2. Токсичные элементы
- •12.2.3. Радиоактивные загрязнения
- •12.2.4. Микотоксины
- •12.2.5. Канцерогенные вещества
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Б.А. Рогов пищевая инженерия производства жировой продукции Справочное пособие
3.1.2. Аминокислоты
Среди аминокислот белковых веществ найдены: моноаминомонокарбоновые кислоты, дикарбоновые аминокислоты, монокарбоновые диаминокислоты, осксиаминокислоты, аминокислоты, содержащие серу, гуанидокислоты, ароматические и гетероциклические аминокислоты. Строение и некоторые свойства природных аминокислот приведены в табл. 3.1. В данной таблице параметры приведены для L-формы аминокислоты. Удельное вращение [α] приведено для раствора в ледяной уксусной кислоте, если не указан другой растворитель.
Таблица 3.1
Строение и некоторые свойства аминокислот
|
Наименование аминокислоты |
Формула |
Свойства |
||
|
Температура плавления, ˚C |
Растворимость в воде при 25 ˚C, г/100г |
Удельное вращение, град/дм |
||
|
Моноаминомонокарбоновые кислоты |
||||
|
Аминоуксусная (гли цин) |
NH2–CH2–COOH
|
292 |
25 |
Не акт. |
|
α- Аминопропионовая (α- аланин) |
NH2–CH–COOH CH3 |
297 |
16,6 |
+33,0 |
|
α- Аминовалериановая (валин) |
NH2–CH–COOH | CH(CH3)2 |
315 |
8,85 |
+62,0 |
|
α- Аминоизокапроно вая (лейцин) |
NH2–CH–COOH | CH2CH(CH3)2 |
337 |
2,2 |
+22,5 |
|
α-Амино-β-этил- метилпропионовая (изолейцин) |
NH2–CH–COOH | CH3–CH–C2H5 |
284 |
4,12 |
+49,0 |
|
Дикарбоновые аминокислоты |
||||
|
Аминоянтарная (аспарагиновая) |
NH2–CH–COOH | CH2–COOH |
270 |
0,5 |
+25,4 . (5 н. HCl) |
|
α-Аминоглутаровая (глутаминовая) |
NH2–CH–COOH CH2–CH2–COOH |
249 |
0,84 |
+31.8 (5 н. HCl) |
Продолжение табл. 3.1
|
Наименование аминокислоты |
Формула |
Свойства |
||||
|
Температура плавления, ˚C |
Растворимость в воде при 25 ˚C, г/100г |
Удельное вращение, град/дм |
||||
|
Амид аминоянтарной кислоты (аспарагин) |
NH2–CH–COOH || CH2–CNH2 |
236 |
2,5 |
+34,3 (3,4 н. HCl) |
||
|
Амид аминоглутаровой кислоты (глутамин) |
NH2–CH–COOH || CH2–CH2 –CNH2 |
185 |
4,2 |
+6,1 (H2O)
|
||
|
Монокарбоновые диаминокислоты |
||||||
|
α-,ε- Диаминокапроновая (лизин) |
NH2–CH–COOH | CH2 / CH2–CH2 –CH2– NH2 |
– |
– |
+25,9 (5 н. HCl) |
||
|
Осксиаминокислоты |
||||||
|
α-Амино-β-окси-пропионовая (серин) |
NH2–CH–COOH \ CH2OH |
228 |
5,0 |
+15,1 (5 н. HCl) |
||
|
α-Амино-β-окси-масляная (треонин) |
NH2–CH–COOH | CH(OH)–CH3
|
253 |
20,5 |
–30,0 |
||
|
Аминокислоты, содержащие серу |
||||||
|
α-Амино-β-тиопро-пионовая (цистеин) |
NH2–CH–COOH | CH2SH |
178 хлоргид-рат |
– |
+13,0 |
||
|
ди-α-Амино-β-тио-пропионовая (цистин) |
NH2–CH–COOH | CH2–S | CH2–S | NH2–CH–COOH |
260 |
0,01 |
–232 (5 н. HCl) |
||
|
α-Амино-γ-метил-тиомасляная (метионин) |
NH2–CH–COOH | CH2–CH2–S–CH3 |
283 |
3,5 |
+20,0 |
||
Продолжение табл. 3.1
|
Наименование аминокислоты |
Формула |
Свойства |
|||||||
|
Температура плавления, ˚C |
Растворимость в воде при 25 ˚C, г/100г |
Удельное вращение, град/дм |
|||||||
|
Гуанидокислоты |
|||||||||
|
α-Амино-δ-гуани-динвалериановая (аргинин) |
NH2–CH–COOH | CH2 NH / || CH2–CH2–NH–C | NH2 |
238 |
15,0 |
+29,4 |
|||||
|
Ароматические аминокислоты |
|||||||||
|
|
NH2–CH–COOH | CH2– |
–
|
3,0 |
–7,5 |
|||||
|
|
NH2–CH–COOH | CH2– – OH
|
344 |
0,05 |
–10,0 (5 н. HCl) |
|||||
|
Гетероциклические аминокислоты |
|||||||||
|
|
NH2–CH–COOH | H2C–
│ NH |
282 |
1,14 |
–34,0 |
|||||
|
Пирролидин-α-кар- боновая (пролин) |
H2C–CH2 | | H2C CH–COOH \ / NH |
222 |
162 |
–80,0 |
|||||
Окончание табл. 3.1
|
Наименование аминокислоты |
Формула |
Свойства |
|||||||||
|
Температура плавления, ˚C |
Растворимость в воде при 25˚C, г/100г |
Удельное вращение, град/дм |
|||||||||
|
γ-Оксипирролидин-α- карбоновая (окси- пролин) |
НО–CН–CH2 | | H2C CH–COOH \ / NH |
270 |
36,1 |
–77,0 |
|||||||
|
ε-Амино-β-имидазол- пропионовая |
NH2–CH–COOH | H2C–C–N || || HC CH \ / NH |
277 |
4,3 |
+7,5 |
|||||||
Аминокислоты – бесцветные кристаллические вещества; они растворимы в воде, но нерастворимы в органических растворителях; имеют высокую температуру плавления, легко кристаллизуются. Аминокислоты содержат одновременно основную (аминную) NH2 и кислую (карбоксильную) COOH –группы.
Аминокислоты могут быть нейтральными, кислыми и основными, о чем можно судить по их изоэлектрической точке. Для рассмотренных 22 аминокислот она меняется от 2,77 для аспарагиновой кислоты до 10,76 для аргинина. Аминокислоты являются амфолитами: они способны взаимодействовать в растворах как с кислотами, так и со щелочами. Аминокислоты содержат асимметрический атом углерода и могут существовать в виде оптических изомеров. Часто природные аминокислоты вращают плоскость поляризации влево.
Ферментативному расщеплению, происходящему в организме, подвергаются преимущественно L-аминокислоты и их производные. D-ами-нокислоты организмом не усваиваются.
При получении аминокислот синтетическим путем образуются рацематы, которые содержат примерно равное количество L- и D-изомеры.
При нагревании α-аминокислот с нингидрином они окисляются с образованием альдегида, CO2 и NH3. Эта реакция применяется для качественного обнаружения и количественного определения α-аминокислот методом хроматографии на бумаге.
Аминокислоты образуют внутренние соли с катионами тяжелых металлов. Для α-аминокислот характерна внутримолекулярная соль меди, дающая синие кристаллы.
Аминокислоты способны к декарбоксилированию с образованием аминов и выделением CO2, взаимодействуют с альдегидами, реакция идет в щелочной среде, способны взаимодействовать также с кетокислотами.
Аминокислоты способны к дезаминированию. При окислении от аминокислот может отщепляться аммиак с образованием кетокислоты, далее кетокислота может распадаться на альдегид и диоксид углерода.
При нагревании α-аминокислот или их эфиров образуются циклические ангидриды, называемые декетопиперазинами.
Многие из перечисленных выше реакций могут происходить при переработке пищевых продуктов под влиянием влаготепловых воздействий. Эти реакции имеют очень важное значение в технологии пищевых производств, ведущихся с применением тепловых воздействий, так как оказывают большое влияние на качество получаемых продуктов. Например, в результате взаимодействия аминокислот с редуцирующими сахарами образуются темно-окрашенные, так называемые меланоидиновые соединения.
Аминокислоты способны соединяться между собой в длинные цепи посредством пептидной связи (–CO–NH–), которая образуется за счет карбоксилов и аминных групп. При взаимодействии двух аминокислот получается дипептид. В зависимости от числа аминокислотных остатков, образующих молекулу пептида, различают дипептиды, трипептиды, тетрапептиды и т. д. Полипептиды различаются между собой числом аминокислотных остатков, их строением, а также порядком расположения аминокислот в полипептидной цепи.
Полипептидные цепи могут замыкаться в циклы в результате образования пептидной связи между концевыми амино- и карбоксильными группами. Замыкание цепи происходит также в результате образования дисульфатной связи между боковыми цепями.


 О
О О
О


 α-Амино-β-фенил-
пропионовая
(фенилаланин)
α-Амино-β-фенил-
пропионовая
(фенилаланин) α-Амино-β-параокси-фенилпропионовая
(тирозин)
α-Амино-β-параокси-фенилпропионовая
(тирозин)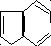 α-Амино-β-индолил-
пропионовая (триптофан)
α-Амино-β-индолил-
пропионовая (триптофан)