
- •Заняття №1
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота Завдання 1. Ознайомлення з основними правилами техніки безпеки в лабораторії неорганічної хімії.
- •Завдання 2. Ознайомлення з основними правилами надання першої допомоги при нещасних випадках.
- •Завдання 3. Фільтрація та декантація
- •Хід роботи Теоретична частина
- •Експериментальна частина
- •Завдання 4. Кристалізація
- •Хід роботи
- •Завдання 5. Дистиляція
- •Хід роботи
- •Завдання 6. Сублімація
- •Хід роботи
- •Література
- •Заняття №2
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Теоретична частина
- •Література
- •Заняття №3
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття №4
- •Самостійна позааудиторна робота
- •Контрольні питання
- •1.Закон Гесса та наслідки з нього.
- •Самостійна аудиторна робота
- •Література
- •Заняття №5
- •Самостійна позааудиторна робота
- •Контрольні питання
- •1.Закон Гесса та наслідки з нього.
- •Самостійна аудиторна робота
- •Література
- •Заняття №6
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Хід роботи Теоретична частина
- •Експериментальна частина
- •Реагуючих речовин Прилади, посуд і реактиви:
- •Методичні вказівки
- •Завдання 2. Залежність швидкості реакції від температури
- •Методичні вказівки
- •Заняття №7
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття №8
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття №9
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття №10
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Хід роботи Теоретична частина
- •Експериментальна частина
- •Завдання 2. Комплексні сполуки з комплексним аніоном Прилади, посуд, реактиви:
- •Методичні вказівки а) Утворення калію тетрайодобісмутату
- •Заняття №11
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття №12
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Хід роботи Теоретична частина
- •Завдання 1. Приготування розчину заданої процентної концентрації з більш концентрованого розчину I води
- •Хід роботи
- •I I Вapiaнт (за густиною):
- •Завдання 2. Приготування розчину заданої процентної концентрації з двох розчинів різної концентрації за їх густиною.
- •Хід роботи
- •Завдання 3. Приготування розчину заданої молярної й моляльної концентрацій з двох розчинів різної концентрації. Прилади, посуд, реактиви
- •Хід роботи
- •Завдання 4. Приготування розчину заданої молярної концентрації з твердої речовини.
- •Хід роботи
- •Література
- •Заняття №13
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття №14
- •Самостійна позааудиторна робота
- •Контрольні питання
- •7.Розчинність газів, її залежність від температури і тиску.
- •Самостійна аудиторна робота
- •Література
- •Заняття № 15
- •Самостійна позааудиторна робота
- •2.Вплив різних факторів на електролітичну дисоціацію.
- •Контрольні питання
- •Самостійна аудиторна робота
- •Хід роботи Теоретична частина
- •Методи визначення рН розчинів
- •Експериментальна частина Прилади, посуд, реактиви:
- •Методичні вказівки:
- •Вимірювання водневого показника розчинів.
- •Заняття № 16
- •Самостійна позааудиторна робота
- •3.Вплив різних факторів на електролітичну дисоціацію.
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття № 17
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Хід роботи Теоретична частина
- •Експериментальна частина
- •Методичні вказівки: Завдання 1. Peaкцiя сepeдoвищa пpи гiдpoлізi coлeй
- •Завдання 2. Bплив тeмпepaтуpи нa гідpoлiз
- •Література
- •Заняття № 18
- •Знати: -процеси оксидації та відновлення;
- •Вміти: -склaдaти елeктpoнний бaлaнc oксидaцiйнo-віднoвниx peaкцiй;
- •Самостійна позааудиторна робота
- •Kонтрольні питання
- •Самостійна аудиторна робота
- •Хід роботи Теоретична частина
- •Деякі додаткові вказівки
- •Заняття №19
- •Знати: -процеси оксидації та відновлення;
- •Вміти: -склaдaти елeктpoнний бaлaнc oксидaцiйнo-віднoвниx peaкцiй;
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
- •Заняття №20
- •Самостійна позааудиторна робота
- •Перелік питань з модуля №1
- •Самостійна аудиторна робота
- •Література
- •Заняття №9
- •Самостійна позааудиторна робота
- •Контрольні питання
- •Самостійна аудиторна робота
- •Література
Контрольні питання
1.Дисоціація води. Йонний добуток води.
2.Водневий та гідроксильний показники водних розчинів.
3.Поняття про кислотно-основні індикатори.
4.Фактори, що впливають на зміщення йонних рівноваг.
5.Добуток розчинності, його значення для розрахунків утворення або розчинення осадів.
6.Реакції в розчинах електролітів. Правила складання йонних рівнянь.
7.Написати в йонно-молекулярній формі рівняння реакцій між водними розчинами наступних речовин: а) NaHCO3 + HCl; б) FeCl3 + KOH; в) Pb(CH3COO)2 + Na2S; г) KHS + H2SO4; д) Zn(NO3)2 + KOH (надл.); е) Ca(OH)2 + CO2.
8.Розчинність СаСО3 при 35С дорівнює 6,910-5 моль/дм3. Визначити добуток розчинності цієї солі.
9.Визначити рН 0,1М розчину нітритної кислоти HNO2 та розчину нітритної кислоти та натрій нітриту NaNO2 в однакових концентраціях, що дорівнюють 0,1 моль/дм3. Константа дисоціації кислоти становить 4,610-4. Вважайте, що сіль у розчині продисоціювала повністю.
Самостійна аудиторна робота
1.Виконання дослідів, описаних в даних методичних вказівках.
2.Обговорення результатів та оформлення висновків.
3.Оформлення та захист протоколу.
4.Відповіді на запитання, запропоновані викладачем, з використанням записів на дошці.
5.Розв'язування розрахункових задач, запропонованих викладачем.
Хід роботи Теоретична частина
Навіть дуже очищена вода має деяку електропровідність. При 25°С питома електропровідність води рівна 6,3.10-4 Омсм-1. Отже, молекули води дисоціюють за рівнянням 2Н2О ↔ Н3О++ОН. Скорочено дисоціацію води можна представити у вигляді: Н2О ↔ Н++ОН і на практиці говорять про вміст у розчині Гідроген-катіонів та гідроксид-аніонів.
Згідно закону дії мас, константа дисоціації води дорівнює:
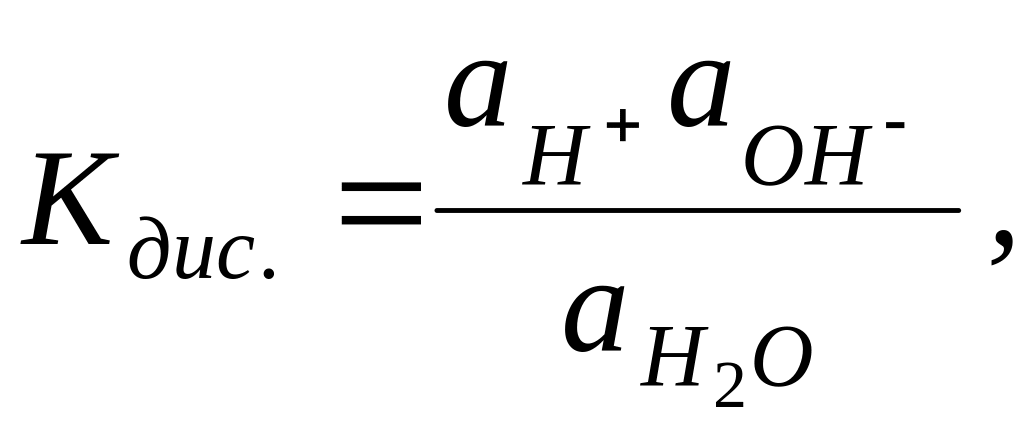
де а - активність відповідних йонів, що виражають ефективну концентрацію якого-небудь йона і є функцією його концентрації в розчині:
a=f.C,
де f - коефіцієнт активності, С – концентрація.
3відси:
![]() .
.
Враховуючи, що активність недисоційованих молекул Н2О набагато більша активності дисоційованих йонів, її можна вважати сталою величиною, тому:
![]() ,
,
де
КВ
![]() ,
КВ
–
йонний добуток води.
,
КВ
–
йонний добуток води.
В
одному дм3
води міститься
![]() води, а значить при даному ступені
дисоціації води при 250С
води, а значить при даному ступені
дисоціації води при 250С
![]() концентрація йонів Гідрогену дорівнює
концентрація йонів Гідрогену дорівнює
![]() Тоді йонний добуток води при 25°С дорівнює:
КВ
=(1,110-7)2
1.10-14
Тоді йонний добуток води при 25°С дорівнює:
КВ
=(1,110-7)2
1.10-14
![]() .
.
Для спрощення способу вираження концентрації йонів Гідрогену Зеренсен в 1909 р. ввів величину, що представляє собою десятковий логарифм концентрації (активності) йонів Гідрогену, взятій з оберненим знаком. Ця величина позначається рН (від латинського potentio – показник) і називається водневим показником:
![]()
3відси: рН++ рОН-=14.
При рН=7 - нейтральне середовище.
При рН<7 - киcле середовище.
При рН >7 - лужне середовище.
Методи визначення рН розчинів
Активність йонів гідрогену через вимірювання рН можна визначити в основному двома методами: колориметричним та потенціометричним.
Колориметричний метод визначення рН грунтується на властивості кислотно-основних індикаторів змінювати своє забарвлення в залежності від активності йонів гідрогену в розчині. Кислотно-основні індикатори представляють собою складні органічні сполуки - слабкі електроліти, що володіють кислотними або основними властивостями та дисоціюють за рівняннями:
HInd ⇄ H++Ind
або IndOH ⇄ Ind++OH.
де HInd - молекулярна форма індикатора (має одне забарвлення), Ind+, Ind - йонні форми індикатора (мають інші забарвлення). Кожний індикатор має своє значення рН переходу одного забарвлення в інші.
Потенціометричний метод визначення водневого показника полягає в наступних вимірюваннях. Якщо помістити електрод, який називається індикаторним в розчин, рН якого треба виміряти, на границі електрод-розчин виникає різниця потенціалів, яка є функцією рН розчину. Індикаторними електродами бувають: водневий, хінгідронний, скляний. В сучасних рН-метрах (або йономірах) як індикаторний застосовується скляний електрод, який представляє собою скляну трубку з тонкостінною кулькою на її кінці зі спеціального сорту скла (літієвого, натрієвого тощо). В середину кульки заливають розчин відповідного електроліту, наприклад 0,1н розчин хлоридної кислоти і вводять в розчин срібну дротинку, покриту тонким шаром нерозчинної солі AgCl. При зануренні електроду в розчин у поверхневі шари скла електроду із розчину інтенсивно проникають йони гідрогену, витісняючи йони лужного металу, наприклад йони натрію:
Н+(розчин)+Na+(скло ) ⇄ Н+(скло) + Na+(розчин)
Це приводить до появи різниці потенціалів, величина якої залежить тільки від активності йонів Гідрогену в розчині.
Другим електродом (електродом порівняння), як правило, застосовують хлорсрібний або каломельний електрод. Останній застосовуюгь частіше. Він складається з пробірки, яка заповнена розчином КCl (як правило, насиченим), в яку поміщена крапля меркурію, покрита тонким шаром важкорозчинної солі "каломелі" (Нg2Cl2) (звідси назва елементу).
