
- •Предисловие
- •Программа курса «Молекулярная физика. Термодинамика.»
- •2. Учебно-тематический план
- •3. Содержание курса
- •4. Примерная тематика семинарских занятий
- •5. Средства обеспечения дисциплины
- •Введение
- •Все вещества состоят из атомов или молекул
- •Атомы и молекулы веществ находятся в состоянии беспорядочного движения
- •Между атомами и молекулами вещества действуют как силы притяжения, так и силы отталкивания.
- •Глава 1 Термодинамика
- •§1. Температура и термодинамическое равновесие
- •Давление
- •§2. Уравнение состояния идеального газа
- •§3. Законы идеальных газов
- •Изотермический процесс
- •Изобарический процесс
- •Закон Авогадро
- •Закон Дальтона
- •§4. Первое начало термодинамики
- •§5. Макроскопическая работа
- •I начало термодинамики для системы в адиабатической оболочке
- •§6. Внутренняя энергия
- •§7. Количество теплоты. Математическая формулировка первого начала термодинамики
- •§8. Различные приложения I начала термодинамики. Теплоёмкость
- •§9. Внутренняя энергия идеального газа. Закон Джоуля
- •Уравнение Роберта Майера
- •§10. Адиабатический процесс. Уравнение Пуассона
- •Работа при адиабатическом изменении объёма газа
- •§11. Политропический процесс
- •Вопросы и задания для самостоятельной работы студентов Основы термодинамики. I начало термодинамики
- •§12. II начало термодинамики
- •Различные формулировки основного постулата, выражающего II начало термодинамики
- •§13. Равновесные состояния
- •§14. Обратимые и необратимые процессы
- •Необратимость и вероятность
- •§15. Цикл Карно
- •Коэффициент полезного действия в цикле Карно
- •§16. Холодильная машина
- •§17. Свободная энергия
- •§18. Энтропия
- •§19. Некоторые термодинамические соотношения
- •§20. Закон возрастания энтропии. Второе начало термодинамики
- •Увеличение энтропии при теплопередаче
- •§21. Энтропия и вероятность
- •§22. Энтропия и беспорядок
- •§23. Третье начало термодинамики
- •Вопросы для контроля самостоятельной работы студентов
- •II начало термодинамики. Энтропия.
- •Глава 2. Неравновесная термодинамика §1. Основные принципы линейной термодинамики
- •§2. Нелинейная термодинамика
- •§3. Принцип синергетики
- •Свойства и примеры самоорганизации диссипативных структур
- •Глава 3. Статистическая физика и её применение к идеальному газу
- •§1. Давление газа с точки зрения молекулярно – кинетической теории
- •§2. Температура как мера средней энергии хаотичного движения молекул
- •Скорость газовых молекул
- •§3. Броуновское движение
- •§4. Кинетическая теория теплоты Внутренняя энергия идеального газа
- •§5. Классическая теория теплоёмкости и её недостатки
- •§6. Барометрическая формула
- •Закон Больцмана
- •§7. Распределение молекул по скоростям
- •§8. Функция распределения
- •§9. Формула Максвелла
- •§10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул
- •§11. Среднее число молекул, сталкивающихся со стенкой сосуда
- •Вопросы для контроля знаний студентов Молекулярно-кинетическая теория
- •Глава 4. Явления переноса §1. Столкновение молекул и явления переноса
- •§2. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- •§3. Рассеяние молекулярного пучка в газе
- •§4. Явление переноса в газах. Уравнение переноса
- •§5. Диффузия
- •§6. Нестационарная диффузия
- •§7. Теплопроводность газов
- •§8. Вязкость газов (внутреннее трение)
- •§9. Соотношения между коэффициентами переноса
- •§10. Физические явления в разреженных газах
- •Вопросы для самостоятельного контроля знаний студентов Явления переноса
- •Глава 5 §1. Неидеальные газы. Уравнение Ван-дер-Ваальса. Отклонение свойств газов от идеальности
- •Уравнение Ван-Дер-Ваальса
- •§2. Учет сил отталкивания между молекулами
- •§3. Учет сил притяжения между молекулами
- •§4. Изотермы Ван-дер-Ваальса
- •§5. Критическая температура и критическое состояние
- •§6. Недостатки уравнения Ван-дер-Ваальса
- •§7. Внутренняя энергия газа Ван-дер-Ваальса
- •§8. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- •§9. Сжижение газов
- •Эффект Джоуля-Томсона
- •Вопросы для самоконтроля изученного материала Реальные газы
- •Глава 6. Жидкое состояние §1.Строение жидкостей
- •§2. Поверхностное натяжение
- •§3. Условия равновесия на границе двух сред. Краевой угол
- •§4. Граница жидкости и твердого тела
- •§5. Силы, возникающие на кривой поверхности жидкости
- •§6. Капиллярные явления
- •§7. Упругость насыщенного пара над кривой поверхностью жидкости
- •Вопросы для самоконтроля знаний студентов
- •Глава 7. Жидкие растворы §1. Свойства растворов
- •§2. Упругость насыщенного пара над идеальным раствором
- •§3. Закон Генри
- •§4. Осмотическое давление
- •Глава 8. Кристаллическое состояние §1. Отличительные черты кристаллического состояния
- •§2. Классификация кристаллов
- •§3. Физические типы кристаллических решеток
- •§4. Тепловое движение в кристаллах
- •Глава 9. Фазовые переходы §1. Фаза и фазовые равновесия
- •§2. Условия равновесия фаз химически однородного вещества
- •§3. Уравнение Клапейрона
- •Вопросы для самоконтроля знаний студентов
- •Содержание
§7. Внутренняя энергия газа Ван-дер-Ваальса
Как мы отметили выше, внутренняя энергия неидеальных газов U зависит не только от температуры Т, но и от объема V, т.е.
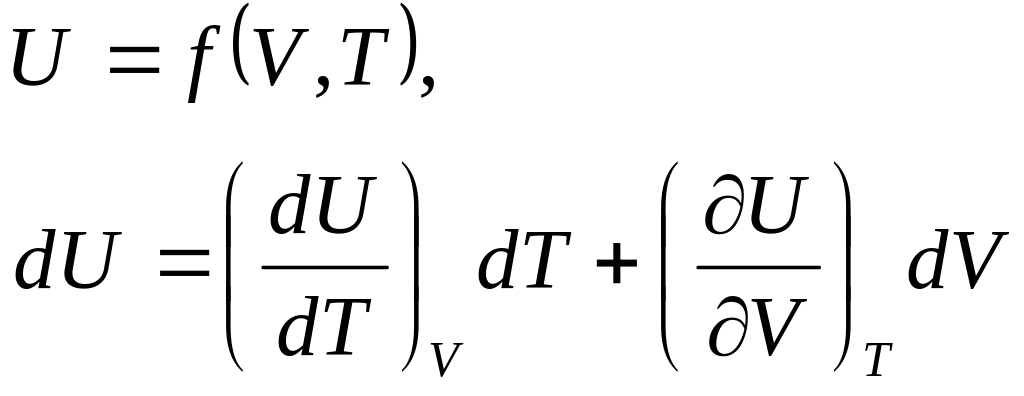 .
.
Отметим, что
![]() .
Получим выражение для
.
Получим выражение для
![]() .
С этой целью запишем I закон термодинамики
в виде:
.
С этой целью запишем I закон термодинамики
в виде:
.
Тогда
![]() .
.
Согласно правилам Максвелла, из выражения (1.49), имеем:
![]() .
.
Таким образом,
![]() .
(5.9)
.
(5.9)
В результате выражение для внутренней энергии газа можно записать в виде:
![]() .
(5.10)
.
(5.10)
Применим формулу (5.10) для вычисления внутренней энергии газа, описываемого уравнением Ван-дер-Ваальса:
![]() .
.
В этом случае легко заметить
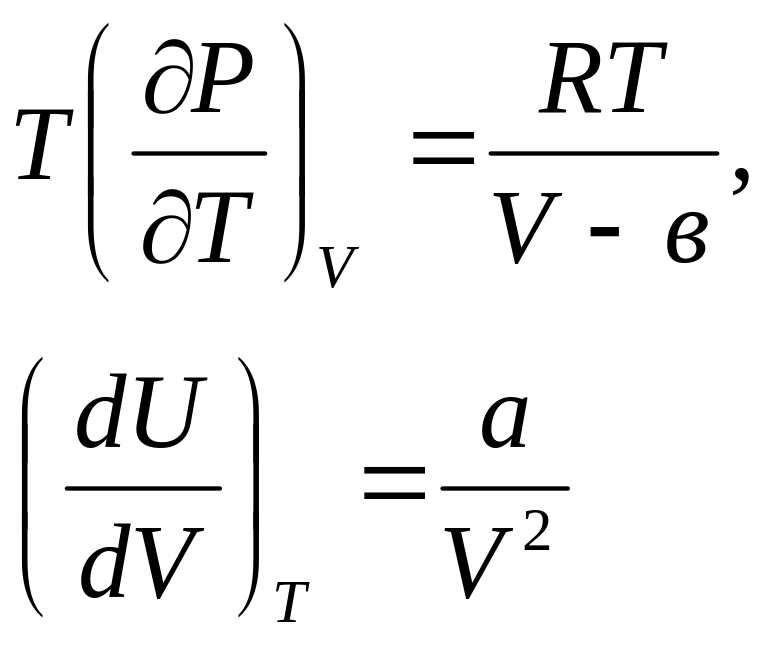 .
.
Отсюда
![]() .
.
Проинтегрировав вторые слагаемые, получим:
![]() ,
,
где В
- постоянная интегрирования. Для
определения значения В,
воспользуемся условием, что при
![]() ,
газ становится бесконечно разреженным,
т.е. он должен обладать свойствами
идеального газа, для которого
,
газ становится бесконечно разреженным,
т.е. он должен обладать свойствами
идеального газа, для которого
![]() .
Это значит, что
.
Это значит, что
![]() .
Таким образом, внутренняя энергия газа
Ван-дер-Ваальса определяется выражением:
.
Таким образом, внутренняя энергия газа
Ван-дер-Ваальса определяется выражением:
![]() .
(5.11)
.
(5.11)
§8. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
Изотермы, построенные
при одной и той же температуре для разных
газов, выглядят по-разному, потому что
и
и связанные
с ними критические величины
![]() различные
для разных газов. Можно, однако, и для
неидеальных газов написать уравнение
изотермы, чтобы оно не зависело от
природы газа, т.е. было бы универсальным.
Для этого оказывается достаточно, чтобы
параметры состояния газа находились в
одинаковых отношениях к соответствующим
критическим параметрам. Для этого введем
безразмерные параметры, обезразмеренные
с помощью критических величин, т.е.
различные
для разных газов. Можно, однако, и для
неидеальных газов написать уравнение
изотермы, чтобы оно не зависело от
природы газа, т.е. было бы универсальным.
Для этого оказывается достаточно, чтобы
параметры состояния газа находились в
одинаковых отношениях к соответствующим
критическим параметрам. Для этого введем
безразмерные параметры, обезразмеренные
с помощью критических величин, т.е.
![]() .
.
Параметры
![]() называют
приведенными параметрами. Поставим в
уравнение Ван-дер-Ваальса значения
параметров
называют
приведенными параметрами. Поставим в
уравнение Ван-дер-Ваальса значения
параметров
![]() ,
вырожденные через приведенные параметры.
Получим:
,
вырожденные через приведенные параметры.
Получим:
![]() .
(5.12)
.
(5.12)
В (5.12) подставим
значения
![]() .
Тогда получим:
.
Тогда получим:
![]() .
(5.13)
.
(5.13)
С учетом известных соотношений
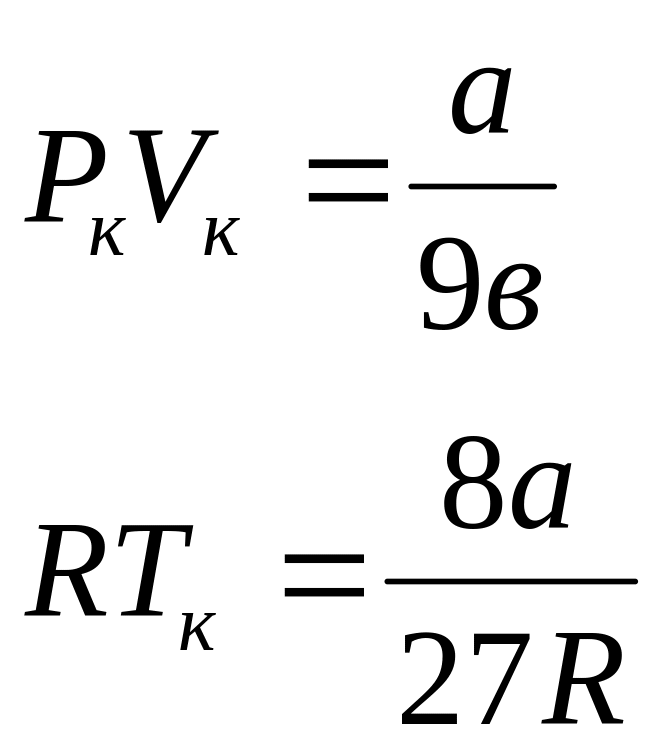
имеем:
![]() .
(5.14)
.
(5.14)
Уравнение (5.14) является приведенным уравнением состояния. В этом уравнении не содержатся константы, характерные для конкретного вещества. Из него следует, что если вещества обладают двумя одинаковыми приведенными параметрами из трех, то и третий параметр тоже одинаков для этих веществ. Этот закон носит название закона соответственных состояний. Он выражает тот факт, что изменяя масштаб, которым измеряются две из трех величин, характеризующих состояние веществ, т.е. используя приведенные параметры, можно совместить изотермы всех веществ.
§9. Сжижение газов
Как следует из анализа изотерм Ван-дер-Ваальса, всякий газ может быть переведен в жидкое состояние путем сжатия, если его температура ниже критической температуры. Например, углекислый газ можно превратить в жидкость при комнатной температуре, поскольку его критическая температура равна 31,10С. Но есть такие газы, которые при комнатной температуре нельзя перевести в жидкое состояние как бы его не сжали. К таким газам относятся, например, воздух, водород, гелий, кислород, у которых критические температуры значительно ниже комнатной. До открытия критической температуры (1822г.) их считали непослушными газами, т.е. газами, не способными сжижаться.
Для сжижения таких газов их необходимо охладить до температуры несколько ниже критической, после чего повышением давления газ может быть переведен в жидкое состояние. Сжиженный таким образом газы удобно хранить под атмосферным давлением (в открытом сосуде), но в этом случае их температура должна быть еще более низкой, чтобы давление соответствующее насыщенному пару, т.е. горизонтальному участку изотермы, было равно 1 атм. Для азота такая изотерма соответствует температуре -195,80С, в то время как критическая температура азота равна -147,10С.
Таким образом, чтобы газ сжижать, необходимо его достаточно сильно охладить. Для достижения такого сильного охлаждения используются два метода. Первый из них связан с использованием так называемого эффекта Джоуля-Томсона.
