
- •Предисловие
- •Программа курса «Молекулярная физика. Термодинамика.»
- •2. Учебно-тематический план
- •3. Содержание курса
- •4. Примерная тематика семинарских занятий
- •5. Средства обеспечения дисциплины
- •Введение
- •Все вещества состоят из атомов или молекул
- •Атомы и молекулы веществ находятся в состоянии беспорядочного движения
- •Между атомами и молекулами вещества действуют как силы притяжения, так и силы отталкивания.
- •Глава 1 Термодинамика
- •§1. Температура и термодинамическое равновесие
- •Давление
- •§2. Уравнение состояния идеального газа
- •§3. Законы идеальных газов
- •Изотермический процесс
- •Изобарический процесс
- •Закон Авогадро
- •Закон Дальтона
- •§4. Первое начало термодинамики
- •§5. Макроскопическая работа
- •I начало термодинамики для системы в адиабатической оболочке
- •§6. Внутренняя энергия
- •§7. Количество теплоты. Математическая формулировка первого начала термодинамики
- •§8. Различные приложения I начала термодинамики. Теплоёмкость
- •§9. Внутренняя энергия идеального газа. Закон Джоуля
- •Уравнение Роберта Майера
- •§10. Адиабатический процесс. Уравнение Пуассона
- •Работа при адиабатическом изменении объёма газа
- •§11. Политропический процесс
- •Вопросы и задания для самостоятельной работы студентов Основы термодинамики. I начало термодинамики
- •§12. II начало термодинамики
- •Различные формулировки основного постулата, выражающего II начало термодинамики
- •§13. Равновесные состояния
- •§14. Обратимые и необратимые процессы
- •Необратимость и вероятность
- •§15. Цикл Карно
- •Коэффициент полезного действия в цикле Карно
- •§16. Холодильная машина
- •§17. Свободная энергия
- •§18. Энтропия
- •§19. Некоторые термодинамические соотношения
- •§20. Закон возрастания энтропии. Второе начало термодинамики
- •Увеличение энтропии при теплопередаче
- •§21. Энтропия и вероятность
- •§22. Энтропия и беспорядок
- •§23. Третье начало термодинамики
- •Вопросы для контроля самостоятельной работы студентов
- •II начало термодинамики. Энтропия.
- •Глава 2. Неравновесная термодинамика §1. Основные принципы линейной термодинамики
- •§2. Нелинейная термодинамика
- •§3. Принцип синергетики
- •Свойства и примеры самоорганизации диссипативных структур
- •Глава 3. Статистическая физика и её применение к идеальному газу
- •§1. Давление газа с точки зрения молекулярно – кинетической теории
- •§2. Температура как мера средней энергии хаотичного движения молекул
- •Скорость газовых молекул
- •§3. Броуновское движение
- •§4. Кинетическая теория теплоты Внутренняя энергия идеального газа
- •§5. Классическая теория теплоёмкости и её недостатки
- •§6. Барометрическая формула
- •Закон Больцмана
- •§7. Распределение молекул по скоростям
- •§8. Функция распределения
- •§9. Формула Максвелла
- •§10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул
- •§11. Среднее число молекул, сталкивающихся со стенкой сосуда
- •Вопросы для контроля знаний студентов Молекулярно-кинетическая теория
- •Глава 4. Явления переноса §1. Столкновение молекул и явления переноса
- •§2. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- •§3. Рассеяние молекулярного пучка в газе
- •§4. Явление переноса в газах. Уравнение переноса
- •§5. Диффузия
- •§6. Нестационарная диффузия
- •§7. Теплопроводность газов
- •§8. Вязкость газов (внутреннее трение)
- •§9. Соотношения между коэффициентами переноса
- •§10. Физические явления в разреженных газах
- •Вопросы для самостоятельного контроля знаний студентов Явления переноса
- •Глава 5 §1. Неидеальные газы. Уравнение Ван-дер-Ваальса. Отклонение свойств газов от идеальности
- •Уравнение Ван-Дер-Ваальса
- •§2. Учет сил отталкивания между молекулами
- •§3. Учет сил притяжения между молекулами
- •§4. Изотермы Ван-дер-Ваальса
- •§5. Критическая температура и критическое состояние
- •§6. Недостатки уравнения Ван-дер-Ваальса
- •§7. Внутренняя энергия газа Ван-дер-Ваальса
- •§8. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- •§9. Сжижение газов
- •Эффект Джоуля-Томсона
- •Вопросы для самоконтроля изученного материала Реальные газы
- •Глава 6. Жидкое состояние §1.Строение жидкостей
- •§2. Поверхностное натяжение
- •§3. Условия равновесия на границе двух сред. Краевой угол
- •§4. Граница жидкости и твердого тела
- •§5. Силы, возникающие на кривой поверхности жидкости
- •§6. Капиллярные явления
- •§7. Упругость насыщенного пара над кривой поверхностью жидкости
- •Вопросы для самоконтроля знаний студентов
- •Глава 7. Жидкие растворы §1. Свойства растворов
- •§2. Упругость насыщенного пара над идеальным раствором
- •§3. Закон Генри
- •§4. Осмотическое давление
- •Глава 8. Кристаллическое состояние §1. Отличительные черты кристаллического состояния
- •§2. Классификация кристаллов
- •§3. Физические типы кристаллических решеток
- •§4. Тепловое движение в кристаллах
- •Глава 9. Фазовые переходы §1. Фаза и фазовые равновесия
- •§2. Условия равновесия фаз химически однородного вещества
- •§3. Уравнение Клапейрона
- •Вопросы для самоконтроля знаний студентов
- •Содержание
§5. Критическая температура и критическое состояние
Из уравнения Ван-дер-Ваальса кроме факта сосуществования двух фаз вещества - жидкого и газообразного, следует и наличие у веществ критической температуры, критического состояния.
Д ля
этого рассмотрим, как изменяются изотермы
с изменением температуры (рис.6). С
повышением температуры изотермы
располагаются выше, причем расстоянием
между максимумами и минимумами
уменьшаются. Наконец, при вполне
определенной температуре максимумы и
минимумы изотермы сливаются, вырождаясь
в точку перегиба. При дальнейшем повышении
температуры, изотермы становятся схожими
с изотермами идеального газа. Таким
образом, при определенной температуре
Тк
все три значения объема сливаются, т.е.
корни уравнения становятся кратными.
Следовательно, при этой температуре
исчезает различие между различными
состояниями вещества. Эту температуру
называют критической.
Воспользуясь уравнением Ван-дер-Ваальса,
вычислим критическую температуру, а
также значения двух других критических
параметров - критического объема
ля
этого рассмотрим, как изменяются изотермы
с изменением температуры (рис.6). С
повышением температуры изотермы
располагаются выше, причем расстоянием
между максимумами и минимумами
уменьшаются. Наконец, при вполне
определенной температуре максимумы и
минимумы изотермы сливаются, вырождаясь
в точку перегиба. При дальнейшем повышении
температуры, изотермы становятся схожими
с изотермами идеального газа. Таким
образом, при определенной температуре
Тк
все три значения объема сливаются, т.е.
корни уравнения становятся кратными.
Следовательно, при этой температуре
исчезает различие между различными
состояниями вещества. Эту температуру
называют критической.
Воспользуясь уравнением Ван-дер-Ваальса,
вычислим критическую температуру, а
также значения двух других критических
параметров - критического объема
![]() и критического
давления
и критического
давления
![]() .
Действительно, при Т=Тк,
Р=Рк,
V=Vк
левая часть уравнения Ван-дер-Ваальса
(5.7) должна быть точным кубом и может
быть представлена в виде:
.
Действительно, при Т=Тк,
Р=Рк,
V=Vк
левая часть уравнения Ван-дер-Ваальса
(5.7) должна быть точным кубом и может
быть представлена в виде:
![]() .
.
Это равенство тождественно выполняется, если коэффициенты при одинаковых степенях в обеих частях равны между собой:
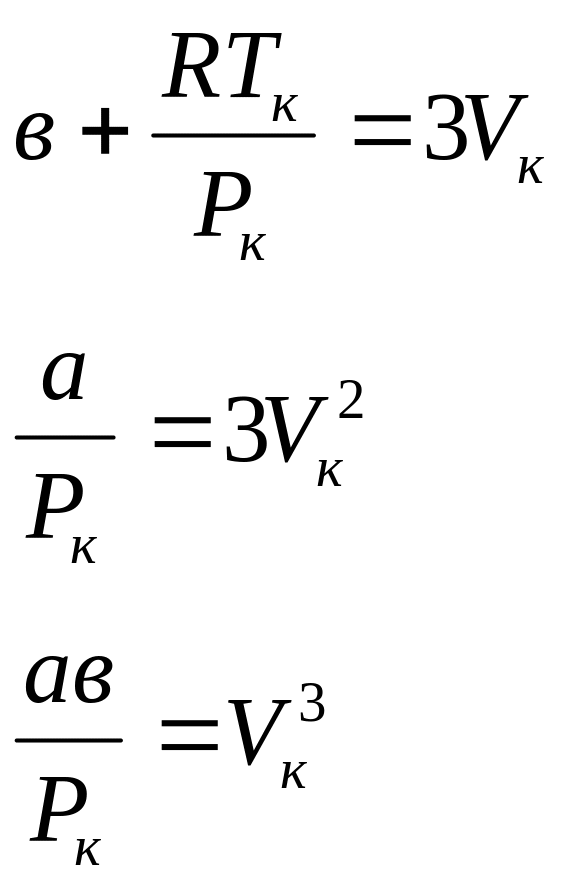 .
.
Решив эту систему уравнений, получим значения критических параметров, выраженных через константы и :
 .
(5.8)
.
(5.8)
Значение критических параметров можно также получить из следующей системы уравнений:
 .
.
Второе уравнение этой системы связано с тем, что в критической точке совпадают максимумы и минимумы изотермы, т.е. критическая точка является точкой экстремума. Третье уравнение этой системы связана тем, что критическая точка является точкой перегиба.
Состояние веществ при критических значениях температуры, объема и давления называется критическим состоянием. В критическом состоянии жидкость проявляет очень интересные свойства:
Происходит резкое возрастание коэффициента изотермической сжимаемости;
Наблюдается скачок теплоемкости;
Наблюдается аномальный рост рассеяния света, т.е. происходит опалесценция света.
§6. Недостатки уравнения Ван-дер-Ваальса
Прежде отметим достоинство этого уравнения. Уравнение Ван-дер-Ваальса правильно описывает явления, связанные с изменением плотности газов при изменении температуры и давления, взаимные переходы жидкости и газа. Из уравнения Ван-дер-Ваальса вытекает наличие у веществ критической точки. В то же время теория Ван-дер-Ваальса имеет существенные недостатки:
а) Параметры и , входящие в уравнение Ван-дер-Ваальса не являются постоянными. Они зависят от температуры, хотя по смыслу уравнение Ван-дер-Ваальса и должны быть постоянными, характерными для данного вещества величинами;
б) Другое количественное расхождение между теоретическим уравнением и опытом связано со значениями критических параметров Рк, Vк, Тк. Из системы уравнений (5.8) следует, что между этими величинами должно существовать соотношение:
![]() ,
,
не зависящее от
природы вещества. Опыт же показывает,
что хотя величина
![]() постоянна
для многих веществ, но равна 3,7. Вместо
вытекающего из уравнения Ван-дер-Ваальса
соотношения
постоянна
для многих веществ, но равна 3,7. Вместо
вытекающего из уравнения Ван-дер-Ваальса
соотношения
![]() ,
опыт показывает, что значительно лучше
выполняется равенство
,
опыт показывает, что значительно лучше
выполняется равенство
![]() .
Из приведенных выше параметров следует,
что уравнение Ван-дер-Ваальса только
качественно правильно описывает явления,
происходящие в реальных газах. Для
количественных оценок оно является
грубым.
.
Из приведенных выше параметров следует,
что уравнение Ван-дер-Ваальса только
качественно правильно описывает явления,
происходящие в реальных газах. Для
количественных оценок оно является
грубым.
В настоящее время принято описывать состояние реального газа более общим уравнением в виде ряда:
![]()
Коэффициенты В, С…, которые определяются или из опыта или теоретически, называются вириальными коэффициентами, причем все они зависят от температуры.
